Синдром леффлера при аскаридозе
Геогельминтозы являются одними из самых распространенных паразитарных заболеваний человека. По оценкам ВОЗ, более 2 млрд людей в мире, включая более 4 млн детей в Европейском регионе ВОЗ, поражены геогельминтозами. В последние годы в Украине наблюдается тенденция к увеличению пораженности некоторыми гельминтозами. Ежегодный показатель заболеваемости гельминтозами в Украине – более 1000 случаев на 100 тыс. населения (С. А. Крамарев, 2006).
Значимой проблемой мирового здравоохранения является аскаридоз– геогельминтоз из группы кишечных нематодозов, вызываемый гельминтом Ascaris lumbricoides. В Индии распространенность тяжелых случаев аскаридоза с высокой паразитарной нагрузкой составляет 768 случаев на 100 тыс. человек; в Китае – 2 179 случаев на 100 тыс.; в субсахарской Африке – 586 случаев на 100 тыс.; в Латинской Америке – 1 802 случая на 100 тыс. человек, что составляет, предположительно, около 8 млн человек [2]. В Украине в структуре паразитарных заболеваний аскаридоз занимает второе место (34%).
Течение аскаридоза проходит две фазы: раннюю (миграционную) фазу, характеризующуюся токсикоаллергическими симптомами (эозинофильные инфильтраты в легких – синдром Леффлера, крапивница и др.), и кишечную фазу с преобладанием диспепсических явлений. И, хотя аскаридоз зачастую протекает бессимптомно, именно во второй фазе может возникнуть ряд гастроинтестинальных и хирургических осложнений, таких как мальабсорбция, аппендицит, перфорация кишечника, кишечная непроходимость, острый холецистит и острый панкреатит. Наиболее частым осложнением является кишечная обструкция: в мире ежегодно отмечается около 730 000 случаев. В случае появления осложнений летальность достигает 5%.
Несмотря на то что люди любого возраста могут быть инфицированы аскаридозом, наиболее часто хозяином паразита становятся дети в возрасте от 4 до 14 лет [1]. В этой же группе наиболее часто встречаются острые гастроинтестинальные осложнения.
Аскаридоз развивается после проглатывания оплодотворенных яиц. В тонкой кишке из них высвобождаются личинки, которые для дальнейшего развития нуждаются в кислороде. Через 3-4 ч они пробуравливают слизистую и внедряются в кишечные вены. С током крови они попадают в малый круг кровообращения, в капилляры альвеол, а затем и в их просвет. Из альвеол личинки, используя движение ресничек мерцательного эпителия, по бронхиолам, бронхам и трахее поступают в глотку и там проглатываются и вновь попадают в кишечник хозяина. На 25-29-й день в тонкой кишке они развиваются во взрослых паразитов. Именно взрослые аскариды и вызывают острые осложнения в кишечнике.
Наиболее распространенным неотложным состоянием, связанным с аскаридами, является обструкционная кишечная непроходимость, вызванная клубком аскарид. Другие острые состояния включают гепатобилиарный аскаридоз и острый панкреатит, острый аппендицит, перитонеальные гранулемы, заворот тонкой кишки и инвагинацию кишечника (табл. 1). Многие из этих состояний могут подлежать консервативному лечению, хотя порой требуется ургентное хирургическое вмешательство (табл. 2).
Осложнение
Количество пациентов
Кишечная непроходимость (полная)
Заворот кишок с гангреной и перфорацией
Миграция в желчевыводящие протоки
Миграция в брюшную полость
Название операции
Общее число
Летальные исходы
Хотя круглые черви могут обитать в кишечнике вплоть до дуодено-еюнального изгиба, большинство (99%) населяет тощую и подвздошную кишку [3]. Круглые черви не касаются стенок кишечника, они удерживаются в просвете благодаря сильным повторяющимся сокращениям мышечного слоя [3]. Там они питаются питательными веществами химуса. Скопления аскарид могут населять кишечник годами и не вызывать острых осложнений.
Существует 4 основных фактора, влияющих на развитие кишечной непроходимости при аскаридозе [4]:
- скопление червей может сформировать клубок, который механически перекроет просвет кишечника. Это наиболее частая причина кишечной непроходимости, вызванной аскаридами;
- клубок червей может стать отправной точкой развития инвагинации или заворота тонкой кишки;
- аскариды, обитающие на илеоцекальном клапане, могут вызвать спазм тонкой кишки путем выделения нейротоксинов. Этот эффект усугубляется при высокой аскаридной нагрузке в области клапана;
- воспалительная реакция организма хозяина на гемолизины, эндокринолизины и анафилатоксины паразита также может способствовать развитию обструкции.
Surendran и Paulose [6] провели пятилетнее исследование кишечной непроходимости, связанной с A. lumbricoides, и классифицировали ее на острую и подострую. Пациенты с подострой обструкцией испытывают диффузные спастические боли в животе, лихорадку, рвоту, которая более выражена в начале, и диарею без крови и слизи. Острая обструкция имеет гораздо более зловещие признаки и симптомы. Пациенты проявляют признаки выраженной дегидратации и интоксикации. Часто отмечается рвота, боль и вздутие живота, повышение температуры тела и лейкоцитоз.
Хорошо локализованные массы паразита иногда пальпируются через брюшную стеку у пациентов с подострой обструкцией и редко – при наличии растянутой брюшной стенки, у детей с острой обструкцией. Пациенты или их родители часто отмечают наличие глистов в кале или рвотных массах в анамнезе. Клиническая картина пациентов с перитонеальными гранулемами аналогична симптомам при обструкции.
Механизм развития перфорации тонкой кишки, вызванной аскаридами, остается причиной споров. Считается, что в экстремальных ситуациях, таких как голодание, воспаление или обструкция просвета кишечника скоплением червей, некоторые аскариды мигрируют в язвы слизистой и вызывают перфорации [5]. Другим возможным объяснением может быть некроз, вызванный давлением клубка аскарид на стенку кишки [6]. После этого кишечник становится подвержен разрывам в результате буравящих движений аскарид [1].
Когда черви попадают в брюшную полость, иммунный ответ организма хозяина приводит к образованию гранулем на большом сальнике, брюшине, серозной оболочке печени и селезенки. Гранулемы – это реакция организма человека на тела мертвых аскарид и их яиц. В целом, перитонеальные гранулемы напоминают туберкулезные поражения, а на рентгенограмме и других методах визуализации они могут имитировать лимфому [7].
Рентгенография органов брюшной полости должна быть первым шагом после сбора жалоб и анамнеза и проведения физикального обследования. В дополнение к растянутым петлям кишечника с визуализацией уровней жидкости на рентгенограммах часто выявляются черви [4]. Масса паразитов напоминает водоворот [4]. На обзорной рентгенограмме перфорация может проявляться в виде свободного воздуха под диафрагмой. При исследованиях стула часто выявляют множество яиц и паразитов, а также большое число эозинофилов. Анализы крови могут демонстрировать выраженный лейкоцитоз, а уровень эозинофилии может приближаться к 25% [7]. Другие диагностические исследования, такие как рентгенография после бариевой клизмы, часто не показывают никаких отклонений, и поэтому не показаны.
Лечение аскаридозной кишечной непроходимости зависит от того, является ли состояние подострым или острым. Tondon и соавт. [8] сравнили применение консервативного и хирургического методов лечения аскаридоза пищеварительного тракта. В этом ретроспективном исследовании приняли участие 250 детей в Центральной Индии. Все пациенты в исследовании первоначально получали консервативную терапию, которая состояла из введения свежеприготовленной гипертонической соляной клизмы. Консервативная терапия была успешной (выявление глистов в толстой кишке) у 239 пациентов (95,6%) [8]. Одиннадцать пациентов в исследовании подвергались диагностической лапаротомии, после того как симптомы не уменьшились после консервативного лечения.
Гипертоническая клизма эффективна, поскольку повышенная концентрация раствора натрия хлорида служит раздражителем для аскаридного клубка. После этого вмешательства клубок часто распадается, и глисты попадают в толстую и прямую кишку. Хотя гипертоническая клизма, как правило, считается безопасной, она может вызвать перфорацию тонкой или толстой кишки, значительную потерю жидкости и обезвоживание, а также последующие электролитные аномалии.
Стандартная терапия подострой обструкции включает введение внутривенных жидкостей и назогастральную аспирацию в течение 48-72 ч [6].
Антигельминтные препараты для элиминации круглых червей стоит назначать только после внутривенной регидратации, установки назогастрального зонда и гипертонической клизмы на фоне стихания симптомов кишечной непроходимости [6], так как они могут вызвать спастический паралич мускулатуры паразита и только усугубить непроходимость.
К противогельминтным препаратам первой линии относятся мебендазол, альбендазол и пирантел, проявляющие схожую эффективность по отношению к аскаридам. Назначаемый ранее пиперазин больше не применяется в развитых странах ввиду его токсичности [1]. В экспериментах на лабораторных животных у мебендазола и альбендазола отмечалось эмбриотоксическое и тератогенное влияние. По этой причине препаратом выбора для беременных женщин и детей младше 2 лет является пирантел.
Всасывание пирантела в кишечнике очень слабое вследствие его нерастворимости. Плазматические концентрации незначительны: от 0,05 до 0,13 мг/мл. Более 93% препарата удаляется с фекалиями в неизмененном виде.
Гельминтокс выпускается в форме таблеток, покрытых пленочной оболочкой, по 125 и 250 мг и принимается один раз в сутки, независимо от приема пищи. Дозировка при аскаридозе: дети до 6 лет – 1 таблетка (125 мг) на 10 кг массы тела, взрослые и подростки весом до 75 кг – 3 таблетки (по 250 мг), более 75 кг – 4 таблетки по 250 мг (максимальная суточная доза – 1 г).
Хирургическое лечение кишечной непроходимости показано у пациентов с ректоррагией, у тех, кто не реагирует на консервативное лечение, или при выявлении на обзорной рентгенограмме органов брюшной полости нескольких уровней воздуха и жидкости [4]. Резекция пораженной кишки с анастомозом конец-в-конец требуется только в случае развития перфорации или гангрены. Более распространенным методом устранения механической обструкции является лапаротомия и массирование клубка аскарид в направлении толстой кишки [4]. При перекруте тонкой кишки преимущество отдается энтеротомии [9]. Во время хирургического вмешательства по поводу кишечной непроходимости, вызванной аскаридами, у пациента могут быть также выявлены перитонеальные гранулемы диаметром до 10 см, которые можно иссечь во время лапаротомии [7].
Несмотря на то что круглые черви чаще всего обитают в просвете тощей и подвздошной кишки, иногда они могут мигрировать в двенадцатиперстную кишку. Затем аскариды могут проникнуть в гепатобилиарное дерево или протоки поджелудочной железы, что приводит к серьезным заболеваниям печени, желчного пузыря и поджелудочной железы.
Хотя кишечная непроходимость чаще встречается у детей, взрослые чаще страдают от гепатопанкреатического аскаридоза (ГПА) [1]. Сеть гепатобилиарных протоков у детей меньше и, следовательно, более трудна для проникновения червя. Средний возраст пациентов с ГПА составляет 35 лет (от 4 до 70 лет), а соотношение женщин и мужчин составляет почти 3:1 [1]. Наибольший риск развития – у беременных женщин и людей, перенесших хирургические вмешательства на желчном пузыре или протоках. ГПА имеет 5 типичных проявлений: острый холецистит, острый холангит, печеночная колика, острый панкреатит и абсцесс печени.
Камни у пациентов с аскаридозом часто пигментированы фрагментами червя, а яйца служат их основообразующим элементом [10]. Острый холецистит, вызванный аскаридами, также может быть акалькулезным. В этом случае симптомы связаны с миграцией червя в желчное дерево, которая вызывает обструкцию желчи [10]. Пациенты с острым холециститом часто жалуются на боль в правом верхнем квадранте, которая иррадиирует в спину, правое плечо и лопатку [11]. Рвота и субфебрильная температура (от 37,2 °C до 37,8 °C) являются частыми симптомами [11].
У пациентов с желчной коликой присутствуют симптомы острого холецистита, включая боль в правом верхнем квадранте, тошноту и рвоту. Однако лихорадка и желтуха отсутствуют.
У пациентов с аскаридозом были описаны два типа холангита. Первый тип – острый холангит, при котором у пациентов обычно высокая температура (от 38,3 °C до 40 °C), желтуха, гепатомегалия, выраженный лейкоцитоз и повышенные уровни аланинаминотрансферазы (АлТ), щелочной фосфатазы и билирубина сыворотки [11]. В случаях тяжелого холангита возможны гипотензия и метаболический ацидоз как проявления эндотоксического шока.
Второй тип – рецидивирующий пиогенный холангит (РПХ), является специфическим состоянием, характеризующимся образованием камней в билиарном дереве наряду с хронической инфекцией [1]. Клиническая картина похожа на острый холангит. На холангиограмме часто выявляют сладж, дилатацию и стриктуры желчных протоков. Существует сильная эпидемиологическая корреляция между РПХ и рецидивирующим ГПА. Предполагается, что длительное нахождение аскарид в желчных протоках может нарушать отток желчи, что может привести к билиарному сепсису и камнеобразованию [12].
Печеночный абсцесс является потенциально опасным состоянием, вызванным присутствием взрослых особей или яиц в ткани печени. При этом пациенты обычно испытывают болезненность в правом верхнем квадранте живота, высокую температуру, гепатомегалию, межреберную болезненность и отек правой грудной стенки [11]. Осложнения печеночного абсцесса включают сепсис и разрыв в плевральную полость.
Глобальная заболеваемость острым панкреатитом в результате инфицирования A. lumbricoides неизвестна, так как многие случаи не диагностируются [10]. Механизм развития острого панкреатита подобен гепатобилиарным заболеваниям. Продвижение паразита в протоки поджелудочной железы и кальцинированные остатки паразита и яиц вызывают развитие острого панкреатита [10].
Диагноз аскаридоза поджелудочной железы часто устанавливается на основании наличия высокого индекса подозрений. Пациенты жалуются на боль в мезоабдоминальной области, которая иррадиирует в спину; в анамнезе есть рвота глистами; в биохимическом анализе крови выявляется повышение уровня панкреатических маркеров, таких как сывороточная амилаза и липаза [13]. Кроме того, уровень печеночных маркеров также превышает норму.
После тщательного изучения анамнеза и физикального осмотра следует провести общий и биохимический анализ крови с определением уровня аспартатаминотрансферазы (АсТ), АлТ, щелочной фосфатазы и сывороточного билирубина, овогельминтоскопию кала. При всех гепатобилиарных проявлениях, описанных выше, уровни печеночных ферментов заметно повышены; наиболее выражено это у пациентов с абсцессом печени [11]. Острый панкреатит приводит также к повышению уровня сывороточной амилазы и липазы.
Визуализационные исследования также необходимы. Ультрасонография является особенно специфическим и чувствительным методом выявления билиарного и панкреатического аскаридоза. Поскольку этот метод не является инвазивным и не требует использования анестезии, можно повторить тест, чтобы отследить миграцию паразита. В случаях гепатобилиарного аскаридоза при сканировании в продольной плоскости будет обнаружена гипоэхогенная полоска, содержащая центральную безэхогенную трубку в общем желчном протоке. Поперечная плоскость может отображать возбудителя внутри трубчатого канала [14]. У пациентов с острым панкреатитом ультрасонография покажет увеличенную поджелудочную железу пониженной эхогенности [11].
Терапию печеночной колики, холецистита и острого панкреатита необходимо начать с ограничения перорального приема, внутривенной инфузии жидкости, антибиотикотерапии и анальгезии. Антигельминтную терапию начинают после устранения острых симптомов [13]. Острый холангит – гораздо более серьезное состояние и требует срочной хирургической или эндоскопической декомпрессии и дренирования желчных путей [11]. Печеночный абсцесс устраняется аспирацией гноя под УЗ-контролем с последующим приемом антибиотиков, аналгетиков и антигельминтных средств.
Таким образом, паразитирование A. lumbricoides может проявляться не только в виде аллергической реакции (крапивница), мальабсорбции и, как следствие, железодефицитной анемии и гиповитаминоза, но и приводить к серьезным и потенциально жизнеугрожающим острым хирургическим состояниям: аппендициту, острой кишечной непроходимости, инвагинации и перфорации тонкой кишки, печеночной колике, острому холециститу, холангиту, панкреатиту и абсцессу печени. Своевременная диагностика аскаридоза и адекватная противогельминтная терапия у детей необходимы для профилактики этих осложнений.
1. Khuroo MS. Ascariasis. Gastroenterol Clin North Am. 1996;25:553-577.
2. Murray CL, Lopez AD. Global Health Statistics – A Compendium of Incidence, Prevalence and Mortality Estimates for Over 200 Conditions. Vol II. Boston: Harvard University Press; 1996:394-405.
3. Paul M. The movements of the adult Ascaris lumbricoides. Br J Surg. 1972;59:437-442.
4. Vilamizar E, Mendez M, Bonilla E, et al. Ascaris lumbricoides infestation as a cause of intestinal obstruction in children: experience with 87 cases. J Pediatr Surg. 1996;31:201-205.
5. Efem SE. Ascaris lumbricoides and intestinal perforation. Br J Surg. 1987;74:643-644.
6. Surendran N, Paulose MO. Intestinal complications of round worms in children. J Pediatr Surg. 1988;23:931-935.
7. Ochoa B. Surgical complications of ascariasis. World J Surg. 1991;15:222-227.
8. Tondon A, Choudhury SP, Sharma D, Raina VK. Hypertonic saline enema in gastrointestinal ascariasis. Indian J Pediatr. 1999;66:675-680.
9. Wiersma R, Hadley GP. Small bowel volvulus complicating intestinal ascariasis in children. Br J Surg. 1988;75:86-87.
10. Sandouk F, Haffar S, Zada MM, et al. Pancreatic-biliary ascariasis: experience of 300 cases. Am J Gastroenterol. 1997;92:2264-2267.
11. Khuroo MS, Zargar SA, Mahajan R. Hepatobiliary and pancreatic ascariasis in India. Lancet.1990;335:1503-1506.
12. Khuroo MS, Zargar SA, Yattoo GN, et al. Oddi’s sphincter motor activity in patients with recurrent pyogenic cholangitis. Hepatology. 1993;17: 53-58.
13. Khuroo MS, Zargar SA, Yattoo GN, et al. Ascaris-induced acute pancreatitis. Br J Surg. 1992;79:1335-1338.
14. Mackrell PJ, Lee K, Garcia N, et al. Pancreatitis secondary to Ascaris lumbricoides infestation. Surgery. 2001;129:511-512.
Подготовила Татьяна Потехина
Почему так важно ежегодно проходить флюорографию и периодически сдавать анализы крови? Эти исследования позволяют на ранней стадии выявить некоторые легочные заболевания, ведь большинство из них протекает бессимптомно. К их числу следует отнести синдром Леффлера. Симптомы и лечение патологического процесса, а также основные причины будут рассмотрены в сегодняшней статье.
Описание недуга
Повышенное содержание этих веществ в анализе крови обычно указывает на аллергические/инфекционные процессы в организме, заражение паразитами или опухоль. Инфильтраты отличаются способностью мигрировать по пораженному органу. Они могут сами по себе исчезнуть и не оставить после себя даже рубцовых изменений.
Впервые эозинофильное поражение легочной системы было описано в начале XX века. С тех пор ученым так и не удалось определить синдром Леффлера в конкретные медицинские рамки. Даже многочисленные исследования не смогли дать ответ относительно точных причин и предпосылок его возникновения. Это настоящая медицинская загадка. Нет конкретной информации о возрастных и социальных порогах. В некоторых исследованиях сказано, что синдром поражает только детей, а в группу риска входят жители стран с тропическим климатом. Однако данная патология успешно мигрирует по всей планете. Среди заболевших встречаются и молодые люди, и представители преклонного возраста.
Причины заражения
Несмотря на сложности в выявлении этиологии патологического процесса, врачам удалось определить группу факторов-провокаторов. Примечательно, что характеризующие синдром Леффлера симптомы могут возникнуть после контакта с животными и даже в процессе лечения иных заболеваний.
Среди основных источников заражения врачи выделяют:
- Воздушные аллергены. Развитие синдрома часто наблюдается в качестве ответной реакции организма на пыльцу растений или плесень грибов. Особую опасность представляют химические реагенты.
- Медикаменты. Применение некоторых групп лекарственных препаратов — это маловероятная, но допустимая причина возникновения легочной эозинофилии. Согласно проведенным исследованиям, соответствующую реакцию удалось выявить на антибиотики, действующими веществами которых являются пенициллин и нитрофуран.
- Бактерии (некоторые виды стафилококков, стрептококков и бруцеллы). Патогенная флора передается от больного человека к здоровому через рукопожатие, предметы личной гигиены и еду. После этого она проникает в организм посредством открытых ран. Не исключается воздушно-капельный путь передачи бактерий.
- Глисты. Паразиты попадают в органы дыхания через 2-3 недели после заражения. Это могут быть аскариды, кишечные угрицы, токсокары, трихинеллы или анкилостомы. Подселение происходит как от больных людей, так и после контакта с животными.
Синдром Леффлера МКБ-10 (Международная классификация заболеваний) определяет под кодом J82.

Группа повышенного риска
Медицинская статистика заболеваемости позволяет выделить группу факторов, которые делают человека уязвимым перед синдромом. Речь идет о конкретных привычках и общем состоянии здоровья.
Кто находится в зоне повышенного риска?
- Любители табака. К этой группе также относятся пассивные курильщики. Пагубная привычка ослабляет защитные функции легких.
- Астматики. Примерно у 50 % пациентов с подтвержденной легочной эозинофилией в анамнезе присутствует бронхиальная астма.
- Инфицированные ВИЧ. Главная причина развития патологического процесса — ослабленный иммунитет.
- Больные онкологическими недугами.
- Путешественники. В большей степени это касается туристов, исследующих страны Азии и Африки.
Принадлежность к одной или одновременно нескольким категориям из списка выше существенно повышает вероятность развития легочной эозинофилии.
Клиническая картина
Какие имеет синдром Леффлера симптомы? Среди основных проявлений патологического процесса врачи выделяют: повышение температуры, общее недомогание и слабость. Некоторых пациентов мучает слабый кашель и отхождение желтоватой мокроты, что объясняется присутствием погибших эозинофилов.
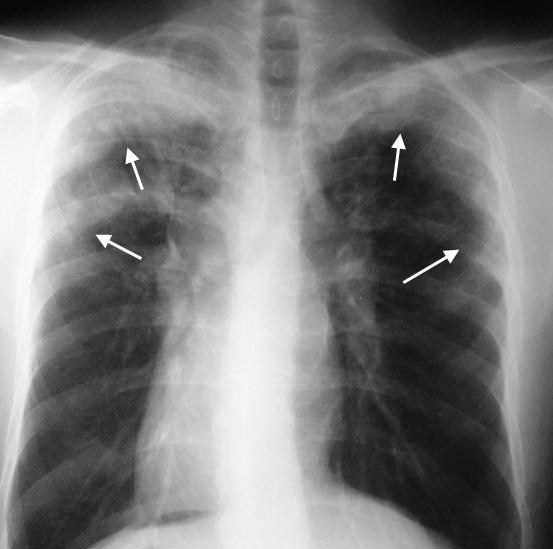
На снимке после рентгенологического исследования можно рассмотреть единичные или множественные очаги скопления инфильтратов. При этом их размеры и локализация варьируются. Если у заразившегося крепкая иммунная система, инфильтраты обычно самостоятельно рассасываются в течение 2-3 недель.
Во время аускультативной диагностики можно выявить еще один симптом — сухие хрипы. Как правило, они обнаруживаются в верхних сегментах легких. Биохимический анализ крови показывает наличие лейкоцитоза на фоне большого числа эозинофилов (60-80 %).

Течение патологического процесса
Данное заболевание может протекать в одной трех форм. Рассмотрим каждый из вариантов более подробно.
- Простая форма. Характеризуется неяркой клинической картиной. Во время кашля возможно выделение мокроты с примесями крови, а в районе трахеи появляется дискомфорт. Если заражение вызвано проникновением гельминтов в организм, а их яйца находятся в системе ЖКТ, развивается панкреатит.
- Острая форма. Синдром Леффлера начинается с внезапного повышения температуры и характеризуется тяжелым течением. У больного наблюдаются симптомы интоксикации. За небольшой промежуток времени развивается дыхательная недостаточность. Лечение всегда проводится в условиях стационара.
- Хроническая форма. Чаще всего выявляется у женщин, страдающих от бронхиальной астмы. Среди основных симптомов врачи выделяют сильную потливость, потерю веса и одышку.
Определение формы патологического процесса помогает правильно подобрать терапию.
Методы диагностики
Описанная выше клиническая картина не является достаточным основанием, чтобы подтвердить синдром Леффлера. Симптомы у детей данной патологии и у взрослых практически не отличаются, поэтому всем категориям пациентов назначается общее комплексное обследование. Оно состоит из следующих мероприятий:
- Рентгенограмма. На снимке при легочной эозинофилии можно отчетливо рассмотреть темные пятна. Это и есть инфильтраты.
- Анализ крови. В норме в крови у здорового человека число эозинофилов не должно превышать отметку в 5-10 %. Увеличение данного показателя до 20-80 % позволяет заподозрить синдром Леффлера. Количество эозинофилов у детей в здоровом теле не отличается от этого параметра у взрослых.
- Анализ мокроты. Секрет проверяют на наличие кристаллических образований из ферментов эозинофилов.
- Анализ кала. Проводится с целью выявления паразитов в организме.
- Аллергологические пробы.
Важной составляющей диагностики является изучение анамнеза пациента. Это неотъемлемая часть процесса установления причин и обстоятельств заражения. Без этих составляющих невозможно назначить грамотное лечение.

Рекомендуемая терапия
Достаточно часто в особом лечении не нуждается синдром Леффлера. Симптомы у взрослых и детей за короткий срок самостоятельно проходят и никогда больше не появляются. Единственное научное объяснение данному факту — отсутствие контакта с аллергеном.
В остальных случаях терапия сводится к исключению провоцирующих его развитие факторов. Например, при заражении паразитами из организма выводят гельминтов. Если причина в принимаемых медикаментах, подбирают аналоговые средства.
Иногда синдром Леффлера не удается победить даже после интенсивной терапии. В этом случае может понадобиться подключение к аппарату ИВЛ и более стрессовое медикаментозное лечение. Среди препаратов, которые назначают при борьбе с легочной эозинофилией, можно выделить:
Медикаментозную терапию может назначить только врач. Самолечение не рекомендуется, поскольку обычному человеку трудно рассчитать дозировку препаратов и длительность их приема. В противном случае редко удается избежать серьезных осложнений.

Антипаразитарный курс лечения
Синдром Леффлера при аскаридозе — это довольно распространенное явление. Поэтому целесообразно отдельно рассмотреть, какие медикаменты используются для борьбы с этой проблемой. Если верить врачам, отлично себя зарекомендовали:
При тяжелой форме глистной инвазии, когда перечисленные медикаменты не справляются со своей первоочередной задачей, больного госпитализируют. В противном случае может наступить полное обезвоживание.

Последствия для организма
Синдром Леффлера хорошо поддается лечению. От терапии не стоит отказываться еще в течение месяца после исчезновения симптомов. Иначе воспалительный процесс продолжит прогрессировать, а аллергия спровоцирует отек легких. Также не стоит исключать фиброз — это еще одно осложнение синдрома. Оно сопровождается необратимым рубцеванием легочной ткани. Недуг может отражаться на работе сердечной системы, органов пищеварения. На фоне развивающегося дефицита кислорода не исключено нарушение функций головного мозга.
Вероятность рецидива
Отдельно необходимо поговорить о случаях рецидива. Чаще всего с ними приходится сталкиваться вследствие неправильной или несвоевременной диагностики, плохого лечения. После курса терапии внешне пациент может выглядеть вполне здоровым. Однако обыкновенный стресс или очередной контакт с аллергеном провоцируют очередной рецидив.

Способы профилактики
Можно ли предупредить Леффлера болезнь? Что это действительно опасный недуг, теперь не возникает сомнений. Поэтому многие люди, относящиеся к группе риска, интересуются вопросами профилактики.
Основной превентивной мерой считается регулярное посещение кабинета аллерголога. Если патология отличается именно этой этиологией, необходимо четко следовать советам специалиста и принимать рекомендуемые лекарства. Домой нужно обязательно купить стандартный набор медикаментов, при помощи которого можно купировать очередной приступ аллергии.
ЛЕФФЛЕРА СИНДРОМ (W. Loffler, швейцарский врач, род. в 1887 г.; син.:летучие легочные инфильтраты, эозинофильная пневмония, эозинофильные инфильтраты легкого) — сочетание транзиторных инфильтратов легких, определяемых при рентгенологическом исследовании, с высокой эозинофилией крови. Подобные инфильтраты обнаруживаются и в других органах.
Описан впервые Леффлером в 1932 г. Встречается во всех странах относительно редко, в тропических странах чаще.
Содержание
Этиология
Вызывается различными патогенными факторами. Основной этиол, фактор — инвазии гельминтами (аскаридами, анкилостомами, трихинами, плоскими червями Taenia saginata, печеночной двуусткой, шистосомами, стронгилоидами, а также кошачьей двуусткой), личинки к-рых мигрируют через легкие. Известны случаи заражения людей, особенно детей, личинками Toxocara — аскаридоподобного паразита собак и кошек. Личинки Toxocara мигрируют через легкие, но, в отличие от личинок аскарид, образуют цисты в легких, печени и других органах, не достигая зрелости. Процесс миграции этих личинок может сопровождаться Л. с. Вторая группа этиол. факторов Л. с.— хим. агенты и лекарства. Известны случаи Л. с. при проф. контакте с никелем и цинком и от многих лекарств как при проф. контакте, так и при леч. применении (пенициллин, ацетилсалициловая к-та, сульфаниламиды, нитрофураны, ПАСК, рентгеноконтрастные вещества и др.). Описаны случаи Л. с. у женщин, получавших по поводу рака молочной железы гормональные препараты (тестостерон-пропионат и синэстрол) в сочетании с лучевой терапией. Третья группа этиол. факторов — различные экзогенные аллергены (пыльца растений, споры грибков, табак и др.), вызывающие атопические заболевания респираторного аппарата (см.Атопия). Транзиторные эозинофильные легочные инфильтраты описаны в числе других проявлений сывороточной болезни, а также узелкового периартериита, протекающего с высокой эозинофилией; имеются указания на их связь с туберкулиновой аллергией и амебиазом. Нередко этиология Л. с. остается неясной.
Патогенез
Клиническая картина
Наиболее характерными в клин, картине Л. с. являются инфильтраты в легких, к-рые выявляются при рентгенол, исследовании, и эозинофилия крови (от 7 до 70%) при умеренно выраженном лейкоцитозе. Жалобы и симптомы (небольшой сухой кашель, легкое недомогание, слабость, потливость, субфебрильная температура) могут отсутствовать или быть очень скудными. Перкуторно при обширных инфильтратах определяется укорочение легочного звука. Аускультативно изредка выслушиваются в небольшом количестве влажные мелко-пузырчатые хрипы. Чаще поражается верхняя доля правого легкого. Описано сочетание эозинофильных легочных инфильтратов с сухимплевритом (см.), при этом могут быть боли при дыхании в соответствующей половине грудной клетки и прослушиваться шум трения плевры. Симптомы продромального периода могут протекать в виде катарального ринофарингита. Иногда температура достигает 38—39 °. В мокроте, если она отделяется, определяются преимущественно эозинофилы.
Для заболевания характерно легкое течение. Спонтанное выздоровление наступает через несколько дней или 2—4 нед. Инфильтраты держатся более продолжительно, вероятно в тех случаях, когда в патогенезе, помимо анафилактических реакций, участвуют реакции по типу феномена Артюса. Осложнений, как правило, не бывает.
При локализации эозинофильных инфильтратов в других органах обычно наблюдаются легкие быстро-преходящие симптомы поражения соответствующих органов и систем— гастрит, панкреатит, аппендицит, менингоэнцефалит и др.— в сочетании с эозинофилией крови.
Диагноз
Диагноз устанавливают на основании рентгенол, данных с их характерной быстрой динамикой и наличия выраженной эозинофилии крови. Часто Л. с. выявляется случайно при профилактическом рентгенол. обследовании.
Наиболее типичным рентгенол, проявлением Л. с. является тень одиночного инфильтрата, расположенного в любом отделе легкого, небольшой или средней интенсивности и, как правило, ее размеры 3—4 см в диаметре. Форма тени обычно неправильная, очертания нечеткие (рис. 1). Окружающий легочный рисунок усилен в связи с местной гиперемией. В большинстве случаев тень соответствующего корня легкого слегка расширена, структурна. При многопроекционном исследовании удается установить, что инфильтрат располагается чаще в плащевидном слое легкого. В связи с этим нередко можно выявить утолщение плевры, расположенной в непосредственной близости к инфильтрату. Характерным для динамики инфильтрата при Л. с. является его исчезновение через 1 — 3 дня после выявления; на месте бывшего инфильтрата в течение нескольких дней остается постепенно уменьшающееся усиление легочного рисунка. Такая быстрая динамика дала основание назвать эти инфильтраты летучими. Реже при Л. с. встречаются инфильтраты, принимающие форму анатомических структур — сегментов, долей, и множественные инфильтраты, к-рые иногда могут быть двусторонними (рис. 2). Быстрое исчезновение является типичным для всех видов инфильтратов при Л. с. В относительно редких случаях инфильтраты могут рецидивировать. В отдельных случаях при наличии крупных инфильтратов можно обнаружить небольшой транссудат в плевральной полости, к-рый рассасывается в течение нескольких дней.
Необходимо отличать эозинофильные инфильтраты в легких при Л. с. от эозинофильных инфильтратов как следствия эмболии легочных сосудов, обусловленной лимфографией. Наличие инфильтратов требует в ряде случаев дифференциальной диагностики с бактериальными и вируснымипневмониями (см.), туберкулезом, в т. ч. милиарным (см.Туберкулез органов дыхания).
Дифференцировать Л. с. необходимо с синдромом Вайнгартена (см.Вайнгартена синдром) и синдромом Лера—Киндберга, для к-рого характерно острое начало болезни, септическая температура (держится неделями), озноб, потливость, эозинофилия и лейкоцитоз, рентгенологически — легочные инфильтраты и плевральный выпот. Скудность и невыраженность клин, симптомов, наличие эозинофилии должны навести на мысль о Л. с. В дальнейшем транзиторный характер инфильтратов в легких решает диагноз в пользу Л. с.
Лечение
Если не наступает спонтанного выздоровления, проводят лечение кортикостероидными гормонами. Курс лечения начинают с дозы 15—20 мг в день (в пересчете на преднизолон), через день дозу снижают на 5 мг; курс продолжается от 6 до 8 дней. Этого курса бывает достаточно для полного выздоровления.
При синдроме Леффлера, вызванном глистной инвазией, проводится соответствующее лечение.
Прогноз благоприятный, выздоровление может наступить без всякого лечения.
К мерам профилактики Л. с. относится специфическаягипосенсибилизация (см.) больных атопическими заболеваниями.
Следует помнить также о различных мерах профилактикилекарственной аллергии (см.).
Библиогр.: Курашова М. В. и Белова Е. В. Синдром Леффлера, Клин, мед., т. 53, JSii 3, с. 13, 1975; Л и нденб р а т e н Л. Д. и H а у м о в Л. Б. Рентгенологические синдромы и диагностика болезней легких, М., 1972: Я с и н о в- с к и й М. А., Г а н д ж а И. М. и Лернер П.П. Поражения легких при ревматизме и некоторых аллергических заболеваниях, Киев, 1969, библиогр.; Loffler W. Zur Differential-Diagnose der Lungenin-filtrierungen, Uber fliichtige Succedanin-filtrate (mit Eosinophilie), Beitr. Klin. Tuberk., Bd 79, S. 368, 1932; Teschendorf W., A n a с k e r H. u. T h u r n P. Rontgenologische Differentia! diagnostik, Bd 1, T. 1, Stuttgart, 1975; U d w a d i a F. E. Pulmonary eosinophilia, Progr. Respirat. Res., y. 7, p. 275, 1975.
H. B. Адрианова; Л. С. Розенштраух (рент.).
Источник: Большая Медицинская Энциклопедия (БМЭ), под редакцией Петровского Б.В., 3-е издание
Читайте также:


