Размер генома кишечной палочки
В настоящее время E. coli, несомненно,
представляет собой самую изученную,
клетку из всех существующих.
Кишечная палочка Escherichia coli - классический объект молекулярной генетики, на котором исследованы наиболее принципиальные проблемы организации генетического материала. Штамм E. coli K12 был успешно использован Дж.Ледербергом и Э.Тейтумом в 1946 г. для доказательства существования рекомбинаций у бактерий. Позже Дж.Ледерберг построил для нее первую генетическую карту, а Ф.Жакоб и Э.Вольман - первую кольцевую карту. В 1963 г. Дж.Кернс сфотографировал кольцевой геном E. coli в процессе его репликации.
Зачем это нужно? Клеточный геном представляет собой сбалансированную систему генов - архив генетической информации, достаточной для контроля всего клеточного метаболизма, развития, морфогенеза, самовоспроизведения [1, 2]. В частности, геном клетки содержит гены всех основных генетических процессов - репликации, транскрипции, трансляции, репарации, рекомбинации, сегрегации и т.д. Полное секвенирование генома позволяет сопоставить и оценить генетическую сложность тех или иных молекулярных систем и геномов, выявить ранее неизвестные гены, выполнить сравнительный анализ функционального и структурного сходства различных генов и геномов, выявить общие принципы организации сложных клеточных молекулярно-генетических систем управления.
Работа по проекту полного секвенирования генома E. coli K12 была начата в 1991 г. под руководством д-ра Фреда Блаттнера (лаборатория генетики, Висконсинский университет, г. Медисон, США). В январе 1997 г. основные результаты были переданы в компьютерную базу данных GenBank [3], а в сентябре 1997 г. в американском журнале "Science" появилась итоговая статья коллектива участников секвенирования [4]. Полная последовательность ДНК генома E. coli K12 стала достоянием науки. Ниже мы приведем в сводной форме основные результаты этих работ с необходимыми комментариями, имея в виду, что такой уникальный материал позволяет ответить на многие принципиальные вопросы молекулярно-генетической организации и эволюции.
| Таблица 1 Общие характеристики некоторых секвенированных прокариотических и эукариотических клеточных геномов | |||
Заметим также, что параллельно с E. coli были секвенированы многие другие клеточные геномы бактерий и эукариот. К концу 1997 г. было опубликовано 8 полных клеточных геномов, а к лету 1998 г. - уже 15 (табл. 1). Среди них геномы микоплазм, энтеробактерий, архебактерий, дрожжей, нематоды. На очереди геномы других бактерий и грибов, а также дрозофилы, арабидопсиса, пшеницы, риса, кукурузы, мыши и, наконец, человека. В целом это направление теперь называют геномикой. Это, вероятно, одна из главных точек роста современной молекулярной генетики.
Общие характеристики последовательности ДНК генома E. coli K12 таковы: 87,8% генома занимают реальные и вероятные белок-кодирующие гены, или цистроны. Примерно 1/3 из них была известна ранее, а остальные выбраны среди огромного числа новых открытых рамок трансляции (возможных цистронов, или ORF) путем сложного сопоставления многих свойств, имеющих характерные различия между кодирующими и некодирующими районами. Функции 38% этих цистронов неизвестны.
- 0,8% - гены стабильных фракций РНК (т-РНК, р-РНК и др.).
- 0,7% - некодирующие повторы.
- 11,0% генома - функциональные сайты и другие участки, выполняющие регуляторные и другие функции.
Таким образом, геном E. coli K12 очень плотно нагружен генами (
88,5%), а межгенные участки занимают относительно малую долю (
11%). Среди 4288 выявленных или предсказанных цистронов 1853 описаны ранее, а 2435 - новые. Самый большой цистрон содержит 7149 нп. (2383 кодона), функция его неизвестна. Средний размер цистрона 951 нп. (317 кодонов). Средний интервал между цистронами - 118 нп. Однако межгенны интервалы в большинстве своем содержат различные функциональные сайты, то есть выполняют регуляторные функции. Кроме того, цистроны не содержат интронов - внутренних некодирующих участков.
Известно, что цистроны выделяются в ДНК и м-РНК начальными и конечными знаками пунктуации. В общей форме они были известны ранее и внесены в генетический код. Однако в геноме E. coli они встречаются с различными частотами:
Начальные знаки пунктуации
Конечные знаки пунктуации
ATG - 3542
TAA - 2705
GTG - 612
TGA - 1257
TTG - 130
TAG - 326
ATT - 1
CTG - 1
Интересно, что у 405 пар смежных цистронов вообще нет межгенных интервалов: знак начала трансляции одного частично перекрывается с конечным знаком другого:
По данным на январь 1998 г. [5] сложность молекулярно-генетической системы управления и метаболической сети E. coli можно охарактеризовать следующим образом:
1. Длина ДНК генома (Мб)
2. Полное число генов
3. Число цистронов
4. Число кодируемых ими ферментов
5. Число метаболических реакций
6. Число метаболических путей
7. Число химических веществ, участвующих в метаболизме
8. Число фракций т-РНК (генов т-РНК)
79 (86)
9. Число регуляторных белков
В таких случаях специалисты говорят: "жизнь при 4909 генах". Метаболизм сложен, но не запредельно. В дальнейшем приведенные цифры могут возрасти в ходе исследований за счет новых знаний.
Более подробная классификация цистронов по 22 функциональным классам представлена в таблице 2. Здесь примерно 1/4 клеточных ресурсов связана с метаболизмом малых молекул, 1/8 - с метаболизмом макромолекул и 1/5 - с клеточными структурами и процессами. В метаболизме малых молекул ключевую роль играет синтез, распад и преобразование нуклеотидов (58 цистронов), аминокислот (131); энергетические процессы (243), транспорт (146), центральный промежуточный метаболизм (188) и другие процессы. В частности, системы, выполняющие основные генетические процессы, содержат:
- репликацию, рекомбинацию, модификацию и репарацию ДНК - 115 (2,68%);
- трапскрипцию, синтез, метаболизм и модификацию РНК - 55 (1,28%);
- трансляцию и посттрансляционную модификацию белков - 182 (4,24%) + 21 ген р-РНК + 86 генов т-РНК.
Кроме того, найдено 9 цистронов, контролирующих синтез шаперонов - вспомогательных белков, способствующих формированию правильной пространственной упаковки всех остальных белков. Этот процесс называется самоорганизацией, или фолдингом белков.
Помимо различных вспомогательных функций, эти системы в совокупности образуют сайзер - универсальную систему самовоспроизведения клетки [1, 2]. Сайзер составляет сердцевину молекулярно-генетической системы управления клетки. Несмотря на внушительное число участвующих генов (
460, свыше 10% всех генов), принципиальная блок-схема сайзера достаточно проста [1, 6].
Далее рассмотрим разнообразие функциональных единиц транскрипции. Для генома E. coli и других энтеробактерий характерно присутствие управляемых единиц транскрипции - оперонов. Первые опероны были открыты именно у E. coli: lac-опе-рон, контролирующий сбраживание сахара лактозы, trp-оперон, контролирующий синтез аминокислоты триптофана, и др. [см. 6]. Важной особенностью оперонов является наличие обратной связи между концентрацией контролируемого метаболита и наработкой ферментов его синтеза или распада. Всего в геноме E. coli выявлено и предсказано 2584 оперона. Среди них: 73% содержат 1 цистрон;
- 16% - 2 цистрона;
- 4,6% - 3 цистрона (в том числе lac -оперон);
- 6% - 4 и более цистронов (в том числе trp-, his -опероны).
Все они имеют не менее 1 промотора - начального знака транскрипции.
Опероны управляются регуляторными белками через специфические функциональные сайты управления. Например, белок-репрессор lac -оперона узнает его оператор - функциональный сайт и через него подавляет функцию инициации транскрипции. Иногда опероны подчинены нескольким регуляторным белкам и имеют несколько регуляторных сайтов [1, 6].
Всего по данным секвенирования выявлены 45 цистронов белков с регуляторными функциями и еще цистроны 133 предполагаемых регуляторных белков. Большинство из них, вероятно, участвует в управлении оперонами.
Так, внутри областей с предсказанными сайтами управления (в основном оперонов)
- 89,2% регулируются 1 белком (в том числе trp- оперон);
- 8,4% - 2 белками (в том числе lac -оперон); - 2,4% - 3 и более белками.
В свою очередь эти области содержат
- 81,2% - 1 сайт управления;
- 12,2% - 2 сайта управления (в том числе lac- оперон);
- 6,6% - 3 и более сайтов управления.
Это значит, что большинство оперонов регулируется достаточно просто. Этим они существенно отличаются от генов эукариот, которые подвержены действию многих общих и специфических белковых факторов управления.
Геном E. Coli содержит 2 функциональные единицы репликации. Ф.Блаттнер и др. назвали их реплихорами [4].
Общее двустороннее начало репликации (ori, origin) локализовано на участке примерно 84,5 мин конъюгационного переноса и занимает
250 нп. В этой зоне инициируется двусторонняя репликация. Реплихор 1 ориентирован по часовой стрелке, реплихор 2 - против нее. Оба процесса заканчиваются на противоположном участке генетической карты,
34-35 мин., где каждый из них имеет свой отдельный ориентированный терминальный знак (ter) - T1 и T2. Следует отметить, что традиционно участки репликации, ограниченные знаками ori и ter, называют репликонами [6].
- 691
- 0,6
- 0
- 4
Электронная микрофотография клетки Ca. Carsonella rudii. Шкала — 200 нм.
Определение минимального набора генов, необходимого для функционирования живого организма, долгое время привлекало внимание исследователей. Особенно интересны в этом отношении организмы с очень небольшим числом генов, а именно, свободноживущие и эндосимбиотические прокариоты, имеющие всего нескольких сотен генов (для сравнения, геном кишечной палочки Escherichia coli содержит около 4200 генов, а в геноме миксобактерии Sorangium cellulosum насчитывается более 11 тысяч генов). Чем отличается метаболизм клеток с такими маленькими геномами? Какие процессы привели к утрате огромного числа генов? Ответам на эти вопросы и посвящен наш обзор.
Геномы с необычно низким количеством генов (или редуцированные геномы) можно найти среди прокариот двух экологических групп: свободноживущих морских бактерий и бактерий-эндосимбионтов. Считается, что в случае свободноживущих микроорганизмов уменьшению числа генов способствует отбор, а у эндосимбиотических бактерий большую роль играют нейтральные процессы, а именно, утрата генов, которые просто-напросто стали ненужными в связи с образом жизни. Действительно, зачем таскать с собой при каждом делении множество генов замысловатых метаболических путей, когда почти все необходимое поставляется или организмом-хозяином, или другим организмом-симбионтом? Особенно любопытно, что среди очень маленьких геномов периодически попадаются такие, которые выбиваются из общего тренда эволюции бактериальных геномов — снижения GC-состава и сохранения порядка следования генов друг за другом (синтении). Кроме того, ученые уже много лет работают над получением бактерий с искусственно уменьшенными геномами и достигли определенных успехов.
В статье мы обсудим, как устроены самые маленькие геномы и как их обладатели приспособились к жизни с таким количеством генов, а также коснемся последних достижений по получению бактерий с искусственно уменьшенными геномами.
Свободноживущие прокариоты с малым числом генов
До появления и широкого распространения современных молекулярно-генетических методов считалось, что свободноживущие прокариоты имеют не менее 1300 генов. Однако в 2013 году с помощью метагеномики в образце воды из Средиземного моря описали актинобактерию Candidatus Actinomaria minuta, геном которой содержит всего лишь 800 генов. Как оказалось впоследствии, эта бактерия и сама по себе весьма миниатюрна: объем ее клеток составляет лишь 0,013 мкм 3 [2].
Среди свободноживущих архей обладателем мельчайшего генома считается Methanothermus fervidus: в его ДНК насчитывается 1311 белок-кодирующих генов и 50 генов, соответствующих некодирующим РНК [2] (рис. 1).
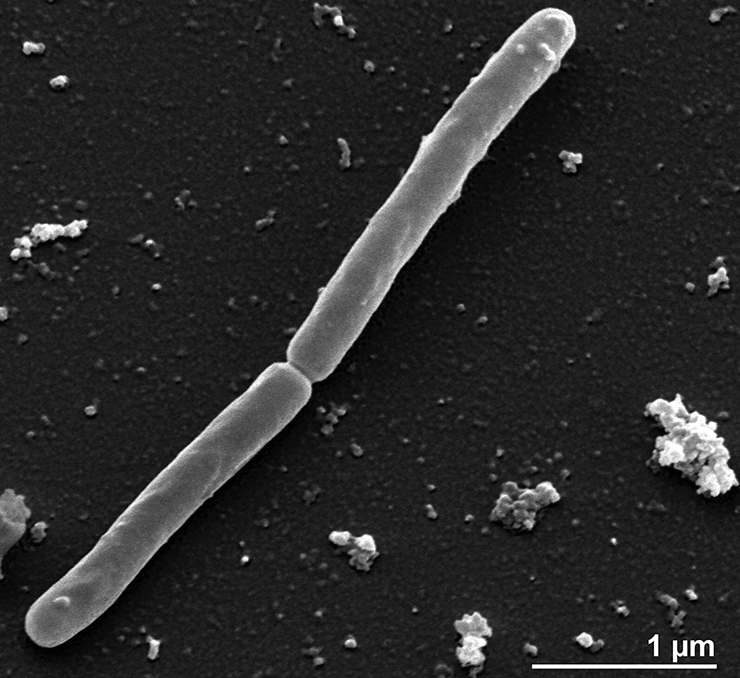
Рисунок 1. Methanothermus fervidus — архея с одним из самых маленьких геномов в своем домене. Фотография получена методом сканирующей электронной микроскопии.
Примерно столько же генов имеется у наиболее разнообразной группы морских гетеротрофных α-протеобактерий, известной как SAR11, и группы β-протеобактерий под названием OM43. Геномы фотосинтезирующих бактерий, как правило, содержат больше генов. Малое число генов имеется и у некоторых неморских прокариот: так, геном сапротрофной бактерии Acholeplasma laidlawii содержит 1380 белок-кодирующих генов, лактобацилла Weissela koreensis имеет 1335 генов, а архея Desulphurococcus mucosus, относящаяся к типу кренархеот и обладающая способностью к серному дыханию, — 1371 ген [2].
Что является движущей силой уменьшения числа генов у свободноживущих прокариот? На этот счет существует несколько гипотез.
Согласно гипотезе рационализации (streamlining hypothesis), естественный отбор поддерживает уменьшение генома свободноживущих прокариот, населяющих местообитания, бедные питательными веществами. Когда в геноме клетки происходит делеция, увеличивающая ее приспособленность, она быстро фиксируется в популяции: в условиях нехватки питательных веществ клеткам невыгодно волочить за собой большой геном, на поддержание которого тратится много энергии и других ресурсов.
Гипотезой рационализации можно объяснить и стремление к понижению GC-состава у свободноживущих микроорганизмов, населяющих бедные среды (в их ДНК суммарная доля гуанина и цитозина, как правило, не превышает 36%). Дело в том, что для репликации генома с низким GC-составом требуется меньше фосфора и азота. Кроме того, в скудных условиях клетке выгодно иметь большое соотношение площади поверхности к объему, чтобы более эффективно поглощать питательные вещества, а снижение объема клетки неизбежно ведет к уменьшению ее генома.
Стоит отметить, что уменьшить геном можно не только за счет утраты белок-кодирующих генов. Так, у бактерии Ca. Pelagibacter ubique с геномом в 1308 т.п.н. среднее расстояние между генами составляет лишь три нуклеотида, а псевдогенов, профагов или дуплицированных генов нет совсем [2].
Гипотезу рационализации удалось проверить в лабораторных условиях. Ученые получили штаммы Salmonella enterica, имеющие большие делеции, причем некоторые из них оказались более приспособленными к окружающим условиям, чем бактерии дикого типа [2].
При уменьшении размеров генома зачастую утрачиваются гены, белковые продукты которых задействованы в репарации, поэтому иногда у бактерий с редуцированными геномами (например, у ряда свободноживущих цианобактерий, а также симбиотических организмов) наблюдается повышенная скорость мутирования белок-кодирующих последовательностей. Это в некоторых условиях может быть на руку бактериям, например, при освоении новых местообитаний. Штаммы, отличающиеся повышенной частотой приобретения мутаций, иногда называют мутаторными [2].
Нас и здесь неплохо кормят: почему эндосимбиотические бактерии теряют множество генов
Уменьшение размеров генома происходит наиболее стремительно после того, как симбиоз становится облигатным, то есть бактерия оказывается неспособной существовать без своего хозяина. Так, эндосимбионт рисового долгоносика (Sitophilus oryzae), Candidatus Sodalis pierantonius, потерял 55% своих генов в течение всего лишь 28 тысяч лет — невероятно короткий срок по эволюционным меркам. Эта бактерия живет внутри специализированных клеток — бактериоцитов и имеет довольно внушительный геном, содержащий 2309 белок-кодирующих генов и 1771 псевдогенов. Еще более удивительно, что около 18% ее генома приходится на мобильные генетические элементы, на совести которых лежат многочисленные геномные перестройки Ca. Sodalis pierantonius и около 10% случаев инактивации генов. Однако стремительное уменьшение числа активных генов и размеров генома может происходить и без участия транспозонов. Например, бактерия Polynucleobacter necessaries, обитающая в клетках инфузории Euplotes aediculatus, утратила более 40% белок-кодирующих генов, хотя мобильных генетических элементов в ее геноме нет [2].
На завершающих этапах формирования эндосимбиотических отношений геном бактерии становится существенно стабильнее, и постоянство расположения генов на хромосоме (синтения) является одной из отличительных черт облигатных мутуалистических бактерий. Первоначально такую стабильность связывали с утратой эндосимбиотическими бактериями гена recA, продукт которого играет важнейшую роль в гомологичной рекомбинации. Однако впоследствии выяснилось, что у многих таких микробов со стабильными геномами ген recA все-таки есть. Верно и обратное: сокращение числа генов, кодирующих белки рекомбинации и репарации, не гарантирует стабильность генома. Эндосимбионт белокрылки Bemisia tabaci, Candidatus Portiera aleyrodidarum, отличается выраженным геномным полиморфизмом, который наблюдается даже среди бактерий, населяющих одно и то же насекомое, хотя активных генов рекомбинации и репарации у него чрезвычайно мало [2].
Известны две бактерии с крайне редуцированными геномами, которые, тем не менее, имеют необычно высокий для эндосимбионтов GC-состав. Речь идет о двух эндосимбионтах цикады Diceroprocta seminitica — Candidatus Hodgkinia cicadicola и Candidatus Sulcia muelleri. Геном ходжкинии достигает лишь 144 т.п.н. в длину, однако его GC-состав равен 58%. Причины, лежащие в основе повышения GC-состава, неясны. Часто этому могут способствовать ферменты, задействованные в конверсии генов, однако у ходжкинии таких белков нет. Польза от столь высокого GC-состава для эндосимбиотической бактерии также не очевидна [2].
У бактерии Candidatus Riesia pediculicola, обитающей в теле вшей Pediculus humanus corporis, есть другая особенность аппарата трансляции: набор ее тРНК сокращен до допустимого минимума. Эта бактерия утратила все ферменты, модифицирующие тРНК, за исключением тех, которые модифицируют антикодоновую шпильку. Именно эта часть молекулы тРНК принимает участие в распознавании комплементарного кодона в мРНК. Некоторые исследователи предположили, что такой скромный набор тРНК у Candidatus Riesia pediculicola похож на набор тРНК самых древних клеток. Действительно, фермент псевдоуридинсинтаза А, ответственный за появление псевдоуридинов в антикодоновой шпильке тРНК, имелся у последнего общего предка всех форм жизни. Однако пока неясно, насколько древними являются те немногие ферменты модификации тРНК, которыми обладает Candidatus Riesia pediculicola [2].
Стоит заметить, что эндосимбиотические бактерии не только теряют гены, но порой и приобретают. Когда в организме одного и того же хозяина обитает несколько бактерий-эндосимбионтов, между ними нередко происходит горизонтальный перенос генов, причем в некоторых случаях в обмене участвуют и гены самого хозяина. В качестве примера можно привести бактерию Ca. Carsonella rudii, которая является облигатным эндосимбионтом листоблошки Pachyphsylla venusta. Она обладает одним из мельчайших известных геномов: он состоит лишь из 160 т.п.н. и содержит 213 генов, среди которых нет ряда генов, необходимых для функционирования любой живой клетки. Однако карсонелла способна жить припеваючи и в отсутствие других эндосимбионтов в организме насекомого. Как показал детальный транскриптомный анализ, биосинтез ряда аминокислот карсонелла осуществляет совместно с бактериоцитом, в котором живет: некоторые реакции катализируют ферменты бактерии, другие — эукариотической клетки. Примечательно, что многие ферменты метаболизма аминокислот в бактериоцитах кодируются генами бактериального происхождения, вероятно, приобретенными от других эндосимбионтов (рис. 2) [2].
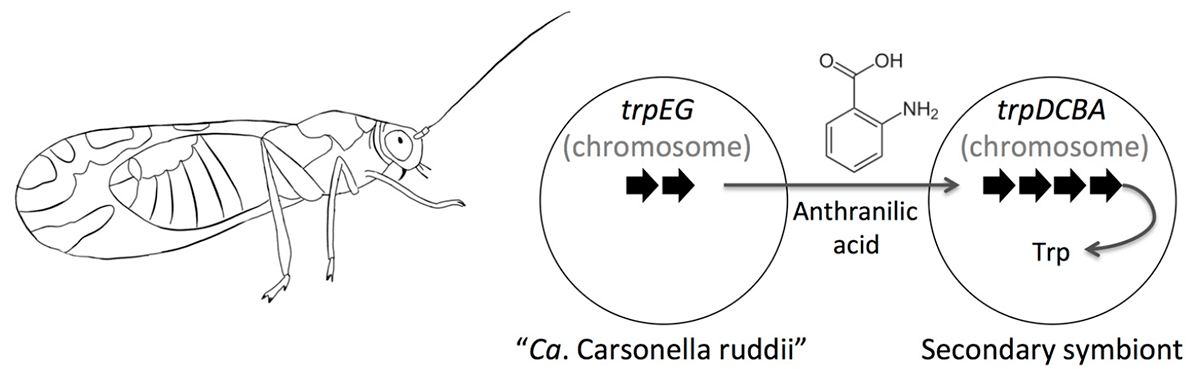
Рисунок 2. Схема синтеза триптофана в симбиотическом союзе листоблошки и Ca. Carsonella rudii. Ca. Carsonella rudii синтезирует антраниловую кислоту, которая превращается в триптофан под действием ферментов другого симбионта или ферментов, которые бактериоцит от него позаимствовал.
В обмен генами с эндосимбиотическими бактериями вступают не только насекомые, но и другие организмы. Например, нематода Brugia malayi более 10% своего генома обязана эндосимбиотической бактерии из рода Wolbachia. А некоторые бактерии приспособились к жизни внутри грибов [2].
Иногда сам хозяин становится зависимым от своих эндосимбионтов. Например, бактерии Buchnera aphidicola и Ca. Serratia symbiotica совместно снабжают своего хозяина, тлю Cinara cedri, триптофаном: часть ферментов его биосинтеза кодируется плазмидой B. aphidicola, а остальные — геномом Ca. Serratia symbiotica [2].
Наконец, эндосимбиотические бактерии иногда сами становятся хозяевами для других бактерий, образуя подобие матрешки. Обладательница одного из самых маленьких геномов Ca. Tremblaya princeps, живет в бактериоцитах войлочника Planococcus citri, но и сама является хозяином бактерии Ca. Moranella endobia. Эти бактерии сами по себе не имеют полного набора генов почти всех жизненно важных метаболических путей, однако взаимно дополняют друг друга, так что в их тандеме имеются все необходимые ферменты. Впрочем, как организован столь запутанный метаболический круг, неясно, поскольку непосредственного перемещения белков между цитоплазмами двух бактерий пока не удалось показать [2].
Синтетическая биология: сделаем мельчайший геном сами
В наше время исследователи располагают внушительным арсеналом методов редактирования геномов и синтеза протяженных последовательностей ДНК, что открывает перспективы создания новых форм жизни с геномами, собранными в лаборатории. Область биологии, занимающаяся созданием искусственных форм жизни и биологических систем, получила название синтетической биологии .
Подробнее о синтетической биологии и создании искусственной жизни читайте в наших статьях [3–5].
Пионером в области искусственных геномов стал известный ученый Крейг Вентер, изобретатель секвенирования методом дробовика и один из ведущих ученых, работавших над секвенированием генома человека. Его группа смогла в лабораторных условиях воссоздать геном бактерии Mycoplasma mycoides, который далее внесли в клетки другой микоплазмы, Mycoplasma capricolum, из которых предварительно удалили ее собственную ДНК. Сенсационные результаты получения нового вида бактерий, названного Mycoplasma laboratorium, были опубликованы в Science в 2010 году [6].
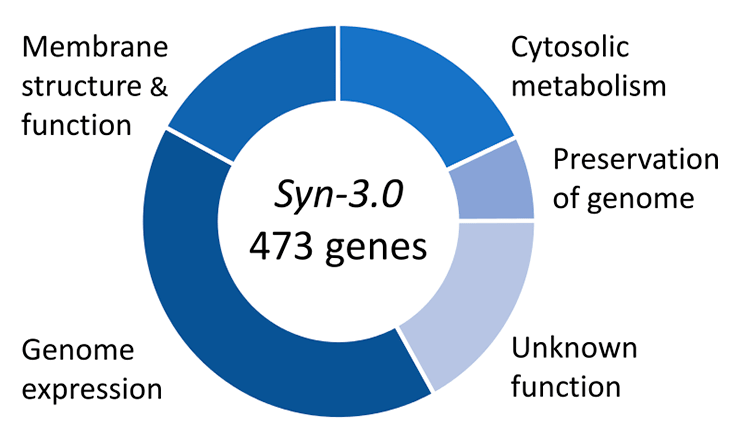
Рисунок 3. Функции генов в минимальном геноме, сконструированном в 2016 году на основе генома M. mycoides.
Стоит заметить, что предпринимались попытки уменьшить геном и других бактерий, правда, не для получения минимально возможного генома, а для других целей: например, клеток, эффективно производящих определенные вещества. Уменьшение генома проводили для кишечной палочки Escherichia coli, еще одной микоплазмы Mycoplasma genitalium, Bacillus subtilis, Corynebacterium glutamicum, Pseudomonas putida, Streptomyces avermitilis и Vibrio natriegens. В этих работах использовали искусственный химический синтез ДНК, а также различные варианты рекомбинации, например, опосредованные системами CRISPR/Cas9 или Cre-loxP (рекомбиназа Cre, распознающая локусы под названием loxP [11]). Ведутся активные работы по созданию оптимизированных геномов цианобактерий и других фотосинтетических бактерий с колоссальным потенциалом для получения биотоплива [7].
| Главная ≫ Инфотека ≫ Биология ≫ Объект, который всегда с тобой / Жертвы науки |

|



