Кишечная палочка в почве что делать
Кишечная палочка (Escherichia coli)
Результаты поиска в Интернете
E.coli является обычным обитателем кишечника многих млекопитающихся, в частности, приматов, к числу которых принадлежит и человек. Поэтому ее часто называют кишечной палочкой. В организме человека E.coli выполняет полезную роль, подавляя рост вредных бактерий и синтезируя некоторые витамины.
Однако существуют разновидности бактерий E.coli, способные вызывать у человека острые кишечные заболевания. В настоящее время выделяют более 150 типов патогенных (так называемых "энтеровирулентных") палочек E.coli, объединенных в четыре класса: энтеропатогенные (ЭПЭК), энтеротоксигенные (ЭТЭК), энтероинвазивные (ЭИЭК) и энтерогемморагические (ЭГЭК).
Бактерии группы кишечной палочки не устойчивы к высокой температуре, при 60°С гибель их наступает через 15 минут, при 100°С - мгновенно. Сохраняемость кишечной палочки при низких температурах и в различных субстратах внешней среды изучена недостаточно. По некоторым данным в воде и почве кишечная палочка может сохраняться несколько месяцев.
Обычные дезинфецирующие вещества (фенол, формалин, сулема, едкий натр, креолин, хлорная известь и др.) в общепринятых разведениях быстро убивают кишечную палочку
Вызываемое заболевание
Кишечные заболевания, вызываемые патогенными E.coli объединяются общим названием эшерихиозы. Используются также термины коли-инфекция, коли-энтерит, диарея путешественников, колибактериоз (в основном в ветеринарии). Эшерихиоз относится к острым кишечным заболеваниям с фекально-оральным механизмом заражения. Каждый из вышеперечисленных классов патогенных E.coli характеризуется определенными различиями в протекании болезни, которая по своим симптомам может напоминать холеру или дизентерию. Инкубационный период длится 3-6 дней (чаще 4-5 дней).
Носители и распространение
Как уже упоминалось, бактерии E.Coli входят в состав нормальной кишечной флоры не только человека, но и крупного рогатого скота, свиней. Молодняк последних часто заражается колибактериозом и, соответственно, их мясо (говядина или свинина) может служить источником заражения. Подвержены этому заболеванию и домашние животные (собаки, кошки), однако основным способом заражение является все-таки фекальное загрязнение питьевой воды или продуктов питания.
Опасность для человека
Инфицирующая доза сильно зависит от типа патогенной кишечной палочки (так для энтеротоксигенной E.coli эта величина может составлять от 100 миллионов до 10 миллиардов бактерий, в то время как для энтероинвазивной и, предположительно, энтерогемморагической E.coli - всего 10 организмов). В наибольшей степени восприимчивы к заболеванию дети раннего возраста, пожилые и ослабленные люди. У детей эшерихиоз протекает в виде различной тяжести энтеритов, энтероколитов в сочетании с синдромом общей интоксикации. При средних и тяжелых формах сопровождается повышением температуры, поносом, сепсисом. У взрослых заболевание, вызванное эшерихией, напоминает по течению и клиническим симптомам острую дизентерию. Протекает чаще в стертой и легкой формах, реже (15-20%) встречается среднетяжелая и тяжелая (3%) формы. Прогноз у взрослых и детей старше года благоприятный, наиболее тяжело заболевание протекает у детей первого полугодия жизни.
Возбудитель - диареегенные штаммы кишечной палочки Echerichia coli из семейства Enterobacteriaceae рода Escherichie. В пределах данного вида выявлены штаммы с более чем 167 различными соматическими (о), 56 жгутиковыми (Н) и неодинаковыми капсульными (К) натигенами. Различают энтарогеморрагические, энтероинвазивные, энтеропатогенные, энтероморрагические и УэнтреаггрегативныеФ категории штаммов кишечной палочки. Диареегенные кишечные палочки устойчивы в окружающей среде, сохраняя жизнеспособность в молоке до 34 дней, детских питательных смесях - до 92 дней, на игрушках и предметах обихода до 3-5 мес. При 60- С гибнут через 10 мин, под струей кипятка мгновенно, 1 % раствора хлорамина, 1-2 % раствора хлорной извести, 1 % раствора фенола, 3 % раствора лизола - за 15-30 мин.
Резервуар и источники возбудителя: человек, больной или носитель. Больные имеют более высокую эпидемиологическую значимость, чем носители.
Период заразительности источника зависит от свойств возбудителя: при эшерихиозе, вызванном ЕТЕС и ЕНЕС, больной заразен только в первые дни заболевания, в случаях EIEC и ЕРЕС - 1-2 нед, иногда до 3 нед. Носители могут выделять возбудителя месяцами.
Механизм передачи возбудителя фекально-оральный; пути передачи - пищевой, водный, бытовой (через загрязненные руки, игрушки и др.).
Естественная восприимчивость людей высокая, особенно выраженная среди новорожденных и ослабленных детей. Около 35 % детей, общавшихся с источником возбудителя инфекции, становятся носителями. Постинфекционный иммунитет, по-видимому, носит серотиповой характер.
Информация
Добавить в ЗАКЛАДКИ| Поделиться: |
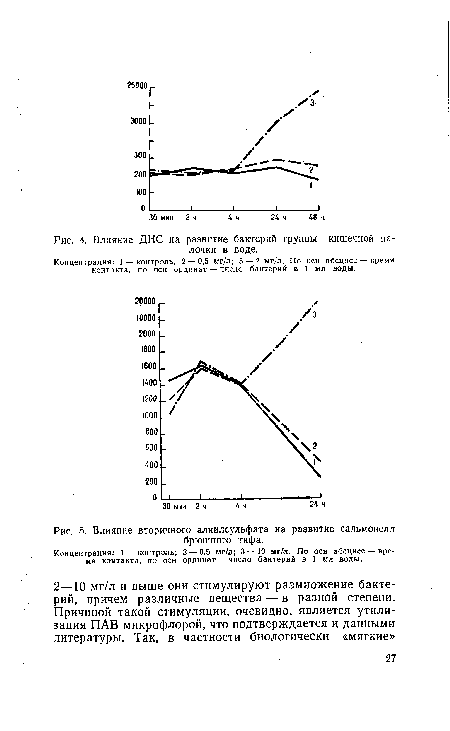
Палочка кишечнаяФаги кишечных палочек как более устойчивые, чем БГК.П, к ряду физико-химических воздействий рассматриваются как показатели энтеровирусного загрязнения водоемов. Наличие фагов кишечных палочек более 1000 БОЕ в 1 л свидетельствует о возможном присутствии в воде источников водоснабжения кишечных вирусов.[ . ] Достоинства кишечных палочек как санитарно-пока-зательных микроорганизмов заключается в значительном их преобладании в загрязненных объектах над другими микроорганизмами — возможными индикаторами загрязнения, в более высокой чувствительности кишечных палочек при обнаружении небольших источников загрязнения и оценке процессов микробного самоочищения, в соответствии данных санитарной характеристики объектов, в достаточной корреляции между содержанием кишечных палочек и сальмонелл (Т. 3. Артемова и др., 1976).[ . ] Преимущество кишечной палочки как показателя фекального загрязнения состоит в полном соответствии основным требованиям, предъявляемым к санитарно-показательному микроорганизму. Кишечная палочка постоянно обитает в кишечнике человека и теплокровных животных, в больших количествах выделяется в окружающую среду; ее выживаемость и устойчивость близка, но несколько превышает таковую патогенных кишечных бактерий. Как правило, кишечные палочки не размножаются до значительных количеств в воде в экспериментальных и натурных условиях. Описаны отдельные случаи размножения кишечных палочек в воде при благоприятной температуре и наличии большого количества легкоусвояемых органических веществ, при изменении естественного биоценоза водоема (в стерильной или обеззараженной воде), в присутствии некоторых химических веществ (например, алкилсульфата). Однако аналогичные условия способствуют более длительному выживанию и увеличению численности патогенных бактерий, в частности, сальмонелл (Е. А. Можаев и др., 1972). При этом кишечная палочка ведет себя так же, как и патогенные энтеробактерии, и сохраняет санитарно-показательное значение.[ . ] Энтерококки наряду с кишечной палочкой изучаются в качестве возможных показателей фекального загрязнения воды. Широкие исследования в этом плане развернулись за рубежом начиная с 50-х годов, когда были разработаны новые эффективные методы определения энтерококков с использованием сред с азидом натрия. В нашей стране изучение энтерококков в качестве санитарно-показательных микроорганизмов начато в 60-х годах, чему немало способствовала разработка для их выделения щелочно-полимиксиновой среды, состоящей из отечественных недефицитных ингредиентов (Г. П. Калина, 1966). Разностороннее изучение энтерококков как санитарно-показательных микроорганизмов привело к тому, что в стандартах ряда стран (Англия, США, Югославия), а также Международных (1973) и Унифицированных методах СЭВ (1975), и в ряде официальных документов санитарного законодательства СССР энтерококки признаны дополнительными показателями фекального загрязнения воды.[ . ] Метод определения фагов кишечных палочек прост, не требует специального оборудования и дефицитных реактивов, ответ получается через 18—24 ч.[ . ] По данным МосгорСЭС, титр кишечной палочки (в г) компоста Московского мусороперерабатывающего завода составляет 0,01 — 1. Продукцию завода охотно разбирают пригородные подмосковные овощеводческие совхозы.[ . ] Для ускорения роста колоний кишечных палочек на мембранных фильтрах К. К- Барсовым (1937) были использованы 0,75% агаровые среды, а затем предложено выращивать посевы воды на матрасиках из фильтровальной бумаги, смоченной питательной средой.[ . ] Учетом лактозоположительиых кишечных палочек можно закончить исследование воды пресных и морских водоемов в местах хозяйственно-питьевого и культурно-бытового водопользования, на этапах очистки питьевой воды и необеззараженных сточных вод.[ . ] Минкевич И. Е. Бактерии группы кишечной палочки как санитарнопоказательные микроорганизмы.[ . ] Серия работ по изучению состава кишечных палочек в кишечнике человека показала, что первоначальным источником цитратположительных бактерий родов Citrobacter и Enterobacter в окружающей среде является кишечник человека. Г. П. Калина (1969), обобщая данные зарубежных авторов за период с 1930 по 1962 г., убедительно, показал, что в составе кишечной микрофлоры человека содержится в среднем 8,6% цитратположительных бактерий при колебаниях от полного отсутствия до 18% (Bardsley, 1934; Malcolm, 1938; Stuart е. а., 1938; Maaben, Preb, 1949; Olitski e. а., 1950; Henriksen, 1955; Borneff, 1957; Papavassiliou, 1958; Bartley, Slanetz, 1960; Geldreich e. a., 1962).[ . ] Из всех облучаемых видов бактерий кишечно-тифозной группы наибольшей сопротивляемостью обладают кишечные палочки. Они полностью не погибают даже при 5-секундном облучении. Поэтому кишечная палочка может служить показателем эффекта обеззараживания при обработке воды, загрязненной патогенными неспоро-образующими бактериями. В том случае, когда обеззараживанию подвергается вода, содержащая устойчивые спорообразующие бактерии (например, бациллы сибирской язвы), критерием для определения дозы облучения должна служить сопротивляемость наименее чувствительных к ультрафиолетовым лучам спорообразующих бактерий.[ . ] Киченко М. Г. Ускоренное определение кишечной палочки в воде.— В кн.: Вопросы санитарной бактериологии. М., 1948, с. 117—126.[ . ]
Мнение бактериологов в отношении преимущества кишечных палочек нашло отражение в официальных нормативных документах, в последних изданиях которых нормируется именно этот показатель. Кишечные палочки являются основным критерием при оценке качества питьевой воды, воды источников водоснабжения, пресной и морской воды плавательных бассейнов, воды в районах морского водопользования, при определении эффективности очистки и обеззараживания сточных вод.[ . ] Изучение соотношения Е. coli и цитратположительных кишечных палочек в водоемах в летний период показало, что Е. coli очень быстро отмирала в сточных водах и при сбросе их в водоем составляла только 30% от числа лактозоположительных штаммов. В реках и особенно в вог дохранилищах Е. coli была редкой находкой. Обнаружение в этих же пробах воды сальмонелл и кишечных вирусов показало, что оценка качества воды водоемов тодько по Е. coli недостаточно надежна как с эпидемиологической точки зрения, так и в отношении фекального загрязнения. Более надежным тестом является учет всей группы кишечных палочек (Т. 3. Артемова и др., 1972).[ . ] По второму показателю — числу бактерий группы Coli (кишечная палочка) оценивают возможное присутствие в воде патогенных микроорганизмов.[ . ] Изучение санитарно-показательного значения фагов кишечных палочек при оценке качества воды позволяет расценивать их как косвенные индикаторы возможного присутствия в данном объекте энтеровирусов (Г. А. Багдасарьян, E. JI. А. Григорьева, 1975).[ . ] Комбинированный метод для одновременного определения кишечных палочек и энтерококков. Внедрение метода Heinrich в нашей стране затруднено в связи с тем, что на втором этапе в качестве элективной среды используют среду KF с дефицитными реактивами — азидом натрия и ß-глицерофосфатом натрия.[ . ] При помощи индикаторных бумажек можно учитывать колонии кишечных палочек через 10—14 ч. Совпадение результатов по индикаторным бумажкам и стандартному бродильному методу составляет около 80%.[ . ] Для увеличения чувствительности метода определения фекальных кишечных палочек предложен ряд усовершенствований, смысл которых сводится к ослаблению действия высокой температуры или компонентов высоко-ингибиторных сред в первые моменты роста бактерий.[ . ] Токоферол (витамин Е) при добавлении в элективные среды ускоряет рост кишечных, брюшнотифозных и дизентерийных бактерий. По данным Л. С. Корецкой с со-авт. (1960), время развития кишечной палочки на среде Эндо с витамином Е сокращается на треть.[ . ] В качестве показателя бактериального загрязнения почвы используют титр кишечной палочки (В. Coli) и титр одного из анаэробов (В. Perfringens). Эти бактерии поступают в почву с фекалиями. Так как анаэроб обладает способностью спорообразования, он сохраняется в почве более продолжительное время, чем кишечная палочка. Наличие в почве анаэроба при отсутствии кишечной палочки свидетельствует о старом фекальном загрязнении.[ . ] Вопрос доброкачественности питьевой воды решают путем определения количества кишечной палочки в 1 л воды. Кишечная палочка — это микроб, постоянно обитающий в кишечнике человека и животных и, следовательно, безвредный. Однако ее присутствие в воде свидетельствует о наличии в ней выделений людей или животных и о возможности загрязнения воды болезнетворными бактериями. Согласно нормам, в 1 л питьевой воды может содержаться не более трех бактерий группы кишечной палочки (БГКП). Это число называется коли-индексом воды; обратная величина, т! е. количество миллилитров воды, в котором находится одна кишечная палочка, называется коли-титром. Питьевая вода, безупречная в бактериальном отношении, должна иметь коли-титр не менее 333.[ . ] Наиболее признанным и распространенным во всем мире санитарно-показательным микроорганизмом является кишечная палочка, открытая в 1885 г. Escherich. Масе (1888) впервые предложил использовать кишечную палочку в качестве показателя фекального загрязнения воды.[ . ] Дополнительные сведения о происхождении загрязнения можно получить путем определения энтерококков и фагов кишечных палочек как более устойчивых к действию обеззараживающих агентов, нежели БГКП.[ . ] Для учета выбирают только те фильтры, на которых выросли изолированные колонии, а число колоний, характерных для кишечных палочек, не боеле 30 и не менее 5—10. Подсчитывают колонии, подозрительные на разложение лактозы, отдельно каждого типа: темно-красные с металлическим блеском, темно-красные без блеска, красные крупные слизистые с отпечатком на обратной стороне фильтра и т. п. Из каждой группы выборочно по 2—3 колонии пересевают на полужидкую среду с лактозой и инкубируют 6 ч при 37°С. При наличии кислоты и газа результат считают положительным, при отсутствии изменения среды — отрицательным. При образовании только кислоты продолжают инкубировать; окончательный результат учитывают через 24 ч. Если произошло характерное разложение лактозы всеми изученными колониями из одной группы, то все остальные бактерии этой группы учитывают в качестве БГКП. Если ферментирует лактозу только часть из пересеянных колоний, то число лактозоположительных кишечных палочек пересчитывают исходя из полученного соотношения. В качестве лактозоположительных кишечных палочек учитывают сумму колоний, ферментирующих лактозу на полужидких средах при 37°С в течение 6—24 ч до кислоты и газа.[ . ] Наряду с нормативами, приведенными в табл. 34, Правила предусматривают, что в местах водозаборов плавательных бассейнов с морской водой количество бактерий группы кишечных палочек и энтерококков не должно превышать 100/л и 50/л соответственно. В местах массового купания дополнительным показателем загрязнения является содержание стафилококков в воде. Сигнальное значение для регламентации нагрузки на пляжи имеет количество стафилококков более 100/л. Коли-ин-декс морской воды на границе I и II поясов зоны санитарной охраны не должен превышать 1 млн.[ . ] На рис. 3 представлена схема, характеризующая микрофлору, вырастающую при 37вС на среде Эндо при посеве воды методом мембранных фильтров или прямым посевом. Все бактерии, вырастающие на среде Эндо в течение 24 ч, — эндобактерии. Из этого числа выделяют энтеробактерии — грамотрицательные, не образующие спор палочки, не обладающие оксидазной активностью; БГКП— энтеробактерии, ферментирующие глюкозу до кислоты и газа при 37°С. Эта группа учитывается и нормируется в соответствии с ГОСТ 2874-73. Лактозоположительные кишечные палочки идентифицируют из всех БГКП по способности ферментировать лактозу до кислоты и газа при 37°С. Эта группа нормируется по Международным стандартам (coliform). Лактозоположительные кишечные палочки, сохранившие способность ферментировать лактозу при 44,5°С, и цитратотрицательные из них, относящиеся к роду Escherichia, являются показателями свежего фекального загрязнения.[ . ] При обнаружении в водопроводной воде бактериального загрязнения выше допустимых норм следует производить повторный отбор проб, в которых качественно устанавливают наличие или отсутствие показателей свежего фекального загрязнения. В качестве таких показателей в настоящее время приняты бактерии группы кишечных палочек (преимущественно E. coli), способных образовывать газ на лактозном бульоне с бриллиантовым зеленым при 44,5°С или с борной кислотой при 43°С (ГОСТ 18963-73).[ . ] Стимулирующее действие оптимальной температуры проявляется не только в более интенсивном размножении бактерий, но и в более быстром проявлении некоторых биохимических признаков (кислотообразование, газообразование, выделение индола и др.). По данным И. Е. Минкевича, температура 43°С, стимулируя рост и развитие кишечной палочки, выделяемой из воды, не снижает биохимической активности даже единичных клеток.[ . ] Основными источниками биологического воздействия являются сточные воды предприятий пищевой и кожевенной промышленности, бытовые и промышленные свалки, кладбища, канализационная сеть, поля орошения и др. Из этих источников разнообразные органические соединения и патогенные микроорганизмы попадают в почву, горные породы и подземные воды. По данным санэпидстанций, патогенные кишечные палочки обнаруживаются в подземных водах на глубине до 300 м от поверхности земли.[ . ] Не исключено, что биологическая азотфиксация возникла сравнительно недавно. Генный комплекс, ответственный за координированные процессы восстановления молекулярного азота, по существу один и тот же у всех способных к этому организмов. Весь он целиком (nif-система) был экспериментально перенесен в составе плазмиды из бактерии Klebsiella pneumoniae, где (присутствует естественным образом, в кишечную палочку (Escherichia coli), у которой не встречается. Такой же перенос мог неоднократно происходить и в природе. Этим легче всего объяснить наличие nif-системы в столь различных группах прокариот. Если способность к фиксации молекулярного азота — позднее эволюционное приобретение, то этим объясняется и ее отсутствие у эукариот: она развилась уже после их дивергенции с прокариотами.[ . ] В настоящее время для получения новых лекарств широко используют шампиньоны в связи с тем, что их легко выращивать в искусственных условиях. Лечебными свойствами обладают также навозники - группа грибов, растущих на сильно удобренных почвах. Навозник рыжий, например, применяют при лечении от алкоголизма. Белые грибы используют как противоопухолевое средство, в них также обнаружены антибиотики, смертельные для палочек Коха и кишечных палочек.[ . ] Учет результатов исследования. Для учета выбирают фильтры, на которых выросли изолированные колонии, и определяют их оксидазную активность. Все колонии, которые приобрели сине-фиолетовую окраску, из учета исключают. Среди колоний, не изменивших первоначального цвета, подсчитывают число темно-красных с металлическим блеском и без блеска, а также слизистых, крупных, выпуклых лактозоположительных колоний с отпечатком на обратной стороне фильтра. Дальнейшего подтверждения принадлежности таких колоний с характерной морфологией, окраской и отрицательным оксидазным тестом к лактозоположительным кишечным палочкам не требуется.[ . ] Определение микробиологических показателей, установленных стандартами для питьевой и другой воды, связано с необходимостью проведения их в лабораторных условиях. Вместе с тем косвенные признаки микробиологического загрязнения можно обнаружить по наличию видимых следов разложения органических остатков, трупов животных, нечистот, впадения в водоем сточных канав и др. Фекальные загрязнения обычно содержат множество бактерий, среди них - патогенные цисты простейших паразитов, яйца гельминтов, микроорганизмы. Индикаторным видом микроорганизмов, указывающим на фекальные загрязнения, принято считать бактерии группы кишечной палочки (БГКП), типичным представителем которых являются E.coli (сами БГКП нетоксичны для теплокровных). Микробиологический показатель качества воды предусматривает определенное число БГКП в единице объема воды (не более 3 в 1 л) - так называемый коли-индекс.[ . ] Капельный метод. Метод прямого посева имеет капельную модификацию (Mallmann, Peabody, 1962). Исследуемую воду или ее разведения наносят микропипеткой на поверхность хорошо подсушенной среды в виде капель по 0,01—0,02 мл. После полного подсушивания посевы инкубируют и учитывают результат обычным способом. Метод отличается простотой, экономичностью, на одну чашку можно сделать до 6 посевов. Метод рекомендуется для исследования сточных вод и почвы.[ . ] В обычных условиях почва может быть загрязнена микрофлорой фекалий, навоза и сточной жидкости. Все эти субстраты весьма богаты кишечной палочкой, определением титра которой пользуются при индикации санитарного состояния почвы и окружающей среды вообще. Внесение навоза в почву, полив ее сточной жидкостью и удобрение фекалиями сильно увеличивают число бактерий группы кишечной палочки в почве. Между тем в эпидемиологическом отношении отмеченные нами загрязнения далеко не равноценны, и нередко возникает необходимость определить характер внесенного в почву вещества. В таком случае дополнительное определение числа термофильных бактерий может быть весьма полезным. Сточная жидкость и фекалии богаты кишечной палочкой, но бедны термофилами; навоз же содержит в большом числе обе отмеченные группы микроорганизмов. Таким образом, если почва имеет низкий титр Bad. coli и в ней обнаруживается много термофилов, то совершенно очевидно, что она была удобрена навозом или компостом. Почвы, показавшие низкий титр кишечной палочки и бедные термофилами, должны иметь фекальное загрязнение. Кишечная палочка относительно быстро вымирает в почве. Споры бактерий, внесенные с загрязняющей почву массой, в латентном состоянии могут сохраняться там значительное время. С фекалиями в почву попадают зародыши Bac. perfringens, установлением титра которого и пользуются при определении старого фекального загрязнения. В случае применения навоза и компостов индикаторными микроорганизмами могут быть термофилы. При исследовании чистых и мало загрязненных почв кишечная палочка практически отсутствует. Термофильных бактерий в таком случае также должно быть мало. Отмеченное положение хорошо обрисовывается материалом, где приведены анализы нескольких почв (суглинистый подзол), взятых под Москвой, около сел. Балашиха. В лесу, куда не исключается заход скота, почва оказалась весьма бедной и по содержанию термофилов, и по титру кишечной палочки. В окультуренных почвах число термофильных бактерий было также невысоким, но все же несколько увеличенным. Группа coli-aerogenes в данном случае не указывала на недавно происшедшее загрязнение. Следует предположить, что в интересующие нас почвы относительно давно был внесен в небольших количествах навоз. Приведенные данные по численности термофильной микрофлоры позволяют эти почвы отнести к категории слабо окультуренных. На полях Института картофельного хозяйства (Коренево, под Москвой) мы подобрали серию делянок, получавших весной разные дозы навозного удобрения. В качестве контроля была взята неудобренная делянка. Усиление степени унавоживания сказалось на соответствующем увеличении в почве числа зародышей кишечной палочки и термофильных бактерий. В дальнейшей судьбе отмеченных групп микронаселения имеется, однако, значительное различие. К осени почва практически самоочищается от кишечной палочки. Даже в делянке, удобренной из расчета 72 т навоза на гектар, к сентябрю остается весьма немного представителей группы coli-aerogenes. Термофильные микроорганизмы, внесенные с навозом главным образом в виде спор, весьма слабо меняются количественно за значительный период времени — с июня по сентябрь. Отсюда становится вполне очевидным, что, сочетая показания coli-титра с учетом термофильных бактерий, можно довольно хорошо определить историю почвы. Даны материалы, характеризующие состояние интересующих нас микроорганизмов в нескольких образцах почв того же Института картофельного хозяйства. Эти почвы, несколько лет повторно удобрялись соответствующими дозами навоза, поэтому в унавоженных делянках здесь было найдено значительно большее число термофилов. В июле, когда производились наблюдения, процесс самоочищения почвы еще не был закончен, поэтому в удобренной почве было много клеток бактерий кишечной группы. Почва опытного поля Института картофельного хозяйства расположена на оподзоленных супесях.. Приведенные материалы наглядно показывают, что во всех трех описанных случаях термофильная микрофлора вскрывает характер причины, вызвавшей обогащение почвы бактериями группы кишечной палочки. При фекальном загрязнении почвы в ней должна увеличиваться лишь группа coli-aerogenes у так как фекалии (и сточная жидкость) не богаты термофилами. Такой случай мы приводим, где описывается изменение микрофлоры при удобрении почв сточной жидкостью и фекалиями. Первый опыт был проведен на супесчаных почвах одного из колхозов, расположенных около ст. Косино Казанской железной дороги (под Москвой), другой — на колхозном поле с тяжелой глинистой почвой в пригороде Москвы, на Ленинских горах. В обоих случаях, судя по количеству термофилов, почвы были довольно чисты. Внесенная с удобрением кишечная палочка к осени вымерла. Наблюдений, аналогичных только что приведенным, проделано достаточно. Все они дали однотипную картину и поэтому здесь не приводятся. Весь опытный материал убедительно показал, что лишь навозно-компостное загрязнение увеличивает в среде число термофильных микроорганизмов. В заключение мы приведем лишь несколько анализов почв подмосковных усадеб. В первом объекте в хлеву лежал навоз. Естественно поэтому, что почва из-под навоза была обогащена всеми; группами интересовавшего нас микронаселения. Все использованные показатели уменьшаются по мере удаления от помещения скотного двора. Во втором объекте навоз был вывезен, поэтому в помещении хлева почва была относительно чиста. Несколько повышенное число термофилов, указывало, однако, на большее здесь навозное загрязнение. У порога хлева повышенный титр группу coli-aerogenes в почве должен быть объяснен заносом фекальных масс. В последнем случае навоза в сарае не было. Все взятые образцы почвы были чисты по показаниям на кишечную палочку. Несколько повышенное содержание термофилов может быть объяснено слабым загрязнением почвы навозом в прошлом. Имеются данные нескольких анализов почв неканализованных владений окрестностей гор. Москвы. Первая проба в каждом владении бралась около уборной, вторая — в некотором отдалении от нее. Все образцы почв были довольно сильно загрязнены бактериями группы кишечной палочки. Однако между ними имеется известное отличие. В то время как почвы первых трех объектов (особенно около уборной) содержали повышенное число термофилов, в двух последних они были довольно чисты по этому показателю. Отсюда следует сделать заключение, что в первых из отмеченных хозяйств в уборные сбрасывали мусор, чего в последних случаях не было. Таким образом, разобранные нами примеры показывают, что термофильные микроорганизму в сочетании с другими бактериологическими показателями могут дать ценные показатели по установлению характера загрязнения внешней среды. Экспериментальный и литературный материал, связанный с изучением термофилов в почве, позволяет сделать следующие выводы. 1. Количество термофильных микроорганизмов, находящихся в почве, зависит в основном от вносимого навознокомпостного удобрения. В одной и той же местности отдельные почвы содержат совершенно различное количество термофильных бактерий. Наиболее богаты термофилами огородные, сильно удобренные навозом почвы. Целинные почвы содержат крайне ограниченное количество термофильных микроорганизмов. Отмеченная зависимость была прослежена на почвах различных климатических зон. Следует отметить, что даже не удобряемые навозом культурные почвы богаче термофилами, чем целинные, что может стоять в связи с большими возможностями, имеющимися у этих ночв для засорения. 2. Для местностей СССР, где степень окультуренности почв связана с унавоженностью, термофилы могут быть использованы как показатель окультуренности почвы. 3. Анализ термофильной микрофлоры может вскрыть историю почвы в части, связанной с ее унавоживанием в прошлом. 4. Термофильные микроорганизмы почвы могут быть использованы как индикаторы при санитарных исследованиях почвы и других объектов внешней среды. Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
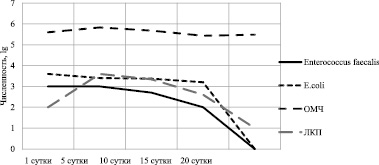
Важными базовыми компонентами качества жизни человека являются природно-климатические условия и состояние окружающей среды. Биологические и социальные потребности в отдыхе населения обеспечивают ландшафты с наличием рек, прудов, водохранилищ и других водных объектов. Почвенный покров береговой полосы водоемов, массово посещаемых горожанами и сельским населением, испытывает повышенную нагрузку, депонируя различные биологические, химические и техногенные отходы. Биологическое загрязнение способствует попаданию и сохранению в верхнем слое почвы потенциально патогенных микроорганизмов. Такие почвы с высокой вероятностью могут быть причиной заболеваний инфекционной природы, а почвы пляжей и песок могут являться резервуаром инфекции [1, 2]. Объективная оценка степени опасности почвы береговой полосы водоемов, используемых в рекреационных целях, возможна при изучении соотношения приоритетных фекальных индикаторных и патогенных микроорганизмов, с учетом антропогенного загрязнения и процессов самоочищения, с возможностью сохранения в почве вирулентных штаммов патогенных бактерий в дозе, достаточной для заражения человека контактным путем. Цель исследования: в ходе полевых исследований изучить численность санитарно-показательных кишечных бактерий, сальмонелл и основных физиологических групп микроорганизмов в почвах береговой полосы водоемов и песчаных пляжей в условиях высокой антропогенной нагрузки. На основании полученных данных и результатов лабораторного эксперимента по скорости элиминации из почвы штаммов кишечных бактерий оценить роль отдельных микробиологических показателей в эпидемиологической оценке почвы. Материалы и методы исследования Пробы почвы для микробиологических исследований отбирали на участках береговой полосы прудов, водохранилищ и малых рек в городской и сельской местности. Критериями выбора участков и времени отбора почв для исследования являлись теплый период года, массовое посещение берегов водоемов населением, биологическое загрязнение в виде пищевых отходов и бытового мусора, наличие домашних и диких животных (собаки, гуси, крысы, утки, чайки, вороны), присутствие в водоохранной зоне автотранспорта. Изученные почвы в Московской области (М.О.) можно в целом охарактеризовать как аллювиальные супесчаные и суглинистые дерново-подзолистые, в Белгородской (Б.О.), Курской (К.О.) и Воронежской (В.О.) областях – аллювиальные суглинистые чернозёмные. Отбирали точечные пробы поверхностного (0–5 см) слоя почвы методом конверта в стерильные полиэтиленовые пакеты для доставки в лабораторию. В 1–2 суточной объединенной пробе определяли численность сапрофитных бактерий на почвенном агаре (ОМЧ22), численность актиномицетов – на крахмало-аммиачном агаре, численность плесневых грибов – на среде Чапека. Интенсивность биологической нагрузки на почву оценивали по следующим показателям: численность потенциально патогенных бактерий – на ГРМ-агаре при 37 °С в течение суток (ОМЧ37); численность колиформных бактерий – на среде Эндо с идентификацией вида; численность E. coli – по образованию кислоты и газа на лактозной среде при 44 °С и росту на хромогенном агар для E. coli; численность энтерококков – на агаре с канамицином, эскулином и азидом натрия; численность сульфитредуцирующих бактерий, в том числе Cl. perfringens – на SPS агаре. Численность патогенных бактерий родов Salmonella выявляли в 10 г навеске почвы методом обогащения с высевом на висмут сульфит агар или XLD агар, и идентификацией до рода. В лабораторном эксперименте использовали 4 типа изученных ранее аллювиальных почв. В 500 г воздушно-сухой почвы, просеянной через сито 3 мм, вносили и равномерно распределяли суточную культуру типовых штаммов Salmonella typhimurium № 5715 E. coli ATCC 25922, Enterococcus faecalis CCM 4224 из расчета 1 мл бактериальной суспензии плотностью 10 ед. по отраслевому стандарту мутности на 1 кг почвы. Динамику изменения численности типовых штаммов внесенных бактерий на фоне развития сапрофитных микроорганизмов изучали методом мембранной фильтрации почвенной суспензии с последующем ингибированием фильтров на чашках Петри с селективными питательными средами. Результаты исследования и их обсуждение Проведено сравнение структуры микробного сообщества разных почв береговой полосы и пляжей в момент максимального антропогенного загрязнения (таблица). Санитарно-микробиологическая характеристика почвы в зонах рекреации в летний период Почва различных посещаемых зон рекреации Показатели интенсивности биологической нагрузки на почвы, КОЕ/г Показатели биологической активности почвы, КОЕ/г Москва, пляж Серебряный бор Москва, берег Джамгаровского пруда М.О., пляж Жестылевского водохранилища М.О., берег рыболовного пруда М.О., берег р. Веля М.О., берег р. Имбушка М.О., берег р. Яуза в парке М.О., берег р. Яуза рядом с автотрассой М.О., пляж Пяловского водохранилища Б.О., берег р. Сейм К.О., пляж на старице р. Сейм К.О., берег р. Речица В.О., пляж пруда в с. Медвежье Общая численность микроорганизмов, численность микромицетов и актиномицетов были повышенными в сравнении с этими же показателями в холодное время лета. Пик этих показателей совпадал с погодно-климатическими условиями, благоприятными для отдыха населения на природе. Почва обследованной территории была сильно уплотнена, растительность – в значительной степени вытоптана, имелись остатки мусора и следы кострищ. В силу того, что почвы пляжно-купальных зон обычно легкого состава, численность микроорганизмов в них была ниже по сравнению с почвами ландшафтов, прилегающих к водоему. Численность актиномицетов была выше в луговых и лесных почвах, богатых гумусом, по сравнению с песчаными почвами пляжей и вытоптанными участками береговой полосы. Численность плесневых грибов также была низкой в песчаной почве, и значительной в дерново-луговой почве, что в большей мере связано не с биологическим загрязнением, а минерализацией органических полимеров. Более ярко биологическое загрязнение почвы проявилось на изменении численности бактерий – индикаторов санитарного состояния почвы. Известно, что в микробном сообществе почвы в местах наибольшей концентрации населения повышается частота доминирования представителей семейства Enterobacteriaceae [3]. Численность колиформных в жаркий период года была выше на два порядка, численность энтерококков – почти в 4 раза. В массовом количестве высевались потенциально патогенные бактерии: Aeromonas hidrophila., Enterococcus faecalis, Bacillus cereus, Staphylococcus intermedius, Staphilococcus lentus, Streptococcus gordonii, Erysipelothrix rhusiopathiae и другие. Современным микробиологическим лабораториям под силу проводить идентификацию не отдельной условной физиологической группы бактерий, объединенной по признаку ферментации лактозы, а конкретных видов бактерий, что позволяет повысить точность оценки опасности почвы. Энтерококки (Enterococcus faecalis, Enterococcus faecium), кишечная палочка (Escherichia coli), сульфитредуцирующие клостридии (Clostridium perfringens) – это санитарно-показательные бактерии, достаточно легко идентифицируемые из объектов окружающей среды. Эти микроорганизмы являются обитателями кишечного тракта теплокровных животных и человека. Они могут некоторое время сохраняться в почвах и воде, особенно загрязненных ксенобиотиками. Их обнаружение всегда однозначно свидетельствует о фекальном загрязнении. Численность энтерококков, кишечной палочки в почвах береговой полосы и пляжей достаточно часто совпадает (одного порядка), что делает привлекательным использование этих микроорганизмов для оценки эпидемической опасности почвы. Эта же аргументация применима к Clostridium perfringens с оговоркой, что оценка степени загрязненности ведется за более продолжительный период времени в связи с высокой устойчивостью в почве спор этого микроорганизма. Остается открытым вопрос о количестве патогенных бактерий в почве пляжей и береговой полосы мест рекреации, достаточном для контактного или перорального способа заражения человека. В литературе имеется достаточно сведений о распространении возбудителей инфекции в пляжных песках [6]. Рассчитано, что посетитель пляжа через частицы песка, прилегающего к коже и загрязненного бактериями, может перенести 6,0×105 КОЕ энтерококков [7]. Число КОЕ при однократном приеме пищи, способное вызвать пищевую токсикоинфекцию, составляет 108–109 для Citrobacter spp., Klebsiella spp., 106–1010 – для энтеровирулентных E. coli, 105–109 – для Salmonella spp. [8]. Экспериментальное микробиологическое исследование выживаемости представителей кишечных бактерий, внесенных в почву, содержащую питательные вещества, микроэлементы и естественную аутохтонную микрофлору, показало закономерный процесс снижения их численности (рис. 1).
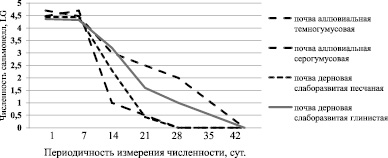
Рис. 1. Формирование искусственного микробиоценоза в дерновой слаборазвитой глинистой почве Численность сапрофитных бактерий (ОМЧ) продолжала оставаться на стабильно высоких уровнях – в пределах 105–106 КОЕ/г и имела тенденцию к увеличению при дополнительном внесении в почву некоторых ксенобиотиков. Численность штаммов Escherichia coli, Enterococcus faecalis, внесенных в дозе 103–104 КОЕ/г, к 20 суткам эксперимента снижалась до нуля. Источником загрязнения почв сальмонеллами и другими кишечными бактериями в естественных условиях являются преимущественно фекалии диких и домашних животных и птиц. В естественных условиях динамика численности патогенных бактерий, пассированных через организм животных, может отличаться по сравнению с динамикой выживаемости в почве типовых штаммов, длительно пребывающих на питательных средах, делая почвы опасным объектом заражения человека. Скорость элиминации Escherichia coli, Enterococcus faecalis из почвы была значительно выше по сравнению с Salmonella typhimurium. Количество сальмонелл на протяжении первой недели изменялось незначительно по сравнению с первоначально внесенной дозой заражения во всех типах почв (рис. 2).
Рис. 2. Изменение численности типового штамма Salmonella typhimurium в различных пойменных почвах На 42 день эксперимента сальмонеллы не обнаруживались в почвах, в том числе при высеве из сред обогащения. Более продолжительное время сальмонеллы сохраняли свою жизнеспособность в почвах тяжелого механического состава с большим количество мелких илистых частиц. Высокая устойчивость сальмонелл в естественных почвах может являться причиной необъективной оценки санитарного состояния почвы по косвенным показателям интенсивности биологической нагрузки. Под влиянием техногенного биологического воздействия условно-патогенные и патогенные бактерии выявляются даже за границами санитарно-защитных зон предприятий, изменяя структуру микробного сообщества [9, 10]. Необходимо с осторожностью делать выводы об отсутствии патогенных бактерий в почве только на основании отсутствия санитарно-показательных видов. Заключение Загрязненные кишечными бактериями почвы и пляжи береговой полосы водоемов, наряду с загрязнёнными поверхностными водами, могут являться причиной заболеваемости населения в результате пляжно-купального отдыха. Биологическое загрязнение почв различного типа носит диффузный характер и увеличивается в местах скопления отдыхающих при прогреве почвенного покрова. В местах массового посещения людей в почвах и пляжах береговой полосы стабильно идентифицируются санитарно-показательные бактерии, но не обнаруживаются или очень редко выявляются бактериальные патогенны. Методы прямого выделения из почв E. coli, Enterococcus spp. более информативны для оценки эпидемической опасности почвы по сравнению с косвенным показателем численности колиформных бактерий. Сальмонеллы более устойчивы к неблагоприятным условиям в почве по сравнению с кишечной палочкой и энтерококками, в связи с чем нужно с осторожностью интерпретировать результаты качества почвы на основании численности санитарно-показательных микроорганизмов. Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции
|