|
В середине 40-х годов группа молодых американских учёных, интересовавшихся природой гена, решила сконцентрировать усилия на работе с кишечной палочкой и её фагами. И тогда оказалось, что генетика у бактерий есть, да ещё какая! Перед исследователями открылось великое разнообразие природных генетических процессов, которые потом обнаружили и у более сложно устроенных эукариот. Короче говоря, практически всю молекулярную генетику сделали на кишечной палочке и её фагах. Подробнее об этом не стоит, ибо, как сказал Козьма Прутков, никто не обнимет необъятного. Желающие могут раскрыть любой учебник молекулярной генетики: почти на каждой странице кишечная палочка будет помянута в связи с каким-нибудь экспериментом. А мы поговорим о самой бактерии.
![]()
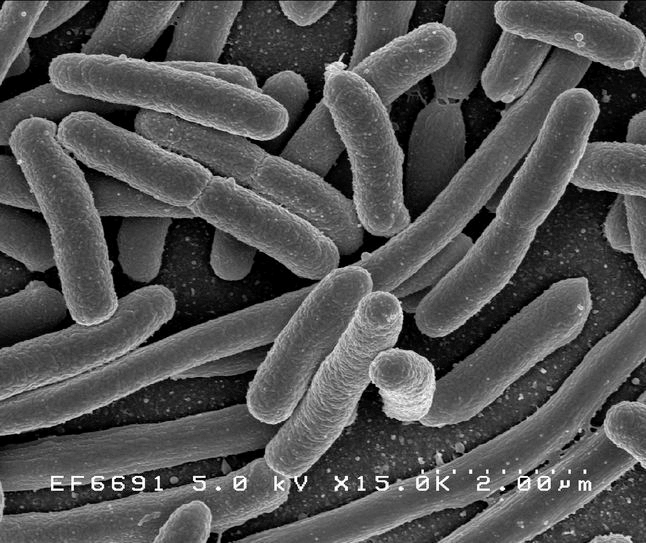
Пожалуй, это самая изученная клетка на планете. Её латинское название Escherichia coli (E.coli) в переводе означает эшерихия кишечная и связано с местом обитания бактерии (она живёт в нижнем отделе кишечника теплокровных) и именем открывшего её Теодора Эшериха. Но обычно её так не называют, а именуют на лабораторном жаргоне е-коли, кишпалкой или же совсем фамильярно — коляшкой. Коляшкины клетки прямые, размером примерно 1 на 3 мкм, объём одной бактерии составляет 2×10 –12 мл, но вмещает она многое. Во-первых, кольцевую молекулу ДНК, которая в тысячу раз длиннее самой клетки и, следовательно, очень плотно упакована. Молекула эта содержит столько генов, сколько необходимо для синтеза 4000 разных белков. Поступлений РНК от этих генов ожидают около 15 000 рибосом. Свой немалый геном кишечная палочка воспроизводит каждые 20 минут, ошибаясь с частотой 10 –8 –10 –10 . Это надо суметь: воспроизводиться так точно и с такой скоростью! Есть в клетках и плазмиды — свободноплавающие, не связанные с большой кольцевой хромосомой колечки ДНК, изучение которых привело к важнейшим достижениям в области биохимии и генной инженерии. Снаружи кишпалку защищает клеточная стенка, покрытая слизистой капсулой. Сквозь капсулу торчат короткие, похожие на волоски структуры, называемые пилями, — функция их пока не совсем понятна. Клетки некоторых штаммов перемещаются с помощью длинных жёстких жгутиков, играющих роль пропеллеров.
Как видите, кишечная палочка достаточно сложно устроена и предоставляет учёному богатое поле для работы и уникальные возможности. Некоторые штаммы E.coli словно специально созданы для лабораторных исследований. Хотя бактерия и обитает в кишечнике человека — среде, богатой органическими компонентами, её пищевые потребности относительно скромны: несколько простых солей и глюкоза, из которых она синтезирует около 5000 необходимых ей соединений. Кишпалка спор не образует, делится каждые 20 мин и при благоприятных условиях вырастает в жидкой среде до концентрации 2–5×10 9 клеток на миллилитр, а из плотной суспензии бактерий можно выделять разные вещества в количествах, достаточных даже для биотехнологических целей. На твёрдой поверхности бактерии образуют десятки тысяч колоний, которые можно быстро проанализировать с помощью специальных сред, красителей и антибиотиков (для сравнения заметим, что рассмотреть тысячи дрозофил одному человеку в короткий срок практически нереально), а это даёт возможность изучать очень редкие генетические события.
Но есть, конечно, и неудобства. Одно из них — явственно ощутимый дурной запах. Дело в том, что кишечные палочки синтезируют индол. Это вещество образуется и в кишечнике при гниении белков. Вместе с другим соединением, скатолом, оно обусловливает характерный запах фекалий. В чистом виде и малой концентрации индол содержится в цветах жасмина и апельсина, сообщая им чудесный аромат. А кишечная палочка индола образует много и пахнет соответственно, хотя лабораторные штаммы кишечника не видали отродясь.
В конце 70-х стало ясно, что в клетках Е.coli можно размножить и заставить работать почти любой эукариотический ген, главное — иметь этот ген. Тогда и расцвело пышным цветом клонирование ДНК. Учёные внедряли в кишечную палочку гены бактерий, грибов, насекомых, растений, животных и даже человека, так что палочка стала своеобразным символом генетического единства мира. Тогда же её стали называть живой пробиркой.
Когда генная инженерия делала первые шаги, обстановка вокруг неё была слегка паническая — генетически модифицированных объектов боялись. Хотя лабораторные штаммы для человека безвредны, кто знает, во что превратится кишпалка с чужим геном внутри. Так появились специальные штаммы, не способные существовать вне лаборатории: с тонкой стенкой, которая лопается при низкой концентрации солей, и нуждающиеся в некоторых веществах, которых они не найдут в окружающей среде и сами синтезировать не могут. Кстати, тонкая бактериальная стенка не только служит гарантией общественной безопасности, но и облегчает выделение клонированной ДНК или синтезированного белка.
Скрестить ужа с ежом
…получится метр колючей проволоки. Скрестить вишню с арбузом не позволяют законы природы, а если это и удастся, по закону подлости получится, скорее всего, арбуз размером с вишню. Но законы природы, как и законы из административного кодекса, часто противоречат друг другу.
Чтобы растение (или животное, или бактерия) приобрело новые свойства, в его ДНК должен появиться новый ген, кодирующий новый белок. Новые сорта и виды появляются в результате мутаций генов под действием радиации, химических веществ или ошибок в копировании ДНК при делении клеток. Межвидовые гибриды в природных условиях образуются постоянно, время от времени они дают начало новым видам. Эти же уловки использует и природа, и селекционеры при выведении новых сортов. Но при искусственном опылении цветков растения одного вида пыльцой другого, даже близкородственного, в лучшем случае в одном из тысяч пестиков завяжется гибридное семя, одно из тысячи таких семян окажется жизнеспособным, одно из тысячи проросших растений будет нести нужные человеку свойства, еще одно из тысячи сможет сохранять эти свойства в следующих поколениях… И результатом многолетних трудов может оказаться что-нибудь высокоурожайное, но малосъедобное или устойчивое к болезням, но с урожайностью полведра с гектара. А люди, в отличие от природы, не могут ежедневно ставить миллиарды новых опытов и ждать результатов сотни или тысячи лет.
При скрещивании сортов одного вида (например, высокоурожайного, но болезненного с устойчивым, но малопродуктивным) потомство то получается ни в мать, ни в отца, то наследует от обоих родителей худшие свойства. Главный недостаток традиционных способов селекции — то, что с их помощью практически невозможно получить растения с принципиально новыми свойствами. А с помощью генной инженерии — можно.
Нельзя нарушить, но можно обойти
Растения хорошо размножаются вегетативным путем. Целое растение можно вырастить и из черенка, и из кусочка листа или корня, и даже из одной-единственной клетки. Культуры растительных клеток уже больше полувека применяются для выведения новых сортов: обработать мутагенами целое поле намного сложнее, чем одну чашку Петри. И пытаться скрестить разные виды с помощью опыления намного сложнее, чем напрямую слить в одну клетки растений разных видов (хотя это тоже очень сложно). А результат — мутантное или гибридное растение — будет так же непредсказуем, как при обычной селекционной работе.
![]()
От природы с любовью
К роду Agrobacterium относятся четыре вида почвенных микроорганизмов. Все они вызывают у растений корончатые галлы — опухоли, похожие на раковые. Именно поэтому их и изучали — с точки зрения борьбы с болезнями растений.
Оказалось, что агробактерии выработали уникальный механизм паразитирования, чем-то напоминающий вирусный. Как и у большинства других бактерий, часть их генома находится не в основной хромосоме, а в плазмидах — небольших, длиной в несколько сотен тысяч пар нуклеотидов, колечках ДНК. Ti-плазмиды (tumor-inducing, опухолеобразующие), найденные в Agrobacterium tumefaciens, оказались лучшим инструментом для генной инженерии.
В природе образование корончатого галла начинается с повреждения стебля растения у самой земли. Разрушенные клетки выделяют в почву промежуточные продукты обмена веществ — ацетосирингон и гидроацетосирингон. Под их действием в плазмидах оказавшихся поблизости агробактерий активируются гены vir (вирулентности, от лат. virulentus, ядовитый). Белки этих семи различных генов обеспечивают отделение от Ti-плазмиды сегмента — Т-ДНК (от англ. transferred, переносимый). По бокам (на флангах) Т-ДНК находятся одинаковые фланкирующие последовательности из 25 пар нуклеотидов, которые обманывают ферменты растительной клетки, заставляя их принять Т-ДНК за родную и встроить ее в собственную хромосому.
После активации vir-генов в оболочке бактерии образуется разрыв, через который Т-ДНК переносится в растительную клетку. Примерно так же у бактерий происходит половой процесс. Правда, при этом микробы просто обмениваются копиями плазмид — и никакой романтики!
Попав в хромосому, Т-ДНК за счет клеточных механизмов синтеза белков приступает к производству ферментов, которые обеспечивают синтез растительных гормонов: ауксина и цитокининов — нескольких веществ со сходной структурой.
И ауксин и цитокинины можно купить в магазине для садоводов, развести одну каплю в ведре воды и полить садовые растения. От этого цветы (и овощи, если вам не жалко потратить на них дорогой препарат) растут быстрее. А когда гормоны действуют на клетки изнутри и в больших концентрациях, вместо прибавки урожая получается местное разрастание тканей, на которое растение тратит изрядную часть своих ресурсов.
И наконец в работу включаются гены, ферменты которых обеспечивают синтез в зараженных клетках опинов — уникальных, встречающихся только в корончатых галлах соединений. Агробактерии могут использовать их как источник углеводов и азота. Каждый штамм агробактерий вызывает синтез только одного из опинов, а усваивает их за счет ферментов, которые тоже закодированы в Ti-плазмиде. Некоторые другие почвенные бактерии тоже могут питаться опинами — скорее всего, эти халявщики позаимствовали нужный ген у соседей: у микробов обмен генами между разными видами — дело житейское.
Есть и более сложный способ модификации Ti-плазмиды, когда ее разрезают на два колечка, а потом снова сшивают их в одно, но перевод описания этого способа с молекулярно-генетического языка на популярный займет слишком много места. Прежде всего, никакие это не колечки, а коинтегративный вектор и неонкогенная Ti-плазмида-помощник, содержащие гомологичные последовательности, которые образуют сайт для гомологичной рекомбинации in vivo. Но на этом трудности только начинаются.
А кто обещал, что будет легко?
Еще один подарок генным инженерам от микробов — Cry-белки (они же — Bt-токсины), выделенные из спор почвенной бактерии Bacillus thuringiensis. Часть работы за селекционеров сделали микробиологи: установили, на какой из нескольких плазмид B. thuringiensis присутствует нужный ген, подобрали наиболее эффективные варианты строения молекулы белка и выяснили последовательность нуклеотидов в разных модификациях его гена.
При создании трансгенных растений приходится решать еще кучу проблем. Синтез любого белка проходит в несколько этапов, для каждого из них нужны свои ферменты. В целевом растении они могут отсутствовать, а вводить в хромосомы не один, а несколько генов — значит усложнять работу в геометрической прогрессии. Если в растение вставляют ген не из другого растения, а из микроба или животного (например, суперморозоустойчивые помидоры получили с помощью гена, кодирующего белок-антифриз из камбалы), приходится решать не только проблемы вроде описанных выше. Например, белок может вообще не превратиться в активную форму из-за различий в биохимии растительных, животных и микробных клеток. Но все эти проблемы решаемы.
И это еще не всё
Разрешения на коммерческое использование дожидаются сотни сортов десятков видов пищевых растений с измененными свойствами — с улучшенным составом жиров, повышенным содержанием белков и витаминов, сладкие без сахара и накапливающие меньше вредных для здоровья нитратов. На опытных делянках растут сотни пород деревьев, у которых часть ненужного человеку лигнина заменена полезной целлюлозой — и растут они вдвое быстрее обычных. Трансгенные растения производят вакцины и лекарства, очищают почву от химического и радиоактивного загрязнения, синтезируют биодеградируемые полимеры для производства упаковки и белок паутины, из которого можно делать колготки и бронежилеты повышенной прочности.
03 февраля 2020
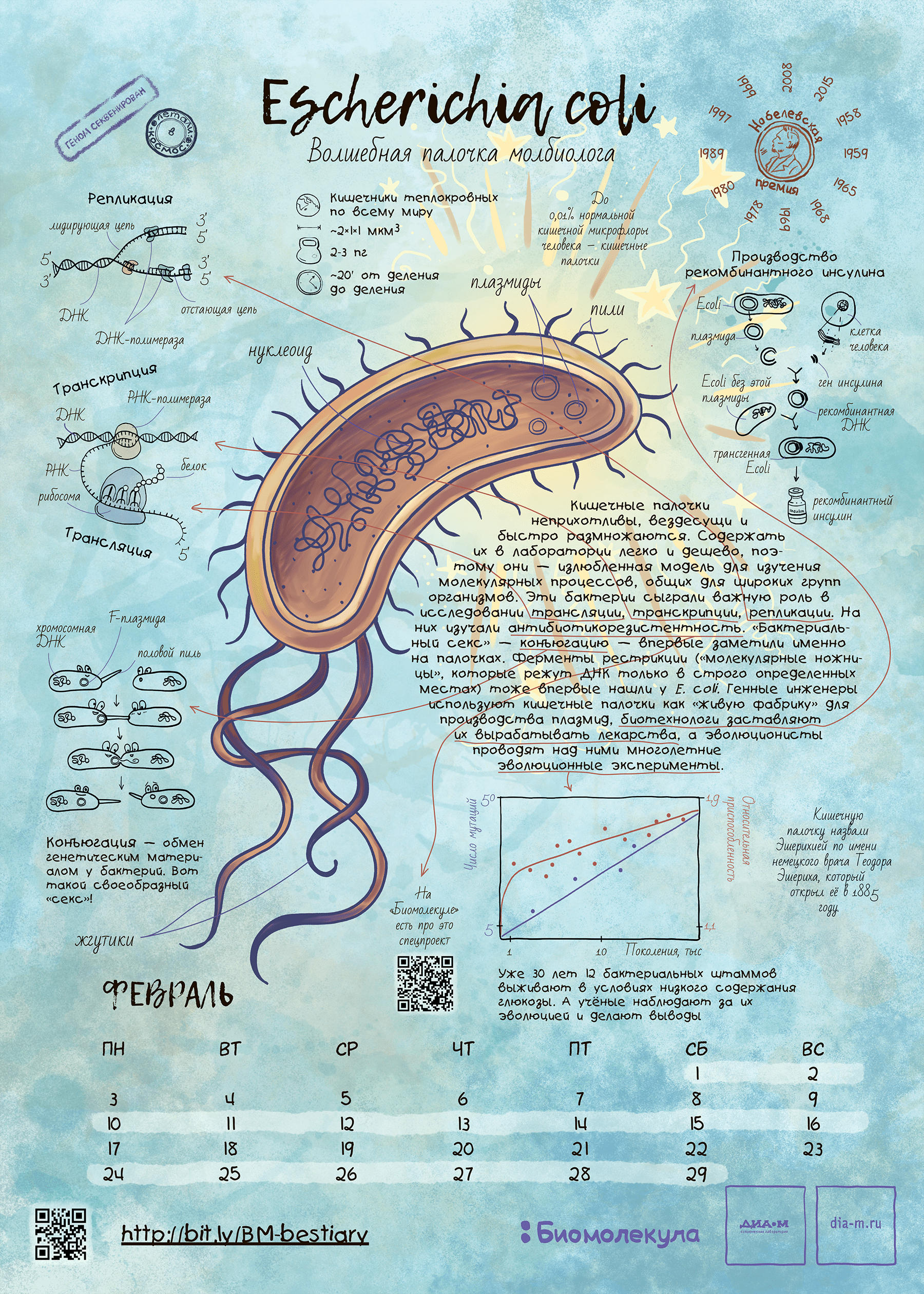
Герой февраля: кишечная палочка Escherichia coli
Скромная бактерия за полстолетия с момента ее открытия в конце XIX в. стала настоящей волшебной палочкой для молекулярной биологии. Сейчас результаты опытов с ее использованием занимают главы и тома профессиональных и популярных изданий. Конечно, в нашем путеводителе по модельным организмам E. coli должна была занять свое почетное место.
![]()
Двенадцать модельных организмов
Escherichia и Eschrichtius — Болезнь путешественников — Главная модельная бактерия — Учебник молекулярной генетики — Невезение с CRISPR/Cas
![]()
Рисунок 1а. Escherichia длиной 2 мкм
![]()
Рисунок 1б. Теодор Эшерих (1857–1911)
![]()
Рисунок 1в. Eschrichtius длиной 14 метров
![]()
Рисунок 1г. Даниэль Фредрик Эшрихт (1798–1863)
Клетки с относительно тонкой клеточной стенкой, не окрашивающиеся красителем генцианом фиолетовым (окраской бактерий по методу датского микробиолога Кристиана Грама).
Зачем же такую опасную бактерию сделали модельной? Дело в том, что в условиях культивирования кишечная палочка часто теряет патогенность, становится неспособной жить в естественных для себя условиях (то есть одомашнивается). И этим свойством в 1940-е годы воспользовались микробиологи, проведя с лабораторными штаммами E. coli (например, со знаменитым штаммом К12) много прорывных для науки экспериментов.
Так, манипулируя мутированными штаммами кишечной палочки, которые уже научились получать при помощи облучения, Джошуа Ледерберг и Эдуард Лаури Тейтем в 1947 году обнаружили способность разных штаммов обмениваться генетическим материалом и спасать друг друга от образовавшихся дефектов, проявлявшихся в неспособности расти на минимальной питательной среде. Так был открыт процесс конъюгации бактерий, который затем послужил важным инструментом для картирования бактериального генома . Ведь тогда это можно было делать только косвенными, микробиологическими методами — сама природа генетического кода была неизвестна.
Кстати, Джошуа Ледерберг был некоторое время мужем Эстер Ледерберг, первооткрывательницы бактериофага лямбда [3].
С начала 1950-х годов исследования по молекулярной генетике с использованием кишечной палочки и ее вирусов в качестве основного инструмента росли как снежный ком. Не будет преувеличением сказать, что к 70-м годам E. coli написала учебник молекулярной генетики! Вспомним открытие генетического кода, в котором участвовало несколько коллективов физиков и молекулярных биологов, в том числе Френсис Крик, Георгий Гамов и другие выдающиеся люди того времени [6]. Основные эксперименты по расшифровке кода велись на бесклеточных лизатах кишечной палочки.
Позднее обнаружилось, что E. coli хорошо подходит для зародившейся в 1960–1970-е годы биотехнологии [7]. Бактерия хорошо переносит введение в свою клетку гетерологичных (то есть чужеродных) генов и во многих случаях способна синтезировать их продукты без вреда для себя. Белки, полученные таким способом, стали называть рекомбинантными, и теперь они широко используются в медицине и других практических задачах.
Кишечная палочка — возможно, самый исследованный организм с точки зрения молекулярной биологии. Тем не менее у элементов ее генома до сих пор обнаруживают новые свойства. Это одновременно плохо (как же мало мы знаем!) и хорошо (будет чем заняться!). Совсем недавно на защите диссертации я услышал о том, как у одной из генных кассет эшерихии, участвующей в каскаде переработки сульфолипидов, также обнаружена и лактазная активность [8]. До этого такая активность была известна только у знаменитого лактозного оперона Жакоба и Моно, описанного в 1961 году!
Кажется, что E. coli — модельный организм без недостатков. Тем не менее биотехнологам не повезло, что у этой бактерии от природы нет системы бактериального иммунитета CRISPR/Cas [9], о которой я уже упоминал в эссе о бактериофаге лямбда [3]. Именно поэтому эту систему, ныне незаменимую в генной инженерии, открыли относительно поздно.
Кишечная палочка-выручалочка — это здорово (рис. 2). Но теперь пора переместиться в мир ядерных организмов. Удобным инструментом для молекулярной биологии и генетики эукариот оказались одноклеточные грибы — дрожжи — и гаплоидный плесневый гриб — нейроспора. Как они дошли до такой одноклеточной и гаплоидной жизни и что было открыто с их помощью — читайте в следующем материале нашего путеводителя по модельным организмам через месяц.
![]()
Благодарность
![]()
Несмотря на существование очевидных преград и трудностей, которые подчас встают на пути развития и внедрения продуктов генной инженерии (ГИ), XXI век уже невозможно представить без плодов этой важной и многообразной технологии в арсенале современного биолога. Наиболее часто используемым организмом в ГИ являются бактерии.
Что такое ГИ и зачем она нам нужна? Почему бактерии так популярны у генных инженеров? В каком виде проще всего внести нужный ген в бактерию? С какими трудностями можно столкнуться, работая с этими организмами? Что произошло раньше: создание первой генноинженерной бактерии или открытие структуры ДНК и генома? Об этом и многом другом читайте под катом.
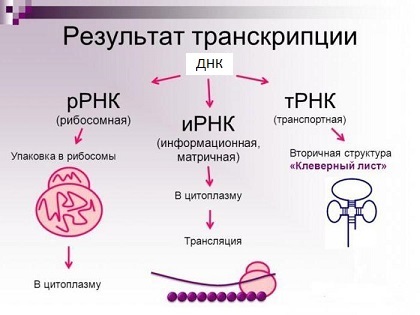
В данном пункте приведено краткое описание так называемой Центральной догмы молекулярной биологии. Если вы обладаете базовыми знаниями в молекулярной биологии, то смело переходите к пункту 1.
![]()
Центральная догма молекулярной биологии в одной картинке
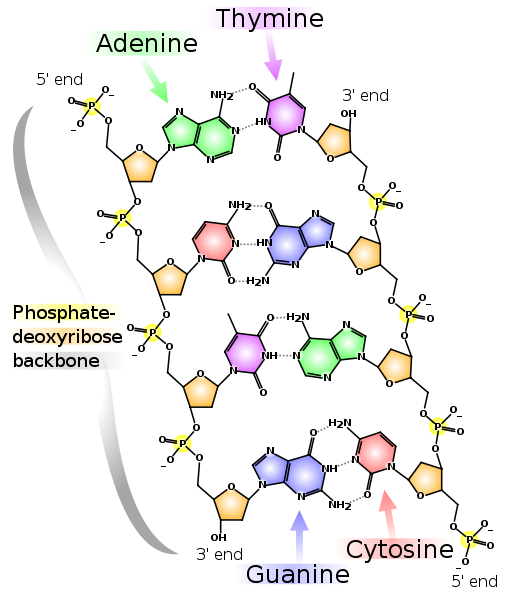
Итак, начнём. Вся информация о всех стадиях развития и свойствах любого организма, будь то прокариоты (бактерии), археи или эукариоты (все остальные одно- и многоклеточные), закодирована в геномной ДНК, которая представляет собой комплекс двух комплементарных друг другу полинуклиотидных цепей, образующих двойную спираль (комплементарные нуклеотиды ДНК: A-T и G-C). Хромосомы эукариот представляют собой линейные двухцепочечные молекулы ДНК, а хромосомы прокариот закольцованы. Зачастую гены составляют лишь небольшую часть всего генома (у человека — около 1,5%).
![]()
Две комплементарные друг другу цепи ДНК. Пунктирными линиями показаны водородные связи между основаниями. Как видно, аденин и тимин образуют между собой две водородные связи, а гуанин и цитозин — три. Поэтому связь G-C прочнее и GC-богатые участки двухцепочечной ДНК сложнее разделить на две цепочки.
![]()
Цепочки ДНК и РНК.
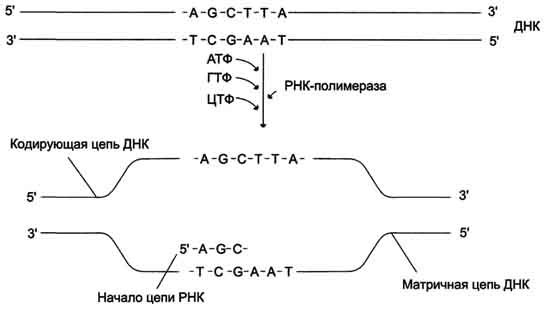
Последовательности ДНК и РНК всегда записывают от 5'-конца к 3'-концу. На то есть ряд причин:
- Синтез новых цепочек ДНК и РНК начинается с 5'-конца (ДНК-полимеразы (ферменты, синтезирующие комплементарную цепь ДНК на матрице ДНК или РНК) и РНК-полимеразы (ферменты, синтезирующие комплементарную цепь РНК на матрице ДНК или РНК) идут по матрице в направлении 3' -> 5', стало быть новая цепь синтезируется в направлении 5' -> 3');
- Рибосома читает кодоны, передвигаясь по мРНК в направлении 5' -> 3';
- Последовательность аминокислот записана в кодирующей цепи ДНК в направлении 5' -> 3' (значащая часть мРНК представляет собой точную копию участка кодирующей цепи ДНК с заменой тимина на урацил и с гидроксильной группой (-OH) вместо водорода в положении 2', разумеется);
![]()
Наконец, просто удобно иметь общепринятое правило записи.
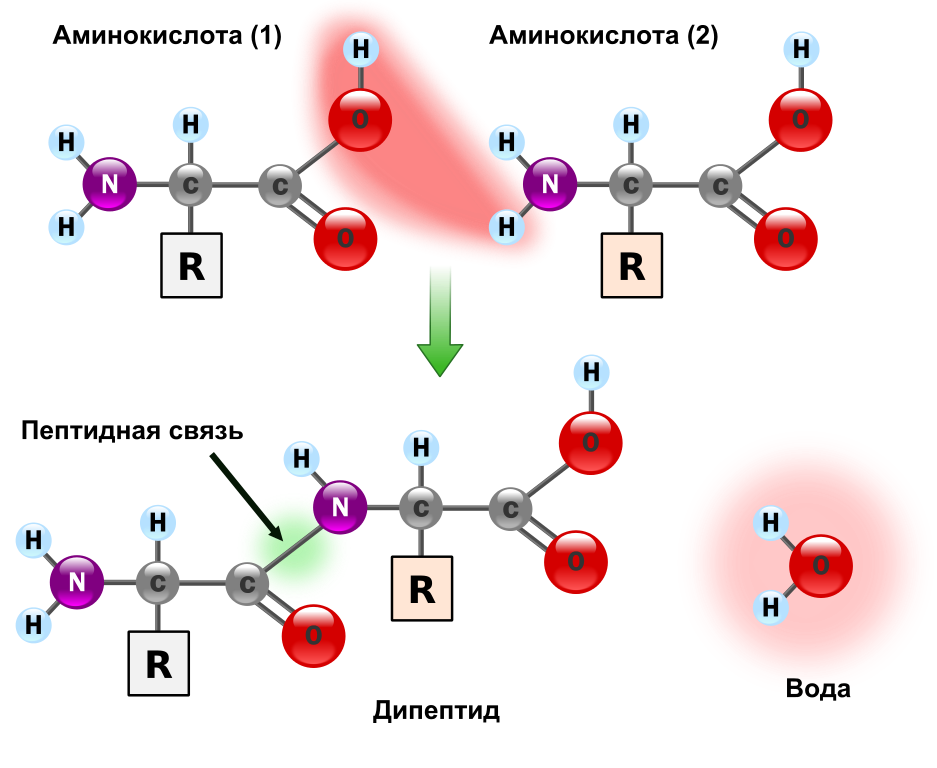
Ген — это участок геномной ДНК, задающий последовательность нуклеотидов молекулы РНК:
![]()
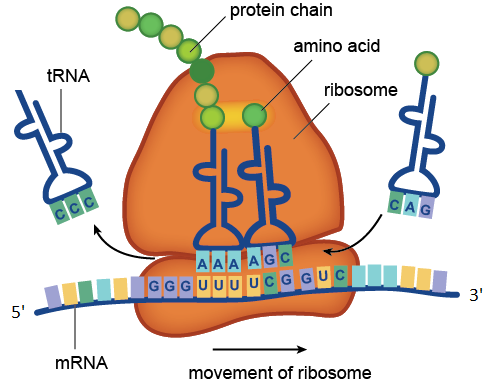
Процесс трансляции, катализируемый рибосомой. На рисунке находящиеся в составе мРНК кодоны UUU и UCG распознаются находящимися в составе молекул тРНК антикодонами AAA и AGC. Транспортная РНК с антикодоном CCC уже отдала свою аминокислоту растущей белковой цепочке, а тРНК с антикодоном CAG ждёт своей очереди. Показанный на рисунке участок молекулы мРНК состоит из четырёх кодонов: GGGUUUUCGGUC. Кодон GGG соответствует аминокислоте глицину, UUU — фенилаланину, UCG — серину, GUC — валину. Значит данный участок мРНК кодирует фрагмент белка с аминокислотной последовательностью глицин-фенилаланин-серин-валин.
Рибосомные РНК — незаменимые компоненты рибосомы. Основной функцией рРНК является обеспечение процесса трансляции: она участвует в считывании информации с мРНК при помощи адапторных молекул тРНК и катализе образования пептидных связей между присоединёнными к тРНК аминокислотами и растущей цепью белка.
![]()
Основные типы молекул РНК (на самом деле их куда больше).
![]()
![]()
В случае с генами, кодирующими белок процесс расшифровки генетической информации выглядит так:
![]()
Прокариотический транскприпционный комплекс. Указанные на рисунке буквы являются общепринятыми обозначениями соответствующих субъединиц. σ70 — сигма фактор генов домашнего хозяйства E. coli
![]()
Кодоны в стандартном генетическом коде. Спасибо википедии за картинку.
Бактерия в генной инженерии — это потенциальный исходный материал для создания:
Интересным является тот факт, что первые успешные опыты в области генной инженерии бактерий произошли задолго до эпохальной работы Уотсона и Крика. Более того, на основании этих опытов был доказан сам факт того, что информация содержится именно в ДНК, после чего учёные могли не тратить своё время на гипотезы об РНК и белке.
Таким образом, было доказано, что носителем информации о признаках является именно ДНК. Кроме того, было наглядно показано, что возможно самопроизвольное проникновение инородной молекулы ДНК в бактериальную клетку.
Почему бактерии так популярны при очевидных недостатках (например, отсутствие эукариотических посттрансляционных модификаций)? Всё просто. Они неприхотливы в работе, просты в использовании и не требуют дорогих питательных сред.
Современная генная инженерия бактерий в основном представляет собой внедрение плазмидного вектора (модифицированной бактериальной плазмиды, содержащей целевой ген и набор других необходимых элементов, о которых речь пойдёт ниже). Изменение хромосомы бактерии менее типично, но эта процедура также не является чем-то диковинным: например, ген РНК-полимеразы бактериофага Т7 был введёт в хромосому кишечной палочки с помощью вектора на основе профага λ в процессе создания одного из популярных в лабораторной плактике штаммов. Причин, по которым зачастую исследователь выберет внедрение гена в составе плазмидного вектора три:
Кроме гена и промотора основными элементами плазмидного вектора являются:
ori — область начала репликации плазмиды. Нужна для поддержания постоянного количества плазмиды и её наследования дочерними клетками;
Другим примером может служить, использование гена β-глюкуронидазы (GUS). Данный фермент превращает определённые соединения в окрашенные или флуоресцирующие, что может быть обнаружено визуально по окрашенности колонии. Естественно, данные соединения нужно добавлять в питательную селективную среду. Ещё один пример — использование гена зелёного флуоресцентного белка (GFP) (хотя использование GUS и GFP более типично для работ с клетками растений и животных);
участок, отвечающий за контроль копийности (мало плазмид в клетке — плохо, много — тоже плохо);
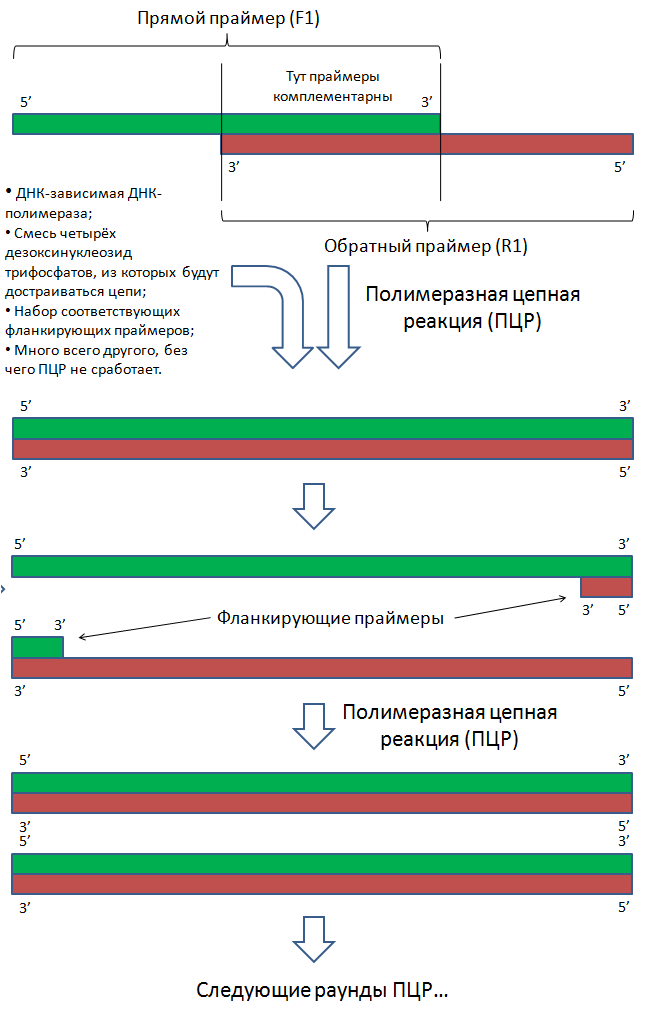
Что ж, вектор у нас на руках. Как в него встроить ген? И вообще, где этот ген взять?
Допустим, что мы знаем последовательность нуклеотидов нужного нам гена. Тогда поступают следующим образом:
- Химически синтезировать короткие одноцепочечные полинуклеотиды таким образом, чтобы они частично перекрывались;
- Объединить эти фрагменты с помощью ПЦР.
![]()
![]()
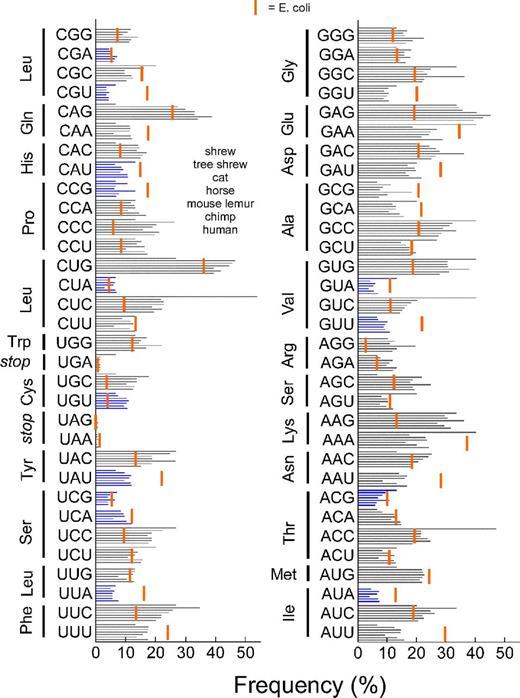
На рисунке синими полосками показаны частоты кодонов у землеройки, тупайи, домашней кошки, лошади, мышиного лемура, шимпанзе и человека. Красной полосой отмечена частота кодонов у кишечной палочки E. coli.
Система на основе регуляторных элементов лактозного оперона E. coli (lac-оперона) и сильного промотора.
Дело в том, что у кишечной палочки есть свои правила питания. Во-первых, существует механизм подавления активности lac-оперона, который включён только тогда, когда в клетку не поступает лактоза. Это логично: зачем тратить силы на синтез того, что не пригодится? Но как только лактоза начинает поступать в клетку в достаточном количестве этот механизм выключается.
Однако, есть второй механизм подавления активности lac-оперона. Если в среде есть глюкоза, то клетка питается исключительно глюкозой, так как она активирует второй механизм ингибирования транскрипции lac-оперона. Таким образом, lac-оперон активен только тогда, когда в окружающем клетку пространстве есть только лактоза. Минусом лактозного оперона является крайне слабый промотор, поэтому в штаммах продуцентах он заменён на сильный. Сильные промоторы часто получают из патогенов. Наиболее широко используемые в генной инженерии прокариот сильные промоторы выделены из бактериальных вирусов — бактериофагов. Например, широко используется промотор фага Т7.
К слову, некоторые сильные промоторы для генной инженерии растений также выделены из вирусов, например, это промотор вируса мозаики цветной капусты.
![]()
Как было указано выше, у E. coli нет РНК-полимеразы, которая бы узнавала промоторы бактериофагов, поэтому предварительно в продуцент встраивают ген РНК-полимеразы соответствующего бактериофага.
Можно поступить и по-другому: вообще не добавлять в питательную среду глюкозу и лактозу, а потом, когда культура дорастёт до нужной плотности, добавить то, что клетка примет за лактозу, но не сможет метаболизировать или разрушить. Сейчас в качестве такого индуктора используют ИПТГ.
Система на основе регуляторного механизма промотора pL бактериофага λ.
Данный промотор инактивируется белком-репрессором cI. При этом была обнаружена термочувствительная форма этого белка, названная cI857: данный фактор транскрипции сохраняет функциональность при температуре около 30⁰С и теряет её при 42⁰С. Поэтому при использовании такой системы сначала бактериальную культуру растят до нужной плотности при 30⁰С, а затем поднимают температуру до 42⁰С, тем самым запуская синтез целевого белка.
Ну что же, вектор разработан. Дальше дело за малым — найти подходящий метод для его внесения в бактериальную клетку. Но это уже совсем другая история.
Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции
|