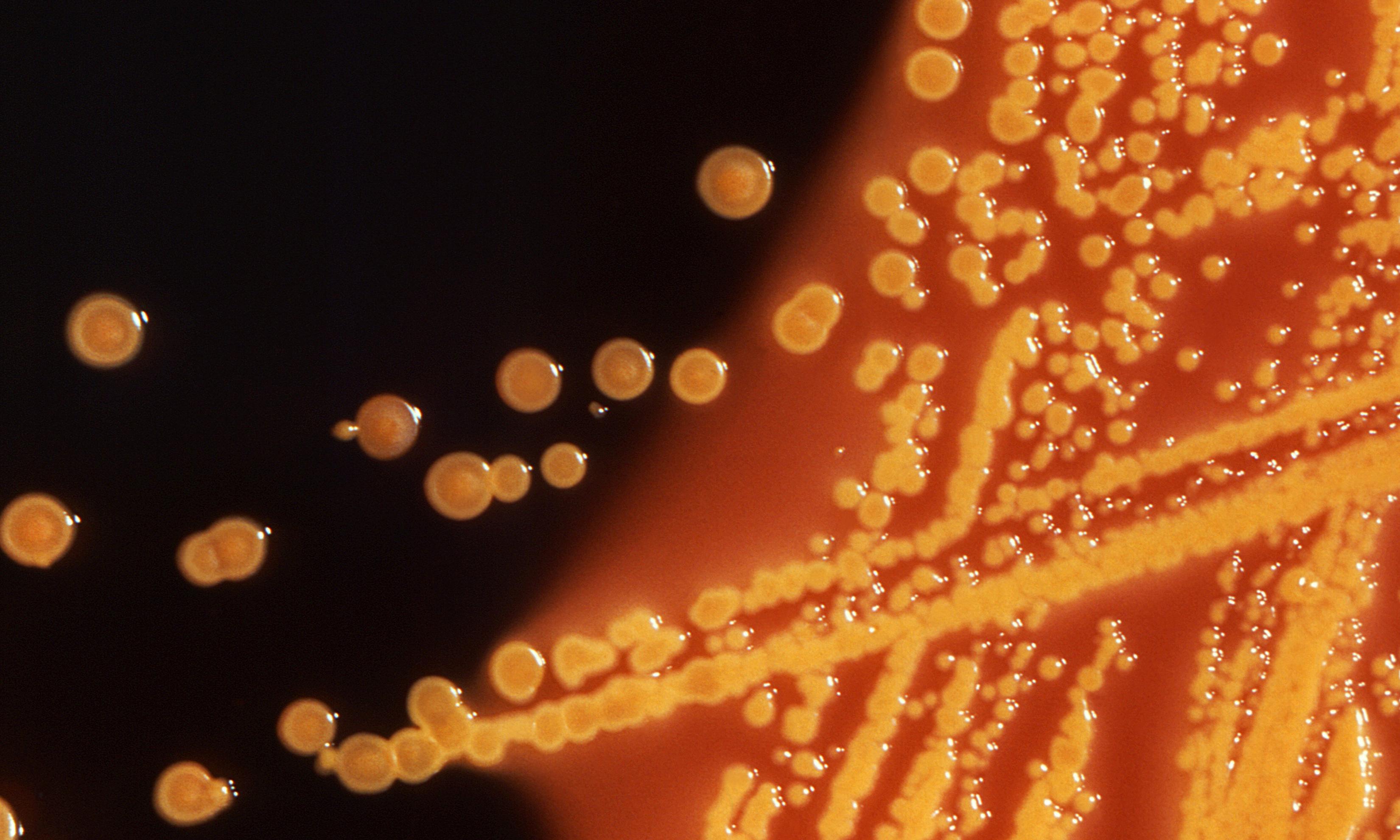
Кишечная палочка синтезирует аминокислоты

Не шути со мной: супермикроб может выглядеть именно так.
Фотография Chris Bickel/Science.

Термин "лайфхак" (life hacking), который дословно можно перевести как "взлом жизни", обычно относится к полезным советам, умным настройкам или изобретениям, призванным сделать жизнь человека легче. Но недавно команда учёных из Медицинской школы при Гарвардском университете "взломала жизнь" в буквальном смысле. Исследователи сообщили о самой перспективной на сегодняшний день "переписи" генома бактерии: их работа видоизменила 3,8 процента пар оснований в ДНК кишечной палочки Escherichia coli.
Учёные заменили в общей сложности 7 из 64 кодонов микроорганизма (последовательностей, которые кодируют аминокислоты) на другие. Специалистам удалось уменьшить количество кодонов, синтезировав 55 фрагментов ДНК, каждый из которых имел 50 тысяч пар оснований. Есть, правда, одно существенное "но": генетикам ещё только предстоит собрать все эти кусочки в функционирующую E. coli.
Но, несмотря на "недоделанную работу", команда исследователей из Медицинской школы при Гарвардском университете отмечает, что они сделали важный шаг в создании организмов с новыми свойствами. Например, устойчивых к вирусным инфекциям.
Учёные, занимающиеся синтетической биологией, целью которой является проектирование и создание новых биологических систем, не встречающихся в природе. Существует мнение, что эта работа также пригодится для Human Genome Project ("Проект генома человека"). В этой программе учёные стремятся синтезировать геном человека из доступных компонентов.
Кроме того, перепрограммированный геном кишечной палочки может стать новой рабочей лошадкой для различных лабораторных опытов, считают специалисты.
"Результаты исследования говорят о том, что такая радикальная реструктуризация вполне реализуема", — говорит синтетический биолог из Гарвардского университета Джордж Чёрч (George Church).
"Уменьшение с 64 до 57 кодонов является довольно серьёзным видоизменением того, чтобы было создано природой", — отмечает синтетический биолог из Йельского университета Фаррен Айзекс (Farren Isaacs), который работал совместно с Чёрчем в более ранних исследованиях, однако не принимал участия в новом проекте.
По его мнению, это очень важный шаг вперёд для демонстрации своеобразной податливости генетического кода и того, как полностью новый тип биологический функций или свойств может быть извлечён из организма через геномы, которые были перекодированы.
Отметим, что уменьшение числа кодонов с 64 до 57 позволяет не потерять машинерию, необходимую клетке для выживания. Исследователи предполагали, что это технически достижимо: 64 кодонов достаточно для кодирования всех 20 аминокислот, продуцируемых организмом, но для одних и тех аминокислот некоторые кодоны дублируются, а значит, от них потенциально можно избавиться. Что и показали исследователи США.
Учёные из лаборатории Чёрча и другие команды ранее показывали, что вполне возможно перекодировать отдельные аминокислоты в E. coli таким образом, что бактерия могла "принимать" аминокислоты, которые не встречаются в природе.
Такие "перепрограммированные" организмы отличаются высокой устойчивостью к вирусным инфекциям. Причина устойчивости проста: они больше не содержат генетический механизм общий со всеми естественными организмами, который вирусы используют для того, чтобы выжить, внедрившись в клетку "хозяина".
Они также могут быть "запрограммированы" таким образом, чтобы полностью зависеть от синтетических аминокислот в их рационе питания. Это может быть сделано для того, чтобы развеять страх того, что "переписанные" бактерии могут "вырваться из лаборатории" и начать сеять хаос в мире. Такие микроорганизмы не смогут питаться за пределами лаборатории (по крайней мере, первое время, пока не мутируют и не перестроятся).
Технология перекодировки использует все самые последние наработки в этой области и, вероятно, ещё несколько лет назад об этом нельзя было и подумать. Скорость проектирования и синтеза ДНК (сегодня этим может заняться любой желающий) значительно выросла за последние десятилетия, что позволяет воплотить в жизнь самые амбициозные генно-инженерные проекты.
Так, в марте 2016 года учёные во главе с Крейгом Вентером из Института Крейга Вентера в Калифорнии заявляли, что создали искусственный геном, основанный на геноме бактерии, в котором были удалены все "ненужные" гены. Но геном того организма был на порядок меньше, чем у нынешней E. coli.
В настоящий момент Чёрч и его коллеги пытаются "сшить" сегменты ДНК перекодированной кишечной палочки в один единый геном. Затем они проверят, способен ли такой реконструированный организм к жизни. Чёрч говорит, что пока непонятно, сколько именно времени займёт эта работа: может быть четыре месяца, а может и четыре года.
Что же касается конечных целей проекта, то учёный в итоге хочет получить настоящую "ферму" стволовых клеток животных и человека, устойчивых к вирусам. Такие клетки могут быть использованы для производства вакцины и для пересадок. По его словам, трудно запрограммировать человека быть устойчивым к вирусам, раку или старению, но учёные могут создавать органы и ткани для трансплантации с такими важными свойствами.
"Конечно, это будет большая работа и она требует много сил, но есть вероятность того, что итог будет хорошим", — заключает Айзекс.
Исследование описано в научном издании Science.
Девять лет назад американские ученые во главе с генетиком Крейгом Вентером объявили, что создали первый в мире живой организм с полностью синтезированным геномом — бактерию Mycoplasma mycoides, которая является возбудителем легочных заболеваний у крупного рогатого скота и домашних коз. Вентер тогда объявил о скором начале новой эры, в которой организмы станут приносить пользу человечеству — например, помогут производить более эффективное биотопливо и лучше высасывать углекислый газ из атмосферы.
Однако спустя несколько лет ученые признали, что геном бактерии в действительности не был радикально изменен. Несмотря на это, работа ученых положила начало новому направлению в генетике, которое занимается созданием организмов с полностью отредактированным ДНК.
Над синтезированием генома работают и ученые из проекта GP-write — им уже удалось создать искусственные копии 2 из 16 хромосом, составляющих геном одного штамма пекарских дрожжей. Но ДНК Mycoplasma mycoides включает всего 1,08 млн пар оснований, а дрожжевые хромосомы — менее 1 млн. Кишечная палочка, с которой работали генетики из лаборатории молекулярной биологии Совета по медицинским исследованиям Англии в Кембридже, содержит 4 млн оснований.
Исследователи во главе с доктором Джейсоном Чином разбили эти 4 млн оснований Escherichia coli на 37 фрагментов и синтезировали их. Получившийся образец похож на своих естественный собратьев, но выживает благодаря меньшему набору генетических инструментов.
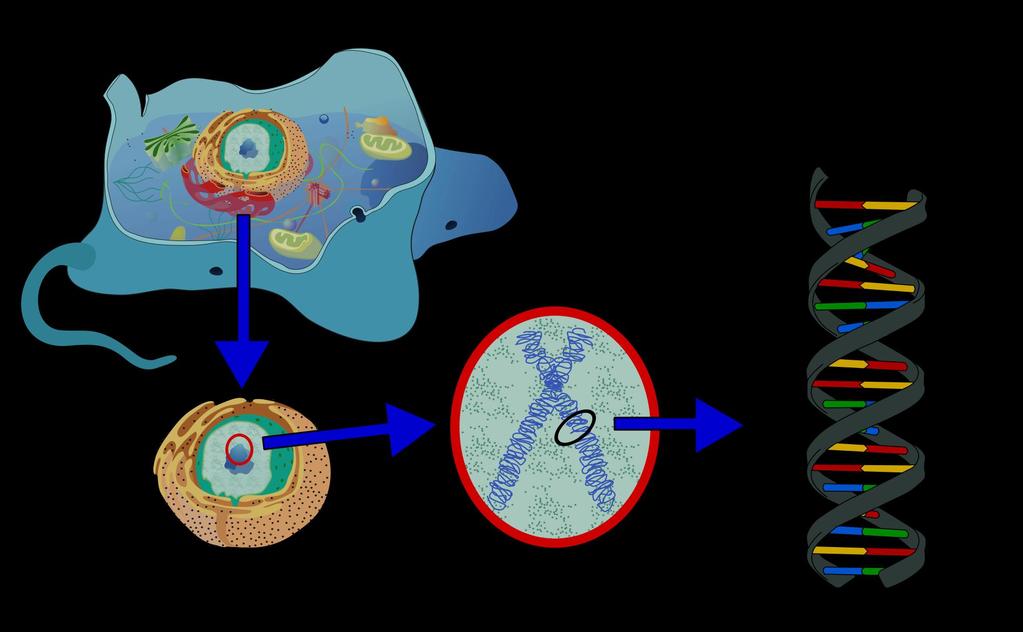
Прежде всего стоит разобраться с тем, что такое ДНК. Это дезоксирибонуклеиновая кислота, которая является наследственным материалом человека и всех живых организмов.
Почти каждая клетка в теле человека имеет одну и ту же ДНК. Большая часть дезоксирибонуклеиновой кислоты находится в ядре клетки (она называется ядерной ДНК), но в небольшом количестве она присутствует и в митохондриях.
Информация в ДНК хранится в виде кода, состоящего из четырех химических оснований: аденина (A), гуанина (G), цитозина (C) и тимина (T). Геном человека состоит примерно из 3 млрд оснований, и более 99% этих оснований одинаковы для всех людей. Их порядок и последовательность определяет то, каким образом построен и поддерживается организм — подобно тому, как буквы алфавита строятся в определенном порядке, образуя слова и предложения.
Основания ДНК спариваются друг с другом — например, A с T и C с G, чтобы сформировать единицы, называемые парами оснований. Каждое основание также присоединено к молекуле сахара и молекуле фосфата. Вместе основание, сахар и фосфат называются нуклеотидом.
Нуклеотиды расположены в виде двух длинных нитей, которые образуют двойную спираль — в таком виде мы привыкли представлять себе ДНК.
Структура двойной спирали чем-то напоминает лестницу: пары оснований образуют ступеньки, а молекулы сахара и фосфата образуют вертикальные боковые части.
ДНК, свернутая в клетку, содержит инструкции, необходимые для ее функционирования. Например, когда клетке требуется больше белка для роста, она считывает ДНК, кодирующую нужный белок. Такие соединения называются кодонами и записываются в виде трех букв — например, TCG и TCA.
Почти все формы жизни, от медузы до человека, используют 64 кодона. Но многие из них делают одну и ту же работу или повторяют свои функции. В общей сложности 61 кодон образует 20 природных аминокислот, которые можно связать вместе, как бусы на нитке, для создания любого белка в природе. Еще три кодона представляют собой своего рода тормоз — они сообщают клетке, когда белок готов, и ей нужно прекратить его генерировать.
Создать такой оптимизированный организм и попытались исследователи.
Группа ученых из Кембриджа изучила весь генетический код штамма E. coli и проанализировала функции всех кодонов. После этого исследователи серинового кодона заменили TCG на AGC, каждый TCA (также сериновый) на AGT и каждый TAG (стоп-кодон) на TAA.
Однако самой сложной работой было собрать химическую копию переписанного генома и обменять его на оригинал внутри живых организмов. Эта работа заняла у ученых около двух лет: когда каждый синтетический фрагмент заменял оригинальный код, исследователи наблюдали, будут бактерии функционировать или погибнут.
Исследователи обнаружили схему перекодирования, которая позволяла заменить оригинальный код на искусственный и сохранить кишечную палочку живой, несмотря использование 59 кодонов вместо 61 для генерирования аминокислот и два, а не 3 кодона, чтобы остановить этот процесс.
Таким образом ученым удалось сократить число кодонов с 64 до 61. Это новый рекорд — до сих пор генетикам удавалось создать бактерию Escherichia coli, которая могла выжить только с 63 кодонами вместо 64.
Главная цель создания отредактированного генома — возможность придать кодонам возможность генерировать одну из сотен аминокислот, помимо 20, заложенных природой. Этом даст возможность синтезировать новые ферменты и другие белки.
Среди этих возможностей — создание новых продуктов питания, появление новых возможностей для промышленности, и, главное, создание бактерий, устойчивых к вирусам. Это позволит фармацевтам создавать препараты, которые будут еще эффективнее бороться с вирусами и бактериями.
Дало ли открытие ученых эти возможности? Нет. Но оно позволило продвинуться далеко вперед в попытке создать полностью синтетический геном живого организма с отличными от оригинальных функциями.

Для расшифровки структуры белка прежде всего необходимо получить его в достаточном количестве. Самым простым и дешёвым методом для этого является экспрессия в клетках E. coli — кишечной палочки, неприхотливой и наиболее изученной бактерии. Для этого ген, кодирующий нужный белок, вводят в клетки E. coli, заставляя бактерий гиперэкспрессировать этот белок (то есть синтезировать в больших количествах). Затем белок выделяют из бактерий, очищают и кристаллизуют, чтобы потом, используя рентгеновское рассеяние, восстановить структуру белка.
Столкнуться с серьёзными проблемами учёные могут уже на первом этапе — экспрессии. Их решение часто происходит перебором различных методов, известных на данный момент, что зачастую долго и дорого. Авторы статьи предложили подход, который позволит решать проблемы экспрессии систематическим способом, на основе чёткого алгоритма. Это позволит значительно ускорить этот этап в исследованиях по всему миру.
Иллюстрация предложенного алгоритма. Изображение: PLOS ONE
Следует отметить, что в итоге получается обнаружить необходимую мутацию за 2log2N экспрессий белка, в то время как случайный её поиск требует 2 N итераций (здесь N — количество аминокислот в его цепочке). Преимущество нового алгоритма можно увидеть на примере небольшого белка из 200 аминокислот: для него потребуется синтезировать не более 16 различных химер, в то время как случайный перебор требует синтезировать порядка 10 60 различных белков — больше, чем во всех живых организмах на планете.
В качестве примера работы алгоритма авторы получили химеру бактериородопсина из бактерии H. halobium. Структура его получена уже давно, но сам он при этом выделялся из родных для него клеток, работа с которыми затруднительна и требует больше времени, чем работа с кишечной палочкой. В E. coli, ученые пытались экспрессировать бактериородопсин уже около 30 лет, но до сих пор методы, которые применялись к этой задаче, не позволяли получить его в больших количествах и в той форме, в которой белок функционирует в клетке.

Кристаллы бактериородопсина — белка, на примере которого проверялся предложенный метод.
Изображение любезно предоставлено авторами исследования
Сам по себе бактериородопсин -- важный модельный белок для проверки различных теорий, связанных с мембранными белками в целом. Алгоритм, предложенный учёными, позволяет получать его без использования экзотических методов экспрессии, что существенно упростит доступ к работе с мембранными белками в лабораториях во всём мире и сильно сократит стоимость их получения. Кроме того, существует несколько десятков изобретений на основе бактериородопсина, использующихся в отраслях от биомедицины и биотехнологии до создания оптических инструментов (лазеров, например) и измерительных систем.
Отметим, что получение белков, последовательность которых чем-либо отличается от исходной, является стандартным методом улучшения экспрессии, но до сих пор этот метод модифицировался индивидуально под каждый белок.
поясняет Валентин Горделий, автор идеи метода.
В перспективе, предложенный метод позволит значительно ускорить процессы исследования мембранных белков, что может изменить стратегию синтеза лекарств и даст возможность с помощью компьютерного моделирования находить новые действующие вещества быстрее и точнее. Также изучение мембранных белков важно для новой науки оптогенетики, которая уже сейчас открывает невероятные возможности для исследования нейродегенеративных заболеваний, таких как болезнь Альцгеймера или Паркинсона.
2.1. ПРОИЗВОДСТВО АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ
МИКРОБНЫХ МУТАНТОВ ОТНОСИТСЯ К ПЕРИОДУ РАЗВИТИЯ
новой и новейшей биотехнологии
2.2. ПРОИЗВОДСТВО ВИТАМИНОВ ОТНОСИТСЯ К ПЕРИОДУ
новой и новейшей биотехнологии
2.3. ПРОИЗВОДСТВО ЭТАНОЛА ОТНОСИТСЯ К ПЕРИОДУ
новой и новейшей биотехнологии
2.4. ПЕРИОД РАЗВИТИЯ БИОТЕХНОЛОГИИ ПРОИЗВОДСТВA
АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ МИКРОБНЫХ МУТАНТОВ
новой и новейшей биотехнологии
2.5. СУБСТАНЦИИ, КОТОРЫЕ ОСУЩЕСТВЛЯЮТ БИОСИНТЕЗ
2.6. ДЛЯ ПРОМЫШЛЕННОГО ПОЛУЧЕНИЯ АСКОРБИНОВОЙ
КИСЛОТЫ ПРИМЕНЯЮТ МЕТОД РЕЙХШТЕЙНА. СОГЛАСНО
ДАННОМУ МЕТОДУ, ПРОЦЕСС СОСТОИТ ИЗ 6 СТАДИЙ, ОДНА ИЗ
КОТОРЫХ ЯВЛЯЕТСЯ БИОТЕХНОЛОГИЧЕСКОЙ
получение D-сорбита из D-глюкозы (полученной из крахмала) методом каталитического восстановления водородом.
получение L-сорбозы из D-сорбита методом глубинного аэробного окисления
получение диацетон-L-сорбозы из L-сорбозы путем ее ацетонирования.
получение гидрата диацетон-2-кето-L-гулоновой кислоты путем окисления диацетон-L-сорбозы
2.7. БИОТЕХНОЛОГИЧЕСКИЙ ПРОЦЕСС ПОЛУЧЕНИЯ
АСКОРБИНОВОЙ КИСЛОТЫ (этап получения гидрата диацетон-2-кето-L-
гулоновой кислоты) МОЖЕТ ВКЛЮЧАТЬ:
культивирование трансформированных клеток Erwinicahebricola
микробиологическое расщепление целлюлозы
совместное культивирование микроорганизмов Corynebacterium и Erwinicahebricola
последовательное культивирование микроорганизмов Corynebacterium и Erwinicahebricola
2.8. В БИОТЕХНОЛОГИЧЕСКОМ ПРОИЗВОДСТВЕ
НИКОТИНОВОЙ КИСЛОТЫ (ВИТАМИНА РР) В КАЧЕСТВЕ
ПРОДУЦЕНТА НАД ИСПОЛЬЗУЮТ
бета-аланин и калия пантоат
2.9. ДРОЖЖИ-САХАРОМИЦЕТЫ КУЛЬТИВИРУЮТ В АЭРОБНЫХ
УСЛОВИЯХ ПРИ ИЗБЫТКЕ УГЛЕВОДОВ В ПИТАТЕЛЬНОЙ СРЕДЕ,
СНИЖЕННОМ КОЛИЧЕСТВЕ АЗОТА И ОПТИМАЛЬНОМ СОДЕРЖАНИИ
КИСЛОРОДА (МАКСИМУМ 2%) ДЛЯ ПОЛУЧЕНИЯ
сразу кристаллического витамина D2
2.10. КИШЕЧНАЯ ПАЛОЧКА Escherichia coli ЯВЛЯЕТСЯ ПРОДУЦЕНТОМ
витаминов В12 и аскорбиновой кислоты
витамина В12 и убихинонов
витамина В12 и пантотеновой кислоты
витамина В12 и витамина D
2.11. ПЕРСПЕКТИВНО ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ
ПРОДУЦЕНТА ГРИБОВ РОДА Candida РАСТУЩИХ НА
УГЛЕВОДОРОДНЫХ СРЕДАХ, Candida maltosa, ПРИ КУЛЬТИВАЦИИ
КОТОРЫХ ПОЛУЧЕННАЯ ЛИПИДНАЯ ФРАКЦИЯ НАЗЫВАЕТСЯ
витаминов В12 и аскорбиновой кислоты
витамина В12 и убихинонов
эргостерина и пантотеновой кислоты
убихинонов и витамина D2
2.12. ДРОЖЖИ-САХАРОМИЦЕТЫ КУЛЬТИВИРУЮТ В АЭРОБНЫХ
УСЛОВИЯХ ПРИ ИЗБЫТКЕ УГЛЕВОДОВ В ПИТАТЕЛЬНОЙ СРЕДЕ,
СНИЖЕННОМ КОЛИЧЕСТВЕ АЗОТА И ОПТИМАЛЬНОМ СОДЕРЖАНИИ
КИСЛОРОДА (МАКСИМУМ 2%) ДЛЯ ПОЛУЧЕНИЯ
сразу кристаллического витамина D2
2.13. ПРОМЫШЛЕННЫМ ПРОДУЦЕНТОМ КАРОТИНОИДОВ
генно-инженерные штаммы кишечной палочки
гетероталлический мицеллярный гриб Blakeslea
2.14. БИОСИНТЕЗ ВИТАМИНА В1 ОСУЩЕСТВЛЯЮТ
2.15. БИОСИНТЕЗ ПАНТОТЕНОВОЙ КИСЛОТЫ ОСУЩЕСТВЛЯЮТ
2.16. АМИНОКИСЛОТЫ В СВЕТЕ БИОТЕХНОЛОГИЧЕСКОГО
внеклеточными целевыми продуктами
2.17. ПРОМЫШЛЕННЫМ ПРОДУЦЕНТОМ ГЛУТАМИНОВОЙ
2.18. Corinebacterium glutamicum ЯВЛЯЕТСЯ ПРОДУЦЕНТОМ ДЛЯ
2.19. НАИБОЛЕЕ ДРЕВНИЙ И НЕЭКОНОМИЧНЫЙ СПОСОБ
ПРОМЫШЛЕННОГО ПОЛУЧЕНИЯ АМИНОКИСЛОТ
гидролиз природного белковосодержащего сырья;
химический синтез с разделением рацематов на иммобилизованной аминоацилазе
2.20. МЕХАНИЗМ КОНТРОЛЯ СКОРОСТИ БИОСИНТЕЗА
АМИНОКИСЛОТЫ У ПРИРОДНОГО ПРОДУЦЕНТА - КИШЕЧНОЙ
ПАЛОЧКИ, ПРЕПЯТСТВУЮЩИЙ ИЗБЫТОЧНОМУ НАКОПЛЕНИЮ
не согласованная репрессия
2.21. КАКОЙ ИЗ ПРИМЕНЯЕМЫХ МЕТОДОВ ПРОМЫШЛЕННОГО
ПОЛУЧЕНИЯ АМИНОКИСЛОТ ЯВЛЯЕТСЯ ПОЛНОСТЬЮ
БИОТЕХНОЛОГИЧЕСКИМ (БАЗИРУЕТСЯ ЦЕЛИКОМ НА ПРИМЕНЕНИИ
гидролиз природного белковосодержащего сырья
химический синтез с разделением рацематов на иммобилизованной аминоацилазе
2.22. Corinebacterium glutamicum ЯВЛЯЕТСЯ ПРОДУЦЕНТОМ ДЛЯ
2.23. Corinebacterium glutamicum ЯВЛЯЕТСЯ ПРОДУЦЕНТОМ ДЛЯ
2.24. Corinebacterium glutamicum ЯВЛЯЕТСЯ ПРОДУЦЕНТОМ ДЛЯ
2.25. ДЛЯ РЕГУЛЯЦИИ БИОСИНТЕЗА АМИНОКИСЛОТ У
2.26. АМИНОКИСЛОТУ ТРЕОНИН ПРОДУЦИРУЮТ МУТАНТНО-
2.27. МУТАНТНО-ИНЖЕНЕРНЫЙ ШТАММ КИШЕЧНОЙ
ПАЛОЧКИ – ПРОДУЦЕНТ ТРЕОНИНА
ауксотрофен по тренину и гомосерину
синтезирует продукт после накопления биомассы
не нуждается в аминокислотах для своего роста
синтезирует продукт до накопления биомассы
ДЕ-3. Производство вторичных метаболитов.
Поправки вносились в представления о том, в каких условиях может существовать жизнь и где следует её искать.
Новые внезапные открытия подвергали сомнению общепринятые положения об эволюции человека и его расселении по Земле.
Самой тяжёлой, впрочем, артиллерией в этом отношении оказываются генетики: их заключения становятся порой совершенно революционными.
Однако создание новой формы жизни уже из другой области.
А именно это событие и произошло не так давно.
По правде говоря, создание учёных из института Scripps Research — не совершенно новое существо. Это, если пользоваться технической терминологией, модификация уже существующего организма — причём достаточно известного и крайне широко распространённого.

И в то же время, учёные добились того, что их создание с чистой совестью можно назвать новой формой жизни.
Подавляющее большинство естественных белков содержат двадцать аминокислотных остатков (АКО). Хотя барьер этот, надо сказать, далеко не абсолютен.
Но куда больший интерес для учёных представляет возможность вводить в натуральные белки другие нестандартные аминокислоты.
Это было бы крайне полезно для медицинских исследований.
Например, некоторые белки, используемые в терапевтических целях, нуждаются в добавлении различных химических групп, таких как полимеры, соединения с поперечной связью и цитотоксичные молекулы.
Кроме того, гидрофобные аминокислоты и кислоты, связывающие тяжёлые металлы, а также кислоты, содержащие спиновые метки, могут быть использованы для зондирования белковых структур, в которые их вводят.
Искусственные аминокислоты, содержащие такие компоненты, как, например, кето-группы, можно использовать для присоединения к ним дополнительных химических структур, например, молекул сахаров, что позволит создавать новые лекарства на белковой основе.
Как явствует из специального пресс-релиза, учёных, как обычно, интересует не столько факт создания, по сути, новой формы жизни, сколько практическое применение их технологии.
В самом внедрении искусственных аминокислот в белки нет ничего нового, однако прежде такие манипуляции можно было проводить только в пробирке. А бактерия с 21 аминокислотой, как уже указано, сама способна вырабатывать модифицированные белки.

Создать саму бактерию Шульцу и его коллегам удалось благодаря избыточности генетического кода.
В момент экспрессии белка, фермент считывает ДНК-основания гена (аденин, гуанин, цитозин и тимин) и транскрибирует их в РНК (аденин, гуанин, цитозин и урацил).
Однако природа использует некоторые из излишних кодонов: часть из них кодируют одни и те же кислоты, и только три из 64 кодонов не кодируют вообще никаких аминокислот.
Эти кодоны имеют важное значение, поскольку обычно, когда синтезирующая рибосома натыкается на несмысловой кодон, она отделяется от иРНК и синтез прекращается.
Шульц знал, что если он введёт в клетки молекулу тРНК, которая распознаёт УАГ (известную как янтарный супрессор), а также фермент, несущий янтарный супрессор с нестандартной аминокислотой, ему удастся найти способ внедрять нестандартную аминокислоту в любой протеин.
Благодаря этой системе, рибосома, считывающая иРНК, внедрит нестандартную кислоту в тот момент, когда ей встретится УАГ. Более того, любой кодон в иРНК, преобразованный в УАГ, будет кодировать новую аминокислоту в том же самом месте, давая Шульцу и его коллегам возможность внедрять эти новые кислоты в белки там, где им нужно.
Используя этот метод, Шульц и его коллеги вводили кислоту О-метил-L-тирозин в белки с точностью переноса более 99% — почти как у естественных аминокислот. Впоследствии то же самое удалось проделать с рядом других кислот, в том числе p-аминофенилаланином, той самой 21 аминокислотой бактерии.

Биологи научились менять генетический код

В 1961 году в журнале Nature появилась блестящая статья одного из открывателей структуры ДНК Френсиса Крика, в которой он, основываясь на очень скудных фактических данных, сумел, тем не менее, расшифровать генетический код. Ровно через 50 лет после выхода этой замечательной работы в другом престижном журнале - Science - появилась публикация, авторы которой предложили удобный и эффективный способ изменять этот код.
Буквы и точки
Все живые организмы планеты Земля "собирают" сами себя, руководствуясь инструкциями, записанными в их ДНК. Молекулы ДНК представляют собой линейные полимеры, составленные из четырех типов "букв" (по химической структуре это нуклеотиды) - А, Т, Г и Ц. Определенные сочетания троек этих "букв" кодируют те или иные аминокислоты - элементарные "кирпичики", из которых состоят белки. Такие тройки нуклеотидов были названы кодонами, и всего их насчитывается 64 штуки.
В действительности, считывание инструкции по синтезу белка и собственно синтез происходит не непосредственно на ДНК, а на ее “зеркальной” копии – молекуле РНК, которая считывается с региона ДНК, содержащего информацию о том или ином белке.
При этом большинство живых существ используют только 21 аминокислоту, так что почти на каждую элементарную составляющую белка приходится несколько кодонов. Кроме того, три кодона не кодируют аминокислот, а отвечают за "знаки препинания", понятные считывающим генетический код ферментам. Пунктуация генетического кода ограничивается точками - натыкаясь на соответствующие кодоны (их называют стоп-кодонами), ферменты прекращают синтезировать цепь аминокислот, и готовый белок высвобождается. Большинство организмов используют три типа точек - ТАГ, ТАА и ТГА.
Функционально эти стоп-кодоны не отличаются друг от друга, но за их распознавание отвечают различные ферменты. Например, у кишечной палочки Escherichia coli фермент RF1 считывает инструкции прекратить синтез белка, закодированные в кодонах ТАА и ТАГ, а фермент RF2 - инструкции, записанные в кодонах ТАА и ТГА.
Как и в любом другом языке, знаков препинания в генетическом коде меньше, чем собственно букв. Соответственно, изменить значение какого-либо стоп-кодона проще, чем значение любой другой тройки нуклеотидов. Авторы новой работы решили заменить в ДНК E. coli стоп-кодоны ТАГ на стоп-кодоны ТАА - таким образом, все "точки" при считывании белка будут распознаваться одним, ставшим универсальным ферментом - RF2.
ТАГ - самый редкий стоп-кодон в геноме E. coli, и он встречается там 314 раз. Процесс замены "точек", разработанный Фарреном Исааксом (Farren Isaacs) из Гарвардской медицинской школы, Питером Кэрром (Peter Carr) из Массачусетского технологического института и их коллегами, состоял из нескольких этапов. На первой стадии ученые искусственно синтезировали 314 коротких фрагментов ДНК E. coli, в норме содержащие последовательность ТАГ - однако в новосинтезированных фрагментах ТАГ были заменены на ТАА.
На следующем этапе работы специалисты "загоняли" эти кусочки ДНК в геном бактерий. Для этого ученые "пробивали" мембрану бактериальных клеток при помощи разрядов тока (это стандартная молекулярно-биологическая техника), и синтезированные ими фрагменты протискивались в образовавшуюся брешь и встраивались в геном. Технологию синтеза и встройки нужных последовательностей в геном бактерий авторы работы в Science создали ранее и назвали ее MAGE (Multiplex automated genome engineering - автоматизированное повторяющееся изменение генома).
В итоге ученые получили 33 линии E. coli, в каждой из которых 10 каких-либо ТАГ-кодонов были заменены на ТАА. Для того чтобы получить линию бактерий, у которой все стоп-кодоны ТАГ были бы заменены на аналоги, исследователи разработали технику под названием CAGE (conjugative assembly genome engineering - изменение генома путем конъюгативной сборки).
Ключевым словом в непонятном названии техники является слово "конъюгация" - этим термином биологи обозначают процесс обмена генетическим материалом у бактерий. У этих живых существ нет полового процесса, аналогичного половому процессу, например, у животных - бактериальные клетки просто делятся надвое, предварительно создав копию собственной ДНК. Однако иногда бактерии обмениваются друг с другом фрагментами своей ДНК - для этого клетки соединяются вместе, и одна из них передает соседке несколько генов.
Авторы добились того, чтобы бактерии передавали друг другу именно те фрагменты ДНК, в которых ТАГ-кодоны "исправлены" на ТАА. Так как ученые знали, какие именно стоп-кодоны заменены на аналоги в каждой из 32 линий, полученных по итогам MAGE, они смогли организовать обмен между линиями так, чтобы конъюгирующая клетка получала от партнера именно те фрагменты ДНК, которые у нее самой все еще содержат неизмененный кодон ТАГ. В результате каждого цикла CAGE количество замен ТАГ на ТАА в каждой клетке удваивалось. В конце концов ученые получили четыре линии E. coli, в каждой из которых около четверти всех ТАГ-кодонов были заменены на ТАА.
На следующих стадиях "скрещивания" из этих четырех линий можно будет получить одну, в геноме которой не будет ни одного кодона ТАГ (пока ученые этого не сделали). Если удалить из ДНК таких бактерий гены, отвечающие за распознавание стоп-кодона ТАГ, то эту тройку нуклеотидов можно превратить в код для какой-нибудь искусственно созданной аминокислоты. Вставка генов, которые кодируют ферменты, распознающие и синтезирующие эту аминокислоту, является рутинной операцией, тем более, что ранее в других лабораториях уже проводились подобные работы.
Зачем
Создание организмов с измененным генетическим кодом является не только занимательной "загадкой для ума", которую любопытно решить. Бактерии, использующие нестандартные сочетания нуклеотидов для кодирования тех или иных аминокислот (или "точек" при синтезе), будут устойчивы к вирусам, которые используют для размножения генетический аппарат бактерий. Вирус, инфицировавший такую искусственно измененную клетку, не сможет синтезировать новые вирусные частицы, так как белоксинтезирующий аппарат зараженной бактерии будет включать в вирусные белки неправильные аминокислоты.
Кроме того, используя технику CAGE, биологи смогут создавать организмы, синтезирующие аминокислоты, которые не встречаются в природе. Теоретически, это позволит создавать белки с новыми свойствами - хотя до сих пор ученым не удалось превзойти природу по способности конструировать эффективно и точно работающие машины из аминокислот.
Одно из основных преимуществ технологии CAGE - это ее дешевизна. Сами авторы сравнивают созданный ими алгоритм внесения большого количества изменений в геном живых существ с весьма затратной работой одиозного исследователя Крейга Вентера, который в 2010 году представил созданный сотрудниками его института организм с полностью искусственным геномом. Хотя многие специалисты сомневаются в практической ценности изысканий Вентера.
Впрочем, до массового использования технологии CAGE, например, в фармакологии, еще далеко. Заменить стоп-кодоны оказалось сравнительно легко, но удастся ли исследователям так же эффективно менять тройки нуклеотидов, кодирующие собственно аминокислоты - пока неясно. Но в любом случае созданная авторами техника массовой замены генетического материала окажется полезной ученым для проведения самых разнообразных молекулярно-биологических исследований.
Читайте также:


