Кишечная палочка окрашивание по граму
Это универсальный дифференциально-диагностический метод окраски. Все бактерии по своему отношению к окраске этим способом делятся на две группы: грамположительные (грампозитивные) и грамотрицательные (грамнегативные). Техника окрашивания состоит в следующем. На обычно приготовленный и фиксированный мазок накладывают небольшой кусочек фильтровальной бумаги, заранее пропитанный раствором генцианвиолета (модификация А.В. Синева) и смачивают 2-3 каплями воды. Окраска продолжается в течение 2 минут. Фильтровальную бумагу с генцианвиолетом удаляют и на мазок наносят несколько капель раствора Люголя на 2 минуты (мазок чернеет). Сливают люголевский раствор и действуют 96°-ным спиртом 30 секунд. Промывают водой. Дополнительно окрашивают разведенным фуксином. Промывают водой, высушивают между листами фильтровальной бумаги и микроскопируют под иммерсионным объективом.
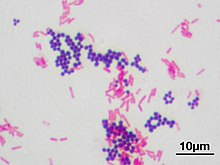
Микрокартина: грамположительные микроорганизмы окрашиваются в темно-фиолетовый цвет, грамотрицательные – в розовый (до красного). Шарообразные формы микроорганизмов в большинстве красятся по Граму положительно, извитые формы – отрицательно, палочковидные формы встречаются как грамположительные, так и грамотрицательные.
Для получения правильных результатов рекомендуется использовать суточные культуры микробов, применять свежеприготовленный раствор разведенного фуксина и проводить окрашивание параллельно с известными культурами микроорганизмов.
Механизм окраски по Граму объясняется физико-химическими особенностями строения цитоплазмы и клеточной стенки грамположительных и грамотрицательных бактерий. У грамположительных содержится значительно больше рибонуклеиновой кислоты и белков в цитоплазме и пептидогликана в клеточной стенке. Поэтому при обработке препарата генцианвиолетом и раствором Люголя у грамположительных бактерий образуется более прочное соединение ионов йода и красителя.
При обработке спиртом грамположительные бактерии удерживают краситель, а грамотрицательные обесцвечиваются и окрашиваются дополнительно разведенным фуксином в розово-красный цвет.
Задания для самостоятельной работы
1. Приготовить препараты из чистых культур кишечной палочки, стафилококка и вакцинного штамма сибирской язвы, окрасить по Граму.
2. Микрокартину зарисовать, результаты работы внести в бланк экспертизы.
Вопросы для самоподготовки и контроля знаний
1. Бактерии по-разному окрашиваются по методу Грама (Грам + и
Грам –), потому что:
А. Имеют капсулу.
Б. Различаются по форме клеток.
В. Различаются по структуре и химическому составу
Г. Имеют различный состав химический цитоплазмы.
2. Какими структурно-химическими особенностями обладает клеточная стенка грамположительных бактерий в отличие от грамотрицательных?
А. Содержит фосфолипиды.
Б. Содержит липопротеины.
В. Имеет пептидогликан до 90% и многочисленные извитые канальца.
3. Выберите правильную последовательность красок и реактивов, необходимых для окраски препарата по Граму:
А. Генцианвиолет, обесцвечивание спиртом, промывание водой, раствор Люголя, разведенный фуксин.
Б. Разведенный фуксин, раствор Люголя, генцианвиолет, обесцвечивание спиртом, промывание водой.
В. Генцианвиолет, раствор Люголя, обесцвечивание спиртом, промывание водой, разведенный фуксин.
Г. Обесцвечивание спиртом, промывание водой, раствор Люголя, генцианвиолет, разведенный фуксин.
4. При окраске препарата по Граму, приготовленного из известной культуры грамположительных бактерий, допущена одна неточность, в результате чего при микроскопии обнаружены бактерии, окрашенные в красный цвет. Найти вероятную причину неправильной окраски бактерий:
А. Длительная окраска генцианвиолетом.
Б. Длительное обесцвечивание спиртом.
В. Кратковременная окраска разведенным фуксином.
Г. Длительная обработка раствором Люголя.
5. При окраске препарата по Граму, приготовленного из известной культуры грамотрицательных бактерий, допущена одна неточность, в результате чего при микроскопии обнаружены бактерии, окрашенные в фиолетовый цвет. Найти вероятную причину неправильной окраски бактерий:
А. Длительная окраска генцианвиолетом.
Б. Кратковременное обесцвечивание спиртом.
В. Длительная окраска разведенным фуксином.
Г. Длительная обработка раствором Люголя.
6. 1. Грамположительные бактерии окрашиваются:
2. Грамотрицательные бактерии окрашиваются:
А. В красный цвет.
Б. В фиолетовый цвет.
7. К грамположительным бактериям относятся возбудители:
8. К грамотрицательным бактериям относятся возбудители:
Окрашивание по Граму или Окрашивание по Граму , также называемый метод Грама , представляет собой способ окрашивания используется для различения и классификации бактериальных видов на две большие группы ( грамположительных и грамотрицательных ). Название происходит от датского бактериолог Hans Christian Gram , который разработал технику.
Окрашивание по Граму различает бактерии от химических и физических свойств их клеточных стенок путем обнаружения пептидогликано , который присутствует в клеточной стенке грамположительных бактерий. Грамотрицательные клетки также содержат пептидогликана, но очень небольшой слой из него , который растворяется при добавлении спирта. Поэтому клетка теряет свой первоначальный цвет от основного пятна. Грамположительные бактерии сохраняют кристалл фиолетового красителя , и , таким образом окрашивается фиолетовые, в то время как грамотрицательные бактерии не делают; после того, как Промывка, контрастирующий добавляются (обычно сафранин или фуксин ) , которые будут окрашивать эти грамотрицательные бактерий розового цвета. Оба грамположительных бактерии и грамотрицательные бактерии подобрать контрастную. Контрастное, однако, является невидимым на грам-положительных бактерий , из - за более темного кристаллического фиолетового пятна.
Грам почти всегда первый шаг в предварительной идентификации бактериального организма. Хотя Грама является ценным диагностическим инструментом в клинических и научных исследованиях, не все бактерии могут быть окончательно классифицированы по этой методике. Это приводит к грам-переменные и грамотрицательных неопределенным групп.
содержание
история
Метод назван в честь его изобретателя, датский ученый Ганс Христиан Грам (1853-1938), который разработал технику, работая с Карлом Фридлендер в морг городской больницы в Берлине в 1884. Gram разработал свою технику не с целью отличить один тип бактерий от другого , но чтобы сделать бактерии более заметными в окрашенных участках легочной ткани. Он опубликовал свой метод в 1884 году, и включил в своем кратком отчете о наблюдении , что тиф бацилла не сохраняет окраску.
Пользы
Окрашивание по Граму является бактериологический лабораторный метод , используемый для дифференциации бактериальных видов на две большие группы ( грамположительных и грамотрицательных ) на основе физических свойств их клеточных стенок . Окрашивание по Граму не используется для классификации археи , ранее archaeabacteria, так как эти микроорганизмы дают весьма различные ответы , которые не следуют их филогенетических групп .
Грам не является непогрешимым инструментом для диагностики, идентификации, или филогенеза, и это крайне ограниченного применение в экологической микробиологии . Он используется в основном для предварительной идентификации морфологической или установить , что существует значительное количество бактерий в клинических образцах. Он не может идентифицировать бактерии на видовом уровне, и для большинства заболеваний, не следует использовать в качестве единственного метода идентификации бактерий. В клинических микробиологических лабораториях, он используется в сочетании с другими традиционными и молекулярными методами для идентификации бактерий. Некоторые организмы являются грам-переменной ( это означает , что они могут испачкать либо отрицательный или положительный); некоторые из них не окрашивали либо красителя в технике Грама и не видели. В современной экологической или молекулярной лаборатории микробиологии, большинство идентификации осуществляются с помощью генетических последовательностей и других молекулярных методов, которые являются более конкретными и информативным , чем дифференциальное окрашивание.
Грам был предложен , чтобы быть столь же эффективным диагностическим инструментом , как ПЦР в одном первичном исследовательском отчете о гонококковом уретрите.
Граму проводят на теле жидкости или биопсии , когда инфекция подозревается. Граму дают результаты гораздо быстрее , чем культивирование , и особенно важно , когда инфекция будет сделать важное различие в лечении пациента и прогнозе; примеры являются спинномозговой жидкостью для менингита и синовиальной жидкости для септического артрита .

Грамположительные бактерии имеют толстую сетчатую клеточную стенку , изготовленную из пептидогликана (50-90% от клеточной оболочки), и в результате окрашивали фиолетовым с кристаллическим фиолетовым, тогда как грамотрицательные бактерии имеют более тонкий слой (10% клеток конверт), так что не сохраняет фиолетовую окраску и противопоказана окрашенный розовые от сафранина. Есть четыре основных шага по Граму:
- Применение первичного пятна ( кристалл фиолетового ) к тепловой фиксированной мазке бактериальной культуры. Термофиксации убивают некоторые бактерии , но в основном используются для прикрепления бактерии к слайду , так что они не прополоскать во время процедуры окрашивания.
- Добавление йодида , который связывается с кристаллическим фиолетовым и улавливает его в клетке
- Быстрое обесцвечивание с этанолом или ацетоном
- Контрастный с сафранином . ФУКОРЦИН иногда заменяет сафранинтак как он более интенсивно пятна анаэробных бактерий, но она меньшеобычно используетсякачестве контрастирующего.
| применение | реактив | сотовый цвет | |||
|---|---|---|---|---|---|
| Грамположительный | Грамотрицательный | ||||
| Первичный краситель | кристаллический фиолетовый | пурпурный | пурпурный | ||
| Ловушки агент | йод | пурпурный | пурпурный | ||
| Decolorizer | спирт / ацетон | пурпурный | бесцветный | ||
| Счетчик пятно | Safranin / ФУКОРЦИН | пурпурный | розовый | ||
Кристалл фиолетовый (CV) диссоциирует в водных растворах в CV +
и хлорид ( Cl -
) Ионы. Эти ионы проникают через клеточную стенку и клеточную мембрану как грамположительных , так и грамотрицательных клеток. CV +
ион взаимодействует с отрицательно заряженными компонентами бактериальных клеток и окрашивает клетки фиолетовыми.
Йодид ( I -
или я -
3 ) взаимодействует с CV +
и образует крупные комплексы кристаллического фиолетового и йода (CV-I) в пределах внутренних и внешних слоев клетки. Йод часто упоминаются как протрава , но является улавливание агента , который предотвращает удаление CV-я сложный и, следовательно, цвет клетки.
При добавлении decolorizer, таких как спирт или ацетон, он взаимодействует с липидами клеточной мембраны. Грамм-негативные клетки теряют свою внешнюю мембрану липополисахарида, а внутренний слой пептидогликан слева подвергаются. В CV-я комплексы отмывают от грамотрицательной клетки вместе с наружной мембраной. В противоположность этому, грамположительные клетка становится обезвоженной от обработки этанолом. Большой CV-I комплексов защемлен в грамположительных клетку из-за многослойный характер его пептидогликан. Шаг обесцвечивания имеет решающее значение и должен быть приурочен правильно; кристалл фиолетовый краситель удаляется из обоих грам-положительных и отрицательных клеток, если агент обесцвечивание остается слишком долго (считанные секунды).
После того, как обесцвечивание, граммы-положительные клетки остаются фиолетовыми и грамотрицательная клетка теряет свою фиолетовую окраску. Контрастное, который, как правило, положительно заряженные Safranin или основной фуксин, применяется последним, чтобы дать обесцвечивают грамотрицательных бактерий розовый или красный цвет.
Примеры
Грамположительные бактерии обычно имеют одну мембрану ( monoderm ) , окруженный густой пептидогликана. Это правило следует два филы: Firmicutes (для классов , кроме молликут и Negativicutes и) Actinobacteria . В противоположность этому , члены Chloroflexi (зеленые без серы бактерии) являются monoderms , но обладают тонким или отсутствует (класс Dehalococcoidetes ) пептидогликана и может окрашивать отрицательным, положительным или неопределенными; Члены Deinococcus-Thermus группы пятна положительного , но являются diderms с толстым пептидогликаны.
Исторически сложилось так , что грамположительные формы составляли фила Firmicutes , имя в настоящее время используется для самой большой группы. Она включает в себя многие известные роды , такие как Bacillus , Listeria , Staphylococcus , Streptococcus , Enterococcus и Clostridium . Он также был расширен , чтобы включить молликуты , бактерии , такие как Mycoplasma , которые не имеют клеточных стенок и поэтому не может быть окрашивали по Граму, но полученные из таких форм.
Некоторые бактерии имеют клеточные стенки , которые особенно искусны в сохранении пятна. Они будут появляться положительное окрашивание по Граму , даже если они не являются тесно связаны с другими грам-положительных бактерий. Это так называемые кислотостойкими бактерии , и может быть дифференцировано только от других грамположительных бактерий с помощью специальных процедур окрашивания .
Грамотрицательные бактерии , как правило , обладают тонким слоем пептидогликана между двумя мембранами ( diderms ). Большинство бактериальных фил являются грамотрицательные, в том числе цианобактерий , зеленых серных бактерий , и большинство протеобактерий (исключение составляют некоторые члены Rickettsiales и насекомых-эндосимбионтов в Enterobacteriales ).
Некоторые бактерии, после окрашивания Грама, выход гр-переменной шаблон: сочетание розовых и пурпурных клеток видны. В культурах Bacillus, Butyrivibrio и Clostridium, уменьшение толщины пептидогликана в процессе роста совпадает с увеличением числа клеток, которые Грам-отрицательным. Кроме того, во всех бактерий, окрашенных с помощью Грама, возраст культуры может повлиять на результатах окраски.
Грамотрицательные бактерии неопределенными действительно предсказуемо не реагируют на Граму и, следовательно, не может быть определена либо как грамположительные или грамотрицательные. Примеры включают в себя множество видов Mycobacterium , в том числе микобактерий туберкулеза и М. лепры .
Орфографический примечание
6.4. Сложные дифференциальные методы окраски
Многие сложные дифференциально-диагностические методы окраски, например окраску по Граму, определение кислотоустойчивости, специфический метод окраски Леффлера и некоторые другие, можно рассматривать как один из первых этапов идентификации микроорганизма.
Дифференциальные методы окраски предусматривают следующие процедуры:
- подготовленный к окраске фиксированный мазок окрашивается первично тем красителем, которым надеются выявить предполагаемый возбудитель болезни;
- первичное окрашивание распространяется на все микроорганизмы, находящиеся в мазке. Поэтому вслед за ним следует протрава мазка химическим соединением, конкретным в каждом отдельном случае – кислотами, спиртом, щелочами, фенолом и пр., целью которой является обесцвечивание всех находящихся в мазке микроорганизмов, кроме искомых потенциальных возбудителей предполагаемого заболевания;
- после протравы следует вторичное дополнительное окрашивание краской контрастного цвета. Предыдущая протрава способствует прикреплению краски к обесцвеченным клеточным компонентам, и в дополнительный цвет окрашиваются практически все находящиеся в мазке микроорганизмы, кроме возбудителя болезни, для обнаружения которого применяется конкретный метод обесцвечивания, не влияющий на искомого возбудителя.
6.4.1. Дифференциальная окраска по методу Грама
В конце XIX столетия датский бактериолог Ханс Христиан Грам предложил метод дифференциальной окраски, разделивший большую часть известных патогенных бактерий на две группы: грамположительные и грамотрицательные.
Грамположительные микроорганизмы содержат в клеточной стенке большое количество тейхоевых и липотейхоевых кислот, связанных с пептидогликанами и образующих многослойную волокнистую структуру.
Поэтому при окраске по Граму эти микроорганизмы удерживают комплекс первичного красителя трифенилметиловой группы (генциан-, метил-, кристаллвиолет).
Грамотрицательные бактерии снаружи покрыты одним слоем пептидогликана, связанного с цитоплазматической мембраной посредством липопротеина, наружная мембрана состоит из липополисахаридов, фосфолипидов и белков. Из-за более Высокого содержания липидов клеточные стенки грамотрицательных бактерий имеют повышенную проницаемость и при Обесцвечивании спиртом первичный фиолетовый комплекс красителя легко удаляется через поры клеточной стенки, после чего бактерии приобретают цвет дополнительной окраски: ярко-малиновый при применении фуксина или желто-розовый – сафранина.
Таким образом, отношение к окраске по Граму определяется структурой клеточной стенки микроба.
Спектр окрашивания по Граму включает подавляющее большинство видов бактерий, имеющих то или иное значение в патологии человека. Исключение составляют плохо окрашивающиеся Leptospira, не окрашивающиеся Treponema, Mycoplasma, L-формы бактерий, у которых отсутствует клеточная стенка, а также очень мелкие внутриклеточные паразиты Chlamidia и Rickettsia.
6.4.1.1. Методика окраски бактерий по Граму
- • На мазок, фиксированный над пламенем горелки, кладут фильтровальную бумагу и наливают избыток основного красителя – карболового кристаллвиолета (рецепт 14). Прокрашивание продолжается 1–2 мин;
- снимают бумагу, сливают остаток красителя и, не промывая препарат водой, наливают раствор Люголя (рецепт 34) на 1–2 мин до почернения препарата;
- раствор Люголя сливают. Предметное стекло для обесцвечивания мазка погружают несколько раз в стаканчик со спиртом. Процесс обесцвечивания считается завершенным, когда от мазка перестают отделяться окрашенные в фиолетовый цвет струйки жидкости;
- препарат тщательно промывают водопроводной водой;
- докрашивают водно-спиртовым раствором фуксина (рецепт 16) в течение 2 мин.
Результаты окраски. Грамположительные бактерии окрашиваются основным красителем в темно-фиолетовый цвет, грамотрицательные бактерии, воспринимая дополнительную окраску, приобретают ярко-малиновый цвет.
В настоящее время более широкое применение в практике бактериологических исследований находит видоизмененный способ окраски Грама по Синеву.
Основной краситель в виде раствора заменяют фильтровальной бумагой, пропитанной 1 % спиртовым раствором кристаллического фиолетового (см. технику приготовления красящей бумаги по Синеву, рецепт 26). На препарат помещают красящую бумажку и наносят на нее 2–3 капли воды. Окрашивание идет в течение 1–2 мин. Затем бумажку снимают и дальнейшую окраску препарата ведут общепринятым способом.
6.4.1.2. Окраска нейссерий по Граму в модификации Г. П. Калины
- На предметное обезжиренное стекло наносят каплю воды, в ней суспендируют культуру. Добавляют каплю спиртового раствора бриллиантовой зелени (рецепт 19) и размазывают тонким слоем. Диаметр мазка примерно 1,0 см;
- после подсыхания препарат фиксируют над пламенем;
- на фиксированный мазок наливают основной реактив (рецепт 20) на 1,5–2,0 мин;
- по истечении указанного времени краску сливают и стекло в наклонном положении промывают вначале водой, затем спиртом (до отхождения облачков краски) и снова водой;
- промытый препарат докрашивают водным раствором фуксина в течение 2 мин, окончательно промывают водой, подсушивают фильтровальной бумагой и микроскопируют.
Результаты микроскопии. При микроскопии грамотрицательные бактерии выглядят ярко-розовыми, грамположительные – зеленовато-черными или темно-фиолетовыми. Желательно для контроля на отдельном стекле делать мазок культуры стафилококка и кишечной палочки.
6.4.1.3. КОН-тест для уточнения сомнительных результатов окраски по Граму
Обычно оценка результатов окраски по Граму не представляет ценностей. Однако в отдельных случаях грамположительные микроорганизмы, например спороносные палочки, приобретают грамотрицательную окраску, тогда как некоторые штаммы грамотрицательных бактерий родов Acinetobacter и Moraxella имеют тенденцию не обесцвечиваться спиртом, вследствие чего выглядят как грамположительные.
Для уточнения таких сомнительных результатов японский ученый Е. Куи в 1938 г. предложил КОН-тест (тест Грегерсена).
В основе этого теста лежит способность клеточных стенок Грамположительных бактерий, в отличие от грамотрицательных, сохранять целостность при воздействии на них гидроксида калия (КОН).
Для постановки этого теста петлю суточной агаровой культуры испытуемого штамма суспендируют на предметном стекле в капле 3 % раствора КОН.
При положительной реакции, свойственной грамотрицательным микроорганизмам, через несколько секунд жидкость а капле приобретает слизистую консистенцию, и при отрыве петли предметного стекла слизистые нити тянутся на 0,5– 2,0 см. Учет результатов пробы рекомендуется проводить на темном фоне.
Приобретение грамотрицательными бактериями слизистой Консистенции при обработке их гидроксидом калия связывают с выходом из клеток ДНК, представляющей собой вязкий Компонент.
6.4.2. Окраска по Романовскому-Гимзе
Рассматриваемый способ относится к сложным методам окраски. Применяют его главным образом при окраске мазков-отпечатков из органов, мазков крови, после фиксации в жидком фиксаторе Корнуа или Никифорова. Краситель Романовского–Гимзы состоит из смеси азура, эозина и метиленового синего. Непосредственно перед употреблением к 10 мл дистиллированной воды (pH 7,0–7,2) прибавляют 10 капель коммерческого красителя Романовского–Гимзы (рецепт 28).
Приготовленный раствор тотчас наливают на предметное стекло с окрашиваемым препаратом, или стекло погружают в стаканчик с красителем. Через 1 ч краситель сливают, препарат промывают водой и высушивают на воздухе. Краситель Романовского–Гимзы, имеющий в растворе сине-фиолетовый цвет, окрашивает протоплазму форменных элементов ткани в голубовато-синий цвет, а ядра клеток, так же, как и микробные тела, – в фиолетово-красный цвет (рис. 6.4 – см. вклейку).
6.4.3. Обнаружение менингококка в "толстой капле" крови при подозрении на менингококкемию
На середину предметного обезжиренного стекла наносят толстую каплю крови диаметром 1,0 см. Стекло оставляют в горизонтальном положении до полного подсыхания крови. Препарат окрашивают водным раствором метиленового синего в течение 2–3 мин (без предварительной фиксации!). После этого осторожно смывают краску водой. Мазок подсушивают на воздухе.
При микроскопии на голубом фоне видны темно-синие ядра лейкоцитов, а между ними – единичные и парные клетки кокков темно-синего цвета.
6.4.4. Окраска кислотоустойчивых микобактерий
Кислотоустойчивыми называют микробы, которые, будучи окрашенными карболовым фуксином, не обесцвечиваются под действием концентрированных минеральных кислот.
Особенностью микробов этой группы является то, что они плохо воспринимают окраску. Это свойство обусловлено наличием в клеточной стенке и цитоплазме кислотоустойчивых бактерий длинных цепочек жирных миколовой, туберкулостеариновой и других кислот с 50–100 атомами, которые делают клеточную стенку микроорганизма непроницаемой для кристаллвиолета и других красителей. Поэтому, чтобы обеспечить проникновение краски в клеточную стенку этих бактерий, приходится применять более концентрированные растворы красок в подогретом состоянии с добавлением детергентов и удлинением сроков окраски. После того как краска введена в клетку, ее нельзя обесцветить обычными кислотными и спиртовыми растворителями.
Для окрашивания кислотоустойчивых бактерий применяют обычно метод Циля–Нильсена или некоторые его модификации.
6.4.4.1. Окраска по методу Циля–Нильсена
- Фиксированный на пламени горелки мазок окрашивают в течение 3–5 мин раствором карболового фуксина Циля (рецепт 17) или окрашенной фуксином бумажкой с подогреванием до появления паров, но не доводя краситель до кипения;
- дают препарату остыть, бумажку снимают, сливают избыток красителя, препарат промывают водой;
- окрашенный препарат обесцвечивают 5 % раствором серной кислоты в течение 3–5 с или 95 % этиловым спиртом, содержащим 3 % по объему хлористоводородной кислоты (НСl), несколько раз погружая стекло с мазком в стаканчик с солянокислым спиртом;
- после обесцвечивания остаток кислоты сливают и тщательно промывают препарат водой;
- докрашивают дополнительно метиленовым синим Леффлера 3–5 мин (рецепт 9);
- окрашенный препарат промывают водой, подсушивают и микроскопируют.
При окраске препаратов по методу Циля–Нильсена кислотоустойчивые бактерии окрашиваются фуксином в рубиново-красный цвет и не обесцвечиваются кислотой.
Некислотоустойчивые бактерии, а также элементы ткани и лейкоциты под действием кислоты обесцвечиваются и приобретают цвет дополнительного красителя.
6.4.4.2. Окраска по Бунге–Траутенроту
- Стекло с нанесенным на него мазком для извлечения жирных кислот опускают на 3 ч в абсолютный спирт;
- по истечении указанного срока стекло вынимают из спирта и погружают на 15 мин в 1N хромовую кислоту;
- промывают водой;
- окрашивают при подогревании карболовым фуксином (рецепт 17);
- в течение 3 мин обесцвечивают 10 % серной кислотой;
- докрашивают в течение 5 мин насыщенным спиртовым раствором метиленового синего (рецепт 7).
Метод Бунге–Траутенрота применяется для окрашивания осадка мочи при дифференциации М.tuberculosis, окрашенных в малиновый цвет, от менее кислотоустойчивых М.smagmatis, приобретающих синий цвет дополнительной краски.
Посоветуйте книгу друзьям! Друзьям – скидка 10%, вам – рубли
Вопрос 1. Основы микробиологии. Классификация микроорганизмов
Микробиология как самостоятельная наука, имеющая свои объекты и методы исследования, сформировалась во второй половине 19 века благодаря работам Пастера, Коха, Эрлиха, Мечникова, Ру и др., но и в настоящее время, также как и тесно связанные с ней, биотехнология и генная инженерия, постоянно и интенсивно развивается.
Зародившись, как наука о возбудителях болезней, т. е. как отрасль медицины, к настоящему времени в зависимости от решаемых задач делится на:
Предметом изучения медицинской микробиологии являются микроорганизмы – представители нормальной микрофлоры тела человека и возбудители различных заболеваний человека, а также методы лабораторной диагностики, специфической профилактики и этиотропной терапии вызываемых ими заболеваний.
Микроорганизмы – это организмы, невидимые невооруженным глазом из-за их незначительных размеров. Этот критерий – единственный, который их объединяет. В остальном мир микроорганизмов еще более разнообразен, чем мир макроорганизмов. Согласно современной систематике, микроорганизмы относятся к трем царствам:
• Vira– к ним относятся вирусы;
• Eucariotae – к ним относятся простейшие и грибы;
• Procariotae – к ним относятся истинные бактерии, риккетсии, хламидии, микоплазмы, спирохеты, актиномицеты.
Основные отличия прокариот от эукариот состоят в том, что прокариоты не имеют:
• морфологически оформленного ядра (нет ядерной мембраны и отсутствует ядрышко), его эквивалентом является нуклеоид, или генофор, представляющий собой замкнутую кольцевую двунитевую молекулу ДНК, прикрепленную в одной точке к цитоплазматической мембране; по аналогии с эукариотами эту молекулу называют хромосомной бактерией;
• сетчатого аппарата Гольджи;
Имеется также ряд признаков или органелл, характерных для многих, но не для всех прокариот, которые позволяют отличать их от эукариотов:
• многочисленные инвагинации цитоплазматической мембраны, которые называются мезосомы, они связаны с нуклеоидом и участвуют в делении клетки, спорообразовании, и дыхании бактериальной клетки;
• специфический компонент клеточной стенки – муреин, по химической структуре – это пептидогликан (диаминопиеминовая кислота);
• плазмиды – автономно реплицирующиеся кольцевидные молекулы двунитевой ДНК с меньшей, чем хромосома бактерий молекулярной массой. Они находятся наряду с нуклеоидом в цитоплазме, хотя могут быть и интегрированы в него, и несут наследственную информацию, не являющуюся жизненно необходимой для микробной клетки, но обеспечивающую ей те или иные селективные преимущества в окружающей среде. Наиболее известны плазмиды:
– (F-плазмиды), обеспечивающие конъюгационный перенос между бактериями;
– (R-плазмиды) – плазмиды лекарственной устойчивости, обеспечивающие циркуляцию среди бактерий генов, детерминирующих устойчивость к используемым для лечения различных заболеваний химиотерапевтическим средствам.
Название рода обычно или основано на морфологическом признаке соответствующего микроорганизма (например, Staphylococcus, Vibrio, Mycobacterium) либо являются производными от фамилии автора, который открыл или изучил данный возбудитель (например, Neisseria, Shigella, Escherichia, Rickettsia, Gardnerella).
Видовое название часто связано с наименованием основного вызываемого этим микроорганизмом заболевания (например, Vibrio cholerae – холеры, Shigella dysenteriae – дизентерии, Mycobacterium tuberculosis – туберкулеза) или с основным местом обитания (например, Escherihia coli – кишечная палочка).
Кроме того, в русскоязычной медицинской литературе возможно использование соответствующего русифицированного названия бактерий (например, вместо Staphylococcus epidermidis – эпидермальный стафилококк; Staphylococcus aureus – золотистый стафилококк и т. д.).
Царство прокариот включает в себя отдел цианобактерий и отдел эубактерий, который, в свою очередь, подразделяется на порядки:
• собственно бактерии (отделы Gracilicutes, Firmicutes, Tenericutes, Mendosicutes);
Бактерии – это прокариотические, преимущественно одноклеточные микроорганизмы, которые могут также образовывать ассоциации (группы) сходных клеток, характеризующиеся клеточными, но не организменными сходствами.
Порядки подразделяются на группы. Основными таксономическими критериями, позволяющими отнести штаммы бактерий к той или иной группе, являются:
• морфология микробных клеток (кокки, палочки, извитые);
• отношение к окраске по Граму – тинкториальные свойства (грамположительные и грамотрицательные);
• тип биологического окисления – аэробы, факультативные анаэробы, облигатные анаэробы;
• способность к спорообразованию.
Дальнейшая дифференциация групп на семейства, рода и виды, которые являются основной таксономической категорией, проводится на основании изучения биохимических свойств. Этот принцип положен в основу классификации бактерий, приведенной в специальных руководствах – определителях бактерий.
• по биологическим свойствам (биовары или биотипы);
• по биохимической активности (ферментовары);
• по антигенному строению (серовары или серотипы);
• по чувствительности к бактериофагам (фаговары или фаготипы);
• по устойчивости к антибиотикам (резистентовары).
В микробиологии широко применяют специальные термины – культура, штамм, клон.
Культура – это видимая глазом совокупность бактерий на питательных средах. Культуры могут быть чистыми (совокупность бактерий одного вида) и смешанными (совокупность бактерий двух или более видов).
Штамм – это совокупность бактерий одного вида, выделенных из разных источников или из одного источника в разное время. Штаммы могут различаться по некоторым признакам, не выходящим за пределы характеристики вида.
Клон – это совокупность бактерий, являющихся потомством одной клетки.
Вопрос 2. Особенности морфологии микроорганизмов
Среди основных морфологических форм бактерий различают:
• шаровидные (кокковые), которые по характеру взаиморасположения делятся на:
– микрококки (отдельное изолированное расположение);
– диплококки (сцепленные попарно);
– тетракокки (сцепленные по четыре);
– стрептококки (сцепленные в цепочку);
– сарцины (сцепленные в пакеты по 8, 12, 16 и т. д.);
– стафилококки (сцепленные беспорядочно в виде виноградной грозди);
• палочковидные, которые различаются:
– правильная (энтеробактерии, псевдомонады);
– мелкие (бруцеллы, бордетеллы);
– средние (бактероиды, кишечная палочка);
– крупные (бациллы, клостридии);
по форме концов
– закругленные (сальмонеллы, псевдомонады);
по характеру взаиморасположения все палочки делятся на:
– диплобактерии и диплобациллы (сцепленные попарно);
– стрептобактерии и стрептобациллы (сцепленные в цепочку);
– извитые формы (по характеру и количеству завитков они делятся на:
вибрионы (слегка изогнутые палочки или неполные завитки);
спириллы (один или несколько завитков);
спирохеты, которые в свою очередь, делятся на:
лептоспиры (завитки с загнутыми крючкообразными концами – S-образная форма);
боррелии (4—12 неправильных завитков);
трепонемы (14–17 равномерных мелких завитков).
Структуру бактерий изучают в основном с помощью электронной микроскопии (техника ультратонких срезов), дифференциального ультрацентрифугирования, цитохимических методов.
Структурные компоненты бактериальной клетки делятся на обязательные и необязательные.
Обязательными структурными компонентами являются:
• цитоплазма с локализованными в ней рибосомами и ядерным аппаратом.
Необязательные структурные компоненты – капсула, микрокапсула, внеклеточная слизь, включения, жгутики, пили, споры.
Функции клеточной стенки состоят в том, что она:
• является осмотическим барьером,
• определяет форму бактериальной клетки,
• защищает клетку от воздействий окружающей среды,
• несет разнообразные рецепторы, способствующие прикреплению фагов, колицинов, а также различных химических соединений,
• через клеточную стенку в клетку поступают питательные вещества и выделяются продукты обмена,
• в клеточной стенке локализован О-антиген и с ней связан эндотоксин (липид А) бактерий.
Имеется 2 типа строения клеточной стенки у бактерий. В обоих случаях ее основу составляет пептидогликан муреин. У одних бактерий (1-й тип) он составляет до 90 % массы клеточной стенки и образует многослойный (до 10 слоев) каркас, при этом муреин ковалентно связан с тейхоевыми кислотами. Такие бактерии при окраске по методу Грама прочно удерживают комплекс генцианового фиолетового и йода; они окрашиваются в сине-фиолетовый цвет и называются грамположительными.
У бактерий со 2-м типом строения клеточной стенки поверх 2–3 слоев пептидогликана муреина располагается слой липополисахаридов. Эти бактерии при окраске по методу Грама не способны прочно удерживать комплекс генцианового фиолетового и йода и, соответственно, обесцвечиваются спиртом, прокрашиваясь дополнительным красителем – фуксином в розово-красный цвет. Они называются грамотрицательными.
В связи с различиями в строении клеточной стенки все бактерии делятся на 4 отдела:
• грациликуты – бактерии с тонкой клеточной стенкой, грамотрицательные, к ним относятся различные извитые, палочковидные, кокковые формы бактерий, а также риккетсии и хламидии;
• фирмикуты – бактерии с толстой клеточной стенкой, грамположительные, к ним относятся палочковидные, кокковые формы бактерий, а также актиномицеты, коринебактерии и микобактерии;
• тенерикуты – бактерии без ригидной клеточной стенки (микоплазмы);
• мендозикуты – архебактерии, отличающиеся дефектной клеточной стенкой, особенностями строения рибосом, мембран и рибосомальных РНК. Эта группа бактерий медицинского значения не имеет.
Из любой бактериальной клетки можно получить формы, полностью или частично лишенные клеточной стенки. Они называются, соответственно, протопласты и сферопласты, и, независимо от исходного морфологического типа бактерии, из-за отсутствия клеточной стенки принимают шарообразную или грушевидную форму. Кроме того, существуют L-формы бактерий, которые, в отличие от протопластов и сферопластов, способны к размножению, являясь вполне полноценными микробными клетками данного вида бактерий. L-формы разных видов бактерий морфологически неразличимы. Независимо от формы исходной клетки (кокки, палочки, вибрионы) они представляют собой сферические образования разных размеров. Различают стабильные L-формы, нереверсирующие в исходный морфотип, и нестабильные L-формы, реверсирующие в исходный при устранении причины, вызвавшей их образование. В процессе реверсии восстанавливается способность бактерий синтезировать пептидогликан (муреин) клеточной стенки. L-формы различных бактерий играют существенную роль в патогенезе многих хронических, рецидивирующих инфекционных заболеваний (бруцеллез, туберкулез, сифилис, хроническая гонорея и т. д.).
К клеточной стенке бактерий примыкает цитоплазматическая мембрана, строение которой аналогично мембранам эукариотов (состоит из двойного слоя липидов, главным образом фосфолипидов со встроенными поверхностными и интегральными белками). Она обеспечивает:
• селективную проницаемость и транспорт растворимых веществ в клетку,
• транспорт электронов и окислительное фосфорилирование,
• выделение гидролитических экзоферментов, биосинтез различных полимеров.
Цитоплазматическая мембрана ограничивает цитоплазму бактерий, которая представляет собой гранулярную структуру. В цитоплазме локализованы рибосомы и бактериальный нуклеоид, в ней также могут находиться включения и плазмиды (внехромосомная ДНК). Кроме обязательных структур бактериальные клетки могут иметь споры.
Вопрос 3. Необязательные структурные компоненты бактериальной клетки
Спорообразующие палочки называются бациллами.
Споры бактерий представляют собой бактериальные клетки в состоянии анабиоза и образуются при неблагоприятных условиях внешней среды (располагаются внутри клетки терминально, субтерминально или центрально).
В процессе спорообразования клетка почти полностью теряет воду, сморщивается, клеточная стенка уплотняется. Появляется новое вещество – дипиколинат кальция, которое образует комплексы с биополимерами клетки, устойчивые к действию температуры и ультрафиолетовых лучей. В окружающей среде споры бактерий могут сохраняться годами, но при попадании в благоприятные условия спора впитывает влагу, комплексы распадаются, дипиколинат разрушается, и спора превращается в вегетативную клетку.
Таким образом, спору следует рассматривать не как способ размножения, а только как форму существования бактериальной клетки в неблагоприятных условиях. При этом преобразования идут по следующей схеме: 1 клетка – 1 спора – 1 клетка, и увеличения количества бактериальных клеток не происходит.
Спорообразование характерно в основном для грамположительных бактерий. У грамотрицательных бактерий эквивалентом спорообразования является переход в так называемое некультивируемое состояние. В такой форме они также длительно сохраняются в окружающей среде.
При использовании окраски по Граму споры красители не воспринимают, поэтому на окрашенном фоне они бесцветны. Окрашиваются споры с помощью специальных методов окраски, например, по Ожешко или Клейну.
Многие бактерии имеют жгутики. Их количество и расположение у разных бактерий неодинаково. Монотрихии имеют только один жгутик (род Vibrio), лофотрихии – пучок жгутиков на одном полюсе клетки (род Pseudomonas), а у амфитрихов жгутики (один или пучок) расположены на обоих полюсах клетки (род Spirillum), а у перитрихов – по всей поверхности (род Escherichia, Salmonella).
По своему строению жгутики представляют собой спирально закрученные нити, состоящие из специфического белка флагеллина, который по своей структуре относится к сократительным белкам типа миозина.
На поверхности ряда бактерий обнаружены белковые образования – ворсинки (фимбрии, пили). Фимбрии отходят от поверхности клетки и состоят из белка, называемого пилином. Различают более 60 видов ворсинок, из которых наиболее изучены F-pili (половые пили) и common pili (пили, ответственные за адгезию).
Основное предназначение капсул – защита бактерий от фагоцитоза. При окраске мазков по Граму истинно капсульные бактерии имеют характерное взаиморасположение (на расстоянии друг от друга). При световой микроскопии капсулы четко не видны, в связи с чем наличие капсул у бактерий выявляется с помощью специальных методов окраски, например, по методу Гимзе. Для выявления капсул и бактерий, образующих их в организме, используют либо микроскопию мазков, приготовленных из патологического материала или мазков – отпечатков из органов погибших животных.
Вопрос 4. Питание и особенности метаболизма бактерий
По химическому составу и характеру биополимеров (белки, полисахариды, нуклеиновые кислоты, липиды) прокариотические клетки не отличаются от эукариотических. Основными химическими компонентами бактериальной клетки являются органогены (кислород, водород, углерод, азот, фосфор).
Процесс, в ходе которого бактериальная клетка получает из окружающей среды компоненты, необходимые для построения ее биополимеров (органоидов), называется питанием.
Бактериальные клетки не имеют специальных органов питания, т. е. являются голофитными. Поступление питательных веществ в микробную клетку может происходить:
• за счет осмоса и диффузии по градиенту концентрации без затрат энергии;
• за счет пассивного транспорта, который также осуществляется по градиенту концентрации с помощью белков-переносчиков, но без затрат клеткой энергии, и отличается от диффузии большей скоростью;
• за счет активного транспорта, который идет против градиента концентрации с затратой энергии и возможным частичным расщеплением субстрата, осуществляется белками-переносчиками или ферментами – пермеазами.
По источникам углерода, необходимого для построения биополимеров, бактерии делятся на следующие группы:
• автотрофы – микроорганизмы, которые используют как единственный источник углерода углекислый газ, и не нуждаются в сложных органических соединениях.
• гетеротрофы – микроорганизмы, которые используют в качестве источника углерода разнообразные органические углеродосодержащие соединения (углеводы, углеводороды, аминокислоты, органические кислоты) как биологического, так и не биологического происхождения.
В зависимости от источника получения энергии микроорганизмы делятся на:
• фототрофные, способные использовать солнечную энергию,
• хемотрофные, получающие энергию за счет окислительно-восстановительных реакций.
В дополнение к этой классификации в зависимости от природы доноров электронов микроорганизмы подразделяются на фототрофные литотрофы и, соответственно, хемотрофные литотрофы, т. е. использующие в качестве доноров электронов неорганические соединения, а также, соответственно фото– и хемоорганотрофы, использующие только органические соединения. К последним принадлежит значительное большинство бактерий, в том числе и патогенные для человека виды.
По источникам азота выделяют:
• азотфиксирующие микроорганизмы (способны усваивать молекулярный азот атмосферы),
• микроорганизмы, ассимилирующие неорганический азот солей аммония, нитратов или нитритов и, соответственно, называющиеся аммонифицирующими, нитратредуцирующими и нитритредуцирующими.
Однако большинство патогенных для человека микроорганизмов способны ассимилировать только азот органических соединений.
Микроорганизмы, способные синтезировать все необходимые им органические соединения (углеводы, аминокислоты и др.) из указанных компонентов, называются прототрофами.
Микроорганизмы, не способные синтезировать какое-либо из необходимых соединений, и ассимилирующие их в готовом виде из окружающей среды или организма хозяина (человека, животного), называются ауксотрофами по этому соединению. Чаще всего ими являются патогенные или условно-патогенные для человека микроорганизмы.
Читайте также:


