Как брать смывы на яйца глист
Санитарно -бактериологический контроль смывов с одежды, рук, инвентаря, оборудования
В целях осуществления постоянного санитарно- бактериологического контроля на предприятиях общественного питания, пищевых отраслей различного профиля за поверхностью объектов, контактирующих с продукцией, применяются различные показатели. Например, определяют общую бактериальную обсемененность объекта (руки работников, спецодежда, оборудование и т.п.), наличие санитарно-показательной микрофлоры (БГКП, энтерококков), а также в отдельных случаях наличие на поверхности исследуемого объекта условно-патогенной и патогенной микрофлоры, характерной для данного производства (при использовании мясного сырья — микроорганизмов рода Salmonella , в кондитерском производстве — Staphylococcus ). Общую бактериальную обсемененность объекта определяют количественно (обычно в перерасчете на 1см 2 поверхности- микробное число), а также, в отдельных случаях- качественно.
Данные показатели определяются как в плановом порядке в лабораториях производства и работниками СЭС, так и внепланово по эпидемическим показаниям.
Отбор проб для санитарно-микробиологического исследования предметов обихода и оборудования проводится с помощью следующих методов:
• смывов (тампонами или салфетками );
• отпечатков (контактный метод );
Метод смывов. Этот метод является основным при отборе проб для исследования твердых поверхностей. Смывы с крупных плоских поверхностей (столы, подоконники, полы, стулья, оборудование, инвентарь и т.д.) производят перед началом рабочего дня, либо после санитарной обработки в санитарные дни. Общая площадь поверхности крупных объектов, с которой берется смыв — 100 см 2 . Для ограничения поверхности используют шаблон (трафарет) площадью 25 см 2 , изготовленный из металла, накладывая его последовательно на 4 разных участка. Трафареты перед отбором смывов должны быть простерилизован ы. Смывы с рук работников следует производить перед началом работы. При взятии смывов с рук протирают тампоном обе ладони рук, проводя не менее 5 раз по одной ладони и пальцам, затем протирают участки между пальцами, ногти и под ногтями. При взятии смывов с санитарной одежды протирают 4 площадки по 25 см 2 : нижнюю часть каждого рукава и две площадки с верхней и передней части спецовки. Смывы с посуды на предприятиях общественного питания производят, протирая тампоном всю поверхность исследуемых объектов — для тарелок, рабочую поверхность — для ложек, вилок и т.д. (в количестве 2-3 штуки для мелких объектов). Смывы с мелких предметов можно получить, погрузив их непосредственно в колбу со стерильной жидкостью. В течение 10 мин их встряхивают, затем полученную смывную среду используют для посевов. В каждом случае используют стерильные ватные или марлевые тампоны,
которые перед употреблением смачивают стерильным изотоническим раствором хлорида натрия, водой или питательной средой (чаще мясопептонным бульоном или средой Кесслера). При контроле жирных поверхностей пользуются сухими тампонами или салфетками.
Метод агаровой заливки применяется для определения микрофлоры различных горизонтальных поверхностей, а также тканей. Для отбора пробы используется специальная металлическая пластинка высотой 2 см в виде кольца усеченной формы с диаметром верхней поверхности круга 5 см и нижней меньшей — 4см. (рис. 9 ,а). Перед исследованием кольцо фламбируют обжиганием, охлаждают, помещают на поверхность исследуемого объекта нижним краем и заливают расплавленным и остуженным до 45 °С мясопептонным агаром или средой Эндо. Спустя 5 -10 мин после застывания среды кольцо осторожно снимают и вытряхивают в стерильную чашку Петри застывшую агаровую пластинку вверх нижней поверхностью, соприкасавшейся с исследуемым объектом. Метод удобен тем, что на поверхность среды захватываются все микроорганизмы, находящиеся на исследуемом участке объекта, но он не дает представления об общей обсемененности предметов из-за ограниченности исследуемой площади. Его рекомендуют применять при небольшой бактериальной загрязненности.
При оценке санитарного состояния предметов обихода, изготовленных из тканей (постельное белье, одеяла, одежда и т. д.) можно применять метод, заключающийся во встряхивании участка загрязненных тканей над чашкой Петри с питательной средой. Обследуемую ткань зажимают в специальной металлической обойме, состоящей из двух колец, вкладываемых друг в друга (рис.9, б), и помещают над чашкой Петри со средой. Встряхивание ткани можно производить просто поколачиванием по ее наружной поверхности стерильным пинцетом или, закрепив в центре ткани стерильную булавку, несколько раз ее оттягивают и отпускают. Вместе с пылью из ткани на питательную среду попадают и находящиеся в ней микроорганизм ы. Чашку закрывают и помещают в термостат для инкубаци и.
Определение общей микробной обсемененности объекта
Этот показатель определяют из смачивающей жидкости, применяемой при взятии смыво в. Посев производят по обычной методике определения общего микробного числа. В пробирках с тампонами или в колбах, содержащих салфетки (после проведения смывов), общий объем жидкости доводят до 10 мл, добавляя стерильный изотонический раствор хлорида натрия и получая исходное разведение 1:10. После интенсивного 2- 3- минутного встряхивания готовят десятикратные разведения. В зависимости от предполагаемой степени загрязненности посевы производят из нескольких разведений.
Определение титра БГКП в смывах Определение титра БГКП проводят бродильным методом. При предполагаемой малой степени фекального загрязнения предварительно производят посев смыва на среду обогащения (среда Кесслера). Подсчет титра проводят на 1см 2 поверхности. При обнаружении БГКП контактным методом или методом агаровой заливки используют среду Энд о. В этом случае можно провести расчет числа БГКП на 1 см 2 поверхности исследуемого предмета (индекс БГКП). Идентификация выделенных культур БГКП (если это необходимо) ведется как при исследовании питьевой воды. Однако чаще всего на производстве пользуются более строгим показателем- по первой бродильной проб е. В этом случае последовательно отбирают несколько десятков смывов с разных объектов (с оборудования крупных размеров- 2-4 смыва из разных мест) на среду Кесслер или Кода. После инкубации пробирок со смывами в термостате при 37°С 18-24ч считают процент смывов с наличием в них БГКП от общего числа взятых смывов.
Определение энтерококков в смывах Проводится титрационным методом или методом мембранных фильтров. Обильный рост колоний энтерококков свидетельствует о свежем фекальном загрязнении исследуемого предмета обихода. За титр энтерококка принимается то
предельное разведение смыва, в котором обнаружены энтерококки.
Исследование смывов на присутствие патогенных стафилококков, сальмонелл, протеев, синегнойной палочки проводят так же, как при санитарно-бактериологическом контроле пищевых продуктов.
Оценка санитарного состояния объектов окружающей среды
При оценке санитарно-микробиологического состояния объектов исходят из цели обследования и назначения этих объектов. Официальных регламентаций о состоянии, составе микрофлоры различных объектов практически нет.
Имеющиеся инструктивные материалы по санитарно- микробиологическому контролю предприятий обществен-ного питания и торговли пищевыми продуктами указывают на то, что фекальное загрязнение должно быть исключено, т. е. не должно быть БГКП на оборудовании (не соприкасающимся с сырыми продуктами), на вымытой посуде. На всех обследуемых предметах обихода и оборудования не должны обнаруживаться патогенные микроорганизм ы: их присутствие указывает на реальную опасность заражения. К сожалению, не всегда удается избежать фекального загрязнения на производстве, в больницах и т.д. В связи с этим, исходя из опыта санитарной практики, если БГКП обнаруживаются только в 5% проб, взятых с предметов обихода и оборудования, санитарно-гигиеническое состояние обследуемого предприятия (лечебного учреждения) расценивается как удовлетворительно е.
По показателям общей обсемененности: санитарное состояние поверхности считается отличным, если ОМЧ на 1см 2 не превышает 100, хорошим — при микробном числе от 100 до 1000, удовлетворительным — более 1000, плохим — более 10000.
В то же время выделение патогенных стафилококков в клиниках хирургического профиля и в родильных домах с предметов обихода и от персонала свидетельствует о санитарном неблагополучии. В этом случае проводится обязательное определение фаговаров и антибиотикограммы выделяемых стафилококко в.
При обследовании различных объектов на стерильность (перевязочный и шовный материал, системы переливания крови, шприцы, иглы, грудное молоко, жидкость для питья детей и т. д.) не должно быть роста во всех посевах.
Стремительное распространение различных паразитарных заболеваний среди животных и людей приводит к интенсивному обсеменению паразитами окружающей среды – воды, почвы, продуктов питания и предметов обихода. При этом самыми распространенными и весьма опасными являются такие возбудители, как токсокары, власоглавы, аскариды, тенииды, лямблии, криптоспоридии, балантидии и пр.

Услуги паразитологической лаборатории
Для чего необходимы смывы на паразитологию
Широкий спектр услуг, предлагаемых санэпидемслужбой, является едва ли не единственным способом, позволяющим адекватно оценить вероятность заражения людей кишечными простейшими и гельминтами. По результатам исследований можно оценить степень обсемененности предметов паразитами и разработать соответствующий план противоэпидемических, санитарно-гигиенических и профилактических мер, направленных на сокращение рисков заражения, а после внедрения контролировать их эффективность.
Одними из наиболее востребованных являются такие исследования лаборатории, как смывы на паразитологию, а также диагностические исследования. Так, по данным Роспотребнадзора, среди всех паразитологических исследований 84% составляют анализы смывов на паразитологию, 7% — исследование почв, 6% — изучение пищевых продуктов и 3% — исследование воды, предназначенной для питья, осадков и сточных вод.
Спектр услуг паразитологической лаборатории
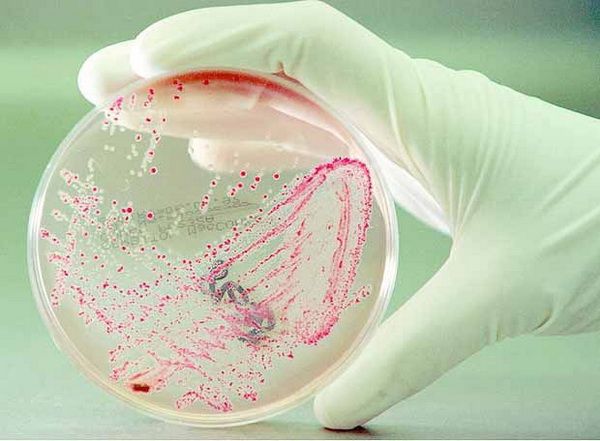
Смывы на паразитологию
Все смывы и исследования на паразитологию можно разделить на 2 группы:
- Санитарно-паразитологические анализы:
- Продуктов питания на яйца гельминтов и цисты патогенных простейших,
- Рыбы и продуктов из неё на наличие личинок трематод и цестод (методом компрессии),
- Мяса и продуктов из него на присутствие цестод и нематод,
- Смывов с рук, посуды, различных предметов и одежды на наличие цист кишечных патогенных микроорганизмов и яиц гельминтов,
- Песка, грунта, речного ила, навоза, удобрений — на наличие кишечных простейших и гельминтов.
- Исследования воды на предмет обнаружения цист простейших и гельминтов:
- Питьевой воды расфасованной (из пластиковых и стеклянных ёмкостей),
- Питьевой – из систем водоснабжения: например, централизованных или нет,
- Из бассейнов,
- Из канализационных и других стоков,
- Из рек, озёр, открытых водоемов.
После сбора материалов проводится обработка данных и подготовка протоколов исследований.
Преимущества обращения в паразитологическую лабораторию при санэпидемслужбе
Заказав исследования и анализы в лаборатории при СЭС, вы всегда можете быть уверены в достоверности полученных результатов, поскольку:
- У нас используется новейшее оборудование, позволяющее достигать отменной точности результатов,
- При исследовании смывов используются только новейшие методы и лучшие реактивы, используя которые, мы быстро и гарантированно выявляем паразитарные инвазии любой интенсивности — высокой, средней или низкой,
- Штат сотрудников укомплектован узкоспециализированными высококлассными специалистами, работающими в паразитологии не один год и занимающимися исключительно диагностикой паразитозов,
- Качество работ и компетентность лаборатории подтверждают:
- Аттестат аккредитации лаборатории
- Лицензии, подтверждающие право на оказание медицинской деятельности,
- Лицензии на работы, связанные с возбудителями инфекционных заболеваний 2-4 групп патогенности,
- Свидетельство об аккредитации.
Стоимость анализов, проводимых в нашей лаборатории, очень доступна, а сроки выполнения – минимальны. Сотрудники санэпидемслужбы всегда могут проконсультировать вас по поводу нюансов сбора, хранения и доставки материалов для анализа, а при необходимости осуществят эту часть работ своими силами.
(1).jpg)
Об актуальных изменениях в КС узнаете, став участником программы, разработанной совместно с ЗАО "Сбербанк-АСТ". Слушателям, успешно освоившим программу выдаются удостоверения установленного образца.

Программа разработана совместно с ЗАО "Сбербанк-АСТ". Слушателям, успешно освоившим программу, выдаются удостоверения установленного образца.
Письмо Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 29 июня 2009 г. № 01/9004-9-32 “О деятельности паразитологических лабораторий в 2008 году”
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека информирует о деятельности паразитологических лабораторий в Российской Федерации в 2008 году.
В 2008 году число проведенных паразитологических исследований осталось практически на уровне 2007 года и составило 11088317 (в 2007 году - 11 025 504). Не изменилось и соотношение проб биологического материала от людей (72%) и санитарно - паразитологических проб (28%).
Число исследованных проб по сравнению с предыдущим годом снизилось: на малярию - на 9,5% и составило 28340, на гельминтозы и протозоозы - на 2,2% и составило 6096038, в 1,2% проб обнаружены возбудители протозоозов и гельминтозов.
В 2008 году отмечались ошибки в идентификации возбудителей малярии (Оренбургская область), вместо P. оvale были обнаружены P. falciparum.
Число исследованных проб на гельминтозы и протозоозы в 2008 году снизилось по сравнению с предыдущим годом на 2,2% и составило 6096038. В 1,2% проб обнаружены возбудители протозоозов и гельминтозов.
По видовому составу возбудители паразитарных болезней распределились следующим образом: доля остриц составила 50%, лямблий -27%, аскарид и описторхид - по 8%, широкого лентеца и бластоцист - по 2%, прочих гельминтов - (карликового цепня, власоглава, стронгилоиды, дирофилярии, тениид) - 3%.
Серологичекими методами на паразитарные заболевания обследовано 170835 человек (2007 году - 164604 чел.), в том числе 94% с одиночными сыворотками и 6% с парными сыворотками, из них при исследовании одиночных сывороток выявлено серопозитивных сывороток к антигенам гельминтов и простейших 23,4% (в 2007 году - 22,7%), парных - 16,5% ( в 2007 году - 9,1%). На большинстве территорий не проводились исследования парных сывороток, что снижает достоверность постановки диагноза.
В 2008 году число санитарно-паразитологических исследований практически осталось на уровне предыдущего года и составило 3093936, при этом выполнено 2385659 проб.
В структуре санитарно-паразитологических исследований наибольший удельный вес занимают исследования смывов - 79,6% , на долю исследований других объектов приходится: почвы - 9,9%, пищевых продуктов - 5,6%, воды централизованного, нецентрализованного водоснабжения, плавательных бассейнов - 3,5%, сточной воды и осадка сточных вод - 0,9%, прочих - 0,5%.
Число исследованных проб смывов снизилось на 2,3% в 2008 году по сравнению с предыдущим годом и составило 1902657. В 0,3% проб обнаружены яйца гельминтов и цисты простейших. На долю яиц остриц приходится 92,7%, аскарид - 5,0%, цист лямблий - 2% и 0,3% положительных находок составляют ооцисты криптоспоридий, онкосферы тениид, токсокар, широкого лентеца .
В 2008 году число исследованных проб почвы увеличилось на 9,2% по сравнению с 2007 годом и составило 237921, в 1,8% проб обнаружены яйца гельминтов и цисты простейших. На долю яиц аскарид приходится 46%, токсокар - 45%, власоглава - 4%, остриц - 2%, в 3% проб обнаружены онкосферы тениид, личинки стронгилоид, яйца описторхид, цисты лямблий.
Возбудители паразитарных болезней обнаружены в почве территорий животноводческих комплексов (3,5%), в растениеводческих хозяйствах (1,5%), в селитебной зоне (1,4%), в том числе на территориях детских дошкольных учреждений и детских площадок (1,4%), курортов (0,3%), в зоне санитарной охраны источников водоснабжения (0,9%).
Число проб пищевых продуктов снизилось на 10,3% в 2008 году по сравнению с предыдущим годом и составило 134914, в 1,0% проб обнаружены яйца, личинки гельминтов и цисты простейших. Процент возбудителей паразитарных болезней в рыбе и рыбной продукции составил - 2,88%, мясе - 0,7%, бахчевых - 0,96%, овощах, зелени - 0,61%.
Число исследованных проб пищевых продуктов по паразитологическим показателям в 2008 году снизилось по сравнению с 2007 годом в 39 субъектах Российской Федерации: в Ставропольском, Камчатском краях, Ханты-Мансийском, Ямало- Ненецком автономных округах, в республиках Алтай, Башкортостане, Ингушетии, Калмыкии, Коми, Мордовии, Татарстане, Саха-Якутии, Хакасии, Чувашской Республике, Архангельской, Белгородской, Брянской, Воронежской, Калининградской, Курганской, Костромской, Московской, Мурманской, Нижегородской, Новгородской, Омской, Орловской, Ростовской, Сахалинской, Смоленской, Тамбовской, Тверской, Томской, Тульской, Тюменской, Ульяновской, Читинской, Ярославской областях, Еврейской автономной области.
В Томской области, эндемичной по описторхозу, за 2008 год исследовано всего 59 проб рыбы, из них в 22 обнаружены личинки гельминтов.
Исследование ягод проведено всего на 39 территориях по одной - две пробы за год, вместе с тем, ягоды, выращиваемые на земле, являются наиболее опасными в эпидемиологическом плане.
Число исследованных проб воды из системы централизованного водоснабжения по паразитологическим показателям в 2008 году увеличилось на 25,1% по сравнению с 2007 годом и составило 27614 проб. В 0,3 % обнаружены цисты лямблий и яйца гельминтов.
Вместе с тем, практически отсутствует контроль за качеством воды в системе централизованного водоснабжения по паразитологическим показателям в Ямало-Ненецком автономном округе, Республике Ингушетии, Удмуртской Республике, в Воронежской, Смоленской, Тульской, Псковской областях, Еврейской автономной области.
Санитарно-паразитологический мониторинг за обеззараживанием сточных вод и их осадков на очистных сооружениях в целом по Российской Федерации за последние годы активизировался, число исследованных проб увеличилось с 16028 в 2004 году до 21353 в 2008 году. По-прежнему не проводятся исследования сточных вод и их осадков в Смоленской области (10 проб), Чеченской Республике и Чукотском автономном округе.
Отсутствие положительных находок (яиц гельминтов и цист простейших) в сточной воде и осадке сточных вод в Ненецком автономном округе, Забайкальском крае, Республике Марий Эл, Ивановской, Костромской, Орловской, Оренбургской, Омской, Магаданской, Мурманской областях свидетельствует не столько о санитарно-эпидемиологическом благополучии объектов по паразитарным заболеваниям, сколько о неудовлетворительном качестве отбора проб, об отсутствии современного оборудования для отбора проб воды, бинокулярных микроскопов, низкой квалификации специалистов, как выполняющих исследования, так и планирующих точки отбора проб.
Анализ представленных материалов показал, что в 2008 году в ряде субъектов Российской Федерации проведена определенная работа по укреплению материально-технической базы паразитологических лабораторий. Обращает внимание, что укрепление материально-технической базы (пробоотборниками, бинокулярными микроскопами, вытяжными шкафами и др.) ведется, в основном, в Центрах гигиены и эпидемиологии в субъектах Российской Федерации, в то время как их филиалы оснащаются по остаточному принципу, за исключением Ханты-Мансийского автономного округа, Красноярского и Приморского краев, Саратовской, Новгородской областей.
В целях улучшения деятельности паразитологических лабораторий по санитарно-паразитологическому мониторингу, совершенствования санитарно-эпидемиологического надзора, оптимизации санитарно-противоэпидемических (профилактических) мероприятий, а также с целью усиления госсанэпиднадзора за вододоотведением на территориях субъектов Российской Федерации предлагаю:
Руководителям управлений Роспотребнадзора по субъектам Российской Федерации, главным врачам ФГУЗ "Центр гигиены и эпидемиологии" в субъектах Российской Федерации:
1. Потребовать от руководителей органов исполнительной власти субъектов Российской Федерации, местного самоуправления, ЖКХ, водоканалов - разработки (доработки) мероприятий по обеспечению очистки поверхностно-ливневых сточных вод, попадающих во второй пояс зоны санитарной охраны источников хозяйственно-питьевого и рекреационного водопользования, по санитарной очистке территорий городских и сельских поселений, внедрение новых эффективных способов по дезинвазии сточных вод и их осадков.
По-видимому, в тексте предыдущего абзаца допущена опечатка. Имеется в виду "СанПиН 2.1.5.980-00 "2.1.5. Водоотведение населенных мест, санитарная охрана водных объектов. Гигиенические требования к охране поверхностных вод"
3. Применять меры административной ответственности к руководителям водоканалов и иных предприятий, допускающих сброс неочищенных и необеззараженных стоков (инфицированных сточных вод) с объектов, представляющих эпидемиологическую опасность, в водоемы, являющиеся источниками питьевого водоснабжения, а также используемые для рекреационного водопользования и в черте населенных мест.
4. Проводить расследования каждого случая вспышки инфекционного и паразитарного заболевания, которые распространяются водным путем, с передачей дел в правоохранительные органы.
5. Уделить особое внимание вопросам качества воды мест рекреационного водопользования. Организовать проведения лабораторного контроля качества воды водоемов перед началом купального сезона, в период его проведения и после окончания.
6. Оптимизировать объем, проводимых в плановом порядке исследований на возбудителей паразитарных заболеваний в пищевых продуктах, воде (сточной, открытых водоемов, плавательных бассейнов) и почвы, акцентировать внимание на исследование почвы на территории ДДУ и детских площадок.
7. Обеспечить контроль за технологическими режимами обеззараживания рыбы от личинок гельминтов
8. Принять необходимые меры по дальнейшему укреплению материально-технической базы паразитологических лабораторий (пробоотборниками, бинокулярными микроскопами, центрифугами, вытяжными шкафами и т.д.) и подготовке специалистов по вопросам лабораторной диагностики паразитарных заболеваний.
| Руководитель | Г.Г. Онищенко |
Письмо Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 29 июня 2009 г. N 01/9004-9-32 "О деятельности паразитологических лабораторий в 2008 году"
Необходимость проведения анализов смывов
Процедура исследования смывов с рук, оборудования и т.д. является частью программы мероприятий производственного контроля, она законодательно закреплена в санитарных нормах. Этот метод исследования очень актуален и востребован благодаря его объективности и точности и является обязательным. Несоблюдение элементарных гигиенических требований является прямой угрозой бизнесу, здоровью занятых на предприятии сотрудников, клиентов.

Цели микробиологических исследований
Изучение микрофлоры смывов с рук и т.д. необходимо в следующих целях:
- Оценка санитарно-гигиенической обстановки в лечебно-профилактических, учебных детских заведениях, на предприятиях общественного питания,
- Исследование бактериологической загрязненности рук персонала, окружающих предметов, оборудования и техники (для этого проводится взятие смывов с оборудования),
- Установление путей распространения различных инфекционных заболеваний,
- Установление эпидемиологической безопасности выпускаемой на предприятии продукции,
- Минимизация рисков отравлений, возникновения различных заболеваний, связанных с приемом или использованием загрязненной продукции и др.
Что обычно изучают при проведении микробиологических исследований
Как правило, работники лаборатории приглашаются руководством компаний, предприятий, фабрик для осуществления санитарно-бактериологического контроля. При этом важно изучить те объекты, которые используются при приготовлении, хранении, транспортировке пищи.
Поэтому в первую очередь микробиологические исследования – смывы проводятся в отношении:
- Посуды, оборудования, кухонного инвентаря, бытовых и столовых приборов и т.п.,
- Собственно, продуктов – полуфабрикатов, сырья, готовых изделий, скоропортящихся продуктов питания и т.п.,
- Воды, используемой в процессе производства,
- Рук работающего персонала, рабочей одежды и рабочих поверхностей (столов, раковин, шкафов).
При изучении состава взятых проб работники лаборатории оценивают такие параметры, как:
- Итоговая обсемененность,
- Присутствие микроорганизмов Proteus,
- Наличие бактерий, вызывающих кишечные инфекции – БГКП,
- Присутствие сальмонеллы,
- Присутствие золотистого стафилококка,
- Общее микробное число (или ОМЧ).
Также смывы с рук покажут эффективность обработки рабочих поверхностей, поможет установить долю обсеменения продукта питания, которая вносится во время технологического процесса – для сравнения работники лаборатории берут как первичные, так и вторичные пробы готовой продукции.

Процедура взятия смывов рук для микробиологических исследований
Существуют нормативные документы, к примеру, МУ 2657-82, регламентирующие порядок сбора материалов для проведения исследования на бактериологическую обсемененность.
Так, забор смывов рук и оборудования производится с использованием специальных стерильных ватных тампонов, увлажненных специальной питательной средой и вмонтированных в пробирки. После взятия смывов тампоны погружают в питательную среду.
Вот примеры того, как происходит забор материала для анализа:
- Смывы с оборудования и рабочего инвентаря берутся до начала работы или в санитарные дни после санобработки. При этом с крупного инвентаря и рабочих поверхностей для снятия смывов используют трафарет со сторонами 5 см. обычно исследуется поверхность в 100 кв.см, причем пробы берутся из нескольких точек.
- Смывы с рук работников берутся следующим образом: сначала тампоном протираются ладони и пальцы рук (обеих, причем тампоном проводят не менее пяти раз), также протираются межпальцевые области, ногти и участки под ногтями.
- Смывы с санитарной одежды берутся так: выбираются и протираются тампоном 4 участка площадью по 25 кв.см. каждый: на правом и левом рукаве, а также с передней и верхней части рабочей одежды.
- Дополнительно необходимо взять смывы с систем кондиционирования и вентилирования.
Пробы для проведения посевов доставляются в лабораторию в термоконтейнерах. Срок доставки не должен превышать 4 часов. По результатам проведенного в бактериологической лаборатории анализа результатов микробиологических смывов клиент получает протокол лабораторных исследований.

Точность и достоверность микробиологических анализов смывов
Наши заказчики, предприятия и частные лица, получают полный спектр услуг в рамках микробиологических исследований. Мы выдаем объективные результаты исследований, четко соблюдаем правила забора проб.
В отзывах о нашей работе называют следующие позитивные стороны сотрудничества:
- оперативность исследований;
- достоверные результаты;
- доступные цены на услугу.
Не стоит ждать штрафных санкций Ростехнадзора и других контролирующих органов. Квалифицированная профессиональная оценка санитарной обстановки путем микробиологического анализа смывов – это спокойствие владельцев бизнеса, качественная продукция, довольные клиенты, и как следствие, прибыль и процветание.
Узнать точную стоимость и быстро оформить заявку
Гельминтокопроскопия (от греческого слова helmins – червь, kopros – кал, навоз, skopeo – смотрю) – совокупность методов взятия, обработки и исследования проб фекалий животных и человека с целью обнаружения в них яиц, личинок гельминтов или же самих паразитов, их фрагментов (членики, отрезки) и постановки диагноза.
Методы исследования направленные на отыскание самих паразитов и их отдельных фрагментов называется гельминтоскопией. Яйца гельминтов обнаруживают гельминтоовоскопическими, а личинок гельминтоларвосколическими методами
1. Порядок взятия и доставки материала для исследований
Фекалии у животных берут либо из прямой кишки, либо с земли (или пола) в зависимости от вида гельминта в количестве 4-10 г. При взятии их из прямой кишки на руки надевают тонкие резиновые перчатки или напальчники. При исследовании на кишечные стронгилятозы и легочные гельминты (особенно при диктиокаулезе) фекалии нужно брать только из прямой кишки во избежание загрязнения исследуемого материала личинками свободно живущих гельминтов. Допустимо отбирать пробы с пола, когда исследования проводят на заболевания, при которых го яиц не выходят личинки (фасциолез, дикроцелиоз, мониезиозы, аскаридиозы и т.д.).
У крупного рогатого скота, лошадей, собак фекалии берут индивидуально, указывая кличку и номер животного. У свиней, овец, оленей, кроликов и пушных зверей не всегда удается индивидуальное взятие проб, у этих животных фекалии чаще берут групповым методом, при этом указывают группу, отару, № станка и клетки.
Исследуют не менее 10% животных отары, фермы, хозяйства. Доставляют пробы фекалии в стеклянной, пластмассовой таре, целлофановых мешочках или пергаментной бумаге с обязательной описью проб в сопроводительном документе. При этом указывают, хозяйство, отделение, бригаду, участок, ферму, вид животного, их возраст, на какие гельминты исследовать, дату взятия и направления материала. Клички, номера животных, станка, клетки должны соответствовать номеру пробы фекалий на упаковке.
2. Методы гельминтоскопии
Гельминтоскопию применяют для обнаружения в исследуемом материале половозрелых и юных гельминтов или их фрагментов. Гельминты нередко отходят сами. А у цестод некоторых групп систематически отторгаются членики и фрагменты (отрезки) стробилы с яйцами и выделяются наружу. Исследуя фекалии животных невооруженным глазом можно заметить гельминтов или их фрагменты и членики, а иногда приходится использовать специальные методы исследования.
Особое значение гельминтоскопия имеет при цестодозах, а также при диагностической дегельминтизации.
С целью обнаружения члеников имагинальных цестод осматривают свежие фекалии. У овец, северных оленей, телят, лошадей члеников цестод нетрудно заметить при обычном осмотре. В фекалиях ягнят и овец рано утром или после дневного отдыха находят членики мониезий, тизакиезий, аветеллин и стилезий. У плотоядных животных членики цестод из отряда тениата способны активно передвигаться во внешней среде. Поэтому необходимо осматривать свежие фекалии.
Весьма характерны по форме членики огуречного цепня ( Dipylidium caninum ) паразитирующий у собак, лисиц, песцов, енотовидных собак, кошек и других плотоядных, а также у человека. Членики этого паразита внешне напоминают огуречные семена, их легко заметить в фекалиях, выделенных инвазированными животными.
Из специальных методов гельминтоскопии практически прост и приемлем метод последовательного промывания.
2.1. Метод последовательного промывания
При проведения этого метода собирают свежие порции фекалий от животных, их кладут в сосуд, заливают водой в соотношении 1:5 и 1:10, тщательно перемешивают. Взвесь оставляют на 5 мин. для осаждения. Затем верхний слой сливают до осадка, после чего снова заливают водой и повторяют эти операции до тех пор, пока жидкость над осадком не будет прозрачной. После надосадочную жидкость сливают последний раз, а осадок помещают в кювет или чашку Петри для исследования под лупой. Так как одни гельминты хорошо видны на белом фоне, а другие на черном, то для более полной выборки гельминтов чашку Петри ставят то на белую, то на черную бумагу. Гельминты выбирают препаровальной иглой или кисточкой, а затем микроскопируют для установления вида, при этом пользуются ручной, а также штативной лупой или стереоскопическим микроскопом.
2.2. Метод отсеивания
При этом методе используют набор из 2 – 4 металлических сит с отверстиями убывающего диаметра. Струей воды промывают фекалии, при этом частицы фекалий уносятся водой, а гельминты в зависимости 6 v величины задерживаются на разных ситах. Затем гельминтов выбирают и исследуют. Этим методом можно собрать гельминтов разной величины
3. Методы гельминтоовоскопии
Гельминтоовоскопия (от латинского ovum – яйцо, греческого skopeo – смотрю) объединяет группу методов исследования, с помощью которых выявляют яйца возбудителей гельминтозов.
Предложено много методов овоскопии. Но не все они заслуживают практического внимания: одни сложны по технике выполнения, при исследовании другими требуется значительное время, третьи малоэффективны. В данной работе мы приведем только те методы, которые заслуживают практического внимания.
Удельный вес яиц тяжелее обычной воды, вследствие этого яйца гельминтов, как более тяжелые частички вымываются из фекалий водой и оседают на дно сосуда с различной скоростью, в зависимости от удельного веса, Быстрее всего оседают яйца более крупного размера.
В растворах же солей высокого удельного веса яйца гельминтов наоборот всплывают (явление флотации) в верхний слой и концентрируются в нем.
На использовании этих физических закономерностей основала технология всех современных методов гельминтоовоскопии, которые подразделяются на три группы:
а) Методы осаждения (седиментации) яиц гельминтов;
б) Методы флотации яиц гельминтов;
в) Комбинированные методы (осаждения и флотации) яиц гельминтов.
3.1. Методы осаждения (седиментации)
Основаны на принципе осаждения взвешенных в жидкости яиц гельминтов, промывки осадка и исследования его. Эти методы применяются в основном для диагностики тех гельминтозов, возбудители которых выделяют яйца с высоким удельным весом (фасциолез, дикроцелиоз, парамфистоматоз, описторхоз и др.). Методики осаждения менее эффективны и более трудоемки, чем флотации. Это связано со сложностью отыскания яиц гельминтов в осадке взвеси.
3.1.1 . Метод последовательных смывов
Пробу фекалий весом 3-5 г кладут в стакан, вливают небольшое количество воды и размешивают палочкой или пинцетом до получения жидкой кашицеобразной массы, затем добавляют воду порциями до объема 50 мл при постоянном размешивании; После взвесь процеживают через металлическое сито или марлю в другой стакан, в нем отстаивают в течение 5-10 мин. Затем верхний слой жидкости над осадком сливают, а к осадку добавляют новую порцию воды и вновь отстаивают в течение 5 – 10 мин. Описанная процедура повторяется до тех-пор, пока вода не станет прозрачной. Ее в последний раз сливают, а осадок (около 5 мл) разливают на предметные стекла или стекла большего размера (12×19) и микроскопирутот.
Эта методика широко применяется в ветеринарных лабораториях для диагностики фасциолеза, дикроцелиоза, парамфистоматоза, эуриггрематоза и других гельминтозов жвачных. Вместе с тем, она трудоемка и по диагностической эффективности значительно уступает специальным флотационным и комбинированным методам гельминтоовоскопии.
3.1.2. Метод Горшкова.
Этот метод предложен ял я диагностики драйшеоза и габромематоза лошадей. Основан на принципе осаждения и концентрации яиц 150-30° г фекалий помещают на металлическом сите или марле в большую воронку с верхним диаметром 15-20 см. Предварительно на нижний конец воронки надевают резиновую трубку длиной 10-15 см с зажимом на конце. Воронку укрепляют в штативе. Фекалии разрыхляют, заливают доверху теплой водой (38 – 39°С) и выдерживают 4-24 часа. Затем зажим осторожно открывают, и жидкость выпускают в центрифужную пробирку и центрифугируют при 1500 об/мин, в течение 3-х мин. Верхний слой жидкости сливают, а осадок наносят на предметное стекло и микроскопируют.
3.1.3. Метод соскоба с перианальных складок
Эту методику применяют для диагностики оксиуроза лошадей и пассалуроза кроликов. Из деревянной палочки или щепочки делают лопаточки (можно и спички), смачивают смесью глицерина с водой (1:1) и делают соскоб с перианальных складок с внутренней стороны хвоста в области промежности. Соскоб переносят на предметное стекло с указанной смесью, накрывают покровным стеклом и исследуют под микроскопом.
3.2. Флотационные методы
Все методы флотации (от англ. Flotation — всплывание) основаны на единой физической закономерности, обеспечивающей всплытие яиц гельминтов в насыщенных, растворах солей. Для этого рекомендуются растворы различных солей, но предпочтительнее дешевых и повсеместно доступных.
Отдельные методы флотации называются по именам авторов, впервые предложивших ту или иную соль для приготовления флотационной жидкости.
3.2.1. Метод Фюллёборна
Для этой методики нужен насыщенный раствор поваренной соли, который готовят путем кипячения 400-420 г соли на 1 л воды.
Пробу фекалий весом 3 – 5 г помещают в стакан, заливают небольшим количеством флотационной жидкости, тщательно размешивают, затем добавляют 50-100 мл этого раствора и процеживают через металлическое сито или марлю в один спой в сухой, чистый стакан. Взвесь отстаивают 40-60 мин., затем прикосновением петли снимают поверхностную пленку, переносят ее на предметное стекло для микроскопирования.
Этот метод в отечественной лабораторной практике может применяться для диагностики аскаридоза, стронгилятозов и стронгилоидоза свиней, неоаскаридоза, стронгилятозов стронгилоидозов, мониезиоза,. тизанизиоза, жвачных, параскаридоза, стронгилятозов кишечника лошадей
Плотность насыщенного раствора поваренной соли невысокая — 1,18-1,20. Тогда как удельный вес яиц аскариса равен 1,10-1,14 : а у неоплодотворенных яиц — 1,26, а трихоцефалюса — 1,16-1,22. Поэтому насыщенный раствор поваренной соли способен флотировать только масть яиц аскарид и трихоцефалюсов, по этой причине диагностическая эффективность данной методики невысокая. Кроме того, раствор на предметном стекле быстро кристаллизуется.
3.2.2. Метод Котельникона-Хренова с аммиачной селитрой
Технология этого метода такая же, как и метода Фюллёборна, но в качестве флотационной жидкости применяется нитрат аммония (техническая гранулированная аммиачная селитра) используемый для удобрений. При приготовлении флотационной жидкости на 1 л кипящей воды растворяют 1,5 кг селитры. Плотность раствора — 1,32. Поверхностную пленку можно микроскопировать через 10 мин.
Данная методика обладает высокой диагностической эффективностью. Кроме того, гранулированная аммиачная селитра, применяемая для флотационного раствора — общедоступная дешевая соль и производится в огромном количестве как минеральное удобрение.
В лабораторной практике эта методика широко применяется для выявления яиц аскаридоза, трихоцефалеза, эзофагостомоза и метастронгилеза свиней, неоаскарндоза, стронгилятозов пищеварительного тракта, трихоцефалеза, авителлиноза жвачных, параскаридоза и стронгилятозов лошадей, токсокароза и токсаскаридоза собак, кошек, песцов, лисиц и других плотоядных, стронгилоидоза животных разных видов, аскаридиоза и гетеракидоза кур.
Недостатком этого метода является то, что флотационная жидкость из аммиачной селитры не способна поднять тяжелые яйца трематод (фасциол, парамфистом, описторхисов и др.), т.к. удельный вес этих яиц больше чем 1,3 и раствор быстро кристаллизуется.
3.2.3. Метод Котельникова-Хренова с нитратом свинца
Техника проведения этого метода аналогична методу Фюллёборна. В качестве флотационной жидкости при этом используется насыщенный раствор нитрата свинца из расчета 0,65 кг на 1 л воды. Плотность этой жидкости достигает 1,5. Применение такого флотационного раствора дает возможность диагностировать широкий круг возбудителей гельминтозов и
с его помощью легко выявляются и тяжелые яйла фасциол (удельный вес 1,31-1,35), парамфистоматат (1,33-1,38), дикроцелиумов (1,3) и еще быстрее яйца с меньшим удельным весом, аскаридат, стронгилят, метастронгилюсов, трихоцефалят, стронгилоидесов, аноплоцефаяят (мониезий), тениат, скребней (макраканторинхусов), а также капсулы тизаниезий.
Недостатком данной методики является дороговизна нитрата свинца. Вместе с тем, при работе данным препаратом петли покрываются белым налетом, (нитрат свинца входит в химическую реакцию с металлами), яйца трематод сильно деформируются, что создает определенные трудности при исследовании. Кроме того, используемый препарат соль тяжелого металла — свинца, который является высокоядовитым веществом, что создает опасность для здоровья исследователей и окружающих, отработанные растворы данного препарата запрещено сливать в канализационные стоки. По совокупности этих причин, указанная методика не нашла широкого применения в практике.
Кроме того, в качестве флотационных жидкостей авторами были предложены насыщенные растворы из следующих солей: нитрата натрия — 1 кг препарата на 1 л воды, р — 1,38 (метод Калантаряна), тиосульфата натрия — 1,75 кг препарата на 1 л воды, р — 1,40 (метод Болховитинова), карбоната калия — 0,6 кг на 1 л воды, р — 1,41 (метод Вольфа). Однако все эти методы по тем или иным причинам также не нашли широкого применения в практике.
Читайте также:


