Что с микрофлорой после лечения лямблий

Взаимоотношения организм человека и окружающая среда представляют собой единую экологическую систему, находящуюся в состоянии биологического равновесия. С современных позиций нормальную микрофлору рассматривают как совокупность микробиоценозов различных биотопов, центральным и наиболее густо заселенным из которых является микробиоценоз кишечника [6,7].
Паразитарные инвазии, в том числе лямблиоз, представляют собой биосоциальное многоуровневое явление, для их диагностики необходимы комплексные исследования – клинические, микробиологические, паразитологические, экологические, эпидемиологические.
При этом именно комплекс лабораторных исследований позволяет клиницисту и эпидемиологу не только уточнить этиологию инфекционного процесса, но и разработать на этой основе действенную систему профилактических мероприятий для оздоровления населения. В работах российских ученых Одинцевой В.Е. с соавторами описан метод лечения лямблиоза высокоэффективным препаратом как мебендазол. Значительные нарушения микроэкологического равновесия вызывают использование сильнодействующих противолямблиозных препаратов, что в свою очередь вызывает элиминацию не только возбудителя инфекционного процесса, но и полезные микроорганизмы. Рациональным является одновременное назначение лекарственных средств, способствующих восстановлению нормальной микрофлоры.
Изменения в количественном составе микрофлоры кишечника обычно сопровождаются увеличением условно-патогенных микроорганизмов на фоне снижения бифидо- и лактобактерий, вследствие чего нарушается трофика, обезвреживание токсических продуктов в печени, снижается иммунологическая (в том числе колонизационная) резистентность. Настораживают данные, что канцерогенез ускоряется на фоне дисбактериоза, проблема формирования дисбактериоза, вредных последствий его для здоровья пациентов разного возраста, становиться проблемой для современной медицины. В научных работах Котовой А.Л. с соавторами в связи с этим была изучена распространенность паразитарных инвазий у подростков г. Алматы. При изучении распространенности простейших в кишечнике человека были обнаружены с одинаковой частотой – Lamblia intestinalis и Trichomonas hominis. Наличие микст-инфекции, вызванных простейшими, выявлено у 1,4+-0,5 %. Были обнаружены простейшие, которые не являются патогенными для человека (у 0,6+-0,3 % подростков были обнаружены Entamoeba coli и Chilomastix mesnili). При изучении распространения гельминтов кишечника среди практически здоровых подростков г. Алматы, были выявлены круглые черви (класса нематоды) Enterobius vermicularis (2.6 %), Ascaris lumbricoides (3.0 %). В этих работах при обследовании инвазированных подростков, использовали анкеты, направленные на выявление анамнестических данных и жалоб, характерных для нарушений системы пищеварения. В работах Рамазановой Б.А с соавторами, проведен подробный анализ паразитологических и микробиологических исследований фекалий условно здоровых подростков, это исследование позволило выявить паразитарные инвазии у 31,4 % обследованных. Удельный вес подростков с паразитарными инвазиям и в 3-х группах обследованных колебался от 30,6 до 32,0 %. Все это сопровождается гиповитаминозом, снижением реактивности организма, его сопротивляемости к инфекционным заболеваниям, особенно кишечным инфекциям [5,2,6].
Цель исследования: определить состав и оценить состояние микробиоценоза кишечника у больных с лямблиозом, до и после противолямблиозного лечения.
Материалы и методы исследования
Забор фекалий производился в объеме 1-3 г, в специализированные транспортные стерильные флаконы и доставка в лабораторию осуществлялась в течение 2-х часов от момента сбора. При доставке кала в лабораторию посев производится немедленно.
Всего обследовано 80 пациентов, у которых выделено 284 микроорганизма, проведено 333 обследований. Из них обследовано 43 мужчины и 37 женщин в возрасте от 18 до 45 лет. У всех пациентов проведено комплексное клинико-бактериологическое обследование и отдельно проведено обследование на лямблиоз.
Среди всех проанкетированных пациентов, проживающих в Караганде и Карагандинской области, у 39,2 % наблюдались – хроническое течение лямблиоза. При анализе анкетных данных было отмечено, что 18,6 % пациентов женщин из основной группы находились на диспансерном учете у следующих специалистов: гастроэнтеролог, инфекционист, аллерголог [8].
Результаты исследования и их обсуждение
При исследовании кишечного микробиоценоза из группы здоровых лиц, включенных в контрольную группу, в 6,6 % случаев отсутствуют какие-либо сдвиги в качественном и количественном составе экологически значимых групп микроорганизмов – эубиоз. В остальных случаях (93,3 %) были отмечены качественные или количественные изменения в составе микробиоценоза. Отклонения, соответствующие дисбактериозу I степени были выявлены у 60,2 % обследованных, в 33,2 % случаев отклонения соответствовали дисбактериозу II степени. Дисбактериоз III степени был выявлен у 6,6 % обследованных пациентов.
Анализ по отдельным группам выявил ряд специфических особенностей, описанных ниже. Резидентные представители кишечной микрофлоры – кишечные палочки были выявлены в составе кишечной микрофлоры у всех обследованных условно-здоровых лиц. При этом E.coli в минимальном диагностически значимом титре (6 Lg КОЕ/г) были выявлены у 20 % пациентов. В большей части случаев кишечные палочки были обнаружены в титрах 7 и 8 Lg КОЕ/г (31,1 % и 46,7 % соответственно).
Условно-патогенная микрофлора, выделенная в группе здоровых лиц, характеризовалась разнообразным качественным составом. Помимо энтеробактерий, условно-патогенная флора была представлена представителями рода Enterococcus (E.faecalis) с β-гемолитической активностью (9,1 %).
Одним из значимых аспектов в оценке микробиоценоза кишечника является оценка количественного и качественного состава лакто- и бифидобактерий, как одних из основных эндогенных регуляторов, обеспечивающих консервативный характер его видового состава. В 6,7 % наблюдений титр лактобактерий составил 4 Lg, в 20 % – 5 Lg, в 17,8 % – 6 Lg, в 11,1 % – 7 Lg и в 4,4 % – 8 Lg. Значительное снижение титра бифидобактерий (ниже 7 Lg КОЕ/г) было отмечено в четверти наблюдений (24,4 %). Бифидобактерии в титре 7 Lg КОЕ/г были обнаружены у 15,6 % обследуемых. В большей части случаев (51,1 %) титр бифидобактерий составил 9 Lg КОЕ/г и только у 8,9 % – 11 Lg КОЕ/г.
Анализ по группам микроорганизмов выявил следующие специфические особенности, в частности, резидентные представители микрофлоры кишечника – E.coli – кишечные палочки высевались в составе кишечной микрофлоры у всех обследованных, при этом E.coli в минимальном диагностические значимом титре (6 Lg КОЕ/г) были выявлены у 20 % пациентов преимущественно у женщин. В большей части случаев (68 %) кишечные палочки были обнаружены в титрах 7 и 8 Lg КОЕ/г (32 % и 36 % соответственно). В 5 % наблюдений титр E.coli составил 9 Lg КОЕ/г. Слабо ферментирующие E.coli выявлялись у 20 % обследованных в группе с лямблиозом, у этих же пациентов 7 % наблюдений были выявленные кишечные палочки с гемолитической активностью.
Важной частью кишечного биотопа являются энтерококки, которые идентифицированные в 46 % случаев. Это 62 % культуры Enterococcusfaecalis и 37 % культуры Enterococcusfaecium.
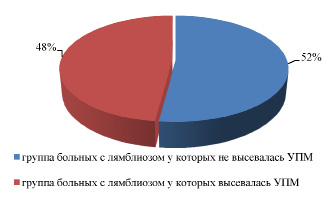
Рис. 1. Количество дисбиозов толстого кишечника больных лямблиозом, содержащих в своем составе условно-патогенную микрофлору
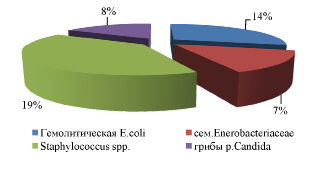
Рис. 2. Состав условно-патогенной флоры у больных с лямблиозом
Кишечные палочки с нормальной ферментативной активностью были выявлены в составе кишечной микрофлоры у всех обследованных больных лиц. При этом E.coli в минимальном диагностически значимом титре (6 lg КОЕ/г) были выявлены у 27 % пациентов. В 68 % случаев кишечные палочки были обнаружены в титрах 7 и 8 lg КОЕ/г. В 5 % наблюдений титр E.coli составил 9 lg КОЕ/г. Наблюдалось в 12 % процентах случаев появление гемолизирующих эритроциты человека и потерявших фермент разлагающий сахар лактозу E. coli. Гемолитически активные кишечные палочки составили 5 % обследованных, лактозонегативные кишечные палочки соответственно – 7 %. Снижение местной иммунологической резистентности кишечника наблюдали, у 98 % обследованных. В основном это выражалось в наличии низких уровней лизоцима (отсутствие лизоцима в разведении 10-1).
Важной частью кишечного биотопа являются энтерококки, которые идентифицированные в 46 % случаев. Это 62 % культуры Enterococcusfaecalis и 37 % культуры Enterococcusfaecium.
Выявлена колонизация слизистой условно-патогенными бактериями в количествах превышающих значения нормального микробиоценоза толстого кишечника. Идентифицированы представители рода Staphylococcus в 19 % случаев (36 % культуры St.aureus, 64 % культуры St. saprophyticus). Выделены представители семейства Enterobacteriacea в 7 % случаях, из них 60 % культуры Enterobactercloacea, 20 % Enterobacteraerogenes, 20 % Klebsiellapneumonia. Выделены грибы рода Candida в 8 % случаев.
У пролеченных больных отклонения от нормальных значений в биотопе толстого кишечника, выявленные до лечения, регистрируются в меньшей степени. Уменьшилась частота выявления условно-патогенных микроорганизмов, лактозонегативных и гемолитических кишечных палочек. Кишечные палочки с нормальной ферментативной активностью выявлялись в большей части случаев в титре 7-8 lg КОЕ/г. Снижение локальной резистентности кишечника (отсутствие лизоцима в разведении 10-1 материала) осталось на прежнем уровне – выявлялось в 97 % случаев. При этом наблюдается увеличение количества бифидобактерий до титра 8-9 lg КОЕ/г. и лакто бактерий до титра 7-8 lg КОЕ/г .
Лактобактерии и бифидобактерии в диагностически значимых титрах присутствовали в 56,2 % и в 71,1 % случаев соответственно.
В преобладающем большинстве случаев отклонения в группе обследованных пациентов с диагнозом лямблиозная инвазия, соответствовали дисбактериозу II – III степени.
Определив состав микробиоценоза кишечника у лиц с гельминтозной инвазией в процессе выполнения данного исследования оценивали состояние микробиоценоза кишечника после противогельминтного лечения, у пролеченных больных с лямблиозом отклонения от нормальных значений в биотопе толстого кишечника, выявленные до лечения, регистрируются в меньшей степени. Уменьшилась частота выявления условно-патогенных микроорганизмов, лактозо-негативных и гемолитических кишечных палочек. Кишечные палочки с нормальной ферментативной активностью выявлялись в большей части случаев в титре 7 lg КОЕ/г – 8 lg КОЕ/г. Снижение локальной резистентности кишечника (отсутствие лизоцима в разведении 10-1 материала) осталось на прежнем уровне – выявлялось в 97 % случаев, для восстановления данного показателя необходим более длительный период восстановления. При этом наблюдается увеличение количества бифидобактерий до титра 8-9 lg КОЕ/г. и лактобактерий до титра 7-8 lg КОЕ/г.
Заключение
Таким образом, лямблиозная инвазия изменяет качественные и количественные характеристики микробиоценоза кишечника. При этом угнетается анаэробный спектр кишечного биоценоза, увеличивается количество условно-патогенной микрофлоры и снижается местная резистентность толстого кишечника.

На территории Свердловской области в течение последних 10 лет отмечаются стабильно высокие показатели заболеваемости описторхозом и лямблиозом. В 2013 году показатель заболеваемости описторхозом составил 36,64 на 100 тыс., а лямблиозом – 66,42 на 100 тыс. населения.
Несмотря на то, что в большинстве случаев лямблиоз у взрослых протекает в виде латентного паразитоносительства, встречаются и клинически манифестные формы. Выраженность клинических проявлений при лямблиозе обусловлена воспалительными и функциональными изменениями верхних отделов желудочно-кишечного тракта При лямблиозной инвазии изменяется качественный и количественный состав кишечной микрофлоры с последующим развитием метаболических и иммунологических нарушений, что усугубляет течение основного заболевания [1].
Одной из причин, ведущих к дисфункции в гастродуоденальной зоне, может быть описторхозная инвазия. В сложном патогенезе описторхоза выделяется несколько основных звеньев: хроническое воспаление, холестаз, присоединение вторичной инфекции, развитие аутоиммунных процессов, гиперчувствительность замедленного типа, формирование паразитарных гранулем. Повторные заражения opisthorchis felineus рассматриваются как дополнительное воздействие, усиливающее иммуносупрессию [3].
Большой интерес представляет изучение паразитоценозов, в частности сочетанной глистно-протозойной инвазии: opisthorchis felineus и lamblia intestinalis [3, 10].
Успех терапии хронической описторхозной инвазии и лямблиоза обеспечивается выполнением основных принципов: комплексность, планирование, специфичность, системность, этапный подход, кратность курсов дегельминтизации. Основной анитигельминтный препарат, использующийся в России для лечения описторхоза – празиквантел [4]. В литературе упоминаются противоречивые данные об антитрематодозной активности других лекарственных препаратов, к числу которых относится: албендазол, который хорошо зарекомендовал себя как антилямблиозный препарат [9]. Выставляя в основу лечения антигельминтик, нельзя забывать о купировании основных патогенетических синдромов, в том числе нарушение качественного и количественного состава микрофлоры кишечника.
Основные требования к современному пробиотику сводятся к следующему: препарат должен содержать от 2 млрд. жизнеспособных бактерий, сохранять стабильность, обладать способностью прикрепляться к стенкам кишечника, иметь доказанную клиническую эффективность и безопасность, обеспечивать антагонизм к условно-патогенной и патогенной микрофлоре, не должен разрушаться под воздействием кислой среды желудка и желчных кислот. Таким требованиям удовлетворяет ротабиотик, представляющий собой комбинацию пробиотических бактерий с инулином [7].
Активным веществом препарата медулак является лактулоза, синтетический дисахарид, не встречающийся в природе. Лактулоза является идеальным питательным субстратом для сахаролитических бактерий. В результате увеличивается биомасса таких бактерий. В такой ситуации возникает конкуренция за питательные вещества, что приводит к угнетению патогенной и условно-патогенной микрофлоры [6]. Лактулоза увеличивает поглощение аммиака из среды, уменьшает образование аммиака бактериями, ингибируект бактериальное разложение аминокислот при помощи механизма катаболического угнетения [8].
Цель исследования – определить эффективность медулака и ротабиотика в комплексной терапии при различных формах описторхозной инвазии инвазии и биинвазии – opisthorchis felineus и lamblia intestinalis на основе клинического обследования больных и оценки качественного и количественного состава микрофлоры кишечника.
Материалы
и методы исследования
Всего обследован 71 пациент: 39 мужчин и 32 женщины. Средний возраст больных составил 43,4±3,5 года.
1. Мужчины и женщины в возрасте старше 18 лет.
2. Впервые установленный клинически манифестный диагноз описторхоза или повторно выявленная инвазия, вызванная opisthorchis felineus специфически не леченная или после одного или двух курсов лечения в сроки не менее шести месяцев до начала исследования.
3. Добровольное согласие пациента на дегельминтизацию и лабораторное тестирование.
4. Выявление яиц opisthorchis felineus в кале и/или желчи.
5. Выявление цист, вегетативных форм lamblia intestinalis в кале и/или желчи и/или обнаружение антител к антигену lamblia intestinalis в крови.
1. Сопутствующая другая паразитарная патология.
2. Хроническое поражение печени, не обусловленное описторхозом.
3. Прием гепатотоксичных препаратов за шесть месяцев до начала исследования.
4. Алкогольная болезнь.
5. Беременные или кормящие женщины.
6. Острое инфекционное заболевание за три месяца до начала исследования.
Больные предъявляли жалобы на боль в правом подреберье и/или в эпигастрии (29,6 %), тяжесть в правом подреберье и/или в эпигастрии (36,6 %), тошноту (25,4 %), горечь во рту (36,6 %), снижение аппетита (33,8 %), неустойчивый стул (66,2 %), диарею (33,8 %), запоры (32,4 %), повышение температуры до субфебрильных цифр (59,2 %), кожный зуд (63,4 %), потливость (53,5 %), сердцебиение (42,3 %). Объективно определялось увеличение печени (100 %), дерматоз (36,6 %).
Учитывались данные эпидемиологического анамнеза: факторы риска заражения за несколько лет. Существенными считались факты диагноза острого или хронического описторхоза и проведение антипаразитарной терапии в прошлом. Пациенты с впервые выявленным описторхозом включены в группу 1 (n=37). Больные с описторхозным анамнезом более трех лет, специфически леченные в прошлом, при наличии факторов риска повторного заражения opisthorchis felineus у которых вновь были обнаружены яйца сибирской двуустки (суперинвазионный описторхоз), включены в группу 2 (n=34).
Лабораторными находками были гиперэозинофилия (у 66,2 %), гипербилирубинемия (45,1 %), повышение активности АЛТ (36,6 %), щелочной фосфатазы (62,0 %), ГГТП (59,2 %), повышение уровня холестерина (45,1 %), увеличение гамма-глобулиновой фракции белка (33,8 %), повышение уровня IgM (36,6 %), IgE (66,2 %), появление циркулирующих иммунных комплексов (63,4 %), С реактивного протеина (33,8 %).
В 100 % случаев описторхоз был подтвержден копроовоскопически и/или билиовоскопически.
Антитела класса IgG к антигенам opisthorchis felineus в крови выявлялись в 66,2 % случаев. Высокий титр антител (> 1/400) зафиксирован в 19,7 %. Низкий титр антител ( 1/400) присутствовал в 15,5 %, низкий титр (
Рассмотрены особенности диагностики и лечения лямблиоза у детей. Определена роль диетотерапии и возможности применения энтеросорбентов в комплексном лечении пациентов с лямблиозом и сопутствующим дисбактериозом кишечника.
Peculiarities of diagnostics and treatment of lambliosis with children were considered. The meaning of dietary therapy and the possibilities of interosorbents use in complex therapy of patients with lambliosis and satellite intestine dysbacteriosis were specified.
Лямблиоз является одним из самых распространенных и часто встречающихся протозоозов, протекающим как в виде латентного паразитоносительства, так и в виде манифестных форм с преимущественным поражением тонкого кишечника. Основным источником инвазии является зараженный человек. Механизм передачи заболевания фекально-оральный. Пути распространения — водный, контактный, пищевой.
Воздействие лямблий на организм хозяина многообразно. Вегетативные формы, фиксируясь на поверхности энтероцитов, не только перекрывают всасывательную поверхность кишки и потребляют готовые питательные вещества, но и вызывают механическое и токсическое повреждение поверхности кишечника, запуская целый ряд патологических механизмов: сенсибилизацию организма продуктами распада лямблий и формирование аллергодерматозов, нарушение синтеза ферментов и развитие вторичного синдрома мальабсорбции, формирование абдоминального синдрома, нарушение функции печени, снижение синтеза иммуноглобулинов, формирование дисбиотических нарушений в кишечнике [1, 3–5].
Полиморфизм клинических признаков лямблиоза зачастую затрудняет диагностику данного заболевания [1, 12]. Согласно классификации ВОЗ нами ежегодно регистрируются: лямблиоз без клинических проявлений (латентный) в 2% случаев, лямблиоз с клиническими проявлениями (манифестный) в 98% случаев. Из манифестных форм кишечную форму заболевания мы наблюдаем в 15% случаев, билиарно-панкреатическую форму — в 9%, форму с внекишечными проявлениями — в 30%, смешанную форму — в 44% случаев соответственно.
Наши исследования показали, что в целом кишечный синдром при различных формах лямблиоза проявляется: болью в животе у 30% больных, диареей у 57%, запорами у 29%, тошнотой и анорексией у 70% пациентов соответственно. У 20–40% детей в зависимости от формы заболевания имеет место лактазная недостаточность. Дисбактериоз кишечника при лямблиозе мы регистрируем у всех детей и подростков — 100% [6].
Под дисбактериозом кишечника понимают клинико-лабораторный синдром, связанный с изменением качественного и/или количественного состава микрофлоры кишечника с последующим развитием метаболических и иммунологических нарушений и возможным развитием желудочно-кишечных расстройств [9]. Многими исследователями доказано, что дисбактериоз кишечника является не только сопутствующим клинико-лабораторным синдромом основной соматической патологии желудочно-кишечного тракта, но и может самостоятельно являться дебютом многих патологических состояний, особенно у детей раннего возраста.
Терапия лямблиоза преследует цель полной эрадикации лямблий из кишечника, поэтому ее успешность во многом зависит от комплексного подхода к лечению, включающего назначение: противолямблиозных средств, энтеросорбентов, препаратов, восстанавливающих функцию желчного пузыря, пробиотиков, пребиотиков, при необходимости антигистаминных средств, гепатопротекторов и иммунокорректоров [4, 5]. Очень важно при лечении лямблиоза правильно назначить диету, соответствующую возрасту ребенка, форме заболевания, сопутствующей патологии. Хорошо себя зарекомендовала диета, богатая мягкими пищевыми волокнами-энтеросорбентами, а также поддерживающая фитотерапия, оказывающая противовоспалительное, обволакивающее, регенерирующее действие на слизистую желудочно-кишечного тракта [3].
В настоящее время в медицинской практике используется большое количество энтеросорбентов, различающихся по лекарственной форме, по химической структуре, по механизму сорбции, селективности. Диапазон клинических эффектов энтеросорбции достаточно широк. Наиболее значимыми являются: дезинтоксикационный, антидиарейный, противовоспалительный, метаболический, цитопротекторный эффекты. Помимо этого энтеросорбенты (особенно пищевые волокна) обладают способностью поддерживать микробиоценоз кишечника [13].
Ввиду неоднородности кишечного синдрома при лямблиозе энтеросорбенты специалистами назначаются индивидуально: при запорах предпочтительны препараты, содержащие лигнин с лактулозой, при диарейном синдроме — препараты, содержащие смектит. Но, к сожалению, практика показывает, что не всегда наши пациенты при назначении энтеросорбентов чувствуют себя комфортно: в одних случаях усиливается газообразование и боль в животе, в других — происходит резкая смена диареи на запор, в-третьих — не всегда возможен длительный курс выбранного сорбента. Поиск альтернативных методов лечения привел к изучению клинико-лабораторной эффективности препарата Мукофальк у детей с лямблиозом и сопутствующим дисбактериозом кишечника.
1) оценить переносимость Мукофалька у детей;
2) изучить клиническую и лабораторную эффективность Мукофалька при лямблиозе у детей с диарейным синдромом и синдромом запора;
3) изучить лабораторную эффективность Мукофалька при сопутствующем дисбактериозе кишечника у детей.
В литературе имеются данные об успешном использовании Мукофалька в лечении пациентов с различными синдромами в гастроэнтерологической и гепатологической практике [2, 11, 15], при инфекционных болезнях: иерсиниозе, эшерихиозе и сальмонеллезной инфекции. Исследователями доказано, что Мукофальк не только адсорбирует бактерии, снижает эозинофильно-клеточную инфильтрацию слизистой, но и приводит к выраженному сдвигу рH в кислую сторону, ингибируя рост патогенных энтеробактерий [7, 8, 14].
Основная группа: 30 детей 3–14 лет с лямблиозом и сопутствующим дисбактериозом кишечника, получающие Мукофальк в комплексном лечении. Кишечный синдром проявлялся болями в животе, метеоризмом, 15 из 30 детей страдали синдромом диареи, 15 детей — запорами.
Контрольная группа: 60 детей 3–14 лет с лямблиозом и сопутствующим дисбактериозом кишечника, не получающие Мукофальк: 30 детей с синдромом диареи получали сорбенты, содержащие лигнин или смектит, 30 детей с запорами получали кремний- или лактулозосодержащие препараты.
По клиническому анализу крови анемия I–II степени выявлена у 30% наблюдаемых детей, повышенное СОЭ у 6,6%, увеличение в лейкоформуле эозинофилов у 30%, моноцитов — у 40% детей соответственно.
При копрологическом исследовании фекалий слизь наблюдали у 40% всех пациентов, количество лейкоцитов до 5–15 в поле зрения — у 26,6%, нейтральный жир — у 30%, жирные кислоты — у 20%, крахмал — у 43,3%, дрожжевые клетки — у 66,6% пациентов. В ряде случаев определяли повышенное содержание углеводов в кале.
Дефицит облигатной микрофлоры наблюдали у 60% детей основной и 58,3% детей контрольной групп. У детей 3–6 лет дисбактериоз кишечника был обусловлен условно-патогенными бактериями преимущественно одного-двух, редко трех видов, у детей старше 6 лет и подростков регистрировали в основном дефицитный дисбактериоз кишечника. Но во всех возрастных группах наблюдали тенденцию к росту клебсиелл, стафилококка, гемолитических эшерихий и грибов рода Candida (табл. 1).
Способ применения и дозы: дети 3–6 лет получали Мукофальк в дозе 1/4 пакета 2–3 раза в день, 6–12 лет 1/2 пакета 2–3 раза в день, старше 12 лет 1 пакет 2–3 раза в день. При запорах препарат рекомендовался предпочтительно между приемами пищи с достаточным количеством жидкости, при диарейном синдроме — предпочтительно с приемом пищи. После купирования кишечного синдрома Мукофальк был рекомендован 1 раз в день с пребиотической целью в течение 2–4 недель параллельно со следующими этапами лечения лямблиоза.
Критериями оценки эффективности были:
1) клиническая эффективность при кишечном синдроме;
2) лабораторная эффективность: клинические анализы (крови, мочи, исследование кала на копрограмму, простейшие), бактериологические анализы кала на дисбактериоз.
На фоне терапии Мукофальком ни у одного ребенка не было аллергических реакций и побочных явлений в виде усиления метеоризма, запоров или диареи. При неэффективности Мукофалька при запорах у детей назначение было увеличено на одну рекомендуемую нами дозу (1 прием).
После проведенного курса лечения у детей с диарейным синдромом основной и контрольной групп жалобы на жидкий стул, боли в животе и метеоризм купированы: в основной группе, получающей Мукофальк, у 13 из 15 больных (86,6%), в контрольной группе — у 22 из 30 больных (73,3%).
У детей же с синдромом запора после лечения жалобы на задержку стула, плотные каловые массы, боли в животе и метеоризм купированы в основной группе, получающей Мукофальк, у 14 из 15 детей, что составило 93,3% наблюдений и было достоверно выше (р
Е. Е. Хасанова, кандидат медицинских наук
ГАУЗ РКИБ им. проф. А. Ф. Агафонова Минздрава Республики Татарстан, Казань
- КЛЮЧЕВЫЕ СЛОВА: микст-инфекции, дисбактериоз кишечника, лямблиоз, нифурател
Проблема микст-инфекционных поражений кишечника в современной гастроэнтерологии весьма актуальна. Клиницистам и врачам-лаборантам приходится решать трудные задачи при диагностике и лечении заболеваний, обусловленных одновременно Helicobacter pylori (гастрит, язвенная болезнь, новообразования желудка и др.), Lamblia (астенический, аллергический и диспепсический синдромы) и другими оппортунистическими микроорганизмами, участвующими в дисбиотических состояниях кишечника, – условно-патогенными микроорганизмами родов Candida, Escherichia, Klebsiella, Proteus, Citrobacter, Staphylococcus aureus и др. (синдром раздраженного кишечника, иммунодефицитный и аллергический синдромы).
С 1981 г. Всемирной организацией здравоохранения возбудители рода Lamblia отнесены к безусловно патогенным кишечным простейшим [1]. Синдром дисбактериоза кишечника диагностируют у значительной части больных, обратившихся за помощью в лечебно-профилактические учреждения.
На этапе разработки тактики лечения остро стоит проблема выбора антимикробного препарата, действие которого было бы направлено против всех участников инфекционного процесса [2–4]. В этой связи актуально изучение препарата нифурател (Макмирор) – средства, характеризующегося широким спектром активности против возбудителей инфекционных поражений желудочно-кишечного тракта (в том числе бактериальных и простейших). Макмирор является препаратом стартовой терапии в лечении лямблиоза по протоколу, утвержденному на ХХ съезде детских гастроэнтерологов России и стран СНГ.
Материалы и методы исследования
В рамках ретроспективного исследования оценивали эффективность нифуратела (Макмирор) в лечении интестинального лямблиоза, ассоциированного с дисбиозом кишечника, у 42 пациентов (26 женщин и 18 мужчин), наблюдавшихся в консультативно-диагностическом отделении микологической клиники Санкт-Петербургской медицинской академии последипломного образования (СПбМАПО) в 2009–2010 гг., были проанализированы амбулаторные карты пациентов в возрасте от 18 до 65 лет (средний возраст 32 ± 4 года).
В исследование не включали данные амбулаторных карт пациентов, страдавших сахарным диабетом 1 и 2 типов и онкологическими заболеваниями, а также получавших одновременно другие антимикробные и/или глюкокортикостероидные препараты.
Все пациенты с микст-инфекционным поражением кишечника отмечали симптомы раздражения кишечника, а также астенический и аллергический синдромы (с различной частотой). Симптомы раздражения кишечника (чаще неоформленный кашицеобразный стул, чередующийся с запором, вздутие живота, абдоминальный болевой синдром) отмечали 27 (64%) пациентов, астенический синдром (слабость, утомляемость, снижение аппетита) – 19 (45%) больных, аллергические заболевания в фазе обострения (крапивница или атопический дерматит) – 11 (26%) пациентов.
Диагноз лямблиоза и контроль излеченности этой инфекции основывались на результатах лабораторного паразитологического исследования кала с использованием методов обогащения – формалин-эфирное осаждение и флотация (проводились в клинической лаборатории НИИ медицинской микологии СПбМАПО). Диагноз устанавливали при обнаружении вегетативных форм и/или цист простейших с указанием числа паразитов в поле зрения. Излеченность лямблиоза подтверждали двукратным исследованием кала с промежутком 5–7 дней. Серологические методы диагностики и контроля излеченности лямблиоза не применяли.
Дисбиоз кишечника выявляли с помощью стандартных бактериологических методов исследования кала, разработанных Р.В. Эпштейн-Литвак и Ф.В. Вильшанской, с определением числа КОЕ в 1 г фекалий в пересчете на десятичный логарифм. Избыточным считали рост оппортунистической микробиоты кишечника при значениях ≥ 10 000 КОЕ/г кала. Одновременно с контрольным исследованием кала на простейшие проводили контрольный анализ кала на дисбактериоз.
С обнаружением лямблий выявили избыточный рост в кале условно-патогенной кишечной палочки (гемолитической, лактозонегативной) – у 17 пациентов, грибов рода Candida – у 13, Citrobacter – у 11, Klebsiella – у 10, Proteus – у 6, S. aureus – у 5, другие – у 5. Контроль излеченности проводили в той же лаборатории (бактериологическая лаборатория микологической клиники).
Макмирор назначали по 400 мг (по 2 таблетки) 3 раза в день курсами по 7 дней (всего на курс 40 таблеток, или суммарно 8 г нифуратела). Одновременно всем пациентам было рекомендовано ограничить прием жирной и жареной пищи и полностью исключить прием алкогольных напитков. Большинство пациентов вместе с нифурателом получали пробиотики или пребиотики. Согласно принципам Хельсинкской декларации все пациенты получали полную информацию о назначенном лечении и свойствах применяемых лекарственных средств. Частоту и характер побочных эффектов терапии нифурателом (Макмирор) оценивали клинически (опрос, объективный осмотр во время второго визита). Статистическую обработку полученных данных проводили с использованием пакета программ SPSS, 12-я версия. Применяли параметрические и непараметрические методы сравнения исходя из характера распределения числовых данных. Частотные характеристики качественных переменных сравнивали с помощью таблиц сопряженности. Изучали корреляционную зависимость между признаками. Значимыми считали различия при р E. coli, Citrobacter spp. и Klebsiella spp. Согласно результатам анализа нифурател можно считать препаратом выбора при сочетании лямблиоза с бактериальным дисбактериозом кишечника и хеликобактериозом пищеварительного тракта.
В то же время эффективность нифуратела при лечении кандидозного, протейного и стафилококкового дисбиоза оказалась существенно ниже: применение нифуратела по 800 мг/сут в течение 7 дней привело к санации кишечника от дрожжеподобных грибов у 6 из 21 пациента, протея – только у 3 из 9, а золотистого стафилококка – у 5 из 8 больных. Возможно, это связано со спецификой возбудителей подобных дисбиозов. Известна широкая распространенность резистентности Candida spp., Proteus spp. и S. aureus ко многим антимикробным препаратам. Видимо, при лечении этих вариантов дисбиоза кишечника требуются либо пролонгированные курсы приема нифуратела, либо применение других энтеросептиков.
На основании проведенного исследования были сделаны следующие выводы.
1. Эффективность нифуратела (Макмирор) при лечении лямблиоза у взрослых по результатам двойных контрольных проб фекалий достигает 95%.
2. Эффективность нифуратела (Макмирор) при коррекции синдрома дисбактериоза у взрослых достигает 100%.
3. Макмирор может быть рекомендован как средство выбора с хорошим профилем безопасности при интестинальном лямблиозе, ассоциированном с дисбактериозом кишечника.
Читайте также:


