Цефтриаксон при кишечной палочке в моче


Антибиотик БИОХИМИК Цефотаксим применяла при тяжёлом цистите, когда бактерии кишечной палочки (Escherichia Coli) 10^7. Отзыв с подробностями моего лечения. Фото
Приветствую всех!
Снова о лекарственном средстве, угораздило меня заболеть острым циститом, да так сильно, что была в отчаянии. Как это случилось просто не понимаю, в грязной или холодной воде не купалась. Про особенности женской гигиены прекрасно осведомлена. Единственное, грешу на больничную инфекцию, так как накануне лежала в гинекологии.
Итак, появились неприятные симптомы, учащенное мочеиспускание, потом уже с болью в конце и ужасным неудобством, кроме того были тянущие в области поясницы. И что вы думаете? Не пошла я к врачу. Решила — сама подлечусь. Откопала в аптечке 5-Нок и травы мочегонные противомикробные и давай всё это принимать. Через 5 дней всё прошло, показалось, что здорова и бросила принимать лекарство.
Через два дня все симптомы вернулись с новой силой — это был сущий ад. Не помогало уже ничего, подключила водяную грелку, но и этого оказалось мало. Ночью спать стало невозможно, позывы были 1 раз в 10 минут, ходила в туалет с закрытыми глазами.
Пришлось сдаваться урологу, лечилась в г.Брянске в поликлинике №4 Советского района, взяла электронный талон на утренние часы и пошла сдаваться. Описала все симптомы и получила назначение антибиотиков Супракс Салютаб, принимать нужно было неделю, только довести лечение до конца не получилось, проявился побочный эффект в виде боли в эпигастрии.
Сдала анализ мочи на посев, нашли:
- Бактерии кишечной палочки (Escherichia Coli) 10^7.
- В общем анализе мочи — белок 0,27 при норме не больше 0.14 г/л
- Лейкоциты 892.4, нормальное значение до 11.4.
Если кому интересно смотрите, там всё видно,фото результатов анализов:
После того как бросила таблетки пошла за новым назначением, врач, выслушав мои жалобы, предложил антибиотик БИОХИМИК Цефотаксим в уколах 2 раза в день, а также Брусники листья и Фитонефрол. Я с радостью согласилась.


Когда пошла приобретать лекарство, фармацевт в аптеке Метр, предложила покупать для разведения не только воду, но и Ледокаин, потому как без обезболивающего антибиотик доставляет невероятные ощущения.
Я не пожалела о дополнительных тратах, так как знаю, что такое антибиотик без Ледокаина, после такого мероприятия таскала как-то ногу в прямом смысле, она просто переставала слушаться.
После первого посещения медсестры, я узнала что на одну процедуру необходимо 2 иголки. Сначала протыкают серую крышку Цефотаксима, разводят все компоненты между собой, набирают шприц и вставляют новую иглу для укола.
В платном отдавала за внутримышечную инъекцию 150 рублей. Но уровень подготовки чувствуется, уколы даже не замечаешь, как это уже произошло. Утром ставила в левую часть, вечером — в правую. Угадайте где были шишки по итогу?
Я убедилась на собственном опыте, болезненные уплотнения — заслуга не антибиотика, а определённо медсестры, которая делает уколы. От её техники, тяжести руки.
Что касается облегчения от цистита, то оно наступило уже на третий день, то есть, я себя уже почувствовала полностью здоровой. Уколы доделала до конца. Отток урины просто волшебный, я уже забыла что такое нормальное, полноводное мочеиспускание.
Не всё было так радужно с этим Цефотаксимом оказалось, на пятый день на пальцах рук появились водяные прыщики, я сразу подключила антигистаминный препарат Лоратадин.
Вывод: В целом Цефотаксим очень эффективный, но рекомендую делать с Ледокаином и выбирать грамотную медсестру, чтобы потом шишки не лечить. В аптеке не забудьте брать иголки с расчётом на 1 укол- 2 шт., ну и перчатки конечно. Если собираетесь делать в платном, то расходные материалы у них свои обычно.
В прессе все чаще говорят о скором кошмарном будущем, где можно будет погибнуть от безобидного пореза: все лекарства окажутся бессильны против даже самой простой инфекции. Апокалиптические сценарии еще далеки от реальности, но проблема антибиотикорезистентности – устойчивости бактерий к лекарствам – с каждым годом становится все острее.
На прошедшей неделе в Давосе британский министр здравоохранения Мэтт Хэнкок призвал "предотвратить ужасное будущее", в котором люди окажутся беззащитны перед бактериями с множественной лекарственной устойчивостью (их иногда называют "супербактериями" или "супермикробами").
Представляя свой план борьбы, Хэнкок сравнил масштаб проблемы антибиотикорезистентности с войнами и изменением климата. Похожими формулировками оперирует Всемирная организация здравоохранения (ВОЗ) и специалисты по всему миру.
Настоящее Время разобралось для вас в антибиотиках и супербактериях.
Насколько все плохо?
Ситуация пока не критическая, но очень серьезная. Бактерии научились противостоять даже самым сильным и редко применяемым лекарствам ("антибиотикам резерва", таким, как колистин), при этом с 1980-х годов принципиально новых антибиотиков практически не появлялось. Исследования идут, но они слишком долгие и дорогие – а бактерии вырабатывают неуязвимость против антибиотиков куда быстрее. Дело осложняется и простотой путешествий: супербактерии получают возможность легко распространяться по всему миру.
Авторы британского исследования антибиотикорезистентности (2016 год) оценивали, что количество смертей от таких супербактерий в мире может вырасти примерно с 700 тысяч в год до 10 млн ежегодно к 2050 году – это больше, чем число жертв онкозаболеваний (на момент публикации). Потери ВВП при таком сценарии достигнут 100 триллионов долларов.
Пока не существует систем, позволяющих полноценно отслеживать мировую ситуацию с антибиотикорезистентностью в мировом масштабе. Проект ВОЗ под названием GLASS стартовал в 2015 году и по состоянию на конец 2018 года включал в себя лишь 71 страну. В последний отчет (опубликован в январе 2019 года) вошли данные об антибиотикорезистентности всего из 49 стран, при этом их качество пока не позволяет сравнивать между собой ситуацию в различных государствах и регионах.
В региональных отчетах также не много поводов для оптимизма. Страны Евросоюза за восемь лет (2007-2015) зафиксировали более чем двукратный рост числа погибших от инфекций, вызванных неуязвимыми для антибиотиков микробами, говорится в недавнем исследовании. По количеству потерянных лет здоровой жизни в пересчете на 100 тысяч населения (170) подобные инфекции практически сравнялись с суммарным эффектом ВИЧ, гриппа и туберкулеза (183). Более всего таким инфекциям в ЕС подвержены дети до года и люди старше 65 лет.
Хотя в еще одной свежей публикации крупный госпиталь Марселя показал, что за 15 лет (2001-2016) у них ситуация с резистентностью к антибиотикам не ухудшилась. К тому же, судя по мировой прессе, пока неуязвимые к абсолютно всем антибиотикам инфекции все же не носят массовый характер: громче всего обсуждали отчет двухлетней давности о 70-летней американке, погибшей от неуязвимой для всех антибиотиков бактерии (ее она скорее всего подхватила в Индии, где попала в больницу с переломом).
Какие именно организмы называют супербактериями?
Супербактерии (супермикробы) – это микроорганизмы, обладающие устойчивостью сразу к нескольким антибиотикам. Иногда – ко всем существующим.
В 2017 году ВОЗ опубликовала список из 12 бактерий, для борьбы с которыми срочно нужны новые антибиотики. Критически важны лекарства, способные справиться с устойчивыми к карбапенему энтеробактериями (например, кишечной палочкой E.Coli), синегнойной палочкой (Pseudomonas aeruginosa) и ацинетобактером (Acinetobacter baumannii). Чаще всего именно эти возбудители вызывают так называемые "внутрибольничные инфекции", с которыми врачам особенно сложно бороться из-за множественной устойчивости бактерий и ухудшенного состояния больных.
Также в список ВОЗ попали ванкомицин-резистентные энтерококки (Enterococcus faecium), невосприимчивый к метициллину и ванкомицину золотистый стафилококк (methicillin-resistant staphylococcus aureus, MRSA), цефалоспорин- и фторхинолон-резистентный гонококк, кларитромицин-резистентный хеликобактер и другие бактерии. Они вызывают серьезные болезни: заражение крови, менингит, пневмонию, инфекции мочевыводящих путей и гонорею.
Часто в материалах об антибиотиках фигурируют понятия “грамположительные бактерии” и “грамотрицательные бактерии”. Последние (например, кишечная палочка) обладают двумя клеточными мембранами: с ними сложнее бороться, и эффективных против них антибиотиков в мире меньше.
Как действуют антибиотики и появляется резистентность?
Антибиотики или "противомикробные препараты" – особые вещества, останавливающие рост клеток бактерий или уничтожающие их. Для этого существуют несколько механизмов: как правило антибиотики атакуют клеточную стенку, мешают синтезу белка или ДНК бактерий.
Резистентность к антибиотикам обнаружили вскоре после их появления. Первый в мире антибиотик – перевернувший медицину ХХ века пенициллин – Александр Флеминг открыл в 1928 году, но массово применять его начали лишь в 1942-м. Еще до этого, в 1940-м стало известно об устойчивой к пенициллину кишечной палочке.
Бактерии постоянно меняются, чтобы стать невосприимчивыми к действию антибиотиков: "выгодные" мутации передаются бактериями друг другу. Микробы приспосабливаются к антибиотикам даже в огромной концентрации крайне быстро. Посмотрите на видео, как всего за 11 дней кишечная палочка адаптируется к тысячекратной дозе (в центре) антибиотика:
Главными "инкубаторами" супербактерий оказываются больницы: там, где постоянно применяются мощные антибиотики, растут популяции невосприимчивых к ним микробов. Способствует развитию устойчивости бактерий и сельское хозяйство: там антибиотики широко применяют для профилактики болезней и ускорения роста животных.
Смертельна ли встреча с супербактерией?
Для здорового человека с нормальным иммунитетом – нет. Но чаще всего такие микробы встречаются в больницах, куда попадают люди, уже ослабленные той или иной болезнью. Для пациентов (например, находящихся на искусственной вентиляции легких) встреча с супербактериями может запросто стать фатальной.
Сейчас без антибиотиков невозможны сложные хирургические операции, трансплантации и борьба с раком посредством химиотерапии. Последняя обычно значительно подавляет иммунитет: для таких больных даже самая обычная инфекция может стать смертельной, не говоря уже о вызванной супермикробами.
При этом с инфекциями от мультирезистентных бактерий, пока на них действуют хоть какие-то антибиотики, можно жить, пусть даже это и будет сопряжено со страданиями.
Эмили Моррис рассказала, что супербактерию в ее мочевом пузыре обнаружили в подростковом возрасте и с тех пор ей пришлось перепробовать множество антибиотиков, в том числе "препараты резерва", вроде карбапенема.
Во время беременности она была вынуждена принимать антибиотик, не проверявшийся на беременных, ее новорожденному ребенку пришлось сразу пройти курс терапии антибиотиками. "Это было очень страшно", – рассказывала 24-летняя Моррис журналу New Scientist в 2017 году.
32-летняя Кэтрин Уильямс уже более 10 лет постоянно принимает антибиотики из-за болезни мочевыводящих путей, вызванной супербактериями.
"Каждый раз, когда заканчивается курс приема антибиотиков, болезнь возвращается, – говорила она в интервью BBC. – Боль просто приковывает тебя к постели до следующего курса приема антибиотиков. То, что мне придется принимать антибиотики всю жизнь, меня очень пугает".
Что в России и других постсоветских странах?
В России и других постсоветских странах – например, Украине, Казахстане, Беларуси – антибиотики долго продавались без рецепта. Это вело к злоупотреблениям и самолечению, а в итоге – способствовало развитию резистентности у бактерий.
В октябре 2017 года в России приняли "Стратегию предупреждения распространения антимикробной резистентности". Документ, подписанный главой правительства Дмитрием Медведевым, предусматривает два главных этапа:
- До 2020 года население будут информировать о правильном использовании антибиотиков, работать над лучшим выявлением резистентности и определении базовых показателей, как оценивать ее распространенность.
- На втором этапе (до 2030 года) планируется снизить число случаев болезней, связанных с супербактериями.
Почему так долго не появляются новые антибиотики?
За последние десятилетия арсенал медиков практически не пополнялся антибиотиками принципиально новых классов. Причин тому несколько.
Разработка таких лекарств – это сложное и затратное занятие, обходящееся в сотни миллионов или миллиарды долларов. Для фармакологических компаний оно не всегда интересно с коммерческой точки зрения: курсы антибиотиков обычно краткосрочны, в отличие от лекарств для хронических заболеваний (антиретровирусная терапия, например, людям с ВИЧ необходима всю жизнь). К тому же из-за быстрого возникновения резистентности растет риск обесценивания инвестиций в разработку новых препаратов.
Тем не менее, в последнее время вошли в обиход мощные антибиотики, полученные на базе старых открытий – в первую очередь, Линезолид (Зивокс). Да и представители существующих классов все время совершенствуются и нередко могут усиливать эффект при совместном использовании.
Что делать?
ВОЗ рекомендует использовать антибиотики только по назначению врача (а врачам – их разумно назначать) и всегда полностью проходить курс лечения, а не останавливать прием антибиотиков сразу после улучшения самочувствия.
Также рекомендуется не хранить, не использовать заново и не передавать другим оставшиеся дозы лекарства.
Важно не пытаться лечить вирусные заболевания антибиотиками, вакцинироваться, укреплять собственный иммунитет и тщательно соблюдать правила гигиены, рекомендует ВОЗ.
Также есть смысл по возможности избегать больниц в регионах, где санитарная ситуация далека от идеальной. В первую очередь – в Азии и Африке. По данным британского отчета, там к 2050 году будет больше всего погибших от инфекций супербактериями.
Если у вас или у близких есть подозрение на такую инфекцию, добейтесь консультации специалиста по инфекционным болезням. Недавнее исследование показало, что это может на 50% снизить смертность от инфекций, вызванных бактериями с множественной лекарственной устойчивостью.
Чего ждать в будущем?
Проблемой невосприимчивости к антибиотикам годами занимаются ученые и специалисты в области охраны общественного здоровья, и поводы для оптимизма есть.
ВОЗ в 2015 году одобрила глобальный план по борьбе с устойчивостью к противомикробным препаратам. Различные страны – в том числе США, Россия и совсем недавно Великобритания – принимают собственные комплексы мер по борьбе с устойчивостью бактерий к антибиотикам. Обычно они включают информирование пациентов и врачей о разумном использовании препаратов, ограничения на применение антибиотиков в сельском хозяйстве и содействие разработкам новых классов антибиотиков.
Несмотря на все сложности, такие разработки уже идут и появляются отдельные многообещающие результаты. Например, теиксобактин – принципиально новый антибиотик, открытый в 2015 году группой ученых из США, Германии и Великобритании.
В конце 2017 года его научились эффективно синтезировать, а в 2018-м действие синтетического теиксобактина успешно проверили на мышах. Но до появления лекарства для людей еще далеко: по оценкам ученых, 6-10 лет.
Оно может и вовсе не появиться: например, многообещающий платенсимицин, представленный в 2006 году, так и не добрался до полноценных клинических тестов из-за его неэффективности при введении стандартными методами. Однако исследования принципов работы платенсимицина позволяют надеяться на появление новых, более эффективных разработок.
В начале 2018 года ученые Рокфеллеровского университета в США представили еще один принципиально новый класс антибиотиков – малацидины, но до появления лекарств на их основе понадобится еще больше времени.
Рассматриваются и другие варианты терапии против супербактерий: целенаправленное усиление иммунитета, антимикробные пептиды, синтетические вещества, позаимствованные у вирусов, добавление особых элементов к уже существующим антибиотикам для повышения эффективности и другие способы. Однако все они пока находятся на разных стадиях готовности и для массового клинического использования не одобрены.
МОСКВА, 7 мая — РИА Новости, Альфия Еникеева. Супербактерии, устойчивые к антибиотикам, — одна из главных проблем современной медицины. Возбудители гонореи, стафилококка, пневмококка мутировали, и теперь непонятно, как с ними бороться. Согласно прогнозам, особо стойкие инфекции угрожают миллионам жизней, поэтому перед наукой поставлена задача — разработать более мощные средства борьбы, а также альтернативу антибиотикам.

Обычная бактерия кишечной палочки Escherichia coli всего за 11 дней приспособилась к тысячекратной дозе антибиотиков. Видео, снятое в ходе эксперимента учеными Гарвардской медицинской школы, показывает, как постепенное увеличение концентрации препарата превращает ее в супермикроб, неуязвимый для любых лекарств.
Вырабатывать антибиотики и уметь им сопротивляться — естественная стратегия выживания в мире бактерий. Но в природе стойкие к антибиотикам штаммы оказывались в проигрыше, поскольку размножались медленнее "диких" бактерий.
В начале XX века Александр Флеминг открыл антибактериальные свойства пенициллина, и с 1950-х годов антибиотики производятся в промышленных масштабах для медицины и животноводства. Так люди неожиданно помогли мутировавшим штаммам микробов победить в эволюционной борьбе и подставили себя под удар. В 2017 году Всемирная организация здравоохранения (ВОЗ) объявила о наступлении "постантибиотиковой эры" и обнародовала список особо стойких инфекций.
Откуда берутся супербактерии
Антибиотики действуют на наименее устойчивые бактерии, а вот мутировавшие держатся до последнего. И если с ними не бороться, они передают ген устойчивости при размножении. Кроме того, бактерии обмениваются мутациями.
Такой супермикроб вырабатывает ферменты, разлагающие антибиотик. Его клеточная мембрана, по которой раньше лекарства наносили сокрушительный удар, теперь неуязвима. Некоторые супербактерии умеют обманывать антибиотики, выстраивая вокруг себя слой белков, мимикрирующих под рибосомы — внутриклеточные белковые фабрики. Препарат их уничтожает, настоящие же рибосомы продолжают функционировать, а бактерия — жить.
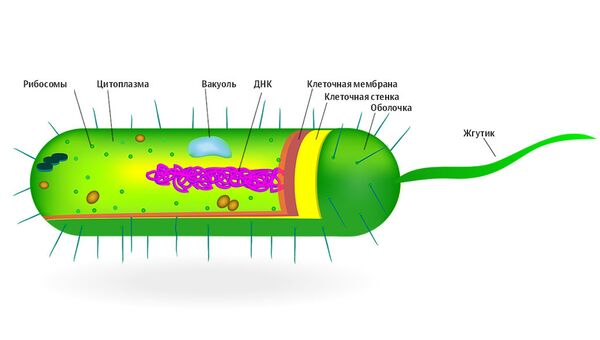
Три смертельно опасных мутанта
Из-за быстрой приспособляемости к антибиотикам супербактерии опаснее для человечества, чем климатические изменения или загрязнение окружающей среды. Уже сегодня, по данным ВОЗ, в мире от заболеваний, вызванных этими микробами, умирает примерно 800 тысяч человек в год. А к 2050-му, по прогнозам специалистов, суперинфекции ежегодно будут уносить до десяти миллионов жизней.
Три супербактерии признаны ВОЗ критически опасными для человека — они показали резистентность практически ко всем антибиотикам, даже к так называемым препаратам последнего резерва, колистину и бета-лактамным антибиотикам широкого спектра. Это акинетобактерия Баумана, приводящая к пневмонии и инфекциям крови, синегнойная палочка, вызывающая кожную сыпь, ушные инфекции у здоровых людей, серьезные кровяные инфекции, пневмонии у пациентов в больницах, а также энтеробактерии, населяющие кишечник человека, в частности сальмонелла и кишечная палочка.
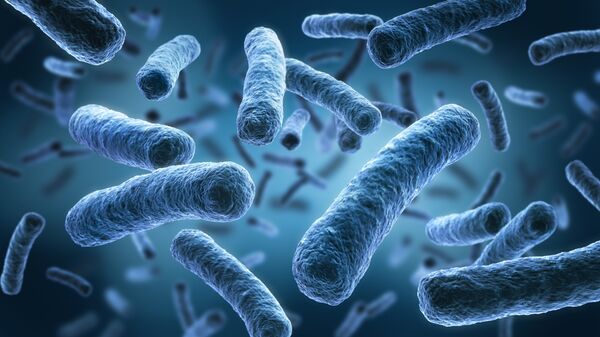
Сильно опасными ВОЗ считает более распространенные золотистый стафилококк (Staphylococcus aureus), пневмококк (Klebsiella pneumoniae) и гонококк (Neisseria gonorrhoeae), вызывающий гонорею. Кстати, первый случай супергонореи, от которой не помогают антибиотики, недавно зафиксировали в Великобритании. Пациент, чье имя не раскрывают, заразился инфекцией после полового контакта с жительницей Юго-Восточной Азии.
Ученые также опасаются супербактерии туберкулеза, поскольку почти половина штаммов этого патогена устойчива к изониазиду и другим средствам противотуберкулезной терапии. Шестнадцать процентов штаммов не поддаются воздействию ни одного из имеющихся антибиотиков. Такие суперустойчивые туберкулезные палочки выявлены в Индии и Ираке.
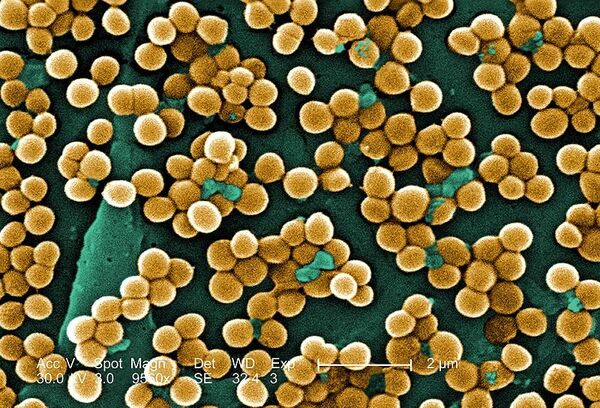
Суперантибиотики против супербактерий
Для борьбы с супербактериями ученые создают новые антибиотики либо модифицируют существующие под генетические изменения в конкретных микроорганизмах. Именно этот путь выбрали исследователи МГУ, разработавшие принципиально новый гибридный антибиотик — митохондриально направленный антиоксидант, воздействующий на мембранный потенциал, который обеспечивает бактериальные клетки энергией.
Другой перспективный препарат создан на основе теиксобактина — антибиотика, открытого в 2015 году в образцах почвы. Совсем недавно ученые успешно применили его синтетическую форму для лечения бактериальной инфекции у лабораторных мышей. Предполагается, что это лекарство поможет в борьбе с метициллин-резистентным стафилококком и энтерококком, устойчивым к ванкомицину.
Помимо антибиотиков, ученые разрабатывают и совершенно новые классы препаратов. Так, исследователи из российско-американской лаборатории биомедицинской химии ИХБФМ СО РАН создали аналоги нуклеиновых кислот — фосфорилгуанидины, умеющие проникать в клетку и вступать во взаимодействие с ДНК и РНК, уничтожая бактерию. Ученые отмечают, что в будущем такие вещества можно будет создавать под каждый конкретный патоген на основе анализа его генома.
Еще один точечный метод — бактериофаги, то есть вирусы, поражающие бактериальные клетки. Совсем недавно команда ученых из ИБХ РАН, ИТЭБ РАН и ИБФМ имени Г. К. Скрябина РАН научила фермент бактериофага Т5 разрушать клеточные стенки бактерии кишечной палочки даже с утолщенной из-за мутаций мембраной. Кроме того, исследователи выяснили, что фермент эффективнее уничтожает бактерии, когда ему помогает агент (например, хлоргексидин в очень низких концентрациях).
Эксперты все же считают, что с супербактериями лучше бороться с помощью антибиотиков. Но необходимо ограничивать их свободную продажу в аптеках и применение в сельском хозяйстве — иначе даже новые высокоэффективные препараты не помогут.
- КЛЮЧЕВЫЕ СЛОВА: инфекции, мочевые пути, беременность, прерывание, пиелонефрит, цистит, бактериурия, Монурал
Инфекции мочевых путей у беременных могут проявляться в виде бессимптомной бактериурии, неосложненных инфекций нижних мочевых путей (острый цистит, рецидивирующий цистит) и инфекций верхних мочевых путей (острый пиелонефрит).
Распространенность бессимптомной бактериурии в популяции беременных женщин в среднем составляет 6%. Острый цистит и острый пиелонефрит встречаются несколько реже – у 1-2,5%. Однако у 20-40% беременных с бессимптомной бактериурией во II и III триместре развивается острый пиелонефрит (13). Острый пиелонефрит развивается в III триместре в 60-75% случаев (7). Примерно у 1/3 больных, страдающих хроническим пиелонефритом, во время беременности развивается обострение (8).
Инфекции мочевых путей могут быть причиной ряда серьезных осложнений беременности и родов: анемия, гипертензия, преждевременные роды, преждевременное излитие околоплодных вод, рождение детей с низкой массой тела ( 3 патогенных микроорганизмов/мл в средней порции мочи при остром неосложненном цистите у женщин;
Бессимптомная бактериурия беременных – это микробиологический диагноз, который основывается на исследовании мочи, собранной с максимальным соблюдением стерильности и доставленной в лабораторию в предельно короткие сроки, что позволяет в наибольшей степени ограничить рост бактерий. Диагноз бессимптомной бактериурии может быть установлен при выявлении 10 5 КОЕ/мл (B-II) одного штамма бактерий в двух пробах мочи, взятых с промежутком более 24 часов при отсутствии клинических проявлений инфекций мочевых путей.
Учитывая высокую вероятность развития восходящей инфекции мочевых путей у беременных с бессимптомной бактериурией, возможность развития осложнений во время беременности с риском летального исхода для матери и плода, всем пациенткам показано проведение скринингового обследования и лечения бессимптомной бактериурии беременных. Алгоритм представлен на рисунке 2.
Клиническая симптоматика острого цистита у беременных проявляется дизурией, частыми императивными позывами к мочеиспусканию, болями над лоном. При проведении лабораторных исследований выявляется пиурия (10 и более лейкоцитов в 1 мкл центрифугированной мочи) и бактериурия: 10 2 КОЕ/мл для колиформных микроорганизмов и 10 5 КОЕ/мл для других уропатогенов.
При остром пиелонефрите появляются лихорадка, озноб, тошнота, рвота, боли в поясничной области. Сохраняется пиурия и бактериурия более 10 4 КОЕ/мл. При этом в 75% – поражается правая почка, в 10-15% – левая почка, в 10-15% имеет место двусторонний процесс (1).
Особое внимание следует уделять диагностике часто рецидивирующих циститов, так как они могут протекать на фоне урогенитальных инфекций, и в таких случаях ни в посеве мочи, ни в клиническом анализе мочи изменений может быть не выявлено. Таким больным необходимо проводить обследование, направленное на исключение инфекций, передающихся половым путем: соскоб из уретры на ИППП методом ПЦР, ИФА, при необходимости применение серологических методов диагностики.
Алгоритм диагностики инфекций мочевых путей у беременных представлен в таблице 2.
В выборе антимикробного препарата (АМП) для лечения ИМП беременных, кроме микробиологической активности, уровня резистентности, фармакокинетического профиля, доказанной эффективности препарата, мы должны учитывать его безопасность и переносимость.
Рациональное и эффективное применение антимикробных препаратов во время беременности предполагает выполнение следующих условий:
- необходимо использовать лекарственные средства (ЛС) только с установленной безопасностью при беременности, с известными путями метаболизма (критерии FDA);
- при назначении препаратов следует учитывать срок беременности: ранний или поздний. Поскольку срок окончательного завершения эмбриогенеза установить невозможно, то необходимо особенно тщательно подходить к назначению антимикробного препарата до 5 мес. беременности;
- в процессе лечения необходим тщательный контроль за состоянием матери и плода.
Если нет объективной информации, подтверждающей безопасность применения лекарственного средства, включая антимикробные препараты, при беременности или грудном вскармливании, назначать их данным категориям пациентов не следует.
Согласно Рекомендациям Европейской и Американской урологических ассоциаций 2007 г., для лечения неосложненных инфекций мочевых путей у беременных возможно применение следующих групп препаратов:
- аминопенициллины/BLI;
- цефалоспорины I-II-III поколения;
- фосфомицина трометамол.
Во всем мире широко пользуются следующими категориями риска применения ЛС при беременности, разработанными Американской администрацией по контролю за лекарствами и пищевыми продуктами – FDA (Food and Drug Administration):
- А – в результате адекватных, строго контролируемых исследований, не выявлено риска неблагоприятного действия на плод в I триместре беременности (и нет данных, свидетельствующих о подобном риске в последующих триместрах);
- B – изучение репродукции на животных не выявило риска неблагоприятного действия на плод, а адекватных и строго контролируемых исследований у беременных женщин не проведено;
- C – изучение репродукции на животных выявило неблагоприятное действие на плод, а адекватных и строго контролируемых исследований у беременных женщин не проведено, однако потенциальная польза, связанная с применением ЛС у беременных, может оправдывать его использование, несмотря на возможный риск;
- D – имеются доказательства риска неблагоприятного действия ЛС на плод человека, полученные при проведении исследований или на практике, однако потенциальная польза, связанная с применением ЛС у беременных, может оправдывать его использование несмотря на возможный риск.
Лечение бессимптомной бактериурии на ранних сроках беременности позволяет снизить риск развития острого пиелонефрита на поздних сроках с 28% до уровня менее 3% (9). Учитывая, что беременность является фактором риска развития осложненных инфекций, применение коротких курсов антимикробной терапии для лечения бессимптомной бактериурии и острого цистита является неэффективным. Исключением является фосфомицина трометамол (Монурал) в стандартной дозировке 3 г однократно, так как в концентрациях, близких к среднему и максимальному уровню, Монурал приводит к гибели всех патогенов, вызывающих острый цистит в течение 5 часов, активность Монурала против E. coli превосходит активность норфлоксацина и ко-тримоксазола (4). Кроме того, концентрация препарата в моче в дозах, превышающих МПК, поддерживается в течение 24-80 часов.
Фосфомицин трометамол является идеальным препаратом первой линии в лечении острого цистита беременных. Он обладает необходимым спектром антимикробной активности, минимальной резистентностью первичных уропатогенов, резистентные клоны микробов повреждаются. Он преодолевает приобретенную резистентность к антибактериальным препаратам других групп, обладает бактерицидной активностью. По данным Zinner, при применении фосфомицина трометамола (n=153) 3 г однократно – показатель излеченности бессимптомной бактериурии через 1 месяц составлял 93%.
Таким образом, для лечения инфекций нижних мочевых путей и бессимптомной бактериурии у беременных показано применение монодозной терапии – фосфомицина трометамол в дозе 3 г; цефалоспоринов в течение 3 дней – цефуроксима аксетила 250-500 мг 2-3 р/сут, аминопенициллинов\ BLI в течение 7-10 дней (амоксициллина\клавуланата 375-625 мг 2-3 р/сут; нитрофуранов – нитрофурантоин 100 мг 4 р/сут – 7 дней (только II триместр).
В России проведено исследование по применению различных препаратов для лечения неосложненных инфекций нижних мочевых путей у беременных, данные представлены в таблице 4. При этом, частота неправильных назначений составляла 48% .
В таблице 5 представлены основные нежелательные явления при назначении ряда препаратов во время беременности.
При выявлении атипичных возбудителей (уреа-микоплазменной инфекции, хламидийной инфекции) у больных с часто рецидивирующим циститом, показано применение макролидов (джозамицина, азитромицина в стандартных дозировках) во II-III триместре беременности.
Больным острым пиелонефритом показана экстренная госпитализация. В комплекс лабораторно-диагностических методов необходимо включить: общий анализ мочи, крови, бактериологическое исследование мочи; УЗИ почек, мочевого пузыря. Проводить мониторинг жизненно важных функций. Краеугольным камнем лечения больных гестационным пиелонефритом является решение вопроса о необходимости дренирования мочевых путей и выборе метода дренирования.
Показанием к дренированию мочевых путей во время беременности является наличие у больной острого пиелонефрита на фоне нарушенной уродинамики.
Выбор метода дренирования мочевых путей во время беременности зависит от: причин нарушения уродинамики (МКБ, снижение тонуса мочевых путей, сдавление маткой, рефлюкс); сроков беременности; стадии пиелонефрита (серозный, гнойный).
В таблице 6 мы приводим методы дренирования мочевых путей в зависимости от стадии пиелонефрита.
Антибактериальная терапия проводится только парентерально с последующим контролем эффективности лечения через 48-72 часа. Впоследствии коррекция антибактериальной терапии осуществляется по результатам бактериологического исследования. Длительность терапии серозной стадии воспаления – 14 дней: 5 дней – парентерально, далее – переход на пероральный режим. К препаратам, разрешенным к применению у беременных для лечения острого пиелонефрита, относятся:
- Амоксициллин/клавуланат 1,2 г в/в 3-4 р/сут;
- Цефуроксим натрия 0,75-1,5 г в/в 3 р/сут;
- Цефтриаксон 1-2 г в/в 1 р/сут;
- Цефотаксим 1-2 г в/в 3-4 р/сут.
Преимущества применения амоксициллин/клавуланата заключаются в его высокой активности в отношении ключевого возбудителя ИМП – E.coli (уровень резистентности ниже, чем к фторхинолонам), препарат обладает доказанной эффективностью при неосложненных и осложненных инфекциях мочевых путей, а также является препаратом выбора при лечении инфекций мочевых путей у детей. Следует подчеркнуть, что амоксициллина/клавуланат не увеличивает риск возникновения врожденных аномалий и уродств, что делает возможным его применение в I триместре беременности.
Подобное исследование применения антимикробных препаратов проведено по поводу лечения больных острым пиелонефритом во время беременности и выявлено, что частота неправильных назначений антибактериальных препаратов составила 78%. Данные представлены в таблице 7.
В России выявлен высокий уровень резистентности кишечной палочки к ампициллину, амоксициллину и ко-тримоксазолу, в связи с чем применять эти препараты нецелесообразно. Данные по уровню резистентности кишечной палочки в России представлены в таблице 8.
В настоящее время инфекционные заболевания мочеполовой системы у женщин отличаются полиэтиологичностью, стертой клинической картиной, высокой частотой микст-инфекции и склонностью к рецидивированию, что требует комплексного подхода к диагностике и лечению. Решению проблемы антибактериальной терапии в акушерстве и гинекологии могут способствовать: создание государственных стандартов и строгое их соблюдение; создание экспертного совета по пересмотру стандартов; осознание врачами принципов доказательной медицины (1).
Читайте также:









