Продолжите фразу сероводород очень ядовит вызывает отравление
Класс: 9.
Познать истину – значит понять сущее.
Познать сущее нельзя извне, можно только изнутри.
Цели урока:
Планируемый результат:
- Знать: Строение, состав, свойства сероводорода, сульфидов.
- Уметь: доказывать свойства сероводорода, сульфидов записывать уравнения химических реакций в молекулярном, ионном и в окислительно-восстановительном виде.
УДД:
- познавательные: развитие умений сравнивать, анализировать, доказывать, составлять схемы на основе работы с текстом, быть способными решать следующие жизненно-практические задачи: умение давать оценку состояния окружающей среды
- регулятивные: развитие умения анализировать и отбирать необходимую информацию, умения готовить и делать сообщения, умения пользоваться Интернатом для поиска учебной информации;
- коммуникативные: развитие умений вести беседу, диалог, задавать вопросы.
Тип урока: комбинированный.
Метод: прогнозирование.
Формы организации работы учителя: обобщает и систематизирует знания учащихся, полученные в процессе работы, оценивает деятельность учащихся на уроке, организует беседу по инструктивной карте, по слайдам и опытам, создает проблемные ситуации.
Технология: КСО (работа в группах), ИКТ, работа с текстом, работа с ОЭР.
Оборудование:
- компьютер, экран, презентация, выполненная в программе Power Point с электронного диска, периодическая система химических элементов Д.И. Менделеева.
- Раздаточный материал (инструкционные карты).
- Оборудование: штатив с пробирками, реактивы: Na2S, Cu(NO3)2, Na2SO3, H2SO4.
План урока
- Мотивация (3 мин.)
- Актуализация знаний учащихся (5 мин.)
- Изучение нового материала (25 мин.)
- Закрепление (10 мин.)
- Домашнее задание (2 мин.)
Ход урока
Работа с презентацией и инструктивной картой.
Показ слайдов. Рассмотрите слайд 1.
Вопросы, подлежащие рассмотрению
Вопросы и задания
1
2
3
Состав, строение молекулы сероводорода
Составьте формулу сероводорода.
Определите степень окисления, валентности серы, вид химической связи, тип кристаллической решетки.
Н2S –2 (II), ковалентная, полярная, молекулярная кристаллическая решетка.
Составьте схему химической связи.
Нахождение в природе
В каком виде сероводород встречается в природе?
Назовите природные соединения сероводорода
Запишите формулы природных соединений сероводорода.
Физиологическое воздействие на живые организмы.
Укажите агрегатное состояние, цвет, запах.
«… Тогда услышал я (о, диво!) запах скверный,
Газ, бесцветный, с запахом тухлых яиц, ядовит, растворим в воде (в 1V H2O растворяется 3V H2S при н.у.); t пл. = –86°C; t кип. = –60°С.
Предложите способ получения сероводорода
Составьте уравнения реакции взаимодействия сульфида цинка и соляной кислоты.
ZnS + 2H + = Zn 2+ + H2S
Свойства сероводорода (сернистой кислоты)
Как изменяется сила кислот в ряду напряжения
Н2S → Н2Sе → Н2Тe.
Как изменяется цвет индикатора?
Какие свойства характерны для соединений, в которых элемент проявляет низшую степень окисления?
Используя, ряд электроотрицательности неметаллов составьте уравнения реакций.
Выпишите элементы, которые претендуют на роль окислителя, восстановителя?
Составьте уравнения реакции диссоциации сероводородной кислоты.
Рассмотрите взаимодействие кислоты с сульфатом меди.
Составьте уравнения реакций горения сероводорода в избытке и недостатке кислорода?
Рассмотрите данную реакцию с точки зрения электролитической диссоциации. Н2S = Н + + НS –
+ Н2S –2 + Сu +2 S +6 О4 –2 = реакция обмена
Сероводород горит голубоватым пламенем:
2Н2S –2 + 3О2 0 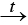
2S +4 O2 + 2H2O
Класс: 9.
Познать истину – значит понять сущее.
Познать сущее нельзя извне, можно только изнутри.
Цели урока:
Планируемый результат:
- Знать: Строение, состав, свойства сероводорода, сульфидов.
- Уметь: доказывать свойства сероводорода, сульфидов записывать уравнения химических реакций в молекулярном, ионном и в окислительно-восстановительном виде.
УДД:
- познавательные: развитие умений сравнивать, анализировать, доказывать, составлять схемы на основе работы с текстом, быть способными решать следующие жизненно-практические задачи: умение давать оценку состояния окружающей среды
- регулятивные: развитие умения анализировать и отбирать необходимую информацию, умения готовить и делать сообщения, умения пользоваться Интернатом для поиска учебной информации;
- коммуникативные: развитие умений вести беседу, диалог, задавать вопросы.
Тип урока: комбинированный.
Метод: прогнозирование.
Формы организации работы учителя: обобщает и систематизирует знания учащихся, полученные в процессе работы, оценивает деятельность учащихся на уроке, организует беседу по инструктивной карте, по слайдам и опытам, создает проблемные ситуации.
Технология: КСО (работа в группах), ИКТ, работа с текстом, работа с ОЭР.
Оборудование:
- компьютер, экран, презентация, выполненная в программе Power Point с электронного диска, периодическая система химических элементов Д.И. Менделеева.
- Раздаточный материал (инструкционные карты).
- Оборудование: штатив с пробирками, реактивы: Na2S, Cu(NO3)2, Na2SO3, H2SO4.
План урока
- Мотивация (3 мин.)
- Актуализация знаний учащихся (5 мин.)
- Изучение нового материала (25 мин.)
- Закрепление (10 мин.)
- Домашнее задание (2 мин.)
Ход урока
Работа с презентацией и инструктивной картой.
Показ слайдов. Рассмотрите слайд 1.
Вопросы, подлежащие рассмотрению
Вопросы и задания
1
2
3
Состав, строение молекулы сероводорода
Составьте формулу сероводорода.
Определите степень окисления, валентности серы, вид химической связи, тип кристаллической решетки.
Н2S –2 (II), ковалентная, полярная, молекулярная кристаллическая решетка.
Составьте схему химической связи.
Нахождение в природе
В каком виде сероводород встречается в природе?
Назовите природные соединения сероводорода
Запишите формулы природных соединений сероводорода.
Физиологическое воздействие на живые организмы.
Укажите агрегатное состояние, цвет, запах.
«… Тогда услышал я (о, диво!) запах скверный,
Газ, бесцветный, с запахом тухлых яиц, ядовит, растворим в воде (в 1V H2O растворяется 3V H2S при н.у.); t пл. = –86°C; t кип. = –60°С.
Предложите способ получения сероводорода
Составьте уравнения реакции взаимодействия сульфида цинка и соляной кислоты.
ZnS + 2H + = Zn 2+ + H2S
Свойства сероводорода (сернистой кислоты)
Как изменяется сила кислот в ряду напряжения
Н2S → Н2Sе → Н2Тe.
Как изменяется цвет индикатора?
Какие свойства характерны для соединений, в которых элемент проявляет низшую степень окисления?
Используя, ряд электроотрицательности неметаллов составьте уравнения реакций.
Выпишите элементы, которые претендуют на роль окислителя, восстановителя?
Составьте уравнения реакции диссоциации сероводородной кислоты.
Рассмотрите взаимодействие кислоты с сульфатом меди.
Составьте уравнения реакций горения сероводорода в избытке и недостатке кислорода?
Рассмотрите данную реакцию с точки зрения электролитической диссоциации. Н2S = Н + + НS –
+ Н2S –2 + Сu +2 S +6 О4 –2 = реакция обмена
Сероводород горит голубоватым пламенем:
2Н2S –2 + 3О2 0 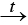
2S +4 O2 + 2H2O
Приобщение к культуре здорового образа жизни посредством исключения алкоголя, наркомании, табакокурения и других веществ, наносящих вред организму (душа, тело, разум).
Цель: Приобщение к культуре здорового образа жизни посредством исключения алкоголя, наркомании, табакокурения и других веществ, наносящих вред организму (душа, тело, разум).
Дать представление о том, что такое здоровый образ жизни;
Заставить учащихся задуматься о необходимости быть здоровым, приобщение к здоровому образу жизни;
Объяснить роль здоровья в жизни и деятельности человека, развитии общества.
Развитие навыков анализа, классификации, обобщения.
Коррекция воли через доказательное обобщение.
Организационное начало мероприятия:
Прежде чем вывести формулу здоровья, давайте уточним, что же такое здоровье?
Обучающиеся: предлагают ответы
Воспитатель: Здоровый человек:
Здоровым считали человека, у которого нет признаков болезни.
Здоровье - такое состояние организма, при котором функции его органов и систем уравновешены с внешней средой и отсутствуют какие-либо болезненные изменения. Здоровье — это не просто отсутствие болезней, это состояние физического, психического и социального благополучия.
Воспитатель: Итак, кто хорошо разбирается в вопросах здоровья.
Викторина (участвуют все присутствующие)
1. Согласны ли вы, что зарядка - источник бодрости и здоровья? (Да)
2. Верно ли, что жевательная резинка сохраняет зубы? (Нет)
3. Верно ли, что кактусы снимают излучение от компьютера? (Нет)
4. Верно ли, что от курения ежегодно погибает более 10000 человек? (Да)
5. Правда ли, что бананы поднимают настроение? (Да)
6. Верно ли, что морковь замедляет процесс старения организма? (Да)
7. Правда ли, что есть безвредные наркотики? (Нет)
8. Отказаться от курения легко? (Нет)
9. Правда ли, что молоко полезнее йогурта? (Нет)
10. Взрослые чаще, чем дети, ломают ноги? (Да)
11. Правда ли, что недостаток солнца вызывает депрессию? (Да)
12. Правда ли, что летом можно запастись витаминами на целый год? (Нет)
13. Правда ли, что детям до 15 лет нельзя заниматься тяжелой атлетикой? (Да)
14. Правда ли, что ежедневно надо выпивать 2 стакана молока? (Да)
15. Правда ли, что ребенку достаточно спать ночью 5 часов? (Нет)
Воспитатель: Разминка, физнагрузка, зарядка, одним словом - активный образ жизни! способствует укреплению здоровья или нет? (Да)
Здоровье - не только личное дело каждого человека. Здоровый человек живет полноценной жизнью и приносит большую пользу обществу.
Стихотворение (Абдурахманов Эрнэст)
Здоровый образ жизни - это система поведения человека, включая физическую культуру, творческую активность; высоконравственное отношение к окружающим людям, обществу и природе. Малыши копируют взрослых, для подростков важно мнение сверстников. Но влияние окружающих может быть не только положительным, но и отрицательным. К сожалению, физический, психический, моральный и экономический ущерб человеку и обществу наносят пьянство, алкоголизм, наркомания и такая вредная привычка, как курение. Все эти пороки, к несчастью, сегодня широко распространены среди молодежи. Молодые люди порой и не осознают, какой вред может нанести это их здоровью.
Вы знаете, что курильщиками, алкоголиками и наркоманами люди не рождаются, они ими становятся.
Воспитатель: Какое влияние на организм человека оказывает курение?
Стихотворение (Рустемов Али)
Колумб Америку открыл -
Великий был моряк!
Но заодно он научил
Весь мир курить табак.
От трубки мира, у костра,
Раскуренной с вождём,
Привычка вредная пошла,
В масштабе мировом.
Колумб, который Христофор,
Не ведал, что творил.
Немало утекло с тех пор,
В дым сизый наших сил
Табак завез он к нам давно,
И все мы здесь отравлены.
Мы погибаем от него,
Совсем им одурманены.
Куда ни глянь – везде табак.
Как от него избавиться?
Не стану ни за что курить,
Мне это так не нравится!
Так что же такое табак и почему же он так вреден? Для того, чтобы ответить на этот вопрос нам нужно знать, что же содержится в одном грамме табака.
-Синильная кислота (цианид) – ядовитая кислота, используется в химической промышленности.
-Сероводород- газ, с запахом тухлых яиц, образуется при разложении, гниении белковых веществ.
-Табачный деготь- вязкая жидкость черного цвета, образуется при разложении, гниении растений без доступа воздуха.
- Формальдегид- ядовитый газ с резким запахом, применяют в производстве фенолоформальдегидных смол. - Угарный газ (оксид углерода) – ядовитый, удушливый газ, образуется при горении.
-Никотин – сильный яд, при курении всасывается в организм, в малых дозах вызывает возбуждение; в больших дозах – вызывает паралич (остановку дыхания, остановку сердца). Многократное поглощение никотина вызывает никотивизм (хроническое отравление организма никотином).
А сейчас я предлагаю вам посмотреть одну сценку, которую приготовили вам ребята.
Сценка о вреде курения
Самый главный вред от курения. Никотин вызывает сужение кровеносных сосудов миокарда – мышечного слоя сердца. В результате миокард не получает нужное количество кислорода. При длительном дефиците кислорода у человека наступает ишемическая болезнь.
Сценка о вреде курения
Я — Никотин, табачный яд.
Всем-всем курильщикам я рад!
Я сокращаю жизнь людей
На много лет и много дней!
Точу здоровье изнутри,
И жертвы здесь сейчас мои
Напомнить о себе пришли!
Эй, расступись, честной народ,
Беда курильщика идет!
(Выходят участники в костюмах с табличками, на которых написаны названия органов.)
Сердце: (Карпенко Маша)
Я — сердце, вредный дым уносит
Мое здоровье — это факт!
От табака мой ритм все чаще,
Грозит мне каждый день инфаркт!
Он наползает отовсюду,
Дым уберите, мне так худо!
Легкие: ( Яковенко Кирилл)
Нам, легким, тяжек этот дух!
За нас обидно нам до слез!
Раз куришь — жди туберкулез!
От дыма сажа — легким враг,
Ведь от нее бывает рак!
Мозг: (Муртазаева Диана)
Я — головной центральный мозг.
Табак беду и мне принес:
Кровь еле-еле поступает,
Мне кислорода не хватает!
И сужаются сосуды.
Ох, от никотина худо!
Пищеварительная система: (Болотов Стас)
Я — за пищеварение отвечаю.
Я от никотина первая страдаю:
Зубы медленно желтеют,
Слюнные железы болеют —
Курильщик же слюну глотает,
И яд в желудок попадает,
Где он, конечно, язву,
Никотин: Вот какой я молодец!
Приближаю ваш конец!
Воспитатель: Теперь и дети понимают,
Как наши органы страдают.
Чтоб беды не допускать,
В свою жизнь смрад сигаретный
Надо просто не пускать!
Вместе: Вон отсюда, никотин,
Быть здоровыми хотим!
Воспитатель: . Какое влияние на организм человека оказывает алкоголь?
Итак, вредные привычки оказывают отрицательное влияние на здоровье. Кроме физических нарушений (нарушения работы сердца, желудка, печени, легких), у человека развиваются нарушения психические: в состоянии алкогольного опьянения меняется его поведение - он становится неуправляемым, теряет контроль над собой; появляется агрессивность - человек становится буйным. В таком состоянии человек способен обидеть родных и близких, друзей, нарушить правопорядок
Воспитатель: Какое влияние на организм человека оказывают наркотики?
Свойства и получение сероводорода
Сероводород (H₂S) представляет собой бесцветный газ c запахом тухлых яиц. По плотности он тяжелее водорода. Сероводород смертельно ядовит для человека и животных. Даже незначительное его содержание в воздухе вызывает головокружение и тошноту, но самым страшным является то, что при длительном его вдыхании этот запах уже не ощущается. Однако при отравлении сероводородом существует простое противоядие: следует завернуть в платок кусок хлорной извести, затем смочить, и какое-то время нюхать этот сверток. Сероводород получают путем взаимодействия серы с водородом при температуре 350 °С:
Это окислительно-восстановительная реакция: в ходе нее изменяются степени окисления участвующих в ней элементов.
В лабораторных условиях сероводород получают воздействием на сульфид железа серной или соляной кислоты:
FeS + 2HCl → FeCl₂ + H₂S
Это реакция обмена: в ней взаимодействующие вещества обмениваются своими ионами. Данный процесс обычно проводят с помощью аппарата Киппа.
Свойства сероводорода
При горении сероводорода образуется оксид серы 4 и водяной пар:
2H₂S + 3О₂ → 2Н₂О + 2SO₂
H₂S горит голубоватым пламенем, а если над ним подержать перевернутый химический стакан, то на его стенках появится прозрачный конденсат (вода).
Однако при незначительном понижении температуры данная реакция проходит несколько иначе: на стенках предварительно охлажденного стакана появится уже желтоватый налет свободной серы:
2H₂S + О₂ → 2Н₂О + 2S
На этой реакции основан промышленный способ получения серы.
При поджигании предварительно подготовленной газообразной смеси сероводорода и кислорода происходит взрыв.
Реакция сероводорода и оксида серы(IV) также позволяет получить свободную серу:
2H₂S + SО₂ → 2Н₂О + 3S
Сероводород растворим в воде, причем три объема этого газа могут раствориться в одном объеме воды, образуя слабую и нестойкую сероводородную кислоту (Н₂S). Эту кислоту также называют сероводородной водой. Как видите, формулы газа-сероводорода и сероводородной кислоты записываются одинаково.
Если к сероводородной кислоте прилить раствор соли свинца, выпадет черный осадок сульфида свинца:
H₂S + Pb(NO₃)₂ → PbS + 2HNO₃
Это качественная реакция для обнаружения сероводорода. Она же демонстрирует способность сероводородной кислоты вступать в реакции обмена с растворами солей. Таким образом, любая растворимая соль свинца является реактивом на сероводород. Некоторые другие сульфиды металлов также имеют характерную окраску, например: сульфид цинка ZnS — белую, сульфид кадмия CdS — желтую, сульфид меди CuS — черную, сульфид сурьмы Sb₂S₃ — красную.
Кстати, сероводород является нестойким газом и при нагревании практически полностью разлагается на водород и свободную серу:
Сероводород интенсивно взаимодействует с водными растворами галогенов:
H₂S + 4Cl₂ + 4H₂O→ H₂SO₄ + 8HCl
Сероводород в природе и жизнедеятельности человека
Сероводород входит в состав вулканических газов, природного газа и газов, сопутствующих месторождениям нефти. Много его и в природных минеральных водах, например, в Черном море он залегает на глубине от 150 метров и ниже.
Сероводород применяют:
- в медицине (лечение сероводородными ваннами и минеральными водами);
- в промышленности (получение серы, серной кислоты и сульфидов);
- в аналитической химии (для осаждения сульфидов тяжелых металлов, которые обычно нерастворимы);
- в органическом синтезе (для получения сернистых аналогов органических спиртов (меркаптанов) и тиофена (серосодержащего ароматического углеводорода). Еще одно из недавно появившихся направлений в науке — сероводородная энергетика. Всерьез изучается получение энергии из залежей сероводорода со дна Черного моря.
Природа окислительно-восстановительных реакций серы и водорода
Реакция образования сероводорода является окислительно-восстановительной:
Процесс взаимодействия серы с водородом легко объясняется строением их атомов. Водород занимает первое место в периодической системе, следовательно, заряд его атомного ядра равен (+1), а вокруг ядра атома кружится 1 электрон. Водород с легкостью отдает свой электрон атомам других элементов, превращаясь в положительно заряженный ион водорода — протон:
Сера находится на шестнадцатой позиции в таблице Менделеева. Значит, заряд ядра ее атома равен (+16), и количество электронов в каждом атоме также 16е⁻. Расположение серы в третьем периоде говорит о том, что ее шестнадцать электронов кружатся вокруг атомного ядра, образуя 3 слоя, на последнем из которых находится 6 валентных электронов. Количество валентных электронов серы соответствует номеру группы VI, в которой она находится в периодической системе.
Итак, сера может отдать все шесть валентных электронов, как в случае образования оксида серы(VI):
Кроме того, в результате окисления серы, 4е⁻могут быть отданы ее атомом другому элементу с образованием оксида серы(IV):
Сера может отдать также два электрона c образованием хлорида серы(II) :
Во всех трех вышеуказанных реакциях сера отдает электроны. Следовательно, она окисляется, но при этом выступает в роли восстановителя для атомов кислорода О и хлора Cl. Однако в случае образования H2S окисление — удел атомов водорода, поскольку именно они теряют электроны, восстанавливая внешний энергетический уровень серы с шести электронов до восьми. В результате этого каждый атом водорода в его молекуле становится протоном:
а молекула серы, наоборот, восстанавливаясь, превращается в отрицательно заряженный анион (S⁻²): S⁰ + 2е⁻ → S⁻²
Таким образом, в химической реакции образования сероводорода окислителем выступает именно сера.
С точки зрения проявления серой различных степеней окисления, интересно и еще одно взаимодействие оксида серы(IV) и сероводорода — реакция получения свободной серы:
Как видно из уравнения реакции, и окислителем, и восстановителем в ней являются ионы серы. Два аниона серы (2-) отдают по два своих электрона атому серы в молекуле оксида серы(II), в результате чего все три атома серы восстанавливаются до свободной серы.
2S-² - 4е⁻→ 2S⁰ — восстановитель, окисляется;
S⁺⁴ + 4е⁻→ S⁰ — окислитель, восстанавливается.
Подписи к слайдам:
Самые вредные привычки – это курение, употребление спиртного и наркотиков.
Это надо знать всем! В лёгких при курении постепенно скапливается табачный дым и сажа. Кашель травмирует лёгкие, в которых накапливается слизь, дыхание становится слабым. Спортивные и учебные показатели значительно снижаются.
Курение очень вредно не только для лёгких, но и для всего организма. Очень плохо, когда курить начинает ребёнок. Он хуже растёт, быстро устаёт при работе, плохо учится, часто болеет.
Разве что-то есть на свете, Что надолго можно скрыть? Пятиклассник Петя Рыбкин Потихоньку стал курить. У парнишки к сигаретам Так и тянется рука. Отстаёт по всем предметам, Не узнать ученика! Начал кашлять дурачок Вот что значит – табачок!
Почему надо отказаться от курения? Курение вырывает из жизни человека от 19 до 23 лет. По данным Всемирной Организации Здравоохранения, ежегодно от курения преждевременно умирает свыше 5 млн. человек в мире. В России каждый год курение уносит жизни 220 тыс. человек. Это очень большие и страшные цифры.
Тоскует сердце, мозг, сосуды, почки, Слабеют лёгкие, от дыма почернев, Мы кашляем весь день и даже ночью, Страдает печень, яд не одолев. Остановитесь, люди, жизнь прекрасна, Но с дымом счастье улетает прочь, Не сразу. Постепенно и ужасно, И лучший врач не сможет вам помочь. Друзья и господа, курить бросайте смело, Не постепенно. Сразу, навсегда. Чтоб голова была здорова, не болела, Чтоб сердце не болело никогда. (автор стихотворения – врач Эдуард Свирский)
Почему надо отказаться от алкоголя? Алкоголь для растущего организма – более опасный яд, чем для сформировавшегося. Алкоголь – враг умственной работы. Алкоголь и спорт – абсолютно несовместимые вещи. Алкоголь – прямая дорога к правонарушениям. Алкоголь – это средство, которое способно человека разумного превратить в безрассудное существо. Алкоголь вызывает привыкание к нему, которое переходит в опасную болезнь – алкоголизм.
Запомни! Наркотики - сильнодействующие вещества, преимущественно растительного происхождения, парализующие деятельность центральной нервной системы и вызывающие искусственный сон и безболезненность. У тех, кто употребляет наркотики, появляются лекарственная зависимость, бесконтрольность своего действия, заторможенность, агрессивность, а это часто приводит к смерти. Сколько бы ни было наркоману лет, как бы он не любил родителей, близких, друзей, на первом месте для него теперь оказывается наркотик, потому что он ассоциируется с поддержанием жизни и отсутствием воли.
Почему надо отказаться от употребления наркотических средств? От отравления алкоголем и наркотиками в России ежегодно умирают более 90 тыс. человек. По данным экспертов, ежедневно от передозировки в России погибают, как минимум, 200 человек. До 80% российских наркоманов – несовершеннолетние и молодежь. Около 80% наркоманов, употребляющих инъекционные наркотики, болеют ВИЧ/ СПИД и гепатитом. Годовой оборот от незаконной торговли наркотиками в России достигает 15 млрд. долларов. Задумайся! Это страшно!
Да - здоровью, да – мечте! Нет - наркотику, беде! Быть здоровым - классно! Пить, курить - опасно! Лучше спортом заниматься, Чем в подвале задыхаться! Лучше уж глотать котлетки, Чем смертельные таблетки! Брось табак и анашу, Лучше запишись в ушу! Чем варить в подвале ханку, Свари борщик со сметанкой! Лучше уж здоровым быть, Чем как труп живой ходить! Если соки, воды пить, Будут девушки любить! Портит зубы сигарета, Помни, девушка, об этом! Наркоманка - как клеймо, Нет любви, нет ничего! Смотрит хмуро, дышит тяжко, - Он курильщик. Ах, бедняжка! Прежде чем наркотик взять, вспомни про отца и мать!
Спорт, любовь, работа, люди - Столько разного вокруг, Выбирай, решайся, ну же: Кто твой враг, а кто твой друг!
ЖИЗНЬ – ЭТО ПРЕКРАСНО! ВЫБЕРИ ЖИЗНЬ.



Сам себе хозяин,
Или как не стать заложником табакокурения
- Здоровье не купишь
- Человек не только хозяин своей судьбы, но и своего здоровья.
- Забота о самом себе складывается из любви к своему организму.
- Мы взаимодействуем с окружающей средой, природной и социальной. Значит, организм подвергается разным испытаниям.
- Человек сам решает, что ему делать, а чего избегать.
- Вредные соблазны
- Курение табака
- Употребление спиртных напитков
- Пристрастие к наркотическим средствам
Почему люди курят
- Табакокурение превратилось в социальную норму. Сейчас курят и мужчины, и женщины, и дети-подростки. Они считают, что это
- снимает стресс;
- делает их социально значимыми;
- позволяет приятно провести время в компании.
- Многие подростки курят для самоутверждения.
B 1s22s22p1 2p1
C 1s22s22p2 2p2
N 1s22s22p3 2p3
O 1s22s22p4 2p4
F 1s22s22p5 2p5
Ne 1s22s22p6 2p6
Простые вещества – неметаллы (фронтальная работа)
С металлами
С неметаллами
Галогены вытесняют друг друга с растворов солей.
Кислород реагирует со сложными веществами
Углерод реагирует с оксидами металлов
Углерод реагирует с углекислым газом
Кремний реагирует с растворами щелочей
Кислотные оксиды – 1 группа
С водой (кроме оксида кремния)
С основными оксидами
Со щелочами
Углекислый газ и оксид кремния реагируют с магнием
Оксид кремния реагирует с углеродом
Оксид кремния реагирует с солями, вытесняя более летучие оксиды
Кислоты – 2 группа
Изменяют окраску индикаторов
Реагируют с металлами
Реагируют с основными и амфотерными оксидами
С основаниями и амфотерными гидроксидами
С солями
Плавиковая кислота реагирует с оксидом кремния
Азотная и концентрированная серная кислоты по особому реагируют с металлами
При нагревании разлагаются азотная, угольная, кремниевая кислоты
Соли – 3 группа
С растворами солей
С кислотами
Со щелочами
С металлами
1. При нагревании разлагаются нитраты, соли аммония, карбонаты (кроме карбонатов щелочных металлов)
Общие и специфические свойства неметаллов и их соединений
Вещества
Общие свойства
^ Отличительные свойства
Простые вещества – неметаллы
- С металлами - С неметаллами
- Галогены вытесняют друг друга с растворов солей. - Кислород реагирует со сложными веществами - Углерод реагирует с оксидами металлов - Углерод реагирует с углекислым газом - Кремний реагирует с растворами щелочей
Кислотные оксиды
- С водой (кроме оксида кремния) - С основными оксидами - Со щелочами
- Углекислый газ и оксид кремния реагируют с магнием - Оксид кремния реагирует с углеродом - Оксид кремния реагирует с солями, вытесняя более летучие оксиды
Кислоты
- Изменяют окраску индикаторов - Реагируют с металлами - Реагируют с основными и амфотерными оксидами - С основаниями и амфотерными гидроксидами - С солями
- Плавиковая (фтороводородная) кислота реагирует с оксидом кремния - Азотная и концентрированная серная кислоты по особому реагируют с металлами - При нагревании разлагаются азотная, угольная, кремниевая кислоты
Соли
- С растворами солей - С кислотами - Со щелочами - С металлами
- При нагревании разлагаются нитраты, соли аммония, карбонаты (кроме карбонатов щелочных металлов)
^ Цель урока: систематизация, закрепление и обобщение знаний учащихся по заданной теме урока. Задачи урока:
Образовательные: развивать навыки самостоятельной работы, умения работать с большим объемом информации, выбирать главное, применять полученные знания при выполнении заданий.
Развивающие: развитие мышления, совершенствование умственной деятельности.
Воспитательные: формирование творческого подхода к решению познавательных и практических задач, умения контролировать свою деятельность.
Данный урок проводится после изучения темы “Неметаллы” (по программе Л.С.Гузей) в 10 классе с применением “проникающей” технологии компьютерного обучения. “ Не в количестве знаний заключается образование, а в полном понимании и искусном применении всего того, что знаешь”. (А.Дистервег) Оборудование.
Мультимедиа учебный курс “Общая и неорганическая химия”
Учебник Л.С.Гузей. Химия. 10класс. М.: Дрофа, 2002.
Таблица “Периодическая система химических элементов Д.И.Менделеева”
Ход урока ^ I. Организационный момент (объявление темы, цели и девиза урока) II. Актуализация знаний. (эмоциональный настрой) - буквенный тест. Задание: выберите букву, соответствующую правильному ответу, и прочтите фразу-напутствие на сегодняшний урок. 1.Где расположены химические элементы – неметаллы в периодической системе химических элементов Д.И. Менделеева: У) в главных подгруппах; Ф) в побочных подгруппах; Х) в главных и побочных подгруппах? 2.Какая электронная формула отражает строение атома металла: Г)2s1 Д) 3s23p5 E) 4s2 3d3 ? 3.Какой из атомов неметаллов не может переходить в возбужденное состояние: А) азот Б) хлор В) сера? 4. Молекула аллотропного видоизменения углерода – графита: Х) одноатомна Ц) многоатомна Ч) полимерна ? 5. Какой вид химической связи в простых веществах, образованных атомами неметаллов: Ж) ковалентная полярная З) ионная И) ковалентная неполярная ? 6. Какой тип кристаллической решетки у (Si)n: А) молекулярная Б) ионная В) атомная? 7. Какую степень окисления имеет азот в соединении HNO3: П) +3 Р) +5 С) -3? 8. Какой из перечисленных элементов обладает наиболее ярко выраженными окислительными свойствами: А) кислород Б) хлор В) сера? 9. Как изменяется химическая активность неметаллов в периоде: А) уменьшается Б) увеличивается В) не изменяется? 10.Как изменяются кислотные свойства водородных соединений неметаллов в ряду: NH3 – H2S – HCl : Н) ослабевают О) усиливаются П) не изменяются? 11.Какой из перечисленных оксидов обладает наиболее ярко выраженными кислотными свойствами: Р) Br2O7 C) I2O7 T) Cl2O7? 12. Какая из перечисленных кислот самая сильная: Е) HClO4 Ж) H2SO4 З) HIO4? 13.С каким настроением Вы пришли на урок: !) хорошим .) плохим ?) отвратительным? Обсуждаем результаты работы и делаем проверку через проектоскоп. (Ответ: Удачи в работе!) Отметьте на листе самоконтроля результаты выполнения буквенного теста. III. Работа с мультимедиа CD-ROM “Общая и неорганическая химия”. Предлагаю занять места у компьютеров и включиться в работу по выполнению план-задания . Выдаются план-задания разного уровня сложности. Выдаются листы самоконтроля и самооценки знаний (приложение 1) ^ План-задание №1. Цель: обобщить и закрепить знания о свойствах металлов и их соединений.
№ п/п
Этапы работы
Рекомендации
1.
Повторите раздел “Азотная кислота”.
Обратите внимание на особенности взаимодействия азотной кислоты с металлами.
2.
Повторите разделы “Химические свойства хлора”, “Кислородсодержащие кислоты хлора”.
Обратите внимание на взаимодействие хлора с холодным и горячим раствором щелочи.
3.
Включите меню “тест”, режим – “прохождение теста”.
4.
Выполните те задания теста, которые вы считаете более доступными для себя.
Пользуйтесь записями в тетради. Обсуждайте варианты ответов в парах. Следите за временем!
5.
Отметьте на листе самоконтроля результаты тестирования.
6.
Пройдите тест повторно, используя карточку-подсказку.
Делайте в тетради необходимые записи.
7.
В листе самоконтроля выставьте итоговую отметку.
^ План-задание №2. Цель: обобщить и закрепить знания о свойствах металлов и их соединений.
№ п/п
Этапы работы
Рекомендации
1.
Выполните последовательно задания 1-10 теста.
Если испытываете затруднения, попробуйте “полистать” теорию. Следите за временем!
2.
Отметьте на листе самоконтроля результаты тестирования.
3.
Пройдите тест повторно, используя карточку-подсказку.
Делайте в тетради необходимые записи.
4.
В листе самоконтроля выставьте итоговую отметку.
^ План-задание №3. Цель: обобщить и закрепить знания о свойствах металлов и их соединений.
№ п/п
Этапы работы
Рекомендации
1.
Включите меню “опыт” и выполните опыт №1.
Вспомните качественные реакции на ионы Fe3+, NH4+, Cl-, CO32-
2.
Оцените результаты своей работы в листе самоконтроля.
3.
Выполните последовательно все задания теста.
Пользуйтесь записями в тетради, теоретическим материалом электронного учебника.
4.
Отметьте на листе самоконтроля результаты тестирования.
5.
Пройдите тест повторно, используя карточку-подсказку.
Делайте в тетради необходимые записи.
6.
В листе самоконтроля проставьте итоговую отметку.
В ходе работы прерываемся на релаксационную паузу ( зарядка для глаз с цветовыми карточками) под музыку “Звуки природы”. . Собираю листы самоконтроля и самооценки знаний. ^ IV. Домашнее задание: составить контрольную работу по теме “Неметаллы и их соединения”. V. Рефлексия. И, как всегда, уходя с урока, продолжите фразу: “Уходя с урока , я хочу сказать ” Приложение 1. Лист самоконтроля и самооценки знаний по теме “Неметаллы и их соединения” ФИ учащегося ______________________
№ п/п
Задания
Количество ошибок
Оценка
1.
Буквенный тест
2.
Опыт №1 (для группы №3)
3.
Контрольный тест
Приложение №2. Карточка-подсказка. 1. С увеличением концентрации азотной кислоты восстановление идет в следующей последовательности: NH4NO3, N2, N2O, NO, NO2 2. Ответ № 2. 3.
HCl + P4O10
Cl2 + H2
Cl2 + KOH
KClO3 + t
HCl + MnO2
Cl2 + P4O6
KClO3 + t
KClO4 + t
4. FeSO4 7H2O Красно-коричневый Fe2O3 H2SO4 5. Вместо вопросов: 4, 2, MgCl2, SiH4, 4, 5, 2, N2, 6, H2O, 3, H2O, 6, NaCl, 3, CO2, 2 6. А – электролиз B – H2 C – O2 D – H2O E – CO2 F – Al2(SO4)3 7. Вместо вопросов: Cl2, HCl, NaOH, NaOCl, NaOH, H2O, NaOH, NaOH, H2O 8. Ответ № 2 и 4. 9. Na2O2, Na2O, NaN3 10. Вместо вопросов: Ca(ClO)2, H2O, Ca(ClO3)2, H2O, CaCl2 11. Ca2+, CaCO3, Mg2+, Mg(OH)2, MgO 12. CO2, 14CaO, 9Ca Ответ № 3. 13. Ответ № 2. Студент: Неметаллы – химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам обычно относят 22 элемента: газы – водород, азот, кислород, фтор, хлор и инертные газы, жидкость – бром, твердые тела – бор, углерод, кремний, фосфор, мышьяк, сера, селен, теллур, йод, астат. Студент: Хлор относится к галогенам, это газ желто-зеленого цвета с резким запахом. При обычной температуре легко сжижается. Химически очень активен, токсичен. Применяется в производстве хлорсодержащих органических соединений, неорганических веществ, для отбелки целлюлозы и тканей, для санитарных нужд и обеззараживания воды. ^ Преподаватель химии: В первую мировую войну 22 апреля 1915 года хлор применили как оружие массового уничтожения на западном фронте недалеко от бельгийского города Ипра против англо-французских войск. Вскоре для той же цели был применен другой удушающий газ – фосген – соединение хлора с оксидом углерода. В1917 году массовое применение нашел иприт, который тоже содержал хлор. К концу войны было разработано более 50 различных боевых отравляющих веществ, 95 % которых были производными хлора. ^ Преподаватель истории: Чтобы судить о действии отравляющих веществ на организм человека, достаточно указать, что в одной только английской армии, занимающей среди воюющих государств пятое место по численности, они вывели из строя с июля 1917г. по ноябрь 1918г. более 160 000 человек. ^ Преподаватель литературы: Послушайте отрывок из романа М.Шолохова “Тихий Дон”. “На рассвете 3 октября немцы, употребив удушливые газы, отравили три батальона 256-го полка и заняли первую линию наших окопов Валет, клацнув зубами, отпрыгнул, и на то место, где секунду назад стояли его ноги, спиленным деревом упал стоявший под сосной человек. Они перевернули его лицом вверх и тут только догадались, что под сосной нашел себе последний приют этот отравленный газами, бежавший от смерти, которую нес в своих легких, солдат одного из трех батальонов 256-го пехотного полка. Рослый, широкоплечий парень, он лежал, вольно откинув голову с лицом, измазанным при падении клейкой грязью, с изъеденными газом, разжиженными глазами, из стиснутых зубов его черным глянцевидным бруском торчал пухлый, мясистый язык. Пойдем. Пойдем ради бога! Пусть он себе лежит, - шепнул товарищ, дергая Валета за руку. Они пошли и сейчас же наткнулись на второй труп. Мертвые стали попадаться чаще. В нескольких метрах отравленные лежали копешками, иные застыли, сидя на корточках, некоторые стояли на четвереньках – будто паслись, а один, у самого хода сообщения, ведущего во вторую линию окопов, лежал, скрючившись калачиком, засунув в рот искусанную от муки руку”. ^ Преподаватель химии: А сейчас мы посмотрим фрагмент видеофильма об отравляющих веществах. Преподаватель химии: Академик Н. Д, Зелинский, выдающийся химик, изобрел противогаз, действующий по принципу адсорбции. Это произошло в 1915 г. Использование угольного противогаза целиком освобождало вдыхаемый воздух от ядовитых примесей. Студент: Древесный уголь – твердый, пористый, высокоуглеродистый продукт, образующийся при пиролизе древесины. Пиролиз – это получение древесного угля. При этом древесину нагревают без доступа воздуха. В результате ее разложения образуется уголь, горючий газ, в состав которого входят метан и другие продукты. Применяется в производстве кристаллического кремния, сероуглерода, активного угля, а также как топливо в быту. Древесный уголь при обычных условиях поглощает различные газы и растворенные вещества. ^ Преподаватель химии: В настоящее время древесный уголь, сохранивший в былых войнах миллионы людей от ужасных мучений и смерти, в знак благодарности демонстрируется на музейных стендах. ^ Преподаватель литературы: Я прочитаю вам отрывок из произведения Э. М. Ремарка “На западном фронте без перемен”. “ Глухие хлопки химических снарядов смешивались с грохотом взрывов. Между разрывами слышно гудение набатного колокола: гонги и металлические трещотки возвещают далеко вокруг: “Газ, газ, газ!”. В эти первые минуты решается вопрос жизни и смерти: герметична ли маска? Я помню страшные картины в лазарете: отравленные газом, которые еще несколько долгих дней умирают от удушья и рвоты, по кусочкам отхаркивая перегоревшие легкие. Я дышу осторожно, прижав губы к клапану Моя голова в противогазе звенит и гудит, она, кажется, вот-вот лопнет. Легкие работают с большой нагрузкой, им приходится вдыхать все тот самый горячий, уже не раз побывавший в них воздух, вены на висках вздуваются. Еще немного, и я, наверно, задохнусь. Ветер разогнал газ, воздух чист. Тогда и я тоже с хрипом срываю с себя маску и падаю. Воздух хлынул мне в грудь, как холодная вода, глаза вылезают из орбит, какая-то темная волна захлестывает меня и гасит сознание”. В этом же романе говорится о том, что отравляющий газ особенно долго держится у земли. “Увидав наверху людей без противогазов, они (солдаты в воронке) тоже сняли свои маски и успели глотнуть достаточно газа, чтобы сжечь себе легкие. Сейчас их состояние безнадежно, они умирают медленной, мучительной смертью от кровохарканья и приступов удушья”. Студент: Сера – химический элемент, желтые кристаллы. Устойчива в двух модификациях – ромбической и многоклинной. В воде нерастворима. Серу выплавляют из самородных руд, получают также окислением кислородом воздуха сероводорода, содержащегося в природном нефтяном, кокосовом газах. Около 50% серы идет на производство серной кислоты, 25% - на получение сульфидов, остальная - для борьбы с болезнями растений, вулканизации, производства спичек. ^ Преподаватель литературы: Константин Паустовский в одном из своих рассказов описывает, как белогвардейцы пытались уничтожить партизан, скрывавшихся в керченских каменоломнях. Заливая по трубам в шахты серную кислоту, они вызывали реакцию выделения углекислого газа, который при концентрации свыше 4% вызывает отравление, нарушение двигательных и речевых функций, а при концентрации свыше 10% - смерть от паралича дыхательного центра. Студент: Фосфор – от греческого phosphorus – светоносный. Образует несколько модификаций – белый, красный и др. Белый фосфор легко самовоспламеняется, светится в темноте, ядовит. Красный фосфор менее активен химически, ядовит. Добывается из апатитов и фосфоритов. Главный потребитель - сельское хозяйство. Присутствует в живых клетках в виде орто- и пирофосфорной кислот и их производных. ^ Преподаватель химии: Специальными опытами было установлено, что кусочки фосфора загораются на воздухе при 40о С, а порошок, образующийся после испарения растворителей, - при 0о С. Это свойство фосфора и привлекло внимание военных. ^ Преподаватель истории: Во время второй мировой войны немцы применили против англичан “бомбы-листочки” для поджигания хлебов на корню, сельских построек, лесов. Такие же бесшумные диверсионные устройства сбрасывались на мирные города и села Кореи, Индонезии, Кубы. Вся бомба представляет собой целлулоидную пластинку размером 10х15 см2, в центре которой укреплена таблетка белого фосфора, покрытая мокрой ватой. Хранят и перевозят их в банках с водой. Во время падения вода испаряется, и “бомба” загорается. Горение продолжается около одной минуты. Раствор белого фосфора в сероуглероде и скипидаре применяется в огнеметах. На вооружении американской армии имеются фосфорные снаряды, содержащие до 7 кг белого фосфора, и дымовые мины с таким же зарядом. Во время второй мировой войны использовались зажигательные бутылки (раствор белого фосфора в сероуглероде). Подобные бутылки использовались в Анголе и Южном Вьетнаме. ^ Преподаватель литературы: В “Повести временных лет” - летописном своде событий, составленном в Киеве, - описание похода князя Игоря заканчивается словами очевидцев: “Словно молниюкоторая на небе, греки имеют у себя и пускали ее сжигая нас, поэтому мы и не одолели их”. Дружинники князя защищались от “греческого огня” мокрыми воловьими шкурами, кожаными щитами, но терпели поражение. Горящая смесь выбрасывалась греками через медные трубы, установленные на бортах византийских кораблей. Состав этой смеси греки держали в тайне. ^ Преподаватель химии: Предполагают, что в нее входили сера, нефть, горючие масла, смола, селитра, клей и вещества для окраски пламени. Погасить этот состав водой было трудно. ^ Преподаватель литературы: А теперь, ребята, давайте вернемся к вашим технологическим картам, которые лежат на столах у каждой группы и в которые занесены вопросы для изучения, рассмотренные на сегодняшнем уроке. Проверьте, все ли мы их разобрали. Вторым пунктом в технологической карте стоят задания по созданию проекта. Т.е. каждой группе необходимо создать свой собственный небольшой проект на одну из тем, предложенных вам в карте. Что это будет, решите вы сами: тезисы по уроку, план-конспект, стихотворение, рисунок, мини-сочинение, модель и т.д. В столах вы найдете необходимые инструменты для создания проекта: бумагу, карандаши, фломастеры, пластилин, спички. Пожалуйста преступайте, но не забывайте о защите своего проекта. (Студенты работают над заданием)Обсуждение проектов. ^ Преподаватель химии: Итак, ребята, наш урок заканчивается и я хочу отметить, что вы все сегодня замечательно поработали. Я говорю вам всем спасибо. Но мы забыли самое главное – поблагодарить ребят, которые подготовили для вас сегодняшнее занятие. Позвольте их представить. (Представление участников). ^ Преподаватель литературы: Сегодняшний урок прошел в нетрадиционной форме, и нам хочется узнать, понравился ли он вам. Поэтому в заключении каждый из вас должен выразить свое отношение к сегодняшнему уроку. Для этого вам необходимо выбрать один цвет из тех карточек, которые у вас в руках и сдать их мне. А домашним заданием будет следующее: написать научно-фантастический рассказ с использованием прозвучавших на уроке терминов.
Заголовок 215
Читайте также:


