Механизм действия и патогенез интоксикации
Ботулотоксин оказывает повреждающее действие на различные структурно-анатомические образования периферической нервной системы: нервно-мышечный синапс, нервные окончания преганглионарных нейронов и парасимпатических постганглионарных нейронов. Токсины избирательно блокируют высвобождение ацетилхолина в этих структурах. Наиболее уязвимыми являются нервно-мышечные синапсы.
Выделяют четыре периода действия токсина на синапс:
• связывание его с плазматической мембраной холинергических нервных окончаний;
• проникновение токсина путем эндоцитоза внутрь нервного окончания;
• высвобождение действующей части белковой молекулы токсина и проникновение ее в цитозоль пресинаптического окончания при участии рН-зависимой транслоказы;
• разрушение действующей частью токсина специфических белков, участвующих в процессе выделения ацетилхолина из нервного окончания.
Протеолитическое расщепление этих специфических белков в нервных окончаниях приводит к угнетению нормального высвобождения ацетилхолина и в конечном счете к появлению основных признаков ботулизма.
Клиника
Скрытый период интоксикации составляет от нескольких часов до суток и более (чаще до 36 ч). Продолжительность периода зависит от пути поступления токсина в организм и подействовавшей дозы. Наименее продолжителен скрытый период при попадании вещества на раневые поверхности. В клинической картине поражения выделяют общетоксический, гастроинтестинальный и паралитический синдромы. Первые симптомы - это вегетативные реакции (тошнота, рвота, слюнотечение) и признаки общего недомогания (головная боль, головокружение). Через 1-2 сут постепенно развивается неврологическая симптоматика. Усиливается слабость, появляется сухость во рту и сухость кожных покровов. Нарушается зрение (затруднена аккомодация, расширяются зрачки, выявляется их слабая реакция на свет). Основным проявлением интоксикации является постепенно развивающийся паралич поперечнополосатой мускулатуры. Процесс начинается с глазодвигательной группы мышц (диплопия, нистагм). Ранним признаком отравления является птоз век. Позже присоединяется паралич мышц глотки, пищевода (нарушение глотания), гортани (осиплость голоса, афония), мягкого неба (речь с носовым оттенком, при попытке глотания жидкость выливается через нос). Затем присоединяется парез (а позже и паралич) мимической мускулатуры, жевательных мышц, мышц шеи, верхних конечностей и т. д. Мышечная слабость нарастает в нисходящем направлении и порой первоначально более выражена в проксимальных мышечных группах конечностей (важный диагностический признак).
Интоксикация постепенно нарастает. Иногда лишь на 10-е сут и в более поздние сроки может наступить смерть от паралича дыхательной мускулатуры и асфиксии (при тяжелых поражениях на 3-5-й день заболевания). Расстройств чувствительности при поражении ботулотоксином не бывает. Сознание у пострадавшего полностью сохранено весь период интоксикации. Нередко присоединяются острые пневмонии, токсический миокардит, сепсис (при раневом процессе). Летальность при отравлении ботулототоксином составляет от 15 до 30%,а при несвоевременном оказании помощи может достигать 90%. Характерными признаками ботулизма являются:
• полностью сохраненное сознание;
• нормальная или замедленная частота пульса;
• отсутствие нарушений чувствительности;
• симметричность неврологических нарушений.
Лечение
Важным моментом является проведение профилактических мероприятий. Специфическими противоядиями ботулотоксина являются противоботулинические сыворотки (А, В, Е). При подозрении на поражение токсином возможно профилактическое внутримышечное введение сывороток по 1000-2000 ME каждого типа с последующим наблюдением за пострадавшим в течение 10-12 дней. Решение о назначении сывороток достаточно сложно и требует участия квалифицированного специалиста, поскольку, с одной стороны, эти лекарственные средства не всегда оказываются эффективными (иные серологические типы токсина, быстрое необратимое взаимодействие яда с нервными окончаниями), а с другой -достаточно высока вероятность осложнений, связанных с их применением (анафилаксия, сывороточная болезнь).
При появлении признаков угнетения дыхания необходимо предусмотреть возможность перевода пострадавшего на искусственную вентиляцию легких.
Дата добавления: 2016-11-04 ; просмотров: 998 ;
Основным патогенетическим фактором действия ФОС является угнетение холинэстеразы (ХЭ).
По современным представлениям при прохождении импульса через синаптическое нервное окончание происходит деполяризация пресинаптической мембраны с выбросом в синаптическую щель кванта нейромедиатора-ацетилхолина, который вступает во взаимодействие с белком - хеморецептором постсинаптической мембраны, вызывая её деполяризацию и дальнейшее проведение импульса. После этого "отработанный" ацетилхолин разрушается с помощью фермента ацетилхолинэстеразы с образованием холина и уксусной кислоты.
В основе антихолинэстеразного действияФОС лежит структурное сходство этих соединений с ацетилхолином. Таким образом, можно представить, что при взаимодействии ФОС с ХЭ происходит реакция по такому же механизму, как и при соединении ХЭ с ацетилхолином. Принципиальное же различие в действии ФОС и ацетилхолина на ХЭ состоит в том, что обратная реакция – дефосфорилирование, протекает исключительно медленно. В результате этого в синаптической щели возникает избыточное количество нейромедиатора ацетилхолина, который возбуждает и перевозбуждает постсинаптическую мембрану, формируя картину гиперхолинергического сдвига в организме. Длительность действия антихолинстеразных веществ определяется скоростью восстановления активности ХЭ.
Некоторые ФОС уже после взаимодействия с ХЭ претерпевают дальнейшие изменения. При этом от ФОС отщепляется алкильный радикал, а между ХЭ и измененной молекулой ФОС устанавливается ковалентная связь. В этом случае ингибирование ХЭ происходит необратимо.
Обратимое ингибирование: И+Ф ИФ
Необратимое ингибирование: И+Ф ИФ ИФ+алкил
И - ингибитор (ФОС); Ф - фермент (ХЭ)
Эффекты действия ФОС
3. Облегчающее действие
3. Иммунодепрессивное действие
4. Холиномиметическое действие
5. Холинолитическое действие
Помимо угнетения ХЭ ФОС вызывает и другие холинергические (синаптические) инехолинергические(внесинаптические) эффекты.
Холиносенсибилизирующее действие– способность ФОС повышать чувствительность холинорецепторов к ацетилхолину. Таким образом, при действии ФОС увеличиваются ответы органов и тканей на воздействие ацетилхолина и других холиномиметиков.
Облегчающее действие – связано с действием ФОС на демиелинированную часть нервного волокна, что вызвает стойкое открытие Са 2+ каналов и деполяризацию пресинаптической мембраны. В результате запасы ацетилхолина выбрасываются в синаптическую щель.
Непосредственное действие на холинорецептор – холиномиметическое действие и холинолитическое действие. Поскольку и холинорецепторы, и ХЭ адаптированы к одному и тому же медиатору - ацетилхолину, то ФОС, как структурные аналоги ацетилхолина, могут проявлять активность и по отношению к холинорецепторам. В начальный период действия ФОС наблюдается возбуждение холинорецепторов, при наращивании концентрации яда происходит постепенный переход постсинаптической мембраны от состояния возбуждения к состоянию запредельного торможения (синаптического блока).
Особенно важным является прямое холинолитическое действие при торможении и блокаде нервно-мышечной передачи (нервно-мышечный блок) в дыхательной мускулатуре. Наличие непосредственного действия ФОС на холинорецепторы подтверждается способностью реактиваторов ХЭ устранять нервно-мышечный блок в дыхательной мускулатуре при полном угнетении ХЭ и "старении" комплексов.
Таким образом, холинергическое действие ФОС приводит к возбуждению и перевозбуждению М - и Н - холинергической системы на периферии и в центре.
М-холинорецепторы располагаются в тканях, получающих парасимпатическую иннервацию (глаза, бронхи, кишечник, мочевая система, сердце) и симпатическую иннервацию (мышцы кровеносных сосудов, потовые железы), а также в центральной нервной системе.
Н-холинорецепторы находятся в поперечно-полосатой мускулатуре, вегетативных ганглиях, хромофинной ткани надпочечников и центральной нервной системе.
Нехолинергическое (внесинаптическое) действие
Мускариноподобное и никотиноподобное действие ФОВ
М – холинолитическая система
Н - холинэзгическая система
Кожа: гипергидроз, стойкий розовый дермографизм;
Глаза: миоз, спазм аккомодации, боли в глазницах, снижение остроты зрения, слезотечение
Органы дыхания - ринорея, бронхорея, стеснение в груди, бронхоспазм.
ССС – брадикардия, синусовая брадиаритмия, атриовентрикулярная блокада, гипотония, боли в сердце
ЖКТ – слюнотечение, тошнота, рвота, спастические боли в животе, понос, тенезмы, задержка желчи и мочеиспускания (спазм сфинктеров)
Мышечная слабость, миофибриляции, слабость дыхательной мускулатуры,
Тахикардия, повышение АД
Страх, беспокойство, чувство тревоги, психомоторное возбуждение,головокружение, дезориентация, нарушение речи, клонико-тонические судороги, центральные параличи, кома.
Антиферментное действие- способность ФОС фосфорилировать различные ферменты (трипсин, хемотрипсин, фосфолипазы, фосфотазы и др.). Ингибирование фермента трансминазы впоследствии вызывает дегенерацию аксона, что приводит к развитию полиневритов, парезов, параличей.
Мембранотоксическое действие- при действии ФОС происходит активация перекисного окисления липидов (ПОЛ), что может вызвать нарушение структуры и функции клеточных мембран.
Иммунодепрессивное действие- механизм опосредован через гиперхолинергические звенья. Это действие важно учитывать в плане возможности развития вторичной инфекции.
Следом за первичными нарушениями гомеостаза из-за недостаточности компенсаторных механизмов происходят вторичные нарушения на органно-системном уровне.
Действие на органы и системы
А. Влияние на центральную нервную систему
Психические расстройства, описанные при наблюдении за отравленными людьми, характеризуются замедлением реакции, неправильным толкованием распоряжений, замешательством при осуществлении тех или иных действий. Характерны нарушения эмоциональной сферы. Они проявляются в умеренной депрессии или эмоциональной лабильности, напряженности. Часто наблюдается расстройство памяти, что связано с нарушением нейромедиаторного обмена в холинергических структурах головного мозга. Дальнейшее распространение процессов возбуждения, в том числе и на моторные центры нервной системы, может привести к развитию судорожного синдрома.
Вследствие накопления ацетилхолина в синапсах мозга в чрезмерных (пессимальных) концентрациях за возбуждением происходит угнетение функции центральной нервной системы, вплоть до паралича жизненно-важных центров. Центральный паралич, захвативший область дыхательного центра, может быть причиной смерти.
Б. Нарушение функции дыхания
Практически при всех степенях поражения ФОС наблюдается расстройство дыхания, обусловленное, главным образом, спазмом бронхиальной мускулатуры и усилением бронхиальной секреции, слабостью дыхательной мускулатуры, а также расстройством центральной регуляции акта дыхания и клонико-тоническими судорогами. Симптомы нарушения функции дыхания появляются рано и, быстро нарастая, становятся ведущими в картине интоксикации.
В нарушении внешнего дыхания обычно выделяют фазу возбуждения, характеризующуюся гипервентиляцией, и фазу угнетения дыхания, характеризующуюся снижением легочной вентиляции. В начале интоксикации возбуждение дыхательного центра обусловлено как непосредственным влиянием ФОС на дыхательный центр, так и рефлекторными реакциями в результате действия ФОС на хеморецепторы каротидных клубочков. При этом наблюдается учащение дыхания, увеличивается количество потребляемого кислорода и выделенной углекислоты. Уменьшение объема легочной вентиляции и газообмена, потребления кислорода и выделения углекислоты отмечается позже, во время развития судорог.
Бронхоспазм и бронхорея при отравлении ФОС могут быть выражены очень сильно. Это приводит непосредственно к развитию асфиксии.
Известно, что тонус гладкой мускулатуры бронхов и секреция желез слизистых оболочек дыхательных путей определяются тонусом блуждающего нерва. Антихолинэстеразные вещества, повышая тонус блуждающего нерва, вызывают спазм бронхов и усиление секреции. В настоящее время способность ФОС вызывать спазм бронхиальной мускулатуры связывают как с их антихолинэстеразной активностью, так и прямым холиномиметическим действием.
При применении ФОС в больших дозах проявляются курареподобное действие ядов и как следствие - слабость, а затем и возникновение паралича дыхательной мускулатуры (диафрагмы, межреберных мышц). Это приводит к тяжелым нарушениям дыхания и может быть причиной смерти.
В. Нарушение функции сердечно-сосудистой системы
Наблюдаемые при отравлении человека или в эксперименте на животных изменения артериального давления (преходящий прессорный эффект, за которым следует падение кровяного давления), возникновение брадикардии, нарушение проводимости (вплоть до атрио-вентрикулярного блока) зависят от многих факторов: воздействия ядов на вегетативные ганглии, сердце, каротидные клубочки, надпочечники.
Г. Нарушение функции желудочно-кишечного тракта
Тошнота, рвота, боли в области живота, другие диспептические расстройства, возникающие при воздействии ФОС, хотя и не относятся к ведущим симптомам отравления, оказывают существенное влияние на характер течения интоксикации. Эти проявления интоксикации в основном обусловлены антихолинэстеразным действием ядов, повышением тонуса блуждающего нерва. При этом возрастает двигательная активность, увеличиваются частота и амплитуда сокращения тонкой и толстой кишок, усиливаются моторика желудка и секреция пищеварительных желез.
Д. Нарушение функции зрения
При местной аппликации на конъюнктиву глаза ФОС вызывают сужение зрачка и спазм аккомодации. Эти же реакции, но в меньшей степени выраженности, наблюдаются и при резорбтивном действии ядов. Миоз и спазм аккомодации, а также сопровождающие их чувство рези в глазах, головная боль и нарушение зрения являются заметными, но не опасными для жизни симптомами. Сокращение ресничной мышцы и круговой мышцы радужки определяет степень развития миоза и спазма аккомодации.
В изучении характера действия психохимических ОВ широко используются экспериментальные данные, хотя соотношение экспериментальных данных – одна из наиболее трудных проблем фармакологии. Дело тем более осложняется, когда речь идет о химических веществах, влияющих на психику человека, ибо психодислептические эффекты в их полной картине можно наблюдать только на человеке.
По фармакологическим свойствам психотомиметики из группы аминоэфиров гликоливой кислоты относятся к М-холинолитикам и по уровню химической активности не уступают атропину. Для проявления центральных эффектов имеют значения скорость проникновения через гемато-энцефалический барьер и характер распределения.
Исследования, проведенные с использованием разнообразных препаратов, показали, что BZ быстро проникает в мозг и уже через 2,5 минуты после внутривенного введения животным достигает максимальной концентрации в большинстве структур мозга. Механизм токсического действия BZ объясняют блокадой мускариночувствительных холинэргических структур в головном мозгу и нарушением вследствие этого медиаторной функции ацетилхолина в синапсах ЦНС.
Известно, что ацетилхолину принадлежит важна роль как медиатору ЦНС, и холинергичнские механизмы лежат в основе многих форм поведения, включая обучение и память. В связи с этим понятно, что блокада холинорецепторов ЦНС приводит к нарушению психической деятельности человека. Установлено, что BZ существенно изменяет оборот ацетилхолина в структуре головного мозга: угнетает активность холинацетилазы, тормозит синтез ацетилхолина, повышает скорость его распада и изменяет проницаемость гранул с медиатором, вызывая усиление его высвобождения. при этом запасы ацетилхолина в ЦНС истощаются.
Снижение содержание ацетилхолина имеет функциональное значение. Существует предположение о прямой связи между степенью снижения содержания ацетилхолина в мозге с психомиметическим действием холинолитических средств.
Схематично можно представить, сто BZ, обладая важной холинэргической активностью, блокирует центральные и периферические М-холинорецепторы и одновременно снижает уровень ацетилхолина. При этом нарушаются существующие в ЦНС сбалансированные отношения, обеспечивающие адекватное реагирование организма на ситуации и раздражители внешней среды. Многие симптомы характерные для отравления BZ (например периодические вспышки психомоторного возбуждения), могут быть объяснены преобладанием адренергической системы как результатом блокады химических структур. Изменения в системе адренергической медиации могут быть так же связаны с действием гликолатов как сильных стрессовых факторов подобно всем другим психотомиметикам.
Предполагают, что в больших дозах BZ нарушает синтез катехоламинов, что тоже может привести к расстройству психики.
Механизм действия ДЛК остается не выясненным. Существуют лишь гипотезы разного уровня достоверности. ДЛК обладает центральным и периферическим действием. К числу центральных эффектов относятся стимулирование синаптических структур, включая синапсы сетевидной формации среднего мозга. С этим действием связаны также проявления интоксикации, как развития медриаза, гипотермии, гипергликемии, тахикардии, повышенной чувствительности к сенсорным раздражителям и т,д,. Периферическое действие проявляется сокращением мускулатуры матки и сосудов. В опытах было установлено, что ДЛК быстро проникает через тканевые барьеры, включая гемато-энцефалический. Через несколько минут после внутривенного введения ДЛК исчезает из крови. В большинстве органов максимальная концентрация обнаруживается через 10-15 минут. В последующие часы содержание вещества, во всех органах постоянно снижается, за исключением тонкого кишечника, где ДЛК накапливается в пределах 50% от введенного количества. На высоте интоксикации в мозге содержится около 0,02% от введенного количества ДЛК.
В настоящее время доминирует представление, что действие ДЛК связано с облегчающим или тормозящим влиянием на симпатическую передачу.
Считается, что в патогенезе интоксикации типичным является изменение активности серотонинэргических систем. Было установлено, что при определенных условиях ДЛК может выступать как антагонист серотонина в симпатических образованьях ЦНС.
При введении ДЛК животным выявлено совпадение во времени указанных биохимических изменений с развитием нарушения поведения.
Согласно другой гипотезе, психомиметическое действие ДЛК связано с его способностью нарушать метаболизм катехоламинов.
Отдельные симптомы отравления, такие как моторная гиперактивность, тахикардия, гипертезия, мидриаз, гиперемия и др., указывают на преобладание у отравленных симпатикотонии. В настоящее время получены убедительные данные, свидетельствующие о снижении у животных под влиянием ДЛК уровня норадреналина, главным образом, в среднем мозге и гипоталямусе. По видимому ДЛК повышает активность катехоламиэргических структур мозга, вследствие чего увеличивается высвобождение норадреналина и развивается дефицит его функциональных запасов. Нейрофармакологическое обследования показывают, что ДЛК наиболее избирательно воздействует на нейрональные катехоламинэгические системы ретикулярной формации ствола мозга и лимбических образований.
В организм иприты и люизит проникают полиапликационным путем: ингаляционно в виде паров и аэрозолей, через неповрежденную и поврежденную кожу в капельно-жидкой форме и через рот с зараженной водой и продовольствием.
После поступления в кровь вещества быстро распределяются в организме, легко преодолевая гистогематические барьеры, проникает в клетки. Метаболизм вещества протекает с большой скоростью и осуществляется он с помощью микросомальных ферментов.
Механизм действия ипритов до конца не выяснен. Для объяснения механизма действия ипритов существуют следующие теории:
1. Иприты являются алкилирующими ядами. Под алкилированием понимается процесс вытеснения молекулой яда функциональных групп белка (например -SН) вообще и нуклеопротеидов в частности. На месте аппликации яда в силу его высоких концентраций алкилирование белков приводит к их денатурации и развитию клиники местных воспалительно-некротических изменений, 80% яда при этом поступает в кровь и распределяется между тканями организма. Здесь механизм действия ипритов объясняется способностью его алкилировать пуриновые основания, входящие в состав ДНК и РНК. Наибольшей чувствительностью к иприту отличается гуанин. Согласно существующим представлениям ДНК содержит две полипептидные цепи, стабильность пространственной конфигурации которых поддерживается водородными связями между противоположными основаниями: против аденина одной цепи всегда находится тимин другой цепи, против гуанина - цитозин. Поэтому связывание гуанинов на обеих комплиментарных цепях ДНК приведет к выпадению гуанин-цитозиновых пар. Если выпадает гуаниновая пара в одной цепи, то хотя реакция и ограничивается одной нитью, при редупликации ДНК происходит восстановление нитей с уничтожением гуанин-цитозиновых пар. Для РНК реакция ограничивается алкилированием соседних гуанинов одной цепи.
Нарушение нуклеинового обмена приводит к цитостатическому эффекту - угнетаются процессы деления, размножения и роста клеток. Особенно это заметно у быстроразмножающихся клеток в стадии митоза (кровь, эпителий кишечника). Более позднее нарушение генного аппарата клеток реализуется как мутагенное, терратогенное и бластомогенное действие.
2. Вторая теория трактует иприты как лучевые яды (радиометрический эффект). При исследовании гидролиза иприта было доказано, что в начале гидролиза образуются так называемые ониевые соединения (ониевые катионы).Ониевые катионы обладают чрезвычайной реакционной способностью. Они могут вызывать появление ионов Н + , ОН - , Н02, которые также весьма реакционноспособны и оказывают; действие на клетки тканей, которое напоминает повреждающее действие ионизирующих излучений.
3.Третья теория. На основании биохимических исследований было установлено, что иприт и его метаболиты оказывают выраженное действие на ферментные системы, особенно на те, которые активируют протеолитические процессы и тормозят анаэробный гликолиз. Являясь ферментными ядами, сказывается на угнетении всех видов обмена веществ, в снижении валового обмена, но преимущественно при поражении ипритом страдает белковый обмен. Иприт подавляет гексокнназу, регулирующую углеводный обмен, и обладает способностью ингибировать холинэстеразу.
Анализ механизма действия и клиники ипритной интоксикации показывает, что в патогенезе ипритных поражений имеются три основных клинических синдрома: 1) местные воспалительно-некротические изменения; 2) шокоподобное состояние; 3) лучевой синдром.
Механизм действия люизита достаточно хорошо изучен. Люизит сам по себе не токсичен, в организме к нему присоединяется атом кислорода (О - ) с образованием оксида мышьяка. Проникая в ткани, производные трехвалентного мышьяка вступают во взаимодействие с ферментами, содержащими SН-группы. Предполагается два возможных типа реакций - взаимодействие с моно - и дитиоловыми ферментами. При взаимодействии с монотиоловыми ферментами образуются непрочные соединения, которые легко распадаются с восстановлением исходной активности ферментов.
При реакции люизита с дитиоловыми ферментами образуется прочное соединение яда с ферментами. В данном случае наиболее ранимой оказывается пируватоксидазная система. В результате нарушается обмен веществ в тканях, что приводит к развитию резкой воспалительной реакции, сопровождающейся некрозом клеточных элементов. Гибель последних, наступает в первые минуты после воздействия люизита. При этом зона некроза всегда окружена далеко распространяющейся зоной воспаления.
При поражении люизитом очень скоро возникает защитная клеточная реакция, проявляющаяся в быстром образовании демаркационного вала вокруг некротизированных участков тканей. Эта интенсивная клеточная реакция значительно уменьшает выраженность и частоту присоединения инфекционного процесса при поражении люизитом, по сравнению с поражением ипритами.
Вследствие резорбции люизита в той или иной степени страдает обмен во всех тканях организма. Особенно нарушается функция ферментов, ответственных за углеводный обмен, в результате чего расстраивается функционирование систем и органов. Особенно это касается центральной нервной системы, где страдают многие отделы. Среди них решающее значение имеет поражение центров продолговатого мозга, и вследствие этого нарушается функционирование сердечно-сосудистой и дыхательной систем.
При интоксикации люизитом наступает выраженное расширение сосудов, особенно капилляров и нарушается проницаемость сосудистой стенки (сосудистый яд !). В результате этого возникает отек тканей, накопление жидкости в полостях организма и кровоизлияния.
Анализ механизма действия и клинической картины при поражении люизитом позволяет выделить два основных клинических синдрома: 1) местные воспалительно-некротические изменения; 2) шокоподобное состояние.
Метиловый спирт.
После приема внутрь метанол быстро всасывается и распределяется в биосредах. Средние значения смертельных концентраций яда в плазме у взрослых составляют 1 г/л, у детей – 0,4 г/л. Метанол преимущественно разрушается в печени (94%), 5% выводится почками в неизмененном виде, 1% – с выдыхаемым воздухом. Период полувыведения метанола (T05), принятого в низких дозах, составляет 14–27 ч и увеличивается до 30 ч при приеме в высоких дозах.
Метаболизм метанола изучен достаточно подробно. Основными метаболитами метанола являются формальдегид и муравьиная кислота, причем трансформация формальдегида в формиат происходит быстро, а расщепление муравьиной кислоты до углекислого газа и воды весьма медленно. Это приводит к тому, что в биосредах накапливаются значительные количества формиата. Биологическое действие неизмененной молекулы метанола ограничивается наркотическим эффектом. Токсичность метилового спирта обусловлена формальдегидом и муравьиной кислотой. Эти метаболиты оказывают многостороннее действие на биохимические системы организма.
Главные направления их действия:
1. подавление окислительного фосфорилирования с развитием дефицита АТФ;
2. метаболический ацидоз (как за счет нарушения окисления, так и в результате накопления формиата);
3. снижение уровня восстановленного глутатиона, дефицит сульфгидрильных групп;
4. образование конъюгатов с биологически активными веществами – аминами, вазоактивными соединениями, нейромедиаторами, нуклеотидами и др.
Метанол – сильный нейрососудистый яд. Основными объектами его воздействия являются наиболее чувствительные к недостатку АТФ структуры (головной мозг, сетчатка и зрительный нерв). Окулотоксическое действие проявляется в различные сроки после приема яда (от 40 мин до 72 ч). При офтальмоскопии регистрируют отек диска зрительного нерва, который развивается вследствие его демиелинизации.
В основе повреждений органа зрения лежат нарушения фосфорилирующих процессов в системе цитохромоксидазы (цитохром AA3). В результате нарушается энергообразование, и как следствие – изменение массопереноса веществ через аксолемму, что приводит к демиелинизации и последующей атрофии зрительного нерва в целом.
Поражения усугубляются метаболическим ацидозом, нарушениями обмена вазоактивных веществ и нейромедиаторов, расстройствами общей и церебральной гемодинамики, повышением проницаемости мембран, перераспределением жидкости с развитием отека головного мозга.
Общемозговые расстройства с нарушением жизненно важных функций являются основной причиной смерти отравленных метанолом.
Этиленгликоль
Этиленгликоль быстро всасывается в желудочно‑кишечном тракте, определяется в крови через 5–15 мин после приема внутрь и достигает максимальной концентрации в крови через 2–5 ч. В связи с этим необходимо у таких больных как можно раньше промыть желудок и очистить кишечник, что и объясняет наибольшую эффективность применения в эти сроки методов форсированного удаления невсосавшегося яда из организма. Этиленгликоль и продукты его распада можно обнаружить в организме до 3–8 дней и более.
Трансформация этиленгликоля в организме происходит по следующей схеме:
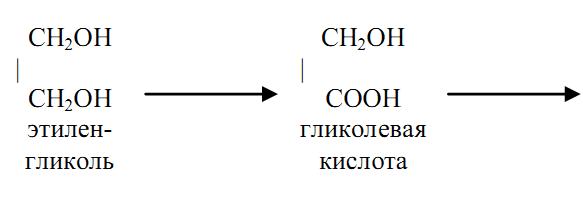
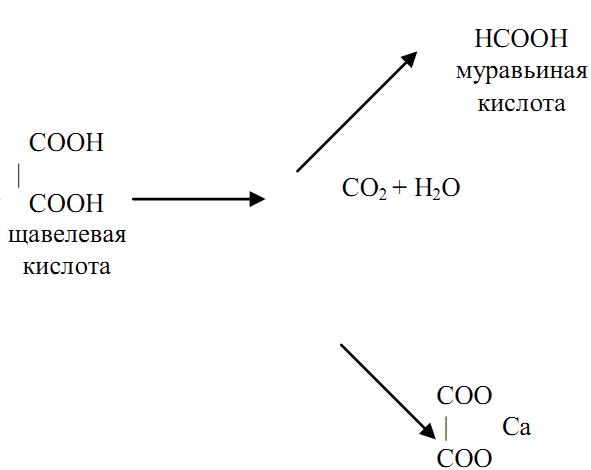
Этиленгликоль подвергается в организме окислению до углекислоты и воды с образованием токсичных промежуточных продуктов – гликолевого альдегида, гликолевой кислоты, щавелевой, уксусной, муравьиной и других кислот, что приводит к ацидозу, выраженным расстройствам обмена, гипоксии. Щавелевая кислота взаимодействует с ионами кальция с образованием нерастворимой щавелевокислой кальциевой соли. Основной путь удаления из организма этиленгликоля и продуктов его распада‑ через почки (до 50% яда). При этом оксалаты осаждаются в стенках капилляров, в канальцах и лоханках почек и, действуя непосредственно и рефлекторным путем, нарушая почечный кровоток, способствуют развитию токсической нефропатии. Гипокальциемия, вызванная связыванием ионизированного кальция, может быть одной из причин нарушения деятельности центральной нервной системы и работы сердца.
Этиленгликоль действует как сосудистый и протоплазматический яд, подавляет окислительные процессы, вызывает отек, набухание и некроз мелких сосудов с расстройством тканевого кровообращения, сдвигает кислотно‑щелочное равновесие в сторону метаболического ацидоза, нарушает водно‑электролитный баланс.
В механизме токсического действия этиленгликоля определенная роль отводится как неизмененному гликолю, так и продуктам его биотрансформации. С целой молекулой связано умеренно выраженное наркотическое действие яда, а также высокая осмотичность, вследствие чего возможны водная дегенерация клетки почечного эпителия и отек мозга. Ведущая же роль в развитии отравления принадлежит метаболитам этиленгликоля. В течение длительного времени основное значение придавалось щавелевой кислоте, способной связывать кальций с образованием плохо растворимого оксалата.
Однако оказалось, что в оксалат трансформируется лишь незначительная доля этиленгликоля, а гипокальциемия развивается далеко не во всех случаях тяжелых отравлений. С другой стороны, кристаллы кальция оксалата образуются в почках, мозге и легких, что ухудшает функцию этих органов.
В настоящее время считается, что в формировании цитотоксического эффекта этиленгликоля главную роль играет гликолевая кислота и ее метаболит – глиоксиловая кислота, которая наиболее токсична. Она разобщает окисление и фосфорилирование.
Таким образом, продукты биотрансформации этиленгликоля вызывают серьезные и разнообразные нарушения энзиматических процессов. Указанные нарушения усиливаются вследствие осмотического действия яда, а также метаболического ацидоза, развивающегося в результате накопления эндогенных продуктов и кислот, образующихся при метаболизме этиленгликоля.
Метаболические расстройства являются пусковым звеном в развитии поражений, наиболее выраженных в головном мозге, почках и печени. Тяжелые расстройства обмена веществ, гипоксия, повышение мембранной проницаемости способствуют формированию экзотоксического шока.
Особенно значительные гемодинамические расстройства при отравлениях этиленгликолем наблюдаются в почках. Известно, что при снижении ОЦК в 2 раза почечный кровоток уменьшается в 20 – 30 раз.
Замедление почечного кровотока, стазы, повышение проницаемости мембран приводят к ишемии ткани почек, отеку интерстиция, повышению внутриорганного давления, нарушению фильтрационно‑реабсорбционных процессов, прогрессированию расстройств гемо‑ и лимфотока.
Рефлекторный спазм артерий коры, раскрытие артерио‑ венозных анастомозов со сбросом крови через юкстамедуллярные пути еще более усиливают поражения почечной паренхимы.
Указанные нарушения в сочетании с прямым повреждающим действием продуктов метаболизма этиленгликоля приводят к развитию весьма характерного для данной интоксикации тотального двухстороннего коркового некроза почек.
Дихлорэтан.
Токсическое действие дихлорэтана связано с продуктами его биотрансформации. Так, в процессе дехлорирования образуется 1‑ хлорэтанол, который при участии алкоголь‑ и альдегиддегидрогеназы окисляется до хлорацетоальдегида и монохлоруксусной кислоты. Естественный путь детоксикации дихлорэтана в организме, как и других рассматриваемых углеводородов, – это реакция с восстановленным глутатионом в печени; в результате образуются малотоксичные меркаптуровые кислоты, однако один из промежуточных продуктов – полуиприт – способен оказывать алкилирующее действие. Метаболиты дихлорэтана обладают высокой активностью и, вступая во взаимодействие с сульфгидрильными группами ферментов, нарушают их структуру и функцию. Наибольшей токсичностью обладает, по‑видимому, монохлоруксусная кислота, которая, блокируя акониттрансферазу, дезорганизует работу цикла трикарбоновых кислот.
Токсичные метаболиты хлорорганических соединений путем алкилирования и (или) стимуляции перекисного окисления липидов повреждают плазматические и внутриклеточные мембраны и запускают, судя по всему, кальциевый механизм гибели клеток. Внутриклеточное накопление кальция блокирует митохондриальное окислительное фосфорилирование, дестабилизирует лизосомальные мембраны, активирует находящиеся в лизосомах эндопротеазы, обладающие аутопротеолитическими свойствами. Следствием этих изменений, а также расстройств липидного обмена (увеличение количества липидов, поступающих в клетку, и угнетение их выведения), являются дистрофические (преимущественно жировая дистрофия) и некротические поражения клеток.
Указанные механизмы (неэлектролитное и электролитное действие токсиканта) являются первичными, реализующимися уже в токсикогенной стадии интоксикации. Они вызывают изменения в различных органах и тканях, приводят к серьезным расстройствам гомеостаза (метаболическому ацидозу, водно‑электролитным, гемокоагуляционным сдвигам и т. д.), формированию ряда вторичных синдромов (центральных и аспирационно‑обтурационных нарушений дыхания, острой недостаточности паренхиматозных органов и т. д.).
Важное место в патогенезе интоксикации хлорорганическими соединениями занимают расстройства гемодинамики, особенно экзотоксический шок, – следствие резкого увеличения проницаемости сосудистой стенки с выходом жидкой части крови в интерстиций, развитием истинной гиповолемии, централизацией кровообращения, периферической вазоконстрикцией, гемоконцентрацией, агрегацией форменных элементов, значительными нарушениями микроциркуляции, углубляющими гипоксию тканей и нарушения гомеостаза.
Описанные выше нарушения на определенном этапе формирования экзотоксического шока приводят к выраженным изменениям реологических свойств крови с развитием в дальнейшем коагулопатии потребления (ДВС‑синдрома).
В соматогенной стадии интоксикации главное место занимают поражения паренхиматозных органов – печени и почек. Дистрофические и некротические изменения в клетках этих органов сопровождаются нарушением всех основных функций печени – синтетической, детоксикационной, регулирующей все основные виды межуточного обмена, и почек – выделения воды, электролитов, азотистых шлаков, регуляции гемопоэза, артериального давления. Эти метаболические нарушения, а также продукты деструкции собственно паренхиматозных органов являются основой формирования вторичной эндогенной интоксикации, нередко с проявлениями полиорганной недостаточности, которая сама по себе приводит к нарастанию дегенеративно‑дистрофических изменений в тканях, способствует развитию осложнений, в том числе инфекционных.
Читайте также:


