Лекция отравление метиловым спиртом

В газодобывающей отрасли метанол препятствует образованию гидратов в трубах газопроводов. Метанол - отличный растворитель, он входит в состав моющих средств для стекол и зеркал, зимней жидкости для омывания стекол автомобиля – "незамерзайки", добавляется в моторное топливо как антифриз, а также для повышения октанового числа, может применяться в качестве топлива.
Как отличить метиловый спирт от этилового?
Опасность для человека состоит в том, что метиловый спирт практически неотличим от этилового на цвет, запах и вкус. Он также, как и последний, легко воспламеняется и горит на воздухе синим пламенем. В быту можно попытаться отличить два спирта при наличии медной проволоки. Скручивая ее в спираль, нагревают на огне докрасна и опускают в исследуемую жидкость. Если мы имеем дело с метанолом, то обязательно появится резкий, характерный запах формальдегида.
Смертельная и токсическая дозы метилового спирта
Наиболее частые случаи отравления метиловым спиртом, нередко массовые, отмечались при употреблении контрафактного алкоголя, а также при кражах из железнодорожных цистерн и промышленных складов. Ситуация усугубляется тем, что по органолептическим свойствам эти два спирта отличить практически невозможно. Поскольку первые симптомы отравления проявляются спустя час, после приема внутрь, то человек нередко успевает принять количество ядовитой жидкости в несколько раз превышающей смертельную.
Доза в 5-10 мл оказывает выраженный токсический эффект, приводит к необратимой слепоте, а 30-40 мл - к смерти. Однако, в силу разных причин, смертельная доза может сильно варьировать. Известны случаи, когда уже после приема 40 мл 15% метилового спирта наступал летальный исход. В то же время был зафиксирован случай выживания после выпитых 500 мл чистого метанола.
Симптомы отравления метиловым спиртом
Спустя час, иногда позже, после приема метилового спирта появляются слабость, озноб, тошнота, рвота, боли в животе. головокружение, головная боль. Со стороны органа зрения - "туман", "пленка" или "хлопья" перед глазами, светобоязнь. При появлении клиники поражения глаз, в большинстве случаев наступает слепота, даже если в этот момент начато оказание медицинской помощи.
Может отмечаться жидкий стул, появление примеси крови в рвотных массах (геморрагический гастрит). В дальнейшем возможно развитие судорог, снижение артериального давления, угнетение сознания, вплоть до комы. Токсические эффекты связаны с продуктами метаболизма метанола – формальдегидом и муравьиной кислотой. Они обусловливают отек и атрофию зрительного нерва, тяжелый метаболический ацидоз. Смерть может наступить в результате острой сердечно-сосудистой недостаточности (отек легких, экзотоксический шок), острой почечной недостаточности, остановки дыхания.
Даже при получении всей необходимой экстренной медицинской помощи, летальность при отравлении метиловым спиртом достигает 20-30% и более, более четверти выживших становятся инвалидами первой группы вследствие полной слепоты или значительного снижения остроты зрения.
Первая помощь при отравлении метиловым спиртом
Эффективность лечения во многом зависит от сроков обращения за помощью и количества принятого яда. Первая помощь при отравлении метанолом или содержащей его жидкостью, заключается в искусственном вызывании рвоты и немедленном принятии антидота. Противоядием же является то, что и собирались принять изначально, т.е. – этиловый спирт.
Необходимо срочно принять внутрь около 100-150 мл водки или любого другого алкогольного напитка в адекватной дозе. Фермент печени алкогольдегидрогеназа играет ключевую роль в метаболизме спиртов в организме человека. Было обнаружено, что сродство этанола к этому ферменту значительно выше.
При всасывании этилового спирта, алкогольдегидрогеназа переключается на него и "забывает" о циркулирующем в крови метаноле. Благодаря этому блокируется образование формальдегида и муравьиной кислоты, метанол постепенно выводиться из организма в неизмененном виде почками.
Необходимо различать банальное алкогольное опьянение, возникающее при употреблении высоких индивидуальных доз алкоголя. Дополнительный прием этилового спирта в этом случае только ухудшит состояние. Действительное отравление метанолом наступает значительно раньше и сопровождается нарушением зрения и стремительным нарастанием жизнеугрожающей симптоматики. После приема антидота нужно незамедлительно обратиться за медицинской помощью.
В токсикологическом отделении стационара или отделении общей реанимации проводят интенсивную терапию, направленную на устранение метаболического ацидоза, коррекцию электролитных нарушений, поддержание витальных функций. Отравление метанолом является показанием для проведения гемодиализа.
1. Отравление метиловым спиртом.
Метиловый спирт поглощается всеми путями – дыхательными, пищеварительными и чрезкожными. Смертельная доза метанола при приеме внутрь колеблется в пределах 40—250 мл, но прием даже 10–20 мл может вызвать слепоту. Отравление возникает и после приема различных алкогольных смесей, содержащих от 1,5 до 2,5 % метанола. После поглощения метанол распространяется по всем тканям в связи с его водорастворимостью. Наибольшее количество скапливается в почках и ЖКТ, наименьшее в мозге, мышцах и жировой ткани.
Патологоанатомические поражения заключаются в отеке головного мозга и повреждениях исходно воспалительного, а в дальнейшем дистрофического характера ганглиозных клеток сетчатки. В отдельных случаях, помимо поражения нервной системы, обнаруживаются дегенеративные поражения печени, почек, легких и сердечной мышцы.
Клиническая картина.
В токсическом эффекте метанола можно выделить двухфазность действия. В начальном периоде (I фаза) метанол воздействует на организм целой молекулой и оказывает преимущественно наркотическое действие, но более слабое, чем у этилового спирта. В последующем (II фаза) проявляется вредное действие продуктов окисления.
В клинической картине выделяют периоды: опьянения, скрытый, или относительного благополучия (продолжительностью от нескольких часов до 1–2 суток), основных проявлений интоксикации и при благоприятном исходе – обратного развития.
По степени тяжести различают легкую, среднюю (или офтальмическую) и тяжелую (или генерализованную). При легком отравлении отмечается быстрая утомляемость, головная боль, тошнота, состояние легкого опьянения, возникающие через скрытый период от 30 мин до нескольких часов. Одновременное поглощение этилового и метилового спирта увеличивает скрытый период и ослабляет тяжесть отравления.
При отравлении средней степени тяжести после небольшого скрытого периода у больного появляется головная боль, головокружение, острая боль в животе (преимущественно в эпигастральной области), рвота, беспокойное состояние, бред, судороги. В конечном итоге наступает глубокая кома. У больного наблюдается гипотермия, в отдельных случаях синюха, когда развивается дыхательная недостаточность центральной природы с последующей сердечно-сосудистой недостаточностью. На этой стадии зрачки расширяются, а исследование глазного дна указывает на наличие отека сетчатки. Характерные нарушения зрения, такие как снижение остроты зрения, сужение поля, расширение зрачков, выпадение рефлекса на свет, боль в глазном яблоке наступают на 2–6 день. Исследование глазного дна обнаруживает признаки атрофии зрительного нерва. Наиболее тяжелым осложнением является полная слепота.
Лечение.
Лечение включает следующие моменты.
1. Прекращение поступления яда в организм. Прекращение употребления яда, удаление из зараженной атмосферы, удаление яда с кожных покровов.
2. Удаление не всосавшегося яда (из ЖКТ):
1) зондовое промывание желудка;
2) применение адсорбентов или солевых слабительных;
3) очистительная или сифонная клизма.
3. Удаление всосавшегося яда:
1) форсирование диуреза;
2) методы экстракорпоральной детоксикации (гемосорбция, гемодиализ, перитонеальный диализ, операция замещения крови).
4. Антидотная терапия, т. е. обезвреживание яда за счет физической или химической нейтрализации, а также конкуренции с ядом за точки приложения.
6. Поддержание жизненно важных функций организма.
7. Нормализация водно-электролитного, кислотно-щелочного состояния организма.
8. Лечение отдаленных последствий и осложнений.
Промывание желудка водой или 2 %-ным раствором гидрокарбоната натрия с последующим приемом внутрь 30 г сульфата магния (натрия) в 100 мл воды. Подкожно 2 мл кордиамина, 1 мл 20 %-ного раствора кофеина.
При коме внутривенно 5 %-ный раствор этилового спирта на 5 %-ном растворе глюкозы из расчета 1,5–2 г алкоголя на 1 кг веса больного в сутки. Внутривенно 400 мл полиглюкина (реополиглюкина), 50—100 мг преднизолона, глюкозоновокаиновую смесь (400 мл 5 %-ного раствора глюкозы с 25 мл 2 %-ного раствора новокаина), 80—120 мг фуросемида (лазикса), 40 мл 40 %-ного раствора глюкозы с 8 ЕД инсулина.
Отравления метанолом часто сопровождаются выявлением индивидуальных и групповых случаев наступления инвалидности и высокой смертностью пострадавших.
Это тяжёлое отравление, протекающее со значительными осложнениями, часто приводящими к летальному исходу, поэтому давайте разберём этот вид интоксикации подробно.
Метанол: характеристика и скрытые опасности
Метанол (метиловый спирт) благодаря своим химическим свойствам активно используется в химической и фармацевтической промышленности:
— как составляющий компонент антифризов;
— как добавка к бензину;
— в качестве жидкого топлива;
По внешним признакам он напоминает этиловый спирт. Большинство отравлений метанолом возникает из-за приёма его внутрь (проглатывания) в результате подмены и использования его в качестве спиртных напитков. К группе повышенного риска возникновения отравления принадлежат лица, злоупотребляющие алкогольными напитками (хронические алкоголики).
Применяя метанол как растворитель для стёкол внутри автомобиля, возможно, развитие отравления с его проникновением через кожу или дыхательные пути.
Метанол и продукты его метаболизма в организме — формальдегид и муравьиная кислота, относятся к сильнодействующим ядам нервной и сосудистой системы. Его коварность проявляется в быстром всасывании в организм и очень медленном выведении.
В основе патогенеза существенную роль играет нарастание ацидоза (кислотности организма) и недостаточности насыщения крови кислородом.
Симптомы отравления метанолом
Симптомы острого отравления метанолом в зависимости от количества токсического вещества возникают от несколько часов до 1–2 суток.
Базовые симптомы отравления метанолом:
— проявления общей интоксикации – головокружение и головная боль, тошнота и рвота, болевые ощущения в мышцах и суставах, боли в животе;
— признаки алкогольного влияния – помутнение (спутанность) сознания, снижения чувствительности, пошатывание при ходьбе, сонливость;
— характерное (специфическое) действие на органы зрения – светобоязнь и нечёткое изображение предметов, расширение зрачков, нарушенная или отсутствует реакция на свет;
— результаты лабораторных исследований – в крови возрастает уровень гемоглобина и эритроцитов, в моче появляется белок и гиалиновые цилиндры.
Метанол вызывает гиперемию (переполнение кровью какого-либо органа) и отёк зрительного нерва и сетчатки, которые в результате приводят к их атрофии и слепоте.
В случае тяжёлого отравления метанолом после фазы психомоторного возбуждения:
— расширяются зрачки и падает острота зрения;
— дыхание становится глубоким и неэффективным;
— появляется цианоз (посинение) кожи и слизистых оболочек;
— пульс фиксируется частый и слабый, давление снижается, вероятное возникновение судорог.
При нарастании патологического процесса и отсутствии первой помощи пострадавший впадает в кому из-за отёка мозга. Причиной летального исхода считают остановку дыхания и работы сердечно-сосудистой системы.
Отравление парами метанола характеризуется симптомами:
— раздражения слизистой оболочки конъюнктивы и верхних дыхательных путей;
Симптомы и клиника хронического влияния метанола
Для метанола свойственны кумулятивные особенности — способность накапливаться в организме. Поэтому существует высокая вероятность развития хронического отравления в результате действие небольших доз этого яда на протяжении определённого времени.
Опасен для здоровья и жизни человека не только метанол, но и химические смеси, которые содержат больше 2% метанола.
Симптомы хронического отравления метанолом:
— быстрая утомляемость и слабость;
— повышенная раздражённость и плаксивость;
— снижение работоспособности и памяти;
— боли в правом подреберье и желудочно-кишечные нарушения;
— границы цветного зрения сужаются;
— отёк и нарушение строение сосудов глазного дна – артерии извивистые и суженные, вены расширены;
— зрительный нерв бледный или атрофирован;
— покраснение сосудистого шара глаза;
-снижение уровня тромбоцитов (тромбоцитопения) в общем анализе крови.
1. Вызвать скорую помощь.
2. Как помочь пострадавшему до приезда врачей?
Неотложная первая помощь больному при отравлении метанолом состоит в максимально быстром выведении яда из организма и противодействию его метаболизму.
Возможный перечень средств применения:
— массивное промывание желудка;
— применение солевого слабительного средства;
— приём этилового спирта в качестве противоядия (0,5 мл на 1 кг веса);
— приём щелочных растворов (питье и внутривенное введение гидрокарбоната натрия).
Этиловый и метиловый спирты в процессе метаболизма задействуют одинаковые ферменты и рецепторы. Поскольку продукты распада этилового спирта имеют низкую токсичность в сравнении с метанолом, обосновано его применение в качестве антидота.
Способы лечения и последствия отравления метанолом
Лечение больного проводится в стационаре и включает нормализацию водно-солевого обмена и коррекция кислотно-основного. Проявления метаболического ацидоза ликвидирую назначением бикарбонатных растворов, мочегонные препараты применяют для профилактики отёка мозга.
В случае тяжёлого отравления, трудно подающегося коррекции ацидоза, нарастании симптомов поражения зрения и функции центральной нервной системы рекомендуется очищение крови — применение гемодиализа. Его целью является извлечении из организма пострадавшего метанола и продуктов его распада — муравьиной кислоты и формальдегида. Следует помнить об увеличении дозы этанола во время проведения гемодиализа, потому что он тоже выводится и не сможет выполнить функцию антидота.
При отсутствии необходимой медицинской помощи наступает смерть, как правило, на третьи сутки.
Последствия отравления метанолом возникают даже при оказании медицинской помощи и проведения лечения. Наиболее частыми повреждениями служат стойкие нарушения качества и остроты зрения вплоть до слепоты, функциональные повреждения работы печени и пищевого тракта, расстройства деятельности центральной нервной системы.
Профилактика отравления метанолом
К профилактическим мероприятиям такого вида отравлений относятся:
— санитарно-просветительная работа и повышение настороженности населения;
— детальный инструктаж работников на предприятиях, использующих метанол;
— применение общих и индивидуальных средств защиты;
— предупреждение использования метанола для хозяйственных нужд;
— проверка качества алкогольных напитков и запрет применения суррогатов.
Таким образом, соблюдение требований профессиональной и личной безопасности обеспечит предупреждение возникновения отравлений такими токсичными веществами, каким является метанол.
Лекция 11: Спирты и фенолы
1. Общая характеристика кислородсодержащих соединений
Спиртами называют соединения, содержащие одну или несколько гидроксильных групп, непосредственно связанных с углеводородным радикалом.
Спирты классифицируют по различным структурным признакам.
1. По числу гидроксильных групп спирты подразделяются на :
· одноатомные (одна группа -О Н)
Например: СH3 – OH метанол; CH3 – CH2 – OH этанол
· многоатомные (две и более групп -О Н).
а) двухатомные спирты. Например: HO–СH2–CH2–OH этиленгликоль ( этандиол ).
Двухатомные спирты с двумя ОН-группами при одном и том же атоме углерода R–CH(OH)2 неустойчивы и, отщепляя воду, сразу же превращаются в альдегиды R–CH=O. Спирты R–C(OH)3 не существуют.
б) трехатомные спирты. Например: HO–СH2–С Н( ОН)–CH2–OH глицерин (пропантриол-1,2,3).
2. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа , различают спирты:

3. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на
Ø предельные (метанол СH3 – CH2–OH)
Ø непредельные ( пропен 2 – ол 1 CH2=CH–CH2–OH)
Ø ароматические ( фенилметанол или бензиловый спирт C6H5CH2–OH)
Непредельные спирты с ОН-группой при атоме углерода, соединенном с другим атомом двойной связью, очень неустойчивы и сразу же изомеризуются в альдегиды или кетоны.
Предельные одноатомные спирты – это кислородсодержащие органические вещества, производные предельных углеводородов, в которых один атом водорода замещён на функциональную группу (-OH), имеющие общую формулу: CnH2n+1OH или ROH
Первым членом гомологического ряда спиртов является метанол Н3С–ОН, каждый последующий член гомологического ряда отличается на группу СН 2 .
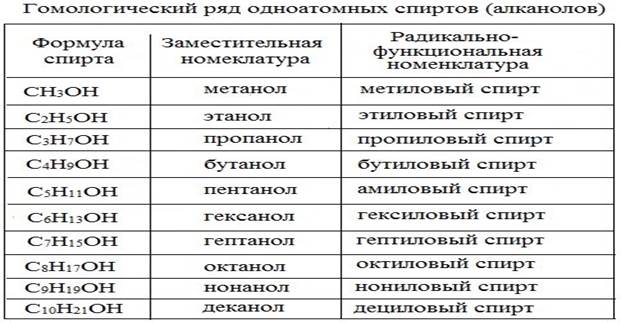
Систематические названия даются по названию углеводорода с добавлением суффикса – о л и цифры, указывающей положение гидроксигруппы (если это необходимо). Нумерация ведется от ближайшего к ОН-группе конца цепи. Цифра, отражающая местоположение ОН-группы , в русском языке обычно ставится после суффикса " ол ".

По другому способу (радикально-функциональная номенклатура) названия спиртов производят от названий радикалов с добавлением слова "спирт".
Метанол – жидкость ( tкип =64,5; tпл =-98; ρ = 0,793г/см3), с запахом алкоголя, хорошо растворяется в воде. бесцветная жидкость (т. кип. 64,5 °С , плотность 0,79), смешивающаяся во всех соотношениях с водой и многими органическими растворителями. Метиловый спирт ядовит, он горит бледно-голубым некоптящим пламенем, по запаху и вкусу почти не отличается от этилового.
Метиловый спирт широко используется в промышленности как растворитель лаков, красок, как исходное вещество для получения многих химических соединений. Он применяется для денатурации этилового спирта, входит в состав антифриза.
Метиловый спирт может поступать в организм через пищевой канал, а также с вдыхаемым воздухом, содержащим пары этого спирта. В незначительных количествах метиловый спирт может проникать в организм и через кожу. Токсичность метилового спирта зависит от обстоятельств отравления и индивидуальной восприимчивости. Под влиянием метилового спирта происходит поражение сетчатки глаза и зрительного нерва, от воздействия 4,0 – 7,0 метанола наступает неизлечимая слепота. Метиловый спирт нарушает окислительные процессы и кислотно-щелочное равновесие в клетках и тканях. В результате этого наступает ацидоз. Отравление метиловым спиртом в ряде случаев заканчивается смертью и смертельная доза спирта составляет 30—100 мл. Смерть наступает в результате остановки дыхания, отека головного мозга и легких, коллапса или уремии. Местное действие метилового спирта на слизистые оболочки проявляется сильнее, а наркотическое действие — слабее, чем у этилового спирта, так как метанол не вызывает чувства опьянения. Одновременное поступление метилового и этилового спиртов в организм уменьшает токсичность метилового спирта. Это объясняется тем, что этиловый спирт уменьшает скорость окисления метилового спирта почти на 50 %, а следовательно, и уменьшает его токсичность.
Метиловый спирт, поступивший в организм, распределяется между органами и тканями. Наибольшее количество его накапливается в печени, а затем в почках, наименьшие – в мышцах, жире и головном мозгу. Метаболитом метилового спирта является формальдегид, который окисляется до муравьиной кислоты. Часть этой кислоты разлагается на оксид углерода (IV) и воду.
Для обнаружения метилового спирта применяют ограниченное число реакций на этот спирт . Большинство из них проводят после переведения его в формальдегид .
1. Окисление метилового спирта . Большинство реакций обнаружения метилового спирта основано на окислении его до формальдегида и определении последнего при помощи реакций окрашивания. Прежде чем приступить к окислению метилового спирта до формальдегида, необходимо проверить наличие этого альдегида в исследуемом растворе.
Для окисления метилового спирта в формальдегид применяют перманганат калия или другие окислители:
При взаимодейств ии ио нов марганца с избытком перманганата калия может образоваться оксид марганца (IV):
2. Реакция образования метилсалицилата . При наличии метилового спирта в исследуемом растворе ощущается характерный запах метилового эфира салициловой кислоты :
Для количественного определения метанола применяют колориметрический метод, основанный на образовании окрашенного продукта при взаимодействии формальдегида с фуксинсернистой кислотой.

Этанол – бесцветная, прозрачная, летучая жидкость, с характерным запахом, жгучая на вкус (т. кип. 77—77,5 °С). Этиловый спирт горит синеватым пламенем, смешивается во всех соотношениях с водой, диэтиловым эфиром и многими другими органическими растворителями, перегоняется с водяным паром.
Этиловый спирт широко используется в промышленности как растворитель и исходный продукт для получения многих химических соединений. Этот спирт используется в медицине как дезинфицирующее средство. В химических лабораториях он применяется как растворитель, входит в состав многих спиртных напитков.
Этиловый спирт может поступать в организм несколькими путями: при приеме внутрь, при внутривенном введении, а также через легкие в виде паров с вдыхаемым воздухом. Поступивший в организм этиловый спирт действует на кору головного мозга: сначала возбуждает, а затем парализует ЦНС. В больших дозах этиловый спирт вызывает угнетение функций как спинного, так и продолговатого мозга. При этом может наступить состояние длительного глубокого наркоза с потерей рефлексов и угнетением жизненно важных центров. Под влиянием этилового спирта может наступить смерть в результате паралича дыхательного центра. Этанол не только вызывает острые отравления, но и способствует скоропостижной смерти от других заболеваний (прежде всего, от заболеваний сердечно-сосудистой системы).
Степень токсичности этанола зависит от дозы, концентрации его в напитках, от наличия в них сивушных масел и других примесей, прибавляемых для придания напиткам определенного запаха и вкуса. Ориентировочно смертельной дозой для человека считается 6—8 мл чистого этилового спирта на 1 кг массы тела. В пересчете на всю массу тела это составляет 200—300 мл этилового спирта. Однако эта доза может изменяться в зависимости от чувствительности к этиловому спирту, условий его приема (крепость напитков, наполненность желудка пищей) и т. д. Этанол относится к наркотическим веществам. Длительное злоупотребление этиловым спиртом приводит к хроническому отравлению. Повторные приемы алкоголя приводят к развитию привыкания, одновременно с привыканием вырабатывается пристрастие, а затем развивается алкогольная зависимость (алкоголизм), которая характеризуется тягостными переживаниями без употребления алкоголя и сильным желанием повторных его приемов.
В результате длительных приемов этилового спирта происходит ряд тяжелых нарушений функций организма: может наступить цирроз печени, перерождение сердечной мышцы и почек, стойкое расширение сосудов лица (особенно сосудов носа), дрожание мышц, галлюцинации, буйный бред (белая горячка) и т.д.
Этиловый спирт неравномерно распределяется в тканях и биологических жидкостях организма, что зависит от количества воды в них. Учитывая большой объем крови в организме, в ней накапливается значительно большее количество спирта, чем в других органах и тканях. Поэтому определение этанола в крови имеет большое значение для оценки количества этого спирта, поступившего в организм, также при оценке результатов количественного определения необходимо учитывать, что этот спирт может образовываться при гнилостном разложении трупов. В отличие от крови в моче трупов образование этилового спирта не происходит. Поэтому для оценки степени опьянения производят определение этилового спирта как в крови, так и в моче.
До 10% этилового спирта выделяется из организма в неизмененном виде с мочой, выдыхаемым воздухом, потом, слюной и т .д Остальное количество этого спирта подвергается метаболизму несколькими путями: определенное количество окисляется с образованием воды и оксида углерода (IV); большая часть окисляется до уксусного альдегида, а затем до уксусной кислоты.
1. Реакция образования йодоформа . При нагревании этилового спирта с раствором йода в щелочной среде образуется йодоформ, имеющий специфический запах. При относительно больших количествах этилового спирта в пробе образуются кристаллы йодоформа, имеющие форму шестиугольников и звездочек.
Предел обнаружения: 0,04 мг этилового спирта в 1 мл раствора. Эта реакция не специфична на этиловый спирт. Ее дают ацетон, молочная кислота и др.
2. Реакция образования уксусно-этилового эфира (этилацетата). Этиловый спирт с ацетатом натрия в присутствии серной кислоты образует уксусно-этиловый эфир, имеющий характерный запах:
3. Реакция образования этилбензоата . При взаимодействии этилового спирта с бензоилхлоридом ( хлористым бензоилом ) образуется этилбензоат , имеющий характерный запах:
Распознаванию запаха этилбензоата мешает избыток бензоилхлорида , имеющего неприятный запах. Поэтому для разложения избытка бензоилхлорида прибавляют раствор щелочи:
4. Реакция образования ацетальдегида (уксусного альдегида). Этиловый спирт окисляется дихроматом калия, перманганатом калия и некоторыми другими окислителями до ацетальдегида, имеющего характерный запах.
Количественное определение этанола производится несколькими методами: 1) этилнитритным ; 2) методом Видмарка в модификации Шоймоша ; 3) фотометрическим; 4) газохроматографическим.
Этилнитритный метод основан на переведении этилового спирта в сложный эфир этилнитрит , омылении его и последующем определении азотистой кислоты – одного из продуктов омыления этилнитрита .
Определение этилового спирта микрометодом Видмарка в модификации Шоймоша . Метод был разработан для определения этанола в крови живых лиц. Принцип микрометода состоит в том, что в колбе определенной конструкции спирт из взятой навески крови отгоняют в присутствии смеси бихромата калия с концентрированной серной кислотой. Спи рт вст упает в реакцию с бихромтом калия и окисляется до уксусной кислоты, а бихромат калия восстанавливается. Исходя из количества бихромата калия, взятого до анализа и оставшегося неизмененным после реакции со спиртом, вычисляют количество его, пошедшее на окисление поглощенного из крови спирта. Фотометрический метод определения этилового спирта основан на ускоренной изотермической диффузии этилового спирта из объекта исследования (кровь, моча) под действием карбоната калия. Спирт восстанавливает бихромат калия в кислой среде; окраска последнего изменяется от светло-желтой до темно-синей. По градации переходных оттенков фотометрированием по отношению к эталонным растворам этилового спирта и к контрольной пробе (дистиллированная вода) определяется содержанием спирта в объектах исследования.
Определение методом газо-жидкостной хроматографии обладает неоспоримыми преимуществами перед химическими методами определения этилового спирта, так как является специфичным, сравнительно точным – чувствительность метода составляет 0,01%, объективным и доказательным. Газо-жидкостная хроматография позволяет разделить спирты – метиловый, этиловый, пропиловый , бутиловый и изоамиловый друг от друга в присутствии других летучих веществ, дать выделенным спиртам качественную и количественную характеристику.
Фенол – представляет собой тонкие длинные игольчатые кристаллы или бесцветное легкоплавкое кристаллическое вещество, с характерным запахом, быстро розовеющее на воздухе вследствие окисления. Фенол растворяется в воде в соотношении (1:20), легко растворяется в этиловом спирте, диэтиловом эфире, хлороформе, жирных маслах, растворах едких щелочей.
Если ароматическое кольцо содержит одну гидроксильную группу, то это одноатомные фенолы:

При наличии двух и более гидроксильных групп фенолы называют, соответственно, двух-, трехатомными и т.д.

Фенолы применяются для изготовления искусственных смол, являются исходным продуктом для синтеза некоторых органических красителей, салициловой кислоты, пикриновой кислоты, применяются для дезинфекции и дезинсекции. Они используются и в качестве инсектицидов, антиоксидантов, химических реактивов и т. д. Одноатомные фенолы, в частности карболовая кислота, ядовиты и изредка имеют место умышленные отравления ею, встречаются отравления и в результате смешения ее с другими веществами.
Широкое применение фенолов в производстве пластических масс, попадание их в воздух при недостаточной вентиляции могут привести к промышленным отравлениям. При приемах фенола внутрь он быстро всасывается, отравление им протекает бурно. Наблюдаются жжение и боль в желудке и кишечнике, рвота беловатыми хлопьевидными массами, понос, иногда с примесью крови, ощущается запах фенола изо рта и от рвотных масс. Моча больного, отравленного фенолом, имеет оливковый или черно-оливковый цвет. Смертельной дозой фенола при приемах внутрь считают 8 - 15 г. При вскрытии трупов ощущается запах фенола, слизистая оболочка рта, пищевода и желудка покрыта молочно-мутного цвета пятнами, жесткими на ощупь. Отмечаются белковое, а затем жировое перерождение органов, мелкие кровоизлияния во внутренних органах и в тканях мозга. Из организма фенолы выводятся с мочой.
Реакция галогенирования . Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола:

Реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.

Индофеноловая реакция . При окислении смеси фенолов и аминов образуются индофенолы, имеющие соответствующую окраску:

Для количественного определения дистилляцию производят до тех пор, пока качественные реакции (с бромной водой) не покажут отсутствия фенола.
1. При достаточном количестве фенола, о чем можно судить
по результатам качественных реакций, может быть произведено
весовое определение его в виде трибромфенола .
2. При малых количествах фенола возможно лишь объемное
броматометрическое определение К веществу добавляют избыток титрованного раствора калия бромата и калия бромида, раствор подкисляют серной или хлороводородной кислотой. Образующийся бром вступает в реакцию замещения с фенолом. Через 10-15 минут избыток брома определяют йодометрическим методом: добавляют калия йодид и выделившийся йод титруют раствором натрия тиосульфата (индикатор - крахмал). КBrO3 + 5 КВ r + 3 Н2SО4 → 3 Вr2 + 3 К2SО4+ 3 Н2О

Избыток Br2 + 2 KI → I2 + 2 KBr
Читайте также:


