Лейкозная интоксикация что это такое

В числе раковых болезней особняком держатся лейкозы. Заболевание не щадит ни взрослых, ни детей.
Так что же такое лейкозы? Это многочисленные опухоли кроветворной системы, возникающие из кроветворных клеток и поражающие костный мозг. Лейкозы делятся на две основные группы – острые и хронические.
Причиной возникновения острых лейкозов человека могут быть нарушения состава и структуры хромосомного аппарата, наследственно обусловленные или приобретенные под влиянием некоторых мутагенных факторов (одним из них является ионизирующая радиация), химических мутагенов.
Доказано учащение острых лейкозов среди лиц, подвергавшихся воздействию бензола, среди больных, получавших иммунодепрессанты (имуран, циклофосфан, лейкаран, сарколизин, мустарген и др.). При этом частота острых лейкозов среди пациентов повышается в сотни раз! Роль наследственных дефектов проявляется в том, что наследуется не сам лейкоз, а повышенная изменчивость – нестабильность хромосом клетки.
Для всех острых лейкозов характерны нарастающая “беспричинная” слабость, недомогание, иногда одышка, головокружение, обусловленные анемией, при некоторых формах – повышение температуры тела, интоксикация. Увеличение лимфатических узлов, печени и селезенки в развернутой стадии бывает не при всех острых лейкозах, но может развиваться независимо от формы острого лейкоза в терминальной стадии. Нередки кровоточивость слизистых оболочек, петехиальная сыпь на коже, особенно голеней, обусловленные резким снижением количества тромбоцитов в крови. В легких, миокарде и других тканях и органах могут появляться инфильтраты. Наиболее частые формы острого лейкоза у взрослых – миелобластный и миеломонобластный лейкозы, у детей – лимфобластный.
Острый промиепоцитарный лейкоз встречается довольно редко. Ему присущи выраженная интоксикация, кровоточивость и снижение уровня фактора свертываемости в крови. Лимфатические узлы, печень и селезенка обычно не увеличены. Непосредственной причиной смерти больного чаще всего бывает кровоизлияние в мозг.
При остром лейкозе показана срочная госпитализация. Лечат больных для достижения ремиссии с помощью комбинированного введения цитостатиков с целью ликвидации всех явных и предполагаемых лейкемических очагов.
Среди хронических лейкозов чаще отмечаются лимфолейкоз, миелолейкоз, миеломная болезнь, эритремия, реже – хронический сублейкемический миелоз (остеомиелосклероз, миелофиброз), хронический моноцитарный лейкоз. При хроническом миелолейкозе опухолевым процессом поражается как гранулоцитарный, так и тромбоцитарный и эритроцитарный ростки костного мозга. Процесс распространяется на печень, селезенку, а в терминальной стадии пораженной может оказаться любая ткань. В клиническом течении хронического миелолейкоза выделяют развернутую и терминальную стадии. Вначале у больного отсутствуют жалобы, не увеличена или незначительно увеличена селезенка, состав периферической крови изменен. Развернутая стадия может продолжаться в среднем четыре года.
При правильной терапии состояние больных остается удовлетворительным, они сохраняют трудоспособность, ведут обычный образ жизни (при амбулаторном наблюдении и лечении). В терминальной стадии течение приобретает черты злокачественности: высокая лихорадка, быстро прогрессирующее истощение, боль в костях, резкая слабость, быстрое увеличение селезенки, печени, иногда увеличение лимфатических узлов. Характерно также быстрое нарастание таких признаков, как анемия, тромбоцитопения, осложняющаяся кровотечениями, инфекцией, некрозами слизистых оболочек.
Длительность жизни больных в этой стадии обычно не превышает 6-12 мес. Лечение хронического миелолейкоза проводят с момента установления диагноза. В развернутой стадии эффективна терапия миелосаном. При неэффективности миелосана назначают миелобромол. При переходе процесса в терминальную стадию используют комбинации цитостатических препаратов, винкристин и преднизолон, ВАМП, цитозар и рубомицин. В начале терминальной стадии нередко эффективен миелобромол.
Причины возникновения лейкозов недостаточно изучены. важное значение, на наш взгляд, имеет профилактика заболеваний, прежде всего обеспечение экологически благоприятной среды для проживания людей.
ЧТО ТАКОЕ ОСТРЫЙ ЛЕЙКОЗ?
Острый лейкоз - это быстро развивающееся заболевание костного мозга, при котором происходит бесконтрольное накопление незрелых белых клеток крови в костном мозге, периферической крови и различных внутренних органах.
Замещение костного мозга опухолевыми клетками нарушает его способность производить необходимое число здоровых клеток крови. В результате развивается нехватка красных клеток крови - эритроцитов, белых клеток крови - лейкоцитов и клеток крови, ответственных за свертывание крови - тромбоцитов.
ОСНОВНЫЕ СИМПТОМЫ ЗАБОЛЕВАНИЯ
- Кровоточивость
- Слабость, утомляемость
- Бледность
- Склонность к инфекциям
Перечисленные симптомы не являются характерными только для острого лейкоза и могут быть обнаружены при других заболеваниях.
ДИАГНОСТИКА ОСТРОГО ЛЕЙКОЗА
Диагноз острого лейкоза помогают поставить следующие виды исследований:
- Врачебный осмотр
- Общий и биохимический анализы крови
- Исследование костного мозга - в образце костного мозга, получаемом из грудины или подвздошной кости, при остром лейкозе выявляют замещение нормальных клеток незрелыми опухолевыми клетками (бластами).
- Специальное иммунологическое исследование - иммунофенотипирование
Иммунофенотипирование проводится методом проточной цитометрии и позволяет определить, к какому подвиду лейкоза принадлежит данное заболевание, что имеет большое значение для выбора оптимальной программы лечения. - Цитогенетическое и молекулярно-генетическое исследование - при цитогенетическом исследовании выявляют специфические хромосомные повреждения, наличие которых помогает определить подвид лейкоза и оценить агрессивность заболевания. В ряде случаев назначается молекулярно-генетическая диагностика, способная выявить генетические нарушения на молекулярном уровне.
- Дополнительные исследования - при некоторых формах лейкоза проводят исследование спинномозговой жидкости, чтобы определить есть ли в ней опухолевых клеток. Это важная информация используется при разработке программы лечения заболевания.
ФОРМЫ ОСТРЫХ ЛЕЙКОЗОВ
Выделяют две основные формы острого лейкоза - острый лимфобластный и острый миелобластный. Каждое из этих заболеваний подразделяется на множество подвидов, отличающихся по своими морфологическими, иммунологическими и генетическими свойствами, а также по подходам к их лечению. Подбор оптимальной программы лечения возможен только на основании точного диагноза заболевания.
Лечение больных острым лейкозом необходимо начинать сразу же после подтверждения диагноза, поскольку при отсутствии терапии заболевание развивается очень быстро. Терапия должна проводиться в специализированном гематологическом стационаре, имеющем необходимый опыт работы и соответствующее оснащение. Размещение должно проводиться в палатах не более чем на 2-х человек, с туалетом и душем. Важную роль играет вентиляция, обеспечивающая быстрое удаление из воздуха микробных тел, представляющих опасность для больных лейкозами, получающих химиотерапию.
Основное содержание лечения острого лейкоза - это химиотерапия, направленная на уничтожение лейкозных (бластных) клеток в организме больного. Кроме химиотерапии используют ряд вспомогательных методов в зависимости от состояния больного: переливание компонентов крови (эритроцитов, тромбоцитов), профилактику инфекционных осложнений, уменьшение проявлений интоксикации и др.
В соответствии с современными представлениями программа лечения острого лейкоза включает два этапа.
- Индукция ремиссии. Индукционная терапия - химиотерапия, направленная на максимальное уничтожение лейкозных клеток, с целью достижения полной ремиссии.
- Химиотерапия после достижения ремиссии. Химиотерапия поле достижения ремиссии обеспечивает предупреждение рецидива острого лейкоза.
На этом этапе лечения могут быть использованы различные подходы: консолидация, интенсификация и поддерживающая терапия.
- Консолидация используется после достижения полной ремиссии и проводится по тем же программам, которые применялись при индукции ремиссии.
- Интенсификация предполагает применение более активной химиотерапии, чем при индукции ремиссии.
- Поддерживающая терапия предполагает использование химиотерапевтических препаратов в дозах меньших по сравнению с этапом индукции, но в течение более длительного периода времени.
Кроме стандартных методов лечения существуют также и другие терапевтические подходы:
- Высокодозная химиотерапия с последующей трансплантацией стволовых кроветворных клеток (аутологичных или аллогенных).
- Трансфузии лимфоцитов донора
- Немиелоаблативная трансплантация стволовых кроветворных клеток
- Новые лекарственные препараты (нуклеозидные аналоги, дифференцирующие средства, моноклональные антитела).
На долю ОЛЛ приходится 75-80% всех опухолевых заболеваний кроветворной системы у детей (3-4 случая на 100 тысяч детей в год). Именно ОЛЛ – самое распространенное онкологическое заболевание у детей. Чаще всего ОЛЛ возникает в возрасте до 14 лет; пик детской заболеваемости приходится на возраст 2-5 лет. У мальчиков эта болезнь встречается чаще, чем у девочек.
Вероятность возникновения ОЛЛ несколько повышена у людей, ранее получавших лечение от какой-либо другой болезни (обычно злокачественной опухоли) с использованием облучения или определенных видов цитостатической химиотерапии. Также риск ОЛЛ повышен у детей с некоторыми генетическими нарушениями – например, с синдромом Дауна, нейрофиброматозом типа I или первичными иммунодефицитными состояниями.
Риск заболеть для ребенка выше среднего, если у его брата- или сестры-близнеца уже был диагностирован лейкоз.
Впрочем, в большинстве случаев лейкоза не удается обнаружить никакого из перечисленных факторов риска, и причины, вызвавшие болезнь, остаются неизвестными.
ОЛЛ характеризуется множеством различных признаков и у разных больных может проявляться по-разному. Большинство наблюдаемых симптомов, однако, обусловлено тяжелыми нарушениями кроветворения: избыток аномальных бластных клеток при ОЛЛ сочетается с недостаточным количеством нормальных функциональных клеток крови.
Обычно наблюдаются слабость, бледность, снижение аппетита, потеря веса, учащенное сердцебиение (тахикардия) – проявления анемии и опухолевой интоксикации. Недостаток тромбоцитов проявляется мелкими кровоизлияниями на коже и слизистых оболочках, кровотечениями из десен, носовыми и кишечными кровотечениями, кровоподтеками, синяками. Из-за накопления бластных клеток часто увеличиваются лимфоузлы – в частности, шейные, подмышечные, паховые. Нередко увеличиваются также печень и селезенка - как говорят, возникает гепатоспленомегалия.
Часто наблюдаются боли в костях и суставах, иногда возникают патологические (то есть вызванные заболеванием) переломы костей. Из-за недостаточного количества нормальных зрелых лейкоцитов возможны частые инфекции. Повышение температуры может наблюдаться как в связи с возникшей на фоне лейкоза инфекцией, так и из-за опухолевой интоксикации. Иногда одним из проявлений острого лейкоза является продолжительная ангина, плохо поддающаяся терапии антибиотиками.
В некоторых случаях ОЛЛ вызывает изменения и в других органах: глазах, почках, яичках у мальчиков и яичниках у девочек, причем у мальчиков поражение половых органов наблюдается чаще. Нередко возникает поражение центральной нервной системы - нейролейкемия.
Так как все наблюдаемые симптомы могут быть связаны и с другими заболеваниями и не специфичны для ОЛЛ, перед началом лечения необходима лабораторная диагностика, которая в срочном порядке производится в больничных условиях.
При ОЛЛ возникают изменения в обычном клиническом анализе крови: понижены уровни эритроцитов и тромбоцитов, появляются бластные клетки. Очень высокий лейкоцитоз возможен, но, вопреки распространенному мнению, наблюдается не во всех случаях. В целом же надежно поставить диагноз можно только при исследовании образца костного мозга; для этой цели необходима костномозговая пункция.
В ходе диагностики ОЛЛ также необходимо исследовать состояние центральной нервной системы. Анализ спинномозговой жидкости (ликвора) позволяет определить, нет ли у больного поражения центральной нервной системы – нейролейкемии. Образец ликвора для анализа получают посредством пункции спинномозгового канала.
Возможны и дополнительные диагностические процедуры для исследования пораженных лимфоузлов и внутренних органов – компьютерная томография (КТ), ультразвуковое исследование (УЗИ) и так далее.
Диагностические исследования позволяют для каждого конкретного больного определить ту или иную группу риска, от которой зависят прогноз заболевания и планируемое лечение. Так, говорят о стандартном риске, высоком риске и т.д. Отнесение к той или иной группе зависит от многих факторов. Перечислим некоторые из них.
- Возраст больного: менее благоприятным считается возраст до 1 года или старше 10 лет.
- Количество лейкоцитов: риск увеличивается при очень высоком лейкоцитозе в момент диагноза.
- Т-клеточный ОЛЛ у детей обычно определяет более высокий риск (худший прогноз) по сравнению с В-клеточным.
- Хромосомные аномалии в лейкемических клетках, связанные с числом хромосом и транслокациями. При некоторых из них усложняется лечение болезни и ухудшается прогноз. Так, особенно неблагоприятна филадельфийская хромосома – транслокация t(9;22). В то же время, например, транслокация t(12;21) связана с относительно хорошим прогнозом.
- Распространение ОЛЛ в другие органы, помимо костного мозга (например, возникновение нейролейкемии), определяет более высокий риск.
- При раннем или повторном рецидиве лейкоза риск значительно повышается.
Как упомянуто в предыдущем разделе, современное лечение ОЛЛ основано на разделении пациентов на группы риска – в зависимости от того, насколько вероятно у них достижение и сохранение ремиссии при одинаковой терапии. Соответственно, пациенты, относящиеся к группам более высокого риска (то есть те, у кого изначальный прогноз хуже), получают более интенсивную терапию, а в группах более низкого риска можно использовать менее интенсивную терапию и тем самым избегать излишней токсичности и тяжелых осложнений.
Терапия ОЛЛ, как правило, состоит из трех этапов:
Индукция ремиссии (то есть терапия, направленная на достижение ремиссии) проводится в течение нескольких первых недель лечения. Под ремиссией здесь подразумеваеся содержание менее 5% бластных клеток в костном мозге и отсутствие их в обычной (периферической) крови в сочетании с признаками восстановления нормального кроветворения.
В ходе индукции проводится интенсивная многокомпонентная химиотерапия лекарствами-цитостатиками, которые вызывают разрушение лейкемических клеток. На этом этапе могут применяться такие лекарства, как винкристин, гормоны-глюкокортикостероиды, аспарагиназа, антрациклины (даунорубицин и др.), иногда и другие препараты. Индукция позволяет достигнуть ремиссии более чем у 95% детей и у 75-90% взрослых с ОЛЛ.
Консолидация (закрепление) ремиссии направлена на уничтожение остаточных аномальных бластных клеток во избежание рецидива заболевания. Общая продолжительность этого этапа составляет несколько месяцев и сильно зависит от конкретного протокола лечения. В ходе курсов терапии на этапе консолидации могут использоваться метотрексат, 6-меркаптопурин, винкристин, преднизолон, а также циклофосфамид, цитарабин, даунорубицин, аспарагиназа и т.д.
На этапах индукции и консолидации введение химиотерапевтических препаратов производится в основном внутривенно, в условиях больничного стационара или стационара одного дня.
Поддерживающая терапия проводится для поддержания ремиссии, то есть для дополнительного снижения риска рецидива после этапов индукции и консолидации. Продолжительность поддерживающей терапии – 2-3 года. На этом этапе основными препаратами являются 6-меркаптопурин и метотрексат.
Поддерживающая терапия представляет собой этап наименее интенсивного лечения. Лекарства принимаются в виде таблеток, пребывание в больнице при этом не требуется.
Для лечения и профилактики нейролейкемии на перечисленных этапах химиопрепараты должны вводиться интратекально, то есть в спинномозговой канал посредством люмбальных пункций. Иногда лекарства вводят в желудочки (особые полости) головного мозга через специальный резервуар Оммайя, который устанавливается под кожей головы. Основной препарат, используемый для интратекального введения при ОЛЛ, - метотрексат; дополнительно также применяются цитарабин и глюкокортикостероиды. У некоторых пациентов используется и облучение головы – краниальное облучение.
К сожалению, несмотря на все перечисленные меры, иногда возникает рецидив ОЛЛ – костномозговой, экстрамедуллярный (то есть вне костного мозга – например, с поражением центральной нервной системы или яичек) или комбинированный. В этом случае проводится противорецидивная терапия. Выбор протокола лечения рецидива зависит от сроков его возникновения (ранний или поздний) и от того, является ли рецидив костномозговым или экстрамедуллярным. К сожалению, при раннем рецидиве шансы на успех терапии значительно снижаются.
В ходе лечения ОЛЛ может применяться трансплантация костного мозга от родственного или неродственного донора. Если по плану лечения предусмотрена трансплантация, то ее проводят после достижения ремиссии. Как правило, трансплантация показана только при высоком риске (например, после раннего рецидива), поскольку вероятность хорошего ответа на стандартную терапию при ОЛЛ в среднем высока, особенно у детей.
Химиотерапия ОЛЛ высокоэффективна, но зачастую тяжело переносится и может быть связана с серьезными побочными эффектами. Так, в процессе лечения подавляется кроветворение и бывают необходимы переливания компонентов донорской крови – тромбоцитов во избежание кровотечений при очень низком уровне собственных тромбоцитов больного, эритроцитов для борьбы с анемией. Переливания донорских лейкоцитов (гранулоцитов) применяются только в редких случаях при тяжелых инфекционных осложнениях.
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения необходимы эффективные антибактериальные и противогрибковые лекарства для профилактики и терапии инфекционных осложнений. Опасны как обычные, так и оппортунистические инфекции. В частности, серьезную проблему представляют такие грибковые инфекции, как кандидоз и аспергиллез.
Интенсивное лечение ОЛЛ накладывает серьезные ограничения на образ жизни больного. Необходимо соблюдать определенную диету и строгие гигиенические требования. Во избежание инфекций ограничиваются контакты с внешним миром. При очень низком уровне тромбоцитов нельзя не только допускать травмы, но даже, например, чистить зубы зубной щеткой - чтобы не спровоцировать кровотечение из десен. После достижения ремиссии строгость этих ограничений постепенно снижается. Врачи и медсестры сообщают каждому больному, что ему можно и что нельзя на текущем этапе лечения.
Без лечения ОЛЛ приводит к гибели больного в течение нескольких месяцев или даже недель. Однако использование современных протоколов лечения дает при ОЛЛ очень хороший результат: можно вылечить около 80% больных детей (некоторые источники приводят и более высокие цифры - например, до 85%). У взрослых, особенно пожилых, результаты хуже, но, тем не менее, примерно у 40% взрослых больных удается достичь стойкой ремиссии – то есть отсутствия рецидивов болезни в течение пяти и более лет, после чего человека можно считать здоровым.
Различные виды гематологических заболеваний требуют специфичных подходов. В каждом случае врач определяет свои методы и технологии оказания помощи пациенту.
Лечение больных острым лейкозом необходимо начинать сразу же после подтверждения диагноза, поскольку при отсутствии терапии заболевание развивается очень быстро. Терапия должна проводиться в специализированном гематологическом стационаре, имеющем необходимый опыт работы и соответствующее оснащение. Основное содержание лечения острого лейкоза - это химиотерапия, направленная на уничтожение лейкозных (бластных) клеток в организме больного. Кроме химиотерапии используют ряд вспомогательных методов в зависимости от состояния больного: переливание компонентов крови (эритроцитов, тромбоцитов), профилактику инфекционных осложнений, уменьшение проявлений интоксикации и др.
Программа лечения острого лейкоза включает два этапа:
1) Индукция ремиссии.
Индукционная терапия - химиотерапия, направленная на максимальное уничтожение лейкозных клеток, с целью достижения полной ремиссии.
2) Химиотерапия после достижения ремиссии.
Химиотерапия после достижения ремиссии обеспечивает предупреждение рецидива острого лейкоза.
На этом этапе лечения могут быть использованы различные подходы: консолидация, интенсификация и поддерживающая терапия.
- Консолидация используется после достижения полной ремиссии и проводится по тем же программам, которые применялись при индукции ремиссии.
- Интенсификация предполагает применение более активной химиотерапии, чем при индукции ремиссии.
- Поддерживающая терапия предполагает использование химиотерапевтических препаратов в дозах, меньших по сравнению с этапом индукции, но в течение более длительного периода времени.
Кроме стандартных методов лечения существуют также и другие терапевтические подходы:
- Высокодозная химиотерапия с последующей трансплантацией стволовых кроветворных клеток (аутологичных или аллогенных).
- Трансфузии лимфоцитов донора.
- Немиелоаблативная трансплантация стволовых кроветворных клеток.
- Новые лекарственные препараты (нуклеозидные аналоги, дифференцирующие средства, моноклональные антитела).
Выбор программы лечения лимфомы зависит от ее разновидности и состояния больного.
Индолентные лимфомы в отдельных случаях могут не требовать лечения, достаточным является наблюдение врача (гематолога или онколога). Однако появление первых признаков прогрессирования заболевания: увеличения лимфатических узлов, усиления слабости, повышения температуры тела и др. являются сигналом для начала лечения. При местно распространенных стадиях часто используют радиотерапию - облучение пораженных опухолью лимфатических узлов. При генерализованных стадиях предпочтение отдают химиотерапии.
Агрессивные лимфомы, как правило, требуют немедленного начала лечения. Одной из наиболее распространенных программ химиотерапии является программа CHOP в сочетании с применением моноклонального антитела Ритуксимаб.
Высокоагрессивные лимфомы лечатся по программам химиотерапии для острых лимфобластных лейкозов или сходных с ними. Целью лечения агрессивных и высокоагрессивных лимфом является излечение.
Одной из эффективных программ лечения агрессивных и высокоагрессивных лимфом является высокодозная химиотерапия с трансплантацией кроветворных стволовых клеток.
В случае вторичного тромбоцитоза проводится лечение основного заболевания, вызвавшего повышение количества тромбоцитов.
Независимо от морфологического варианта и стадии лимфогранулематоза конечная цель терапии - излечение заболевания.
При I-II-й стадиях заболевания вероятность излечения очень высока, но и при далеко зашедших стадиях адекватное лечение имеет хорошие шансы на успех.
При стадиях I и IIA лечение может проводиться методами лучевой терапии ± химиотерапия.
В случае стадий IIB и IIIA применяют методы лучевой терапии или химиотерапии.
При распространенных стадиях заболевания (стадии IIIB-IV) проводится 6-8 циклов стандартной химиотерапии.
При неблагоприятном течении лимфогранулематоза эффективным методом лечения является высокодозная химиотерапия с аутологичной трансплантацией костного мозга.
Новейшие технологии пересадки кроветворных стволовых клеток используются при заболеваниях крови (лимфомах, множественной миеломе, лейкозах), нервной системы (рассенном склерозе, миастении), аутоиммунных заболеваниях (ревматоидном артрите, системной красной волчанке, скеродермии, болезни Крона, неспецифическом язвенном колите). В сочетании с высокодозной иммуносупрессивной терапией методика пересадки стволовых клеток позволяет достичь превосходных результатов при большинстве аутоиммунных заболеваний.
В ходе лечения полностью устраняется главная причина заболевания - больные клетки иммунной системы, уничтожающие собственные здоровые ткани организма. Затем пациенту производят трансплантацию заранее заготовленных кроветворных стволовых клеток, полученных из костного мозга или крови. Стволовые клетки способны к многократному делению и длительному функционированию в организме пациента. Потомки кроветворных стволовых клеток дифференцируются в различные виды клеток крови и иммунной системы. Поэтому после введения кроветворных стволовых клеток у пациента восстанавливается здоровая иммунная система. В результате у больных, которым не помогали самые современные лекарства, в большинстве случаев наблюдается прекращение прогрессирования заболевания и значительное улучшение качества жизни.
Трансплантация кроветворных стволовых клеток применяется и при онкологических заболеваниях системы крови, где она помогает провести максимально интенсивное лечение опухоли химиопрепаратами, увеличивая его эффективность и предотвращая развитие нежелательных побочных эффектов. Эта область применения стволовых клеток хорошо изучена; трансплантация кроветворных стволовых клеток получила международное признание в качестве наиболее эффективного метода лечения ряда онкогематологических заболеваний.
При копировании материалов
ссылка на сайт обязательна.
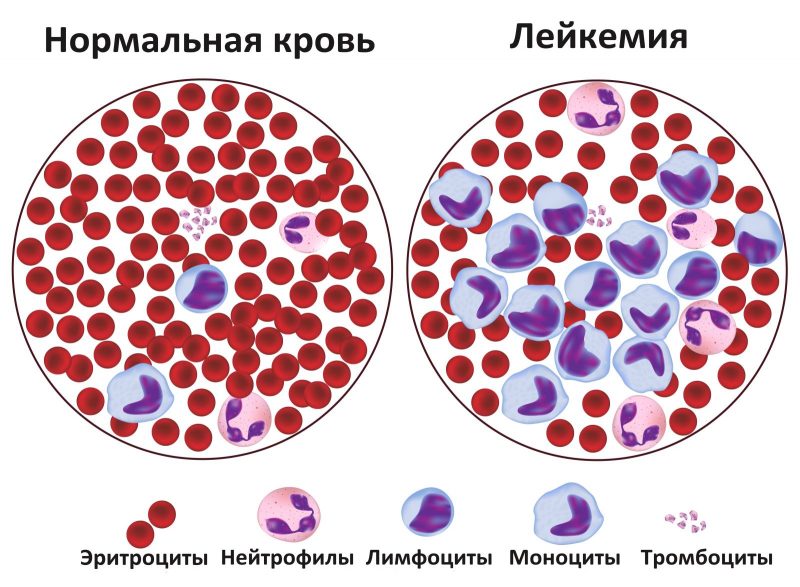
Кровь представляет собой жидкую ткань организма, которая состоит из красных и белых клеток. К первым относятся эритроциты и тромбоциты. Белые представлены гранулоцитами и агранулоцитами. Свое название они получили в результате микроскопического исследования: те клетки, в которых обнаружены гранулы, — гранулоциты. Соответственно, агранулоциты их не имеют. Каждая из фракций крови выполняет определенную функцию. При лейкозе нарушаются функции всех органов и систем человеческого организма.
В составе крови существует четкая пропорция соотношения красных клеток к белым. Ее изменение определяется как лейкоз, то есть разрастание клеток крови одного из ростков — белого или красного. Чаще всего опухолевым изменениям подвергаются белые ростки, поэтому лейкоз иначе называют лейкемией. Опухоль злокачественная, но не называется раком, потому что раковые клетки зарождаются только в эпителиальной ткани.
Причины развития лейкозов
Поражение ростков крови приводит к повреждениям зрелых клеток, которые имеют все признаки опухоли, следовательно, не выполняют полезных функций. Ростки называются мегалобластами, поэтому лейкозы имеют второе название — мегалобластозы. Их изменения происходят на генном уровне в результате необратимых мутаций. Этому способствуют следующие факторы:
- наследственная предрасположенность — чаще всего характерна для хронических лейкозов;
- радиационное поражение — одна из форм лучевой болезни;
- неблагоприятная экологическая обстановка — воздействие канцерогенных факторов;
- синдром иммунодефицита.
Опухоль зарождается в красном костном мозге. По мере развития лейкоза опухолевые клетки замещают здоровые ростки кроветворения. Попадая в общий кровоток, они метастазируют во все органы и ткани организма. Продолжая размножаться на новых местах локализации, клетки вновь циркулируют по кровеносной системе. В зависимости от того, на каком этапе кроветворения происходит генная мутация, лейкозы подразделяются на острые и хронические.
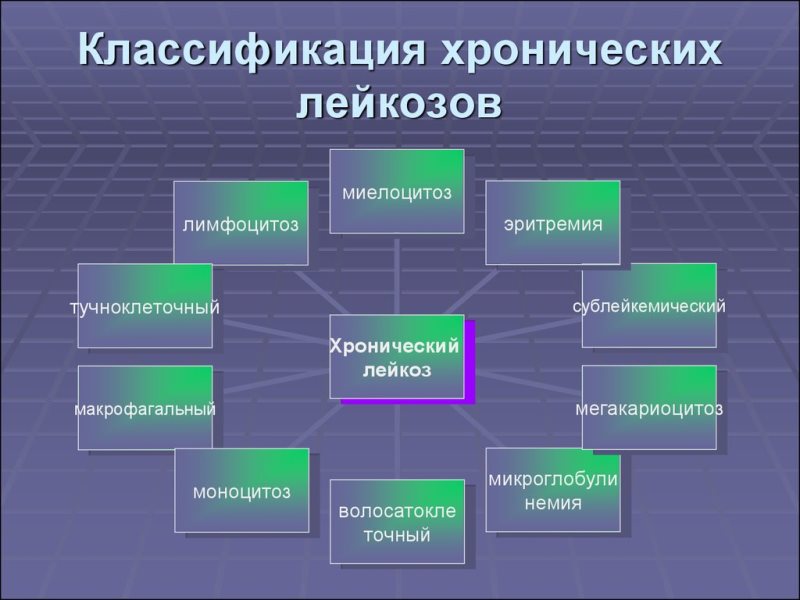
Классификация лейкозов
Классификация гемобластозов основана на морфологических признаках. Острый лейкоз развивается при поражении унипотентной, стволовой клетки крови. Названия хронических форм зависят от того, какие зрелые клетки крови поражены опухолью. Острая форма лейкоза никогда не станет хронической, которая, в свою очередь, по характеру течения ничем не отличается от острой.
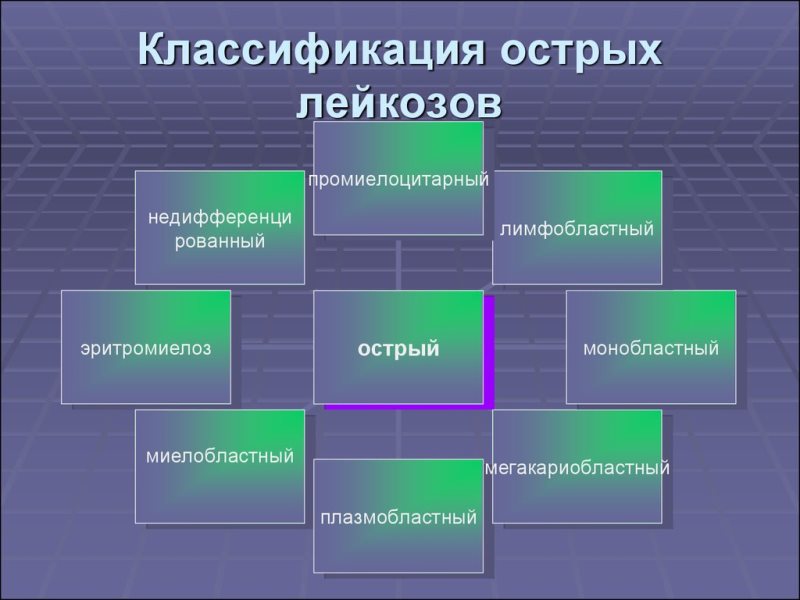
Формы острых лейкозов в зависимости от уровня поражения системы кроветворения:
- миелобластная — стволовые клетки;
- монобластная — моноциты (агранулоциты);
- лимфобластная — лимфоциты (гранулоциты);
- эритромиелобластная — предшественники эритроцитов;
- мегакариобластная — тромбоциты (мегакариоциты);
- недифференцированная — ростки всех клеток крови.
- миелоцитарные, нейтрофильные, эозинофильные, базофильные, миелоидные, тромбоцитемические, эритремические;
- лимфоцитарные — лимфолейкоз, парапротеинемические формы — миеломная и болезнь Сезари, макроглобулинемия Вальденстрема, болезнь Франклина;
- моноцитарные, миеломоноцитарные, гистиоцитоз X.
Симптомы лейкоза:
- боли в костях и суставах;
- кровоточивость;
- увеличение лимфатических узлов, печени, селезенки;
- состояние иммунодефицита — снижение сопротивляемости к инфекциям;
- менингит и энцефалит вследствие метастазов в головной мозг;
- общие явления интоксикации, лихорадка, быстрое похудение, слабость.
Диагностика лейкозов
Диагностические критерии определяются в лаборатории. В зависимости от того, какая именно клетка поражена, выставляется верный диагноз. Генетические исследования позволяют определить стадию и тяжесть опухолевого процесса. Обнаружение экспрессии определенных групп генов и филадельфийской хромосомы имеет значение для выбора препаратов для химиотерапии и своевременного решения о трансплантации красного костного мозга.
Лечение лейкоза
Независимо от формы заболевания, в первую очередь производится уничтожение всех опухолевых клеток — как в месте образования, так и в метастазах. При лейкозах применяется химиотерапия цитостатиками — препаратами, прекращающими рост опухоли. Подбираются средства, к которым чувствительны злокачественные клетки крови. После курса химиотерапии при острых лейкозах производится трансплантация красного костного мозга или проводится повторный курс лечения цитостатиками такой же длительностью и в такой же дозировке. Третий курс химиотерапии — профилактический. При хронических формах лейкоза применяется оперативное лечение и радиотерапия.
Читайте также:


