Интоксикация после обширной резекции кишечника

Введение. Острая кишечная непроходимость стабильно занимает ведущее место в структуре хирургической летальности, являясь одним из наиболее тяжелых осложнений заболеваний и повреждений органов брюшной полости, имеющая клиническую картину самостоятельного заболевания и представляющая собой комплекс нарушений со стороны всех органов и систем организма из-за развития энтеральной недостаточности [2, 4, 5].
Заживление кишечного анастомоза, формированного в условиях острой кишечной непроходимости, безусловно, протекает в отягощенных условиях из-за факторов, препятствующих нормальному течению процесса регенерации [1].
В настоящее время важное значение в замедлении заживления тканей кишечного анастомоза отводится энтеральной недостаточности, при которой пролонгируется эндогенная интоксикация, происходит транслокация микроорганизмов в крово- и лимфоток, а также в свободную брюшную полость [6].
В последние годы особый интерес представляют сведения о значимости процесса перекисного окисления липидов в заживлении кишечного анастомоза в отягощенных условиях, в частности при перитоните [3]. Показано, что этот патологический процесс может быть одним из значимых в срыве репаративной регенерации, а активность его зависит от многих факторов, в том числе от конструкционных особенностей соустья [1, 4].
Целью исследования явилось изучение процесса заживления тканей толстокишечного анастомоза в условиях острой кишечной непроходимости; установление сопряженности течения репаративного процесса с изменениями метаболизма регенерирующих тканевых структур.
Материалы и методы исследования. В основу работы положены результаты хронических опытов на 25 взрослых беспородных собаках, которые разделены на 2 группы. В первой группе (n=10) изучалось заживление толстокишечного анастомоза после резекции толстой кишки в неосложненных условиях. Во второй группе (n=15) исследовалось заживление толстокишечного анастомоза после резекции толстой кишки в условиях острой кишечной непроходимости.
При формировании анастомоза во всех группах опытов был использован классический двухрядный шов Ламбера – Альберта. Оба ряда соустья образовывали узловым викриловым (3/0 – 4/0) швом: внутренний ряд – через все слои кишечной стенки; наружный ряд – серозно-мышечный. Брюшную полость промывали изотоническим раствором хлорида натрия (0,89 %) и ушивали наглухо.
Во время операции после резекции толстой кишки и формирования кишечного соустья, а также на контрольных этапах периода наблюдения оценено функционально-метаболическое состояние тканей кишки в зоне анастомоза. С этой целью изучен их электрогенез путем измерения окислительно-восстановительного потенциала (редокс-метрия) и оценена диффузионная способность тканей для кислорода путем определения коэффициента диффузии кислорода. Для этого электрод (платиновый) помещали в ткани области анастомоза по его периметру в пяти точках. Полученные данные позволяли оценить трофику тканей соустья сразу же после его формирования и в динамике раннего послеоперационного периода.
В послеоперационном периоде животным указанных групп проводили антибактериальную и инфузионную терапию: внутримышечные инъекции 2 раза в сутки раствора гентамицина из расчета 0,8 мг/кг массы тела; внутривенно 1 раз в сутки 5 % раствор глюкозы и 0,89 % раствор хлорида натрия из расчета 50 мл/кг.
В раннем послеоперационном периоде наблюдали за общим состоянием животного, его поведением, аппетитом, характером и частотой стула, измеряли температуру тела, пальпировали брюшную полость. Этапы периода наблюдения за животными: 1, 3, 5, 7-е сутки. В контрольные этапы наблюдения животным под наркозом производили релапаротомию.
В работе использовали следующие методы исследования.
- Макроскопия на аутопсии и во время релапаротомии.
- Определение редокс-потенциала (окислительно-восстановительного потенциала (ОВП)) для изучения электрогенеза тканей.
- Определение коэффициента диффузии кислорода (КДК) в тканях на основе учета темпа падения диффузного тока восстановления по уравнению И.М. Эпштейна (Труфанов Л.А., 1991).
Полученные цифровые экспериментальные данные обработаны методом вариационной статистики с использованием критерия t Стьюдента. Вычисления и построение диаграмм, отражающих динамику изученных показателей, совершали с поддержкой программы Microsoft Excel XP. Применен текстовый процессор Microsoft Word XP.
Результаты исследования и их обсуждение. Отметим, что выбранный способ воспроизведения острой кишечной непроходимости полно и адекватно моделирует исследованную патологию. Наложение лигатуры на толстую кишку через двое суток приводило к формированию выраженной острой обтурационной толстокишечной непроходимости. Клинически отмечались основные признаки илеуса. В раннем послеоперационном периоде у животных отсутствовал стул, отмечалось увеличение живота, в ряде случаев была рвота. Подопытные животные отказывались от пищи, но воду охотно принимали. Они постоянно лежали, с трудом передвигались по вольеру.
Под внутривенным тиопентал-натриевым наркозом (0,04 г/кг веса) животным выполнялась операция: устранение острой кишечной непроходимости путем резекции толстой кишки с последующим восстановлением непрерывности желудочно-кишечного тракта посредством анастомозирования. При релапоротомии в брюшной полости выявлялось незначительное количество серозного экссудата. Толстая кишка выше препятствия была увеличена в диаметре за счет скопления в ней большого количества содержимого твердого характера.
При исследовании резецированного отдела толстой кишки выявлено, что в зоне наложения лигатуры в стенке органа возникали достаточно выраженные воспалительные явления как со стороны серозной, так и слизистой оболочек.
Отметим, что в приводящем отделе толстой кишки (выше зоны обтурации) видимые макроскопические изменения были особенно выраженными, причем как со стороны серозной, так и слизистой оболочек.
Хирургическую операцию животные перенесли удовлетворительно. Через 2–3 ч после вмешательства собаки просыпались. Они лежали в клетке, мало реагировали на попытку контакта с ними, не пытались встать. Через 12–18 ч начинали лакать воду.
Через одни-двое суток после хирургического вмешательства собаки поднималась, у них была одышка, повышалась температура тела до субфебрильных или фебрильных цифр (реже).
В первые двое-трое суток у собак отмечалось увеличение живота из-за вздутия, задержка стула и газов – признаки послеоперационного пареза кишечника. В последующие сроки состояние подопытных животных заметно улучшалось, регистрировались признаки активизации кишечной деятельности. Они начинали принимать пищу, передвигаться по вольеру, появлялся стул, который был полуоформлен с незначительным количеством крови и слизи.
Нами, как указано выше, изучен процесс заживления тканей по линии толстокишечного анастомоза в динамике. Оказалось, что заживление толстокишечного соустья протекало по типу вторичного натяжения или приближалось к этому типу.
При релапаротомии через сутки после операции резекции толстой кишки и формирования анастомоза установлено, что в брюшной полости имелся выраженный спаечный процесс. К области анастомоза были припаяны пряди большого сальника, которые легко отделялись от толстой кишки. В брюшной полости имелось незначительное количество экссудата серозного характера, который располагался в области анастомоза и малом тазу.
В области анастомоза после отделения спаек от толстой кишки выявлялись обширные кровоизлияния и гиперемия тканей. Видимых дефектов по линии швов не определялось.
На аутопсии во время исследования толстой кишки со стороны слизистой оболочки выявлено, что по линии швов вершины шовного валика, который был ориентирован в просвет органа, имелись участки некроза тканей с образованием обширного тканевого (язвенного) дефекта. Эти явления особенно четко определялись в области наложения внутреннего ряда швов.
Через трое суток после операции при оценке морфологического состояния брюшной полости выявлено, что в ней регистрировался достаточно выраженный спаечный процесс, особенно в области толстокишечного соустья. При отделении спаек от толстой кишки выявлено, что по линии швов анастомоза конец в конец со стороны серозной оболочки воспалительные явления сохранялись. Эта область кишечника была гиперемирована, с участками кровоизлияний, покрыта фибрином, особенно по линии швов.
При исследовании зоны толстокишечного анастомоза со стороны слизистой оболочки по линии швов определялся выраженный язвенный дефект, воспалительные явления в тканях, прилежащих к области соустья, уменьшались.
Через 5–7 суток после операции воспалительные явления в брюшной полости и толстой кишке, несущей анастомоз, существенно уменьшались. При релапаротомии установлено, что спаечный процесс регистрировался во всех случаях. К этому сроку раннего послеоперационного периода в брюшной полости экссудата не обнаруживалось. При разделении спаек по линии швов наружного ряда отмечались явления гиперемии, кровоизлияний.
Следует подчеркнуть, что толстокишечный анастомоз конец в конец, формированный по способу Ламбера – Альберта в условиях толстокишечной непроходимости, не всегда оказывался надежным. В трех наблюдениях отмечена несостоятельность швов с развитием местного или общего перитонита.
На аутопсии двух животных при разделении спаек по линии швов выявлен некроз тканей с развитием дефекта в стенке толстой кишки. Отметим, что в начальные сроки после операции дефект в стенке ограничивался спаечным перипроцессом. Поэтому общего перитонита у этих животных не возникало.
Таким образом, в условиях острой толстокишечной непроходимости после резекции толстой кишки и формирования первичного двухрядного анастомоза по способу Ламбера –Альберта заживление соустья протекало по типу вторичного натяжения и с развитием в ряде случаев несостоятельности швов.
Перед нами стояла задача исследовать причины такого неблагоприятного течения репаративного процесса в отягощенных острой кишечной непроходимостью условиях. Для решения этой задачи применены биофизические исследования, оценивающие трофику тканей по линии соустья. Такого рода исследования позволили достаточно углубленно определить сопряженность репаративного процесса с трофикой тканей регенерирующих структур.
Уже во время операции после резекции толстой кишки и формирования кишечного соустья выявлены существенные нарушения трофики тканей анастомоза. Установлено, что окислительно-восстановительный потенциал в области соустья после его формирования существенно падал и составил –48,14 ± 1,24 мВ, что было ниже нормы на 27,2 % (р

Рак толстого кишечника в последние годы привлекает особое внимание ученых и клиницистов в связи с неуклонным ростом заболеваемости данной патологией, прежде всего в социально-экономических развитых странах. Каждый год на планете диагностируется более 800 тыс. вновь выявленных пациентов с колоректальным раком и 440 тыс. смертей от него, при этом общее количество больных составляет 3,5 млн человек [2, 3, 6]. Несмотря на внедрение новых медицинских технологий и значительные достижения в онкологии и хирургии, по-прежнему продолжается рост числа больных с осложненными формами колоректального рака. Так, в 2001 г. было зарегистрировано 24 849 вновь заболевших раком ободочной и 20 541 – раком прямой кишки. В 2003 году (10 лет назад) в России выявлено 50 689 новых случаев заболевания, на данный момент имеется тенденция роста данной нозологической единицы [1, 5].
В 2003 году в России от данной патологии умерло 36 036 человек [1, 5]. Прирост стандартизированных показателей смертности за последнее десятилетие наиболее выражен при раке ободочной кишки за счет осложнений в послеоперационном периоде – 13,3 % [5, 6]. Основной причиной летальности при данной патологии является отсутствие раннего выявления злокачественных заболеваний толстой кишки и развившихся осложнений [4, 7].
Цель исследования: анализ осложнений в периоперационном периоде хирургического лечения больных раком толстого кишечника.
Материал и методы исследования
С 2010 по 2012 годы в клинике кафедры госпитальной хирургии медицинского факультета им. Т.З. Биктимирова Ульяновского государственного университета г. Ульяновска пролечено 196 больных по поводу осложненных форм рака толстой кишки. Мужчин было 101 человек (51,5 %), женщин – 95 (48,5 %) в возрасте от 36 до 86 лет. Анализ возрастного состава больных показал, что 138 (70,4 %) пациентов были пожилого и старческого возраста, опухолевый процесс у которых был отягощен сопутствующими заболеваниями сердечно-сосудистой системы, органов дыхания и мочевыделительной системы, а также нарушениями обменных процессов. И 58 (29,6 %) пациентов были молодого и среднего возраста. Диагностика распространенности рака ободочной кишки, выявление осложнений опухолевого процесса, а также сопутствующих заболеваний основывались на комплексе клинико-инструментальных обследований, который включал лабораторные, рентгенологические, ультразвуковые, эндоскопические и морфологические методы диагностики.
В зависимости от осложнений злокачественных опухолей толстой кишки было выделено четыре группы пациентов, представленные в таблице, в клинической картине которых преобладали основные симптомы: первая группа – острая толстокишечная непроходимость – 98 (50,0 %), вторая группа – воспалительные параканкрозные осложенения с элементами абсцедирования – 45 (23,0 %), третья группа – перфорация опухоли с развитием перитонита различной распространенности – 28 (14,3 %), четвертая группа – профузное кишечное кровотечение – 25 (12,7 %).
Группы пациентов, распределённые по клиническим проявлениям
Симптомы рака толстого кишечника
Острая толстокишечная непроходимость
Воспалительные параканкрозные осложенения с элементами абсцедирования
Перфорация опухоли с развитием перитонита
Профузное кишечное кровотечение
Большая часть выявленных осложнений отмечена у пациентов с раком сигмовидной и слепой кишок – 78 %. Осложненные опухоли в 36 % случаев (n = 70) локализовались в правой половине ободочной кишки, в 59 % (n = 116) – в левой, в поперечной ободочной кишке у 5 % (n = 10) больных.
Наибольшее количество больных с вновь диагностированным колоректальным раком приходится на 3–4 стадию заболевания [1, 2]. По нашим данным, у большинства оперированных пациентов – 123 (62,7 %) – выявлена III стадия, у 54 (27,5 %) – IV стадия рака ободочной кишки и лишь у 19 (9,8 %) – II стадия.
При анализе данных обследования и клинической картины, изучении операционных находок и морфологического материала не было обнаружено зависимости распространения процесса от пола и возраста больных. Во всех группах больных по данным гистологического исследования основное место занимали аденокарциномы различной степени дифференциации – 80,8 %, гораздо реже встречались перстневидно-клеточные и недифференцированные формы рака (7,1 и 12,1 % соответственно).
В 45 % наблюдений во время оперативного вмешательства было обнаружено метастатическое поражение регионарных лимфатических узлов, отдаленные метастазы выявлены у 27 % обследованных с наиболее частой локализацией в печени (62 %), легких (12 %), канцероматоз брюшины выявлен в 18 % наблюдений.
Результаты исследования и их обсуждение
Острая обтурационная толстокишечная непроходимость (n = 98 (50 %)) являлась самой частой формой осложнений рака ободочной кишки. Причем в 75 % это были больные старше 60 лет. Преобладающее число пациентов с этим осложнением составили больные с опухолями сигмовидной (n = 54 (53,3 %)) и слепой (n = 29 (31 %)) кишок. В эту группу вошли больные с декомпенсированным нарушением проходимости ободочной кишки и при отсутствии эффекта от консервативных мероприятий, направленных на разрешение непроходимости кишечника. Клинически у всех были отмечены анемия, интоксикация, гипопротеинемия и нарушение водно-электролитного баланса. В 59 % наблюдений отмечены проявления токсико-анемичного синдрома преимущественно у пациентов с локализацией опухоли в правых отделах ободочной кишки. Неблагоприятным явился тот факт, что у 21 (22 %) больного обтурационная непроходимость сочеталась с опухолевым перифокальным воспалением, у 12 (11 %) – имела место перфорация опухоли в свободную брюшную полость с развитием разлитого перитонита, у 4 (4 %) – с пенетрацией опухоли в брыжейку тонкой кишки с развитием абсцесса. Предоперационная подготовка заключалась в проведении лечебных мероприятий, направленных на коррекцию водного и белково-электролитного баланса, кислотно-щелочного состояния, купирования интоксикации.
Объем операции при обтурационной непроходимости ободочной кишки зависел от локализации опухоли, степени непроходимости, состояния толстой кишки, характера метастазирования, тяжести общего состояния и наличия сопутствующих заболеваний. Из 70 оперированных пациентов с локализацией опухоли в правых отделах ободочной кишки в 21,2 % (n = 15) случаев выполнили правостороннюю гемиколэктомию с наложением илеотрансверзанастомоза и интраоперационную декомпрессию тонкой кишки. Восьми (11,4 %) пациентам с локализацией нерезектабельной опухоли в печеночном изгибе и восходящем отделе ободочной кишки были выполнены паллиативные симптоматические операции – наложение илеотрансверзанастомоза с обязательной зондовой назоинтестинальной декомпрессией, пятерым пациентам (7,1 %) этой группы при наличии тяжелой сопутствующей патологии наложена разгрузочная цекостома. При IV стадии онкологического процесса с наличием отдаленных метастазов, но при технически возможной резектабельности опухоли считали правомочным выполнение паллиативной санационной правосторонней гемиколэктомии с первичным наложением анастамоза.
При раке левой половины и поперечно-ободочной кишок, осложненных кишечной непроходимостью, у 71 (61,2 %) пациента выполнены резекции сегмента кишки со стенозирующей опухолью с последующим ушиванием дистального отрезка кишки и выведением проксимального конца в виде одноствольной колостомы на переднюю брюшную стенку по типу операции Гартмана. При неоперабильности опухоли 45 (38,7 %) пациентам были наложены разгрузочные трансверзо- и сигмостомы.
Умерли после операции 12 (12,2 %) пациентов от прогрессирующей раковой интоксикации и декомпенсации сопутствующей патологии.
Параканкрозные воспалительные процессы осложняют клиническое течение рака ободочной кишки. По нашим данным, воспалительные изменения в опухоли, выходящие за пределы кишечной стенки, составили 22,9 % (n = 45). У большинства пациентов (n = 38 (84 %)) опухоль с перифокальным воспалением локализовалась в правой половине ободочной кишки, что клинически проявлялось токсико-анемичным синдромом. И только у 7 (16 %) пациентов воспалительный процесс локализовался при опухолях селезеночного изгиба и сигмовидной кишки.
Клинические проявления в этой группе зависели от степени выраженности и характера воспалительной реакции тканей вокруг опухоли (стадии развития опухолевого процесса, локализации опухоли, реактивности организма больного). В 87 % случаев эти больные поступали по неотложным показаниям с симптоматикой острых хирургических заболеваний органов брюшной полости или забрюшинного пространства. Сложность дифференцировки перифокального воспаления, обусловленного опухолью или доброкачественной воспалительной инфильтрацией стенки ободочной кишки (при дивертикулите, болезни Крона, неспецифическом язвенном колите), позволяла разрешить эндоскопическое исследование. При ирригоскопии определялся суженный участок ободочной кишки, неровность рельефа слизистой, выход контрастного вещества за пределы кишечной стенки, что не позволяло отдифференцировать опухолевое поражение от доброкачественного воспалительного процесса. В сомнительных случаях при наличии положительных симптомов раздражения брюшины, а также в связи с дифференциальной диагностикой острой хирургической патологии органов брюшной полости у 8 (17,7 %) пациентов была выполнена диагностическая лапароскопия, которая позволила определить характер воспалительного процесса и его распространенность. У 22 больных (51,1 %) этой группы при отсутствии симптомов перитонита и прогрессирования воспалительного процесса предпринята выжидательная тактика, позволяющая выполнить операцию в плановом порядке после купирования воспалительного процесса путем проведения курса антибактериальной и детоксикационной терапии. Однако у 15 (33,3 %) из 45 больных с клиникой прогрессирования перитонита и кишечной непроходимости пришлось выполнить экстренные оперативные вмешательства.
При локализации опухоли в правых отделах, печеночном изгибе, правой трети поперечной ободочной кишки с распространением воспалительной инфильтрации на брыжейку у 25 (55,5 %) больных была выполнена расширенная правосторонняя гемиколэктомия с адекватным дренированием забрюшинной клетчатки и брюшной полости в зоне оперативного пособия. При левосторонней локализации (n = 8 (16 %)) выполняли операцию типа Гартмана, так как наличие даже умеренного перифокального воспаления тканей в зоне оперативного вмешательства не создают условия для безопасного наложения первичного толстокишечного анастомоза, тем более при наличии параканкрозных абсцессов.
Тяжелым осложнением при раке ободочной кишки является перфорация кишечной стенки. Перфорацию кишечной стенки в зоне опухоли и диастатическую перфорацию проксимальнее опухоли мы наблюдали у 28 (14,2 %) больных. Значительно чаще это осложнение развивалось при поражении левых отделов ободочной кишки (n = 26 (92,8 %)) с перфорацией опухоли вследствие ее распада. Перфорация вне зоны опухоли от пролежня каловым камнем или перерастяжения кишечной стенки при обтурационной непроходимости выявлена у 2 (7,2 %) больных. Обнаруженные осложнения позволяют предполагать, что ведущим этиологическим фактором при диастатической перфорации кишки являются сосудистые расстройства и дистрофические изменения стенки кишки, тогда как основной причиной перфорации самой опухоли явились нарушения кровоснабжения с последующей ишемией и некрозом. Во всех случаях перфорации обнаружены при III и IV стадии заболевания преимущественно у пациентов пожилого и старческого возраста.
Исходы лечения в этой группе пациентов характеризовались наибольшим количеством осложнений и летальных исходов (n = 12, что составило 42,8 %).
Кишечные кровотечения являются нередким осложнением рака ободочной кишки. Мы наблюдали 25 (12,7 %) больных с профузными (n = 7, то есть 28 %) и рецидивирующими (n = 18 соответственно 72 %) кровотечениями из опухолей толстой кишки. Локализация опухолей, явившихся источником профузного кровотечения, по нашим данным была преимущественно в левой половине ободочной кишки (92 %), тогда как для рецидивирующих кровотечений более характерна правосторонняя локализация опухоли (8 %). Как правило, возникновение обильных кровотечений связано с аррозией сосудов при распаде опухолевой ткани.
Клиническая картина кишечного кровотечения проявляется значительной слабостью пациентов, анемией и кровянистыми выделениями или кратковременными периодическими кровотечениями из прямой кишки. Длительность существования этих признаков у 20 пациентов (80 %) превышала несколько месяцев. Эти больные длительно лечились и обследовались по поводу анемии, которая в определенной степени была связана не только с кровотечением, но и с раковой интоксикацией. Половина пациентов этой группы (n = 13, что составило 52 %) поступила в стационар с анемией тяжелой степени и требовала заместительных гемотрансфузий.
В диагностический алгоритм этой группы пациентов нами включены эндоскопия и ультразвуковая диагностика, которые в 72 % случаев помогли поставить правильный диагноз. Проведение экстренной диагностической фиброколоноскопии у 5 (20 %) больных было затруднительным вследствие невозможности адекватной подготовки кишечника к исследованию из-за наличия сгустков крови и поступления её из проксимальных отделов кишки, затрудняющих визуализацию и идентификацию источника кровотечения.
В связи с отсутствием эффекта от гемостатической терапии и невозможностью выполнения эндоскопического гемостаза 2 пациента с профузным кишечным кровотечением опухолевого генеза были оперированы по жизненным показаниям в ургетном порядке, выполнена правосторонняя гемиколэктомия. Крайне тяжелое состояние двух пациентов старческого возраста с анемией тяжелой степени позволило выполнить только паллиативные резекции сигмовидной кишки с кровоточащей опухолью по типу операции Гартмана. Эта группа пациентов с геморрагическими осложнениями опухолей ободочной кишки характеризовалась наименьшим количеством послеоперационных осложнений и двумя летальными исходами.
У 166 (84,7 %) пациентов удалось выполнить радикальную операцию. Умерло 26 пациентов, следовательно, послеоперационная летальность составила 13,3 %. Наибольшее количество осложнений в послеоперационном периоде выявлено у больных с перфорацией опухоли и развитием перитонита.
Таким образом, непосредственные результаты хирургического лечения больных осложненным течением рака ободочной кишки находятся в прямой зависимости от своевременной диагностики основного заболевания и его осложнения, обоснованной хирургической тактики, выбора способа и техники выполнения оперативного вмешательства, а также от полноценной профилактики и терапии послеоперационных осложнений.
Несмотря на современный уровень организации и оснащенность медицинской помощи, ранняя диагностика рака толстого кишечника остается на низком уровне, и выявление данной патологии происходит на поздних стадиях, что способствует увеличению периоперационных осложнений.
Рецензенты:
Записаться на консультацию +7 921 903-04-03
Отдел абдоминальной онкологии ПСПбГМУ им. И. П. Павлова осуществляет лечение рака кишечника. Уровень оказываемой учреждением медицинской помощи соответствует мировым стандартам.
Кишечник человека состоит из двух отделов — тонкой и толстой кишки. Новообразования в данной области встречаются со следующей периодичностью:
- 50 % — в двенадцатиперстной кишке;
- 30 % — в тощей;
- 20 % — в подвздошной.
Примерно 50 % новообразований толстой кишки обнаруживаются в слепой и сигмовидной кишке. Заболеваемость раком за последние 20 лет увеличилась в несколько раз. Наиболее часто колоректальный рак встречается у пациентов мужского пола. Онкопатологии кишечника диагностируются у 18 из 100 тысяч человек.
Узнать цены на платные услуги
| Услуга | Цена |
| Ректороманоскопия жестким ректоскопом | 880 р |
| Видеоколоноскопия тотальная | 4 500 р |
| Биопсия толстой кишки с помощью эндоскопии Без стоимости основного исследования | 440 р |
| Резекция поперечно-ободочной кишкиГистологическое исследование оплачивается дополнительно | 20 900 р |
| Правосторонняя, левосторонняя гемиколонэктомияГистологическое исследование оплачивается дополнительно | 25 300 р |
| Операция Гартмана (резекция сигмовидной кишки с колостомой)Гистологическое исследование оплачивается дополнительно | 23 100 р |
| Формирование anus praeternaturalis | 19 800 р |
| Передняя резекция прямой кишкиГистологическое исследование оплачивается дополнительно | 24 200 р |
| Брюшно-анальная резекция прямой кишки с низведениемГистологическое исследование оплачивается дополнительно | 25 300 р |
| Брюшно-промежностная экстирпация прямой кишкиГистологическое исследование оплачивается дополнительно | 33 000 р |
| Наложение обходного межкишечного анастомоза | 16 500 р |
| Реконструктивная операция на кишечнике, 1 категория сложности | 27 500 р |
| Реконструктивная операция на кишечнике, 2 категория сложности | 38 500 р |
Причины и симптоматика
Факторы, способствующими возникновению рака кишечника:
- особенности рациона (дефицит растительной клетчатки при обилии продуктов животного происхождения);
- ректальные полипы и местные воспалительные процессы;
- преклонный возраст;
- генетическая предрасположенность.
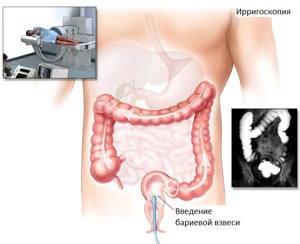
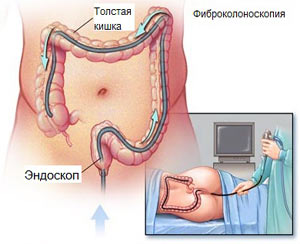
Диагностика
Кроме этого, развитию рака способствует наличие папилломавирусной инфекции, работа с асбестом и анальный секс.
Онкологический процесс оценивается в соответствии с международной классификацией TNM.
Симптомы заболевания зависят от локализации новообразования. Показания для проведения незамедлительного специфического обследования:
- потеря веса;
- метеоризм;
- неустойчивый стул;
- рвота;
- периодические спазмы и боли в области живота;
- интоксикация.
При разрушении кишечника опухолью показано экстренное лечение. Процесс сопровождается перфорацией, кровотечением и перитонитом. При сдавливании стенок кишечника или соседних органов возможно развитие непроходимости, желтухи, панкреатита и асцита.
Современные подходы к лечению опухолей кишечника
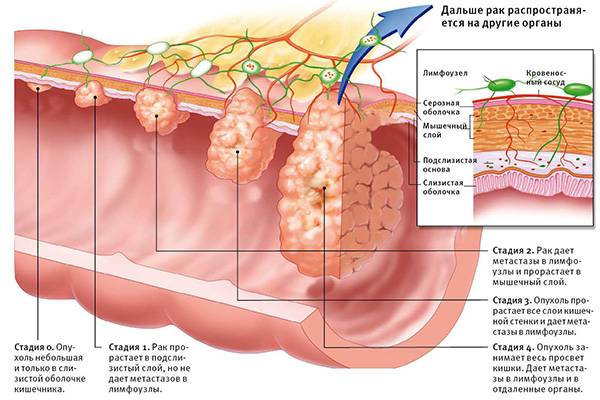
Стадии рака кишечника
Лечение рака направлено на удаление новообразования вместе с близлежащими тканями и региональными лимфоузлами. После их иссечения формируется герметичный анастомоз. При опухолях сигмовидной кишки лечение предполагает временное выведение колостомы на переднюю брюшную стенку.
При обширном онкологическом процессе, выходящем за пределы кишечника, в ходе операции, помимо удаления новообразования и резектабельных метастазов, выполняется частичное иссечение пораженных органов. Вмешательства выполняются как открытым, так и лапароскопическим способом (без широкого рассечения брюшной полости). Оптимальная методика радикального лечения опухоли кишечника определяется по результатам обследования пациента.
В тяжелых и запущенных случаях, при неоперабельном раке и кишечной непроходимости показана паллиативная терапия, направленная на спасение жизни и облегчение состояния больного. Без резекции опухоли колостома выводится на переднюю брюшную стенку. При операбельном раке показанием для такого вмешательства является необходимость разгрузки кишечника от каловых масс перед последующим удалением новообразования.
Тактика лечения колоректального рака
При локализации новообразования в дистальном отделе кишечника показана комбинированная терапия. Она включает в себя:
- хирургическое вмешательство;
- химиотерапию;
- лучевую терапию;
- таргетную терапию (направленное уничтожение раковых клеток при сохранении здоровых).
На ранней стадии болезни (категория Т1-Т2) выполняется местное иссечение опухоли с последующим наблюдением пациента. При наличии показаний в дальнейшем может быть проведено хирургическое вмешательство.
Тактика лечения опухолей кишечника определяется исходя из распространенности онкологического поражения и его близости к анальному сфинктеру. В ходе операции мышца, сжимающая сфинктер, может быть удалена либо сохранена. В результате вмешательства формируется временный либо постоянный противоестественный задний поход. При локализации опухоли в верхних отделах кишечника возможно наложение анастомозов без выведения колостомы.
Обращение к специалисту на ранней стадии болезни обеспечивает хорошие результаты лечения, а также благоприятный прогноз. Передовые методики лечения колоректального рака в отделе абдоминальной онкологии ПСПбГМУ им. И. П. Павлова позволяют сохранять не только жизнь пациента, но и ее качество.
Преимущества нашей клиники

многопрофильность и
оснащенность всех
отделений

собственные
диагностические и
лабораторные центры;

кадровый потенциал –
в клинике работают более
600 кандидатов наук,
докторов и профессоров,
а также 5 академиков;

квалифицированная медицинская
помощь пациентам, имеющим
различные основные и
сопутствующие патологии
--> Вопрос: Нашей маме удалили опухоль толстой кишки (была на 18 см), вывели наружу кишечник, врачи сказали, что это на время, и операцию по ее соединению необходимо сделать через 2-3 месяца. Скажите, делаете ли Вы такие операции?
Ответ: Данное хирургическое вмешательство называется операцией по восстановлению непрерывности толстой кишки. Да, в нашем отделении выполняются такие оперативные вмешательства. Свяжитесь с нами по нашему контактному телефону, и мы назначим время для очной консультации, чтобы обсудить Вашу ситуацию и возможные сроки госпитализации.
Нашей маме удалили опухоль толстой кишки (была на 18 см), вывели наружу кишечник, врачи сказали, что это на время, и операцию по ее соединению необходимо сделать через 2-3 месяца. Скажите, делаете ли Вы такие операции?
Ответ: Данное хирургическое вмешательство называется операцией по восстановлению непрерывности толстой кишки. Да, в нашем отделении выполняются такие оперативные вмешательства. Свяжитесь с нами по нашему контактному телефону, и мы назначим время для очной консультации, чтобы обсудить Вашу ситуацию и возможные сроки госпитализации.

Трушин Антон Александрович
врач-хирург онкологического
отделения №1
В 2010 году окончил лечебный факультет Санкт-Петербургского Государственного Медицинского Университета им. акад.
И.П. Павлова
В 2010 году окончил лечебный факультет Санкт-Петербургского Государственного Медицинского Университета им. акад.
И.П. Павлова

Скуридин Паата Михайлович
В 2001 году окончил Санкт-Петербургский Государственный Медицинский Университет им. акад. И.П. Павлова по специальности лечебное дело.

Тен Олег Андреевич

Купенская Татьяна Владимировна
В 2001г. окончила Санкт-Петербургский Государственный Университет им. акад. И.П. Павлова.
С 2002г. по 2003г. проходила клиническую ординатуру в НИИ онкологии им. Н.Н. Петрова на химиотерапевтическом отделении.

Смирнов Александр Александрович
В 1997 году поступил на педиатрический факультет Санкт-Петербургской Государственной Педиатрической Медицинской Академии, которую закончил в 2004 году.
В том же году поступил в интернатуру по хирургии в СПбМАПО, которую закончил в 2005 году.

Блинов Егор Владимирович
В 2011 году окончил лечебный факультет Санкт-Петербургского Государственного Медицинского Университета им. акад. И.П. Павлова.

Марина Магомедовна Саадулаева
Читайте также:


