Суперинфекция кандидоза что это такое
Известно, что грибковые инфекции занимают одну из ключевых позиций среди заболеваний слизистой оболочки полости рта по распространенности среди населения и тяжести возможных осложнений для организма пациента.
В последние годы во всем мире, и особенно в развитых странах, наблюдается значительное увеличение числа грибковых заболеваний, вызываемых дрожжеподобными грибами рода Candida.
Согласно последним исследованиям, кандидоз слизистой оболочки рта относится к наиболее распространенным заболеваниям, что подтверждается увеличением его распространенности среди других заболеваний слизистой оболочки рта до 63% [30].
Основываясь на данных современных литературных источников, лечение кандидоза должно быть комплексным, с повторными курсами и индивидуальным подходом. При проведении лечебных мероприятий учитывают этиологию, характер и продолжительность заболевания 16.
Кандидоносительство статистически определяется у 5% младенцев, у лиц же пожилого возраста этот показатель увеличивается до 60% [6]. Однако истинное проявление патогенных свойств грибов рода Candida зависит главным образом от состояния макроорганизма. Главную роль в развитии кандидоза играет ослабление иммунной системы. Именно состояние функциональной системы ротовой полости у каждого индивидуума с учетом его возраста, гигиенических навыков и других факторов характеризует экосистему в целом. Кандидоз возникает, как правило, на фоне более или менее выраженного иммунодефицита или дисбаланса иммунной системы [14].
Развитию кандидоза могут способствовать тяжелые сопутствующие заболевания: злокачественные новообразования, ВИЧ-инфекция, туберкулез, эндокринопатии (сахарный диабет, гипотиреоз, гипопаратиреоз, гипо- и гиперфункция надпочечников). Заболевания желудочно-кишечного тракта, особенно пониженная кислотность желудочного сока и ахилия, часто обусловливают развитие кандидоза слизистой оболочки рта.
Возникновению кандидоза слизистой оболочки полости рта способствует длительное лечение кортикостероидными препаратами, цитостатиками, которые подавляют иммунную систему организма и усиливают вирулентность дрожжеподобных грибов [15].
Однако следует отметить, что используемые большинством пародонтологов антисептики при их разведении ротовой жидкостью явно снижают свою активность, а некоторые антисептики, например, хлоргексидин, оказывают побочное действие [6,13,23 и др.]. Что касается применяемых в настоящее время иммунотерапевтических препаратов, то иммуномодулятор левамизол обладает пирогенными свойствами [24], а имудон эффективен лишь при легких формах заболеваний пародонта [3].
Вследствие широкого применения антибиотиков за последние годы значительно увеличилось количество больных кандидозом слизистой оболочки рта. Длительный прием антибиотиков нарушает состав резидентной микрофлоры полости рта, в результате чего формируется дисбактериоз. Происходят угнетение резидентной микрофлоры полости рта и резкий рост вирулентности условно патогенных грибов рода Candida, вызывающих заболевание слизистой оболочки рта (суперинфекция, аутоинфекция). Прием антибиотиков может вызвать также дисбактериоз кишечника, следствием чего являются гипо- и авитаминозы В, В2, В6, С, РР, что в свою очередь отрицательно сказывается на функциональном состоянии слизистой оболочки рта (она становится подверженной влиянию кандидозной инфекции).
В настоящее время, с учетом всего вышеперечисленного, кандидоз рассматривается как иммуннодефицитное состояние, возникшее в результате существенной разбалансировки экосистемы в целом. Такое представление о заболевании обуславливает принципиальную необходимость комплексного лечения кандидоза, в состав которого будут непременно включаться:
- мероприятия, направленные на устранение местных проявлений заболевания;
- мероприятия для системного лечения проявлений кандидоза;
- мероприятия, направленные на восстановление и нормализацию функций иммунной системы.
Материалы и методы исследования
Таблица 1. Общее количество пациентов
| Возраст | Количество пациентов | ||
| муж. | жен. | Всего | |
| 20-30 | 5 | 7 | 12 |
| 31-40 | 10 | 8 | 18 |
| 41-50 | 9 | 11 | 20 |
| Общее число | 24 | 26 | 50 |
По мнению Шумского А.В. (2009), системная терапия кандидоза слизистой оболочки рта назначается при определенных показаниях: хронический гиперпластический кандидоз, эрозивно-язвенная форма кандидоза, кандидоз рта на фоне сахарного диабета, иммунодефицитного состояния, при неэффективной местной терапии [32].
В схему местного лечения входит комплекс мероприятий, включающих профессиональную гигиену полости рта, санацию рта, ортопедическое лечение, коррекцию протезов и др. [7].
По данным современных литературных источников, используемые в лечении кандидоза противогрибковые средства подразделяются на полиеновые антибиотики (нистатин), азольные соединения (флуконазол), аллиламиновые средства (нафтифин и тербинафин), смешанные вещества (антисептики, щелочные полоскания и анилиновые красители) [31].
Антисептическим препаратом из группы четвертичных аммониевых соединений является Мирамистин ® , который обладает широким спектром антимикробного действия, включая госпитальные штаммы, резистентные к антибиотикам.
Рис. 1. Бензилдиметил[3-(миристоиламино)пропил] аммоний хлорид, моногидрат

Активное вещество препарата -бензилдиметил[3-(миристоиламино) пропил]аммоний хлорид, моногидрат - относится к классу поверхностно-активных веществ (см. рис. 1).
Проведенные экспериментальные исследования показали, что препарат оказывает выраженное бактерицидное действие в отношении грамположительных (Staphylococcus spp., Streptococcus spp., Streptococcus pneumoniae и др.), грамотрицательных (Pseudomonas aeruginosa, Escherichia coli, Klebsiella spp. и др.), аэробных и анаэробных бактерий, определяемых в виде монокультур и микробных ассоциаций, включая госпитальные штаммы с полирезистентностью к антибиотикам. Оказывает противогрибковое действие на аскомицеты рода Aspergillus и рода Penicillium, дрожжевые (Rhodotorula rubra, Torulopsis glabrata и т.д.) и дрожжеподобные грибы (Candida albicans, Candida tropicalis, Candida krusei, Pityrosporum orbiculare (Malassezia furfur) и т.д.), дерматофиты (Trichophyton rubrum, Trichophyton mentagrophytes, Trichophyton verrucosum, Trichophyton schoenleini, Trichophyton violacent, Epidermophyton Kaufman-Wolf, Epidermophyton floccosum, Microsporum gypseum, Microsporum canis и т.д.), атакже на др. патогенные грибы в виде монокультур и микробных ассоциаций, включая грибковую микрофлору с резистентностью кхимиотерапевтическим препаратам (см. рис. 2) [1, 9].
Рис. 2. Преобладающий механизм действия мирамистина

Кроме того, мирамистин характеризуется низкой токсичностью, отсутствием аллергизирующего и раздражающего действия. Мирамистин ускоряет репаративную активность, а также усиливает действие антибиотиков, снижая устойчивость бактерий и грибов к ним; обладает противовоспалительным действием; эффективно действует на патогенные микроорганизмы, не оказывая при этом отрицательного действия на ткани организма человека; повышает местный иммунитет - стимулирует защитные реакции в месте применения за счет активации поглотительной и переваривающей функции фагоцитов; потенцирует активность моноцитарно-макрофагальной системы (см. рис. 2) [25].
В ходе исследования мирамистин применялся для лечения кандидоза слизистой оболочки полости рта в виде бактерицидной повязки. Курс лечения кандидоза составил 21 день.
Спектр антимикробного действия мирамистина довольно широк и включает грамположительные (стрептококки, стафиллококки), грамотрицательные (гонококки, эшерихии, вибрионы, спирохеты, шигеллы, сальмонеллы), а также вирусы гриппа, герпеса, грибы рода Candida и простейшие [9, 11, 12, 20, 33].
Изучение фармакодинамических свойств мирамистина показало, что наряду с антимикробным действием препарат стимулирует репаративные процессы и функциональную активность иммунокомпетентных клеток, оказывая иммуномодулирующее действие в патологическом очаге [18]. При комбинированном применении мирамистина с антибиотиками он замедляет развитие резистентности микрофлоры к антибиотикам [21]. Мирамистин устойчив во внешней среде. Действие мирамистина представлено на рис. 3.
Рис. 3. Действие мирамистина

Конечно, нельзя исключать и возможность общего воздействия на обменные процессы. Поэтому автор статьи рекомендует включать в комплекс терапии расшлаковку (детоксикацию) ЖКТ (полисорб, лактофильтрум, активированный уголь), лечение дисбактериоза (нормофлорин-Л и нормофлорин-Б, биовестин-лакто) [2].
Таблица 2. Количественное определение состояния индексов индивидуальной гигиены полости рта до лечения
| Возраст | Индексы индивидуальной гигиены полости рта | |||
| Silness-Loe | РМА | Kotzschke | SBI | |
| 20-30 | 0,95 | 30% | II степень | 4 |
| 31-40 | 1,5 | 45% | II степень | 4 |
| 41-50 | 2,6 | 60% | II степень | 4 |
| Средний показатель | 1,68 | от 30% до 60% (средняя степень тяжести гингивита) | II степень | 4 |
Таблица 3. Количественное определение состояния индексов индивидуальной гигиены полости рта при лечении кандидоза в динамике
| Возраст | Индексы индивидуальной гигиены полости рта | |||||||
| Silness-Loe | РМА | Kotzschke | SBI | |||||
| 3 нед. | 3 мес. | 3 нед. | 3 мес. | 3 нед. | 3 мес. | 3 нед. | 3 мес. | |
| 20-30 | 0,3 | 0,2 | 6% | 5% | I степень | I степень | 1 | 1 |
| 31-40 | 0,8 | 0,7 | 16% | 14% | I степень | I степень | 1 | 1 |
| 41-50 | 1,6 | 1,4 | 22% | 20% | I степень | I степень | 1 | 1 |
| Средний показатель | 0,9 | 0,77 | от 6% до 22% | от 5% до 30% | I степень | I степень | 1 | 1 |
| легкая степень тяжести гингивита | ||||||||
Таблица 4. Количественные данные исследования применения мирамистина в комплексе с медикаментозной терапией при лечении пациентов с диагнозом кандидоз слизистой оболочки полости рта*
| Кол-во пациентов** | Отсутствие признаков заболевания | ||
| Через 3 нед.*** | Через 3 мес.*** | ||
| Число пациентов | 50 человек | 84% (43 человек) | 90% (45 человек) |
Таблица 5. Данные бактериологического исследования материала при применении мирамистина в комплексе с медикаментозной терапией при лечении пациентов с диагнозом кандидоз слизистой оболочки полости рта*
| Динамика изменения количества пациентов с наличием грибов рода Candida | |||
| До начала лечения | Через 3 нед.** | Через 3 мес.** | |
| Число пациентов | 50 | 7 | 5 |
| % | 100 | 14 | 10 |
Результаты исследования и их обсуждение
Оценка эффективности лечения складывалась из совокупности субъективных и объективных данных, полученных в процессе исследования. В качестве субъективных данных рассматривались наличие или отсутствие жалоб у пациента, а также оценка врачом клинической картины заболевания.
Оценка основных показателей пародонтологического статуса включала: количественное определение уровня гигиены полости рта с использованием индекса РМА, индекса Silness-Loe (Silness I., Loe H.), индекса Kotzschke (1975), индекса кровоточивости десневой борозды (SBI) (Muehlemann, Son, 1971) [28].
Оценка гигиенического состояния полости рта проводилась по количеству зубного налёта. Индекс гигиены Silness-Loe основан на определении количества мягкого зубного налёта в придесневой борозде. Папиллярно-маргинально-альвеолярный индекс предназначен для оценки тяжести гингивита. Наличие воспалительных заболеваний пародонта является одним из показателей кандидоза. Индекс Kotzschke (1975) фиксирует кровоточивость по данным анамнеза. Индекс кровоточивости десневой борозды (SBI) (Muehlemann, Son, 1971) учитывает кровотечение из десневой борозды, возникающее при зондировании, а также гиперемию, припухлость и отек десны (см. табл. 2-3 и рис. 4-5).
Рис. 4. Количественное определение индекса Silness-Loe

Рис. 5. Количественное определение индекса РМА

Рис. 6. Данные бактериального посева на определение содержания грибов рода Candida и отсутствие почкующегося мицелия на дорсальной поверхности языка во всех возрастных группах исследуемых при применении мирамистина в комплексе с медикаментозной терапией пациентов с диагнозом кандидоз слизистой оболочки полости рта

Рис. 7. Данные бактериологического исследования материала при применении мирамистина в комплексе с медикаментозной терапией пациентов с диагнозом кандидоз слизистой оболочки полости рта

Изучение динамики воспалительного процесса на фоне лечения в различных возрастных группах пациентов свидетельствует о следующем:
- кровоточивость десен при чистке зубов(индекс Kotzschke) - до начала лечения II степень, после лечения - снизилась до I степени; припухлость и отек десен отсутствовали, отмечались незначительная гиперемия десен и кровотечение из десневой борозды при зондировании (индекс SBI до начала лечения соответствовал 4, а после лечения равен 1); снизилось количество мягкого зубного налета в придесневой борозде (индекс Silness-Loe - до начале лечения - 1,68, а в конце лечения - 0,9); индекс РМАдо начала лечения находился в интервале от 30% до 60%, в конце лечения - от 6% до 22% (до начала лечения отмечалась средняя степень гингивита, а в конце лечения - легкая степень гингивита).
Следует отметить, что числовые значения вышеуказанных показателей через 3 месяца после лечения незначительно снизились.
Наиболее объективными показателями эффективности лечения пациентов всех возрастных групп с диагнозом кандидоз слизистой оболочки полости рта являются результаты, полученные при бактериологических исследованиях материала на определение содержания грибов рода Candida на дорсальной поверхности языка. По полученным данным, во всех исследуемых возрастных группах пациентов до начала лечения мирамистином грибы рода Candida были выявлены у 100% (50 человек), через 3 нед. - приближались к норме (14% - у 7 чел.), через 3 мес. - отмечены единичные проявления (10% - 5 человек). Данные, полученные через 3 нед. и 3 мес. после курса лечения, свидетельствуют о прогрессирующей динамике лечения мирамистином в комплексе с другими препаратами (см. выше) пациентов с диагнозом кандидоз слизистой оболочки полости рта во всех возрастных группах. По моему мнению, незначительное количество грибов рода Candida на дорсальной поверхности языка у пациентов всех возрастных групп могло быть обусловлено многими факторами, например, ремиссией заболевания, возрастными изменениями организма, особенностями иммунитета, географией проживания,экологией местности и т.д. (см. табл. 4-5 и рис. 6-7).
Заключение
Применение мирамистина в комплексе с медикаментозной терапией кандидоза полости рта в течение 3 мес. уменьшает тяжесть воспалительного процесса и образование зубного налета и обеспечивает стойкий положительный клинический эффект, что подтверждается длительной нормализацией цитологических и микробиологических показателей.
Данные, полученные при проведенном исследовании, ярко свидетельствуют о том, что при лечении кандидоза слизистой оболочки полости рта необходимо воздействовать не только на возбудителя инфекционного процесса, но и на все предрасполагающие факторы заболевания. Терапия, направленная на все звенья патологического процесса, позволяет повысить эффективность лечения и, кроме того, способствует достижению длительного периода ремиссии заболевания.

В последние годы во всем мире, и особенно в развитых странах, наблюдается значительный рост грибковых заболеваний, вызываемых дрожжеподобными грибами рода Candida.
Известно, что грибковые инфекции занимают одну из ключевых позиций среди заболеваний слизистой оболочки полости рта по распространенности среди населения и тяжести возможных осложнений для организма пациента.
Кандиданосительство статистически определяется у 5% младенцев, у лиц же пожилого возраста этот показатель увеличивается до 60% [1]. Однако истинное проявление патогенных свойств грибов рода Candida зависит главным образом от состояния макроорганизма. Главную роль в развитии кандидоза играет ослабление иммунной системы. Именно уровень состояния функциональной системы ротовой полости у каждого индивидуума с учетом его возраста, гигиенических навыков и других факторов характеризует экосистему в целом. Кандидоз возникает, как правило, на фоне более или менее выраженного иммунодефицита или дисбаланса иммунной системы [2].
Развитию кандидоза могут способствовать тяжелые сопутствующие заболевания: злокачественные новообразования, ВИЧ - инфекция, туберкулез, эндокринопатии (сахарный диабет, гипотиреоз, гипопаратиреоз, гипо и гиперфункция надпочечников). Заболевания желудочнокишечного тракта, особенно пониженная кислотность желудочного сока и ахилия, часто обусловливают развитие кандидоза слизистой оболочки рта. Развитию кандидоза полости рта способствует длительное лечение кортикостероидными препаратами, цитостатиками, которые подавляют иммунную систему организма и усиливают вирулентность дрожжеподобных грибов [3].
Вследствие широкого применения антибиотиков за последние годы значительно увеличилось количество больных кандидозом слизистой оболочки рта. Длительный прием антибиотиков нарушает состав резидентной микрофлоры полости рта, в результате чего формируется дисбактериоз. Происходят угнетение резидентной микрофлоры полости рта и резкий рост вирулентности условнопатогенных грибов Candida, вызывающих заболевание слизистой оболочки рта (суперинфекция, аутоинфекция). Прием антибиотиков может вызвать также дисбактериоз кишечника, следствием чего являются гипо- и авитаминозы В, В2, В6, С, РР, что в свою очередь отрицательно сказывается на функциональном состоянии слизистой оболочки рта (она становится подверженной влиянию кандидозной инфекции).
В настоящее время, с учетом всего вышеперечисленного, кандидоз рассматривается как иммуннодефицитное состояние, возникшее в результате глубокой разбалансировки экосистемы в целом. Такое представление о заболевании обуславливает принципиальную необходимость комплексного лечения кандидоза, в состав которого будут непременно включаться:
- мероприятия, направленные на устранение местных проявлений заболевания;
- мероприятия для системного лечения проявлений кандидоза;
- мероприятия, направленные на восстановление и нормализацию иммунной системы.
Целью данного исследования явилось определение эффективности комплексного лечения кандидоза полости рта.
Материалы и методы исследования
Изучение данного вопроса осуществлялось на кафедре стоматологии ФУВ ВолгГМУ, на базе терапевтического отделения ГСП №1 г. Волгограда. В исследовании участвовали 50 человек, диагноз "кандидоз" которым ставили на основании ряда критериев – жалоб пациента, клинической картины заболевания и данных бактериологического посева материала, забранного с поверхности дорзальной части языка. Для реализации исследования были сформированы 2 группы пациентов – основная и контрольная. Основную группу составили 28 человек в возрасте 31 – 55 лет, страдающие кандидозом полости рта. По форме клинических проявлений больные распределялись следующим образом: острая псевдомембранозная форма – 13 пациентов, хроническая псевдомембранозная – 8, хроническая атрофическая – 7 человек. В контрольную группу были включены пациенты с тождественной возрастной категорией, в количестве 22 - х человек. В данной группе острая псевдомембранозная форма определялась у 7 пациентов, хроническая псевдомембранозная – у 10, хроническая атрофическая форма регистрировалась у 5 человек.
Пациентам обеих групп назначалось лечение, направленное на ликвидацию возбудителя заболевания. Оно включало в себя антимикотическую терапию, системную и местную.
Для применения системной антимикотической терапии необходимо наличие ряда показаний, в первую очередь определенной клинической формы поражения (острый псевдомембранозный кандидоз, клинические признаки диссеминации, хронические формы заболевания, резистентные к ранее проводимой местной терапии и т.д.), поэтому отбор пациентов в группы осуществлялся с учетом данных показаний. Фунгицидные средства назначались по данным результатов бактериологического посева на чувствительность к препаратам. При этом у 83% пациентов выявлялась высокая чувствительность к флуконазолу, у 17% - к итраконазолу. Данные препараты принимались больными внутрь в таблетированной форме по общепринятой схеме.
Местная противогрибковая терапия осуществлялась 0,5% мирамистином в виде мази, аппликации препарата проводились 3 раза в сутки. Мирамистин – антисептик с выраженным антимикробным, фунгицидным и противовирусным действием, усиливающий местные иммунные реакции и регенераторные процессы. Кроме этого, всем пациентам 4 раза в день назначались полоскания ротовой полости 2% бикарбоната натрия.
Всем пациентам назначалась также десенсебилизирующая терапия, этой целью рекомендовался эриус (5 мг 1 раз в сутки).
Помимо данной схемы, пациенты основной группы получали лечение, направленное на повышение иммунологической резистентности организма. Известно, что при кандидозе резко снижается усвояемость таких жизненно важных элементов как витамины и минералы (особенно железо). Учитывая этот факт, оптимальным в данном случае представляется препарат ферроглобин В12 – комплекс, содержащий железо, витамины группы В и С, фолиевая и пантеноновая кислоты, а также экстракт корня солодки. Корень солодки оказывает стимулирующее действие на неспецифическую резистентность организма. Препарат назначали пациентам внутрь, после еды по 1 ч.л. 3 раза в сутки.
Высокой эффективностью в борьбе с кандидозной инфекцией обладают конкурентные пробиотики. Их использование обусловлено антагонистическими свойствами относительно грибов рода Candida, которые реализуются путем конкуренции за питательные субстраты и синтеза антикандидозных метаболитов. Наш клинический опыт подтверждает высокую эффективность самоэлиминирующего пробиотика Бактистатин. Препарат назначался пациентам основной группы по 1 капсуле 3 раза в день во время еды.
Таким образом, пациенты основной группы помимо антимикотической и десенсебилизирующей терапии получали дополнительное лечение, направленное на коррекцию иммунных механизмов организма в виде двух препаратов – Ферроглобин В12 и Бактистатин.
Курс лечения кандидоза в обеих группах составил 21 день.
Далее состояние пациентов оценивали с учетом наличия или отсутствия жалоб и динамики клинической картины заболевания, а также данных повторного бактериологического посева материала спустя 21 день (3 недели) и шести месяцев после окончания лечения и отдаленной реколонизации экосистемы.
и их обсуждение
Оценка эффективности лечения складывалась из совокупности субъективных и объективных данных, полученных в процессе исследования. В качестве субъективных данных рассматривались наличие или отсутствие жалоб у пациента, а также оценка врачом клинической картины заболевания. При анализе полученных фактов выяснилось, что в краткие сроки после проведенного лечения (через 3 недели) отсутствие признаков заболевания было зарегистрировано в основной группе в 92, 8% случаев, в контрольной – у 68,2% пациентов. В отдаленные сроки, через 6 месяцев после лечения, в основной группе ситуация принципиально не изменилась, и в 89,3% случаев не было зафиксировано случаев рецидива заболевания. В контрольной группе пациентов с отсутствием рецидива было зарегистрировано значительно меньше – в 36,4% случаев (табл. 1).
Исчезновение признаков заболевания у пациентов в динамике
Отсутствие признаков заболевания через 3 недели после лечения
Отсутствие признаков заболевания через 6 месяцев после лечения
Марина Поздеева о подборе лечения при вагинальном кандидозе
Вагинальный кандидоз (ВК) — распространенное заболевание, которое развивается у 70—75% женщин по крайней мере однажды в течение репродуктивного периода (по данным исследований под руководством Жерома Собеля, опубликованных в 1998 г, США). У 40—50% пациенток наблюдаются повторные случаи заболевания, а примерно 5% страдают от рецидивирующей инфекции (данные исследования 2004 г. на базе Колледжа медицины им.Альберта Энштейна, Бронкс, США).
Этиология ВК
Candida spp., возбудители вагинального кандидоза, — это условно-патогенные грибы, которые являются наиболее распространенной причиной грибковых инфекций у человека. Род Candida насчитывает около двадцати видов. Как правило, ВК ассоциируется с каким‑то одним видом Candida, но существует вероятность (2—5%) одновременного инфицирования двумя и более видами.
В России, США, Австралии и Европе у женщин с ВК чаще всего выявляется Candida albicans (76—89%). За ним следует C. glabrata (7—16%). Процент не-albicans Candida колеблется от 11 до 24%. Некоторые исследования показали тенденцию к увеличению частоты не-albicans кандидозов, однако недавняя работа ученых из США с участием девяноста тысяч образцов опровергла это утверждение: соотношение видов Candida, вызывающих ВК, с 2003 по 2007 год практически не изменялось.
Этиологически различные кандидозы клинически весьма схожи, однако нетипичные возбудители характеризуются устойчивостью к азоловым антимикотикам. Более других к азоловыми противогрибковым препаратам резистентны C. glabrata и C. krusei.
провизор первой категории и заведующая аптекой. Автор многочисленных работ по фармакологии и фармакотерапии, город Днепропетровск.
Эти данные подчеркивают важность определения вида Candida spp. у женщин с высоким риском развития не-Сandida аlbicans-ассоциированного ВК с целью подбора эффективной терапии заболевания.
Факторы риска
У многих здоровых женщин ВК развивается спорадически. Тем не менее существуют факторы риска возникновения кандидоза. Среди поведенческих факторов это частые половые контакты и оральный секс, а также использование спермицидов.
Тесная одежда и нижнее белье обычно не провоцируют заболевания. Однако среди женщин с рецидивирующим ВК (РВК) ношение тесных колготок и ежедневных прокладок положительно ассоциировано с рецидивом.
К биологическим факторам риска ВК относятся:
- применение антибиотиков;
- неконтролируемый сахарный диабет;
- генетическая предрасположенность;
- высокий уровень половых гормонов;
- прием оральных контрацептивов, содержащих высокие дозы эстрогена;
- беременность.
Антибактериальные препараты способствуют снижению количества лакто- и бифидобактерий, сдвигу pH во влагалище и росту Candida spp.
Тетрациклины, цефалоспорины и ампициллин чаще других антибиотиков широкого спектра действия провоцируют развитие кандидоза.
Беременность — один из наиболее распространенных предрасполагающих факторов. Согласно исследованиям, у трети беременных развивается ВК. Высокий уровень половых гормонов способствует увеличению содержания гликогена во влагалище, который в свою очередь обеспечивает постоянный источник углерода, необходимый для роста грибов.
Кроме того, повышенная кислотность вагинальной флоры беременных может подавлять рост других микроорганизмов, которые естественным образом ингибируют Candida. Хотя начальное прикрепление клеток гриба происходит при более высоких значениях pH (6–7), кислая среда благоприятствует развитию мицелия.
В патогенезе вагинального кандидоза (ВК) выделяют две основные фазы: фазу адгезии, то есть прикрепления клеток гриба к эпителиальным клеткам, и мицелиальную фазу. Мицелиальная фаза начинается с момента проникновения Candida spp. в эпителиоциты. Растущий псевдомицелий грибов проникает в глубокие слои цервикального и вагинального эпителия.
Cаndida способны пенетрировать клетки, не нарушая целостности своей маннопротеиновой оболочки (это фибриллярное покрытие клеточной стенки гриба, участвующего в адгезионных процессах). В итоге Cаndida противостоит факторам защиты и выживает в макроорганизме.
Группы риска инфицирования не-albicans видами Candida включают:
- женщин с рецидивирующим ВК;
- ВИЧ-инфицированных женщин;
- женщин в возрасте старше 50 лет;
- женщин с неконтролируемым сахарным диабетом.
Во всех вышеперечисленных группах наиболее распространенным видом является С. glabrata.
Процент случаев заболевания не-albicans Сandida-ассоциированной инфекцией увеличивается с возрастом женщин.
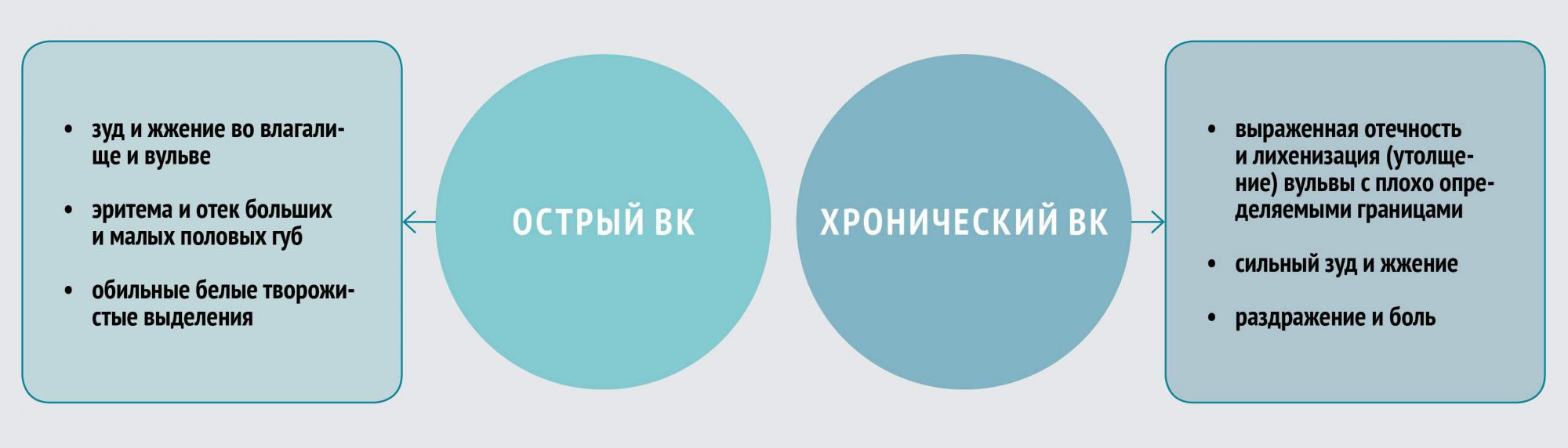
Большинство женщин с ВК быстро реагируют на терапию, однако в некоторых случаях может развиться рецидивирующая форма, которая характеризуется четырьмя и более эпизодами инфекции в год. Предрасполагающие факторы:
- неконтролируемый сахарный диабет;
- прием иммунодепрессантов;
- отклонения в местном вагинальном иммунитете слизистых оболочек;
- генетическая предрасположенность.
Исследования доказали, что у пациенток с РВК регистрируется более высокая частота специфических генных полиморфизмов по сравнению с контрольной группой. Кроме того, у этих пациенток обнаруживаются определенные антигены системы Льюис в крови.
Периодический ВК может быть также связан со снижением в естественных условиях концентрации манноз-связывающего лектина. Последний, связываясь с сахарами на поверхности клетки Candida, запускает путь активации системы комплемента и приводит к гибели гриба с помощью комплемент-опосредованного фагоцитоза.
При данном заболевании также фиксируется повышенная концентрация интерлейкина-4, что тормозит местные защитные механизмы.
Система антигенов Льюис зависит от группы генов, которые экспрессируются в железистом эпителии. Антигены Льюис, в отличие от эритроцитарных антигенов, являются компонентами экзокринных эпителиальных выделений, в том числе и влагалищных.
Роль полового пути передачи остается недоказанной. Тем не менее большинство исследований говорит о необходимости лечения половых партнеров. Так, эксперимент доктора Горовитц, Великобритания, продемонстрировал наличие видов Candida в эякуляте мужчин, партнерши которых страдали РВК.
Однако тот же Горовитц провел еще одно исследование, где изучались результаты терапии у 54 женщин, разделенных на две группы. Партнеров из первой группы подвергали противогрибковой терапии, а из второй — нет. Существенных различий в скорости наступления рецидива у женщин этих групп обнаружено не было.
Рецидивы могут быть вызваны и другими видами Candida, которые не являются в равной степени чувствительными к терапии препаратами первой линии.
Клиника ВК
Клинические симптомы ВК неспецифичны и могут быть связаны с другими вагинальными заболеваниями, в том числе бактериальным вагинозом, трихомониазом, хламидиозом, гонореей. Отличительной чертой симптоматики являются зуд и жжение. В некоторых случаях возможно развитие диспареунии (болезненности при половом акте) и дизурии.
Исследования in vivo показали, что противогрибковые препараты имидазола (миконазол и клотримазол) менее эффективны в лечении не-albicans видов Candida. Так, C. tropicalis и C. glabrata в 10 раз менее чувствительны к миконазолу, чем C. albicans.
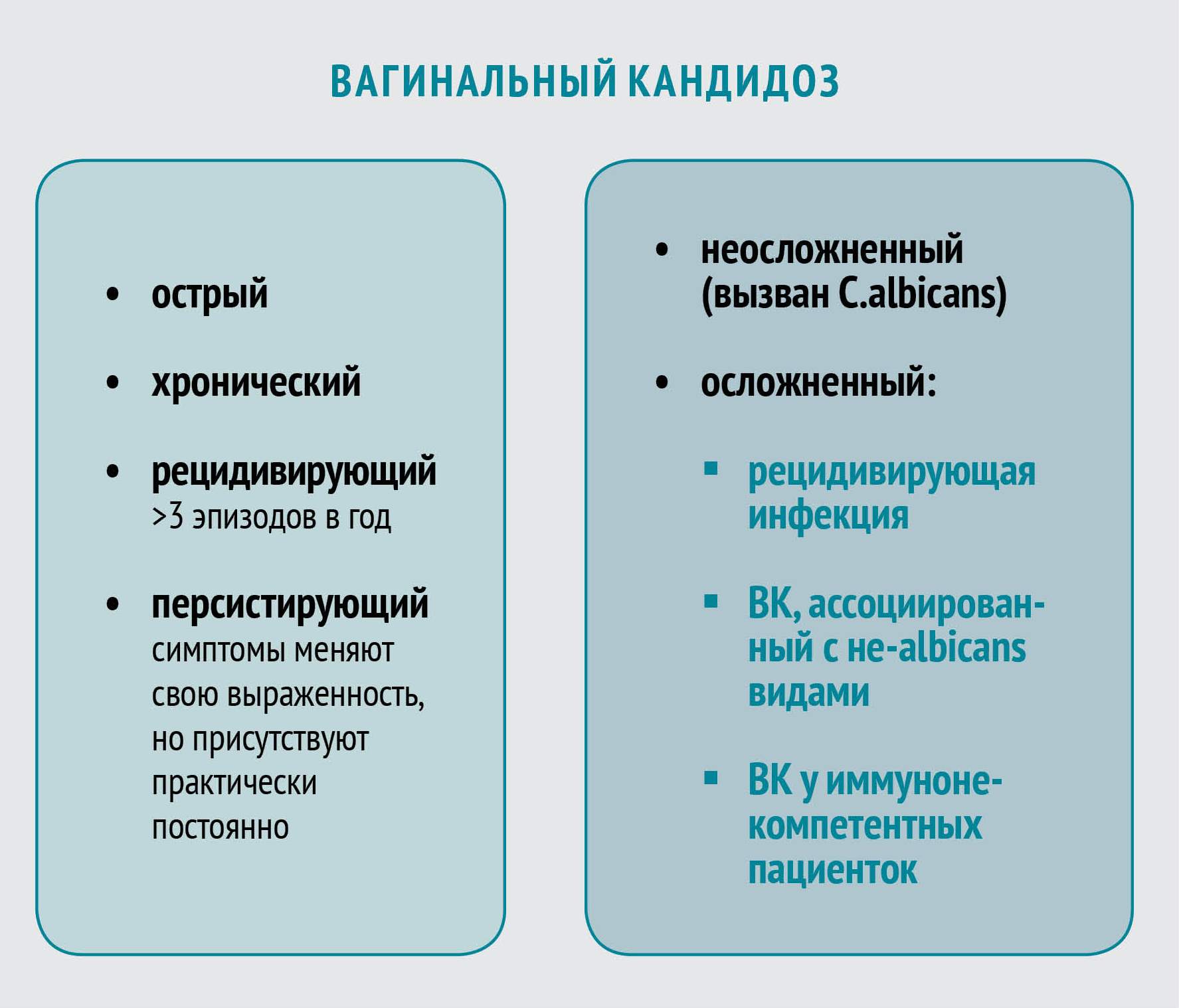
Лечение неосложненного ВК
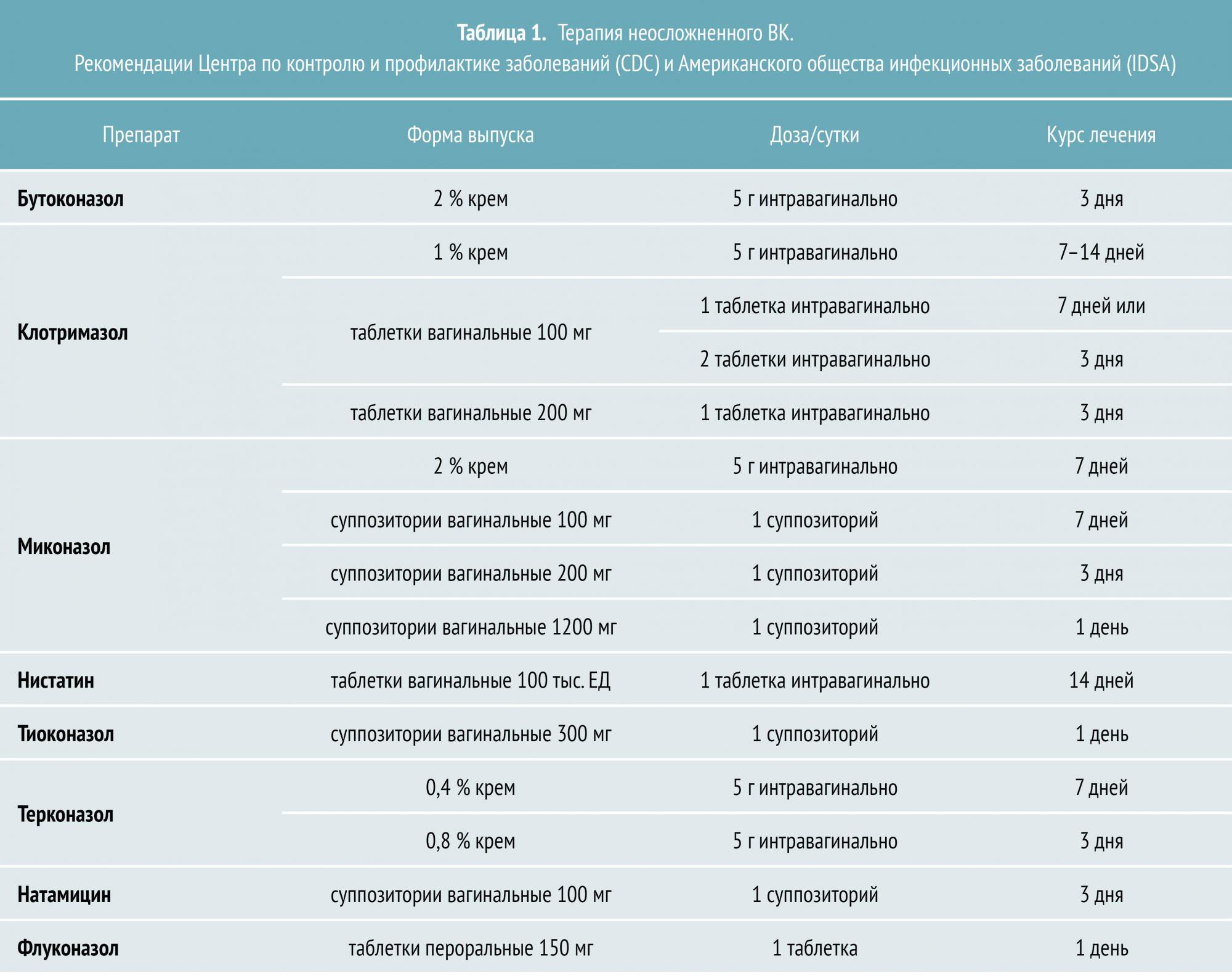
Неосложненный ВК вызывается штаммами C. albicans, большинство из которых демонстрируют чувствительность к азоловым противогрибковым препаратам. Лечение неосложненного заболевания приводит к положительному результату в 90% случаев даже при назначении однократной дозы пероральных или короткого курса местных антимикотиков. На выбор можно использовать несколько топических азоловых препаратов с приблизительно одинаковой эффективностью.
Эмпирическое назначение антимикотиков при этой форме заболевания совершенно оправданно. Более того, зачастую выбор лечения основывается на индивидуальных предпочтениях пациентки.
Клеточная стенка Candida представляет собой комплексный гликопротеин, который зависит от постоянного синтеза эргостерола. Соединения азола, которые являются действующими веществами азоловых противогрибковых препаратов, блокируют выработку эргостерола, позволяя топическим антимикотикам оказывать эффект в 80—90% случаев.
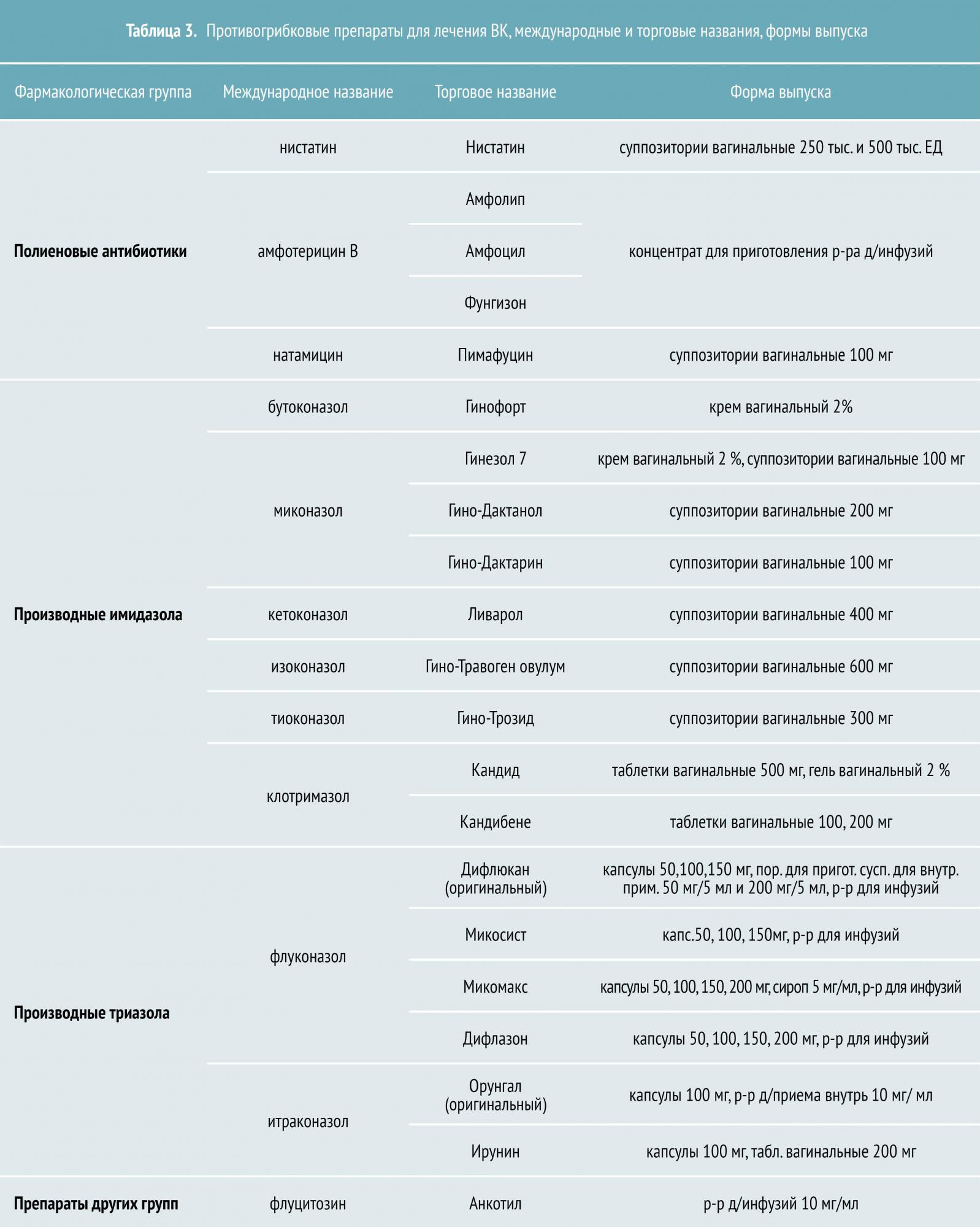
Азоловые препараты, которые подразделяются на производные имидазола и триазола, являются самой многочисленной и эффективной группой противогрибковых средств. К азоловым антимикотикам относятся как системные препараты (кетоконазол, флуконазол, итраконазол), так и местные (бифоназол, клотримазол, изоконазол, эконазол и другие).
В сравнительных испытаниях 10—14‑дневных курсов терапии азолами и нистатином была выявлена преимущественная эффективность первых (80—95 % микологического излечения по сравнению с 70—80 % в группе нистатина). Кроме того, азолы доказали эффективность даже при лечении короткими курсами.
Терапия ВК у беременных женщин предусматривает применение местных противогрибковых препаратов. К числу безопасных топических антимикотиков относятся миконазол и клотримазол, рекомендуемый курс лечения — семь дней. Кроме того, при беременности назначают полиеновый антибиотик натамицин. Стандартная схема противогрибковой терапии местными формами натамицина рассчитана на применение в течение трех дней. При необходимости курс может быть увеличен вдвое.
Лечение осложненного РВК
Оптимальный курс лечения осложненного ВК до сих пор точно не определен. Некоторые исследования показали эффективность противогрибковой супрессивной терапии в течение нескольких месяцев.
Препаратом выбора при РВК является пероральный флуконазол. При тяжелом рецидивирующем ВК флуконазол применяют по схеме 150 мг (три дозы) каждые 72 часа в течение девяти дней, после чего лечение продолжают по 150 мг в неделю на протяжении длительного времени. Такой режим противогрибковой терапии значительно снижает вероятность рецидивов по сравнению с тремя дозами флуконазола без поддерживающего лечения.
Долгосрочная супрессивная терапия пероральным флуконазолом отличается удобством и хорошей переносимостью по сравнению с другими антимикотиками. Как показали исследования, эффективность супрессивной схемы лечения РВК достигает 90%. Вопреки ожиданиям, у больных, длительно принимающих флуконазол, не подтвердилось развитие резистентности к C.albicans или суперинфекции не-albicans видами. Тем не менее пациенткам с упорной инфекцией рекомендуется проводить идентификацию возбудителя.
В качестве препаратов для супрессивной терапии могут применяться иные пероральные средства, которые доказали эффективность в лечении РВК. В качестве альтернативных схем лечения назначают:
- кетоконазол по 100 мг в сутки (из‑за гепатотоксичности перорального кетоконазола предпочтение обычно отдают другим препаратам);
- итраконазол по 200 мг два раза в день в течение одного дня каждого месяца;
- клотримазол вагинальные свечи.

Женщинам, предпочитающим местное лечение, клотримазол рекомендуется в дозировке 500 мг в неделю или 200 мг дважды в неделю. Также допустимо применение других местных противогрибковых препаратов, при этом практически не имеет значения, какое действующее вещество используется.
У пациенток с РВК, которым не проводится поддерживающая терапия, вероятность рецидива в течение шести месяцев после успешного лечения очередного эпизода заболевания составляет 70%. Риск рецидива у женщин, принимающих антимикотики в качестве супрессивного лечения, составляет 40—50% в течение одного года после прекращения приема препаратов.
Лечение РВК, вызванного не-albicans видами Candida
Не-albicans виды весьма умеренно отвечают на терапию азоловыми антимикотиками. Поэтому схему лечения в таких случаях подбирают индивидуально, основываясь на степени тяжести заболевания и реакции на препараты.
В течение многих десятилетий для лечения РВК местно использовалась борная кислота. Однако препараты борной кислоты могут всасываться через слизистую оболочку влагалища в кровь и оказывать токсическое действие. Во избежание всасывания вагинальные средства на основе борной кислоты выпускают в желатиновых капсулах. Рекомендуемая схема лечения — одна капсула 600 мг в сутки в течение двух недель.
Готовой лекарственной формы в России нет, но капсулы могут готовить в аптеках ex tempore. Согласно исследованиям, лечение вагинальными капсулами с борной кислотой эффективно в 70% случаев РВК, ассоциированного с C. glabrata.
Альтернативой токсичной борной кислоте являются суппозитории с амфотерицином В. Антибиотик проникает через клеточную мембрану гриба и, связываясь с эргостеролом, разрушает клеточную стенку. Курс лечения составляет 50 мг на ночь per os в течение двух недель. Такая схема терапии успешна у 70% пациенток, страдающих заболеванием, вызванным не-albicans видами, не поддающимися азоловой терапии, особенно C. glabrata.
Активность по отношению к не-albicans видам Candida доказали и местные препараты для вагинального применения, содержащие 17% флуцитозина. Клетки гриба поглощают флуцитозин, после чего он дезаминируется и превращается в 5‑фторурацил, который встраивается в ДНК Candida вместо урацила. В результате нарушается синтез белка и клетка погибает. Возможна также комбинация 17% крема флуцитозина и 3% крема амфотерицина В. Средняя продолжительность лечения флуцитозином должна быть не меньше двух недель. Особенность препарата — его высокая стоимость.
Альтернативные методы лечения РВК
В некоторых случаях пациентки прибегают к применению пробиотиков, большинство из которых содержат лактобактерии. Предполагается, что лактобактерии способны ингибировать или уменьшать рост Candida во влагалище. Однако единого мнения специалистов по этому поводу пока нет. Действительно, часть клинических исследований подтверждает эффективность пробиотиков при ВК. В то же время другие эксперименты полностью опровергают эти данные.
Так, недавно было опубликовано рандомизированное исследование с участием двух групп женщин с РВК. Пациенткам первой группы в схему лечения включали вагинальные пробиотики, а участницы второй подвергались монотерапии итраконазолом. Исследование показало, что исход терапии в течение месяца был одинаково положительным в двух группах.
Учитывая безопасность применения пробиотиков, право включения этих препаратов в схему лечения РВК имеет и врач, и пациентка.
Список использованных материалов
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Читайте также:


