Из-за молочницы у плода гиперэхогенный кишечник
Самые часто встречающиеся ультразвуковые маркеры хромосомной аномалии:
Оценка этого параметра проводится в первое скрининговое УЗИ (11-14 недель)
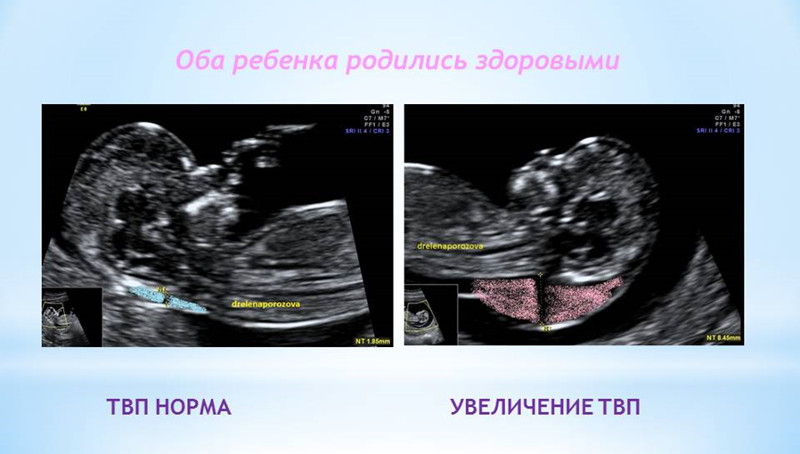
ТВП (толщина воротникового пространства) может оказаться больше нормы по нескольким причинам.
Почему у плода может выявляться увеличение ТВП?
Родители бывают крайне взволнованы и хотят сразу же получить ответы на все, возникающие у них вопросы – с чем связано, что делать и многие другие. Вопросы, на которые невозможно ответить сразу. Ведь причин увеличения ТВП множество. Данная находка может встречаться у абсолютно здоровых плодов, это не порок развития, это лишь сигнал к более глубокому обследованию, потому что такая особенность может иметь место у плодов с хромосомной патологией, аномалиями сердца либо другими врожденными или наследственными заболеваниями. При увеличении максимального порога ТВП ВАЖНО, чтобы врач оценил все остальные ультразвуковые маркеры (признаки), а также провел детальную оценку анатомии плода. Возможно, причина увеличения ТВП кроется в нарушении развития плода (например, аномалии строения сердца).
Что делать при выявлении увеличения ТВП у плода?
Если у вашего плода обнаружили расширение ТВП, Вас обязательно направят на консультацию к врачу генетику, который собрав анамнез, оценив все риски, даст рекомендации по дополнительным методам исследования (инвазивная диагностика). Далее потребуется экспертное УЗИ плода на сроке 20 недель для детальной оценки анатомии. Если по всем этим исследованиям отклонений не выявлено, то шансы родить здорового ребенка велики даже при значительной величине ТВП.
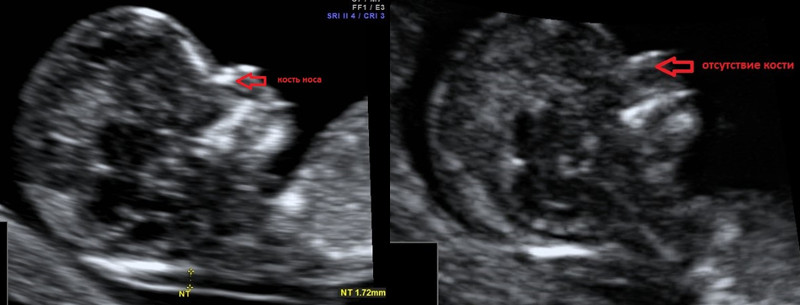
Гипоплазия костей носа – уменьшение размеров косточки носа в зависимости от КТР вашего малыша.
Аплазия костей носа – отсутствие визуализации косточки носа у вашего малыша.
Отсутствие видимости костной части спинки носа у плода или ее недоразвитие (недостаточно яркая) на первом скрининге связана с задержкой отложения кальция. Такая ситуация несколько чаще может встречаться у плодов с синдромом Дауна, однако важно, что:
- само по себе отсутствие костей носа на УЗИ не является аномалией развития; может встречаться у абсолютно здоровых плодов (в 3% случаев);
- для оценки степени индивидуального риска необходима оценка остальных ультразвуковых маркеров (толщина воротникового пространства плода, показатели кровотока на сердечном клапане, показатели кровотока в венозном протоке, ЧСС плода) и биохимического анализа материнской сыворотки (РАРР-А, ХГЧ);
- Если результат комбинированного скрининга (оценка в специальной программе данных УЗИ и анализа крови) показывает НИЗКИЙ риск хромосомной патологии – беспокоиться не стоит. Обязательно пройдите контрольное УЗИ в 19-20 недель беременности, где будет проведена тщательная оценка анатомии плода и исследованы определенные ультразвуковые маркеры второго триместра беременности.
- Что делать если результат комбинированного скрининга оказался ВЫСОКИМ? – Переживать не стоит. Вас обязательно направят на консультацию к врачу генетику, который собрав анамнез, оценив все риски, даст рекомендации по дополнительным методам исследования (инвазивная диагностика).
Это термин, говорящий о повышенной эхогенности (яркости) кишечника на ультразвуковом изображении. Выявление гиперэхогенного кишечника НЕ является пороком развития кишечника, а просто отражает характер его ультразвукового изображения. Необходимо помнить, что эхогенность нормального кишечника выше, чем эхогенность соседних с ним органов (печени, почек, легких), но такой кишечник не считается гиперэхогенным. Гиперэхогенным называется только такой кишечник, эхогенность которого сравнима с эхогенностью костей плода.
Почему кишечник у плода может быть гиперэхогенным?
Иногда гиперэхогенный кишечник выявляется у абсолютно нормальных плодов, и при УЗИ в динамике этот признак может исчезать. Повышенная эхогенность кишечника может быть проявлением хромосомных болезней плода, в частности, синдрома Дауна. В связи с этим при обнаружении гиперэхогенного кишечника проводится тщательная оценка анатомии плода. Однако при выявлении гиперэхогенного кишечника можно говорить лишь о повышенном риске синдрома Дауна, так как подобные изменения могут встречаться и у совершенно здоровых плодов. Иногда гиперэхогенный кишечник может быть признаком внутриутробной инфекции плода. Гиперэхогенный кишечник часто обнаруживается у плодов с задержкой внутриутробного развития. Однако при этом будут обязательно выявляться отставание размеров плода от срока беременности, маловодие и нарушение кровотока в сосудах плода и матки. Если ничего из вышеперечисленного не выявлено, то диагноз задержки развития плода исключен.
Что делать при выявлении гиперэхогенного кишечника у плода?
Вам следует обратиться к специалисту генетику, который еще раз оценит результаты биохимического скрининга и даст необходимые рекомендации по дальнейшему ведению беременности.
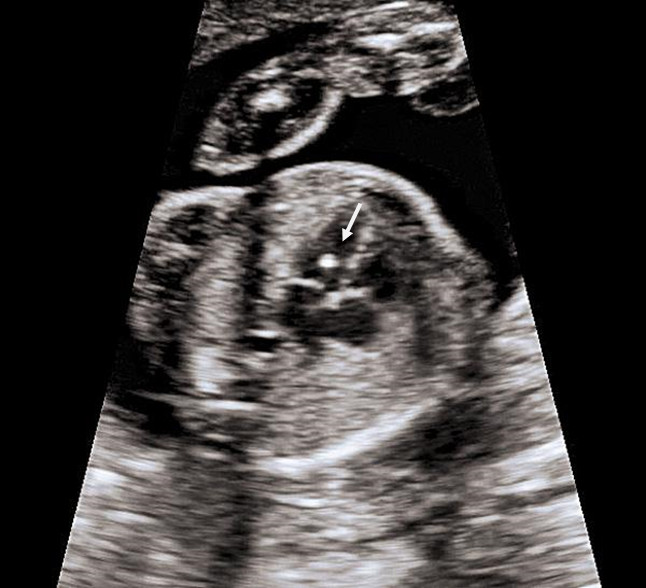
Это термин, говорящий о повышенной эхогенности (яркости) небольшого участка сердечной мышцы на ультразвуковом изображении. Выявление гиперэхогенного фокуса в сердце НЕ является пороком развития сердца, а просто отражает характер его ультразвукового изображения. Гиперэхогенный фокус возникает в месте повышенного отложения солей кальция на одной из мышц сердца, что не мешает нормальной работе сердца плода и не требует никакого лечения.
Почему у плода может выявляться гиперэхогенный фокус в сердце?
Что делать при выявлении гиперэхогенного фокуса в сердце плода?
Если у плода выявлен ТОЛЬКО гиперэхогенный фокус в сердце, то никаких дополнительных обследований не требуется; риск болезни Дауна не увеличивается. На плановом УЗИ в 32-34 недели еще раз будет осмотрено сердце плода. В большинстве случаев гиперэхогенный фокус в сердце исчезает к этому сроку беременности, но даже если он продолжает оставаться в сердце, это никак не влияет на здоровье плода и тактику ведения беременности.
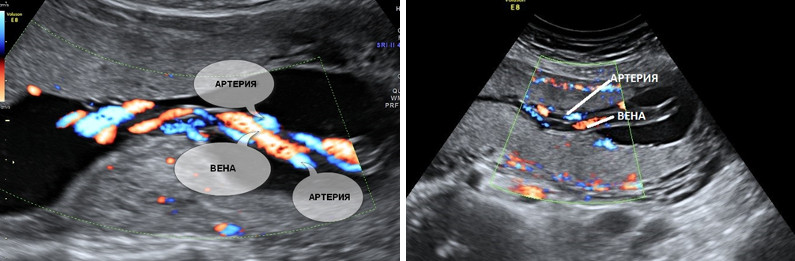
Нормальная пуповина состоит из трех сосудов – две артерии и одна вена. Иногда вместо двух артерий в пуповине формируется только одна артерия и одна вена, таким образом, в пуповине определяется всего два сосуда. Данное состояние считается пороком развития пуповины, однако этот порок не оказывает никакого влияния на послеродовое состояние ребенка и его дальнейшее развитие.
Почему у плода может определяться единственная артерия пуповины?
Что делать при выявлении единственной артерии пуповины у плода?
Выявление только единственной артерии пуповины не повышает риск наличия синдрома Дауна и не является показанием к консультации генетика и проведению других диагностических процедур. Необходимо контрольное УЗИ в 26-28 и 32 недели беременности для оценки темпов роста плода и оценки его функционального состояния.
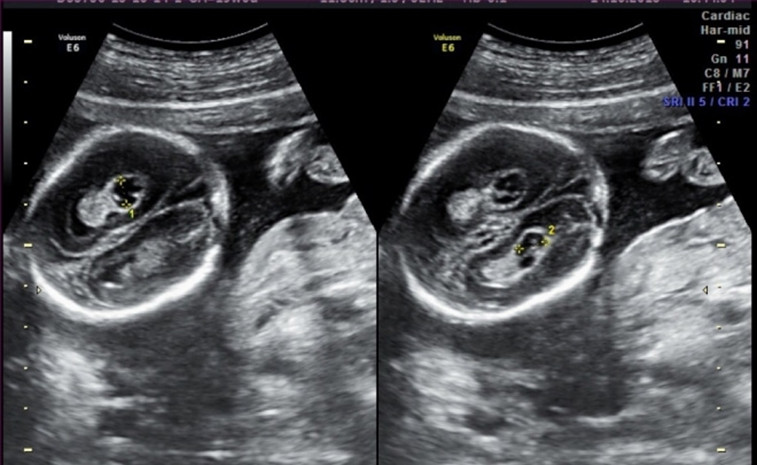
Сосудистые сплетения - одна из первых структур, которая появляется в головном мозге плода. Это сложная структура, и присутствие обоих сосудистых сплетений подтверждает, что в мозге развиваются обе половины. Сосудистое сплетение производит жидкость, питающую головной и спинной мозг. Иногда жидкость образует скопления внутри сосудистых сплетений, которые при УЗИ имеют вид "кисты". Кисты сосудистых сплетений иногда могут быть найдены при ультразвуковом исследовании в сроках 18-22 недели беременности. Наличие кист не оказывает влияния на развитие и функцию головного мозга. Большинство кист самопроизвольно исчезает к 24-28 неделям беременности.
Часто ли встречаются кисты сосудистых сплетений?
В 1-2 % всех нормальных беременностей плоды имеет КСС, в 50 % случаев обнаруживаются двусторонние кисты сосудистых сплетений, в 90 % случаев кисты самопроизвольно исчезают к 26-ой неделе беременности, число, размер, и форма кист могут варьировать, кисты также найдены у здоровых детей и взрослых. Несколько чаще кисты сосудистых сплетений выявляются у плодов с хромосомными болезнями, в частности, с синдромом Эдвардса (трисомия 18, лишняя 18 хромосома). Однако, при данном заболевании у плода всегда будут обнаруживаться множественные пороки развития, поэтому выявление только кист сосудистого сплетения не повышает риск наличия трисомии 18 и не является показанием к проведению других диагностических процедур. При болезни Дауна кисты сосудистых сплетений, как правило, не выявляются. Риск синдрома Эдвардса при обнаружении КСС не зависит от размеров кист и их одностороннего или двустороннего расположения. Большинство кист рассасывается к 24-28 неделям, поэтому в 28 недель проводится контрольное УЗИ. Однако, если кисты сосудистых сплетений не исчезают к 28-30 неделям, это никак не влияет на дальнейшее развитие ребенка.
Почечные лоханки это полости, где собирается моча из почек. Из лоханок моча перемещается в мочеточники, по которым она поступает в мочевой пузырь.
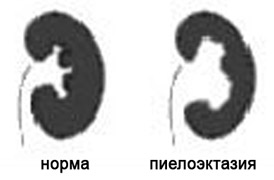
Пиелоэктазия представляет собой расширение почечных лоханок. Пиелоэктазия в 3-5 раз чаще встречается у мальчиков, чем у девочек. Встречается как односторонняя, так и двухсторонняя пиелоэктазия. Легкие формы пиелоэктазии проходят чаще самостоятельно, а тяжелые иногда требуют хирургического лечения.
Причина расширения почечных лоханок у плода.
Если на пути естественного оттока мочи встречается препятствие, то моча будет накапливаться выше данного препятствия, что будет приводить к расширению лоханок почек. Пиелоэктазия у плода устанавливается при обычном ультразвуковом исследовании в 18-22 недели беременности.
Опасна ли пиелоэктазия?
Умеренное расширение почечных лоханок, как правило, не влияет на здоровье будущего ребенка. В большинстве случаев при беременности наблюдается самопроизвольное исчезновение умеренной пиелоэктазии. Выраженная пиелоэктазия (более 10 мм) свидетельствует о значительном затруднении оттока мочи из почки. Затруднение оттока мочи из почки может нарастать, вызывая сдавление, атрофию почечной ткани и снижение функции почки.
Нужно ли обследовать ребенка после родов?
У многих детей умеренная пиелоэктазия исчезает самопроизвольно в результате дозревания органов мочевыделительной системы после рождения ребенка. При умеренной пиелоэктазии бывает достаточно проводить регулярные ультразвуковые исследования каждые три месяца после рождения ребенка. При присоединении мочевой инфекции может понадобиться применение антибиотиков. При увеличении степени пиелоэктазии необходимо более детальное урологическое обследование.
В случаях выраженной пиелоэктазии, если расширение лоханок прогрессирует, и происходит снижение функции почки, бывает показано хирургическое лечение. Хирургические операции позволяют устранить препятствие оттоку мочи. Часть оперативных вмешательств может с успехом выполняться эндоскопическими методами – без открытой операции, при помощи миниатюрных инструментов, вводимых через мочеиспускательный канал. В любом случае вопрос об оперативном лечении решается после рождения ребенка и полного его обследования.
Что делать при выявлении ультразвуковых маркеров хромосомной патологии у плода?
Вам следует обратиться к специалисту генетику, который еще раз оценит результаты ультразвукового исследования и биохимического скрининга, рассчитает риск индивидуально для вашего случая и даст необходимые рекомендации по дальнейшему ведению беременности.
ЖУРНАЛ "ПРАКТИКА ПЕДИАТРА"
Муковисцидоз (МВ), или кистозный фиброз (cysticfibrosis), - одно из наиболее частых моногенных наследственных заболеваний с полиорганной патологией, резко сокращающее продолжительность и качество жизни пациентов без адекватного комплексного лечения в течение всей жизни. МВ распространен среди населения всей Земли, но наиболее часто поражает европеоидов: в среднем с частотой 1 на 2500-4500 новорожденных. Еще совсем недавно больные муковисцидозом умирали в раннем детском возрасте или даже на первом году жизни от пневмонии и истощения, обусловленными мальабсорбцией.
Ключевые слова: диагностика, генетика, мутации, неонатальный скрининг, потовая проба, эластаза кала.
Key words: cystic fibrosis, diagnosis, genetics, mutation, newborn screening, sweat test, fecal elastase.
Своевременная диагностика муковисцидоза, обеспечивающая в большинстве случаев раннее начало терапии, в том числе на доклиническом этапе, улучшает прогноз заболевания, повышает эффективность лечения, позволяет предупредить развитие тяжелых осложнений, значительного отставания в физическом развитии, а в ряде случаев и необратимых изменений в легких. Ранняя диагностика позволяет семье вовремя решить необходимые вопросы, связанные с рождением здорового ребенка (генетическое консультирование, пренатальная диагностика МВ в последующие беременности).
Диагностика делится на:
1) пренатальную диагностику;
2) диагностику по неонатальному скринингу (до клинических проявлений или при их дебюте);
3) диагностику при клинических проявлениях:
4) диагностику среди родственников больных.
В настоящее время налаживается дородовая диагностика муковисцидоза в перспективных и информативных семьях (Москва, Санкт-Петербург, Уфа, Томск, Красноярск, Ростов-на-Дону, Владивосток и некоторые другие города), что, безусловно, важно для профилактики этой тяжелой патологии. Пренатальная диагностика возможна в виде ДНК-диагностики при проведении амниоцентеза (получение околоплодных вод в ранний срок -13-14 недель и поздний - обычно 16-20 недель беременности) в семье носителей одной мутации гена CFTR и имеющей больного ребенка. Диагноз может быть заподозрен при УЗИ плода внутриутробно при наличии характерной УЗ-характеристики в виде гиперэхогенного кишечника. УЗИ во время беременности рекомендуют в скрининговые сроки: 11-14, 18-21 и 30-34 недели беременности. Обязательно проводят повторное исследование. В 50-78% случаев это состояние будет связано с МВ и проявится мекониальным илеусом. Диагноз в этом случае может быть установлен еще до рождения ребенка. В то же время этот признак не является высокоспецифичным для МВ, может быть транзиторным явлением, а также связанным с другими патологическими состояниями. При этом ДНК-диагностика родителей дает необходимую информацию о наличии мутаций у каждого из родителей и позволяет предполагать заболевание у ребенка при рождении.
Клинические признаки
1. Диагностика классической формы МВ обычно не представляет сложностей. Классический фенотип больного является результатом наличия двух мутантных копий гена муковисцидозного трансмембранного регулятора (CFTR) и характеризуется хронической бактериальной инфекцией дыхательных путей и придаточных пазух носа, стеатореей из-за внешнесекреторной недостаточности поджелудочной железы, мужским бесплодием из-за обструктивной азооспермии, а также повышенной концентрацией хлоридов потовой жидкости.
2. Проблемы диагностики МВ, как правило, связаны с фенотипическим разнообразием его форм, обусловленным генетическим полимор-
В ряде случаев атипичного течения МВ возможна его диагностика во взрослом возрасте. Как правило, в этой группе больных отмечается более мягкое течение болезни в связи с сохранностью функции поджелудочной железы и нетяжелым поражением органов дыхания.
В абсолютном большинстве случаев МВ может быть диагностирован в раннем детском возрасте (в 90% случаев - на первом году жизни). К сожалению, нередки случаи диагностики МВ у взрослых с классическим фенотипом.
В настоящее время выделяют несколько групп риска по МВ.
Основной группой риска по заболеванию в РФ в настоящее время являются новорожденные с неонатальной гипертрипсиногенемией. Учитывая возможность получения ложноотрицательных результатов неонатального скрининга, а также то обстоятельство, что в РФ неонатальный скрининг на МВ проводится с 2006-2007 гг., не теряет своей актуальности анализ групп риска, включающих пациентов с патологией желудочно-кишечного тракта, бронхолегочными нарушениями, патологией других органов и родственников больных МВ (табл. 1).
Таблица 1.
Группы риска для дифференциальной диагностики муковисцидоза
| I. Бронхолегочные нарушения |
| 1. Повторные и рецидивирующие пневмонии с затяжным течением, особенно двусторонние 2. Бронхиальная астма, рефрактерная к традиционной терапии 3. Рецидивирующие бронхиты, бронхиолиты, особенно с высевом Ps. aeruginosa 4. Двусторонние бронхоэктазы |
| II. Изменения со стороны желудочно-кишечного тракта |
| 1. Синдром нарушенного кишечного всасывания неясного генеза 2. Мекониальный илеус и его эквиваленты 3. Гиперэхогенность кишечника плода 4. Желтуха обструктивного типа у новорожденных с затяжным течением 5. Цирроз печени 6. Сахарный диабет 7. Гастроэзофагеальный рефлюкс 8. Выпадение прямой кишки |
| III. Патология со стороны других органов |
| 1. Нарушение роста и развития 2. Задержка полового развития 3. Мужское бесплодие 4. Хронический синусит 5. Полипы носа 6. Электролитные нарушения |
| IV. Члены семей больных муковисцидозом |
Среди клинических проявлений, характерных для МВ, можно выделить высоко-и менее специфичные (табл. 2). Состояния, представленные в левой колонке таблицы, в абсолютном большинстве случаев встречаются у больных МВ. Причиной состояний из правой колонки могут быть другие заболевания, например первичная цилиарная дискинезия, гуморальный иммунодефицит и т. д.
Таблица 2.
Клинические проявления, характерные для МВ
| Высокоспецифичные для МВ | Менее специфичные для МВ |
| Желудочно-кишечные:
| Желудочно-кишечные:
|
| Со стороны дыхательных путей:
| Со стороны дыхательных путей:
|
| Другое:
| Другое:
Генетическое исследование Рекомендации: Для диагностики МВ или его исключения при пограничных результатах пробы необходимо: В европейских странах для подтверждения дефекта ионного транспорта применяется метод определения разности назальных потенциалов или измерение электрического тока в биоптате кишки, отражающие нарушение функции хлорного канала. Оба метода основаны на электрическом характере транспорта ионов и являются высокоинформативными для диагностики МВ. Диагностика панкреатической недостаточности включает: У больных МВ показатель эластазы может снижаться в течение первых лет жизни, поэтому определяется в динамике. Низкий уровень панкреатической эластазы расценивается как один из признаков МВ. Приблизительно 1% пациентов с МВ имеет пограничный результат потового теста в комплексе с сохранной функцией поджелудочной железы и хроническим бронхитом. Диагностика хронического бронхолегочного процесса: В качестве дополнительных диагностических маркеров могут быть использованы азооспермия в постпубертатном возрасте, идентификация МВ-ассоциированных патогенов из респираторного тракта, рентгенологические признаки синусита. Знание основных симптомов МВ и особенностей его течения в разные возрастные периоды позволяет своевременно заподозрить наличие заболевания и направить пациента для дальнейшего обследования. Нередкие случаи поздней диагностики МВ связаны как с отсутствием у врачей достаточных знаний о заболевании, так и с фенотипическим разнообразием его форм. Ограниченные возможности ДНК-диагностики МВ в России и ее низкая доступность затрудняют и затягивают окончательную верификацию заболевания. С.И. Жук, С.Н. Косьяненко, Е.А. Ночвина г. Винница
Внутриутробное инфицирование плода является одной из наиболее важных проблем современного акушерства. Частота его колеблется от 6 до 53%. В структуре перинатальной смертности внутриутробная инфекция составляет 65,5%. В последнее время отмечена тенденция к росту инфекционных заболеваний, связанных с условно-патогенной микрофлорой. В связи с этим изменилась и структура инфекционной патологии беременной, плода и новорожденного. В качестве основного источника гравидарного воспалительного процесса все чаще выступают очаги инфекции, расположенные во влагалище и шейке матки. Вагинальной микрофлоре как фактору риска долгое время не уделяли должного внимания, однако на сегодняшний день не вызывает сомнения, что среди микробов, проникающих в полость матки из нижерасположенных отделов репродуктивного тракта, явно превалируют условно-патогенные бактерии, а дисбаланс среды влагалища рассматривается как основная причина осложненного течения беременности и внутриутробного инфицирования плода. Спектр возбудителей включает многочисленные патогены от таких как стрептококки группы А до условно-патогенных анаэробов, достаточно часто выявляемых во влагалище. Наиболее распространенным нарушением вагинальной микрофлоры, частота которого у беременных женщин составляет 10-20%, является дисбиоз, характеризующийся резким снижением представителей нормальной микрофлоры и заменой ее на смешанную флору, состоящую из анаэробных условно-патогенных бактерий. Изменяется качественный и количественный состав микрофлоры влагалища и шейки матки как за счет увеличения интенсивности колонизации микроорганизмов, так и за счет повышения частоты их выделения. Однако рассматривать дисбиотические изменения как фактор внутриутробного инфицирования только на уровне влагалища невозможно, так как необходимо учитывать тесную взаимосвязь влагалищного и кишечного биоценозов. Именно симбиоз микрофлоры всех открытых биологических систем организма, благодаря выработке специфических адаптационных механизмов, обеспечивает не только метаболическую, регуляторную и генетическую функцию, но и создает мощную защиту от вторжения чужеродных микроорганизмов из внешней среды. В последние годы с развитием медицинской микробной экологии симбионтную микрофлору можно рассматривать не только как инфекционный агент в развитии внутриутробного инфицирования плода, но и как причину возникновения других осложнений течения беременности. Микрофлора выполняет множество жизненно важных функций, в частности непосредственно участвует в метаболизме женских половых гормонов (эстрогенов, прогестерона, андрогенов), вызывая их деконъюгацию, ароматизацию, эпимеризацию, восстановление кето- и гидроксигрупп. В условиях дисбиоза процессы метаболизма и инактивации нарушаются, что приводит к гормональному дисбалансу и как следствие – возникновение осложнений течения беременности. За счет непосредственного участия в синтезе факторов иммунологической резистентности микрофлора обеспечивает иммунный гомеостаз, что так же немало важно для нормального течения беременности. Нарушение микробиоценоза сопровождается дисбалансом в местном иммунном статусе, выражающемся в снижении уровня Ig G и увеличением количества Ig А. Иммунологическая недостаточность ослабляет компенсаторно-защитные механизмы организма в целом. Таким образом, создается порочный круг: активация условно-патогенной флоры и длительное воздействие инфекционного агента способствуют развитию иммунных нарушений, которые, в свою очередь, еще больше усугубляют дисбиотическое состояние, поддерживая тем самым воспалительный процесс и значительно повышая риск внутриутробного инфицирования. В последнее время все большее внимание в акушерской практике отводится грибковой инфекции. Candida spp представляет собой компонент симбионтной для человека микрофлоры. В норме основным местом обитания Candida в организме является кишечник, но доля грибов в нем очень мала. Рост колоний дрожжевых грибов контролируется различными факторами, в частности нормальным составом кишечного биотопа, функционированием эндокринной системы, работой различных звеньев иммунной системы. При беременности происходят значительные изменения гормонального баланса, накопление гликогена в эпителиальных клетках из-за иммуносупрессорного действия высокого уровня прогестерона и присутствия в сыворотке крови фактора иммуносупрессии, связанного с глобулинами. В результате создаются условия для избыточного роста и реализации патогенных свойств условно-патогенного компонента микрофлоры кишечника – грибов рода Candida, возникает так называемый кандидозный дисбиоз. Первично кандидоз локализуется в желудочно-кишечном тракте, а вторично в других областях, в частности на слизистой оболочке гениталий. Кандидозная инфекция имеет важное значение в акушерской практике, так как часто сочетается с другими нарушениями микроценоза влагалища и может быть причиной угрозы прерывания беременности, самопроизвольных выкидышей, преждевременных родов, хорионамнионита, несвоевременного излития околоплодных вод, рождения детей с малой массой тела, хронической гипоксии и внутриутробного инфицирования. Таким образом, принимая во внимание роль условно-патогенной микрофлоры в развитии внутриутробного инфицирования целью нашего исследования является изучение микробиологического состава кишечного и вагинального биоценозов у беременных групп риска, а также определение корреляционной зависимости между микробными показателями, состоянием фетоплацентарного комплекса, течением беременности и родов у данной группы женщин. Для оценки качественного и количественного составов вагинального и кишечного биотопов использовались следующие методы: микроскопия мазков содержимого влагалища в нативных и окрашенных по Грамму препаратах, посев влагалищных выделений и кала на различные питательные среды (среда Сабуро, кровяной агар, среда Эндо). С целью изучения функционального состояния фетоплацентарного комплекса проводилось ультразвуковое исследование с определением биофизического профиля плода, плацентометрия, доплерометрия маточных артерий, артерий пуповины, средней мозговой артерии, кардиотокография. Результаты исследования и обсуждение. В наше исследование вошли беременные женщины, составляющие группу риска в отношении внутриутробного инфицирования плода на основании данных анамнеза и особенностей течения беременности. Среди них беременные с наличием постоянных очагов инфекции – хронический пиелонефрит встречался у 16,7% обследуемых нами женщин, кариес и перидонтит у 27,4%, заболевания ЖКТ (гастрит, холецистопанкреатит, колит) у 35,1%, патология органов дыхания (бронхит, пневмония) у 13,6%, воспалительные заболевания органов малого таза, кольпиты, цервициты, эрозии имели место у 61,9% женщин. Также к группе риска внутриутробного инфицирования мы отнесли беременных с отягощенным гинекологическим и акушерским анамнезом: самопроизвольные выкидыши в анамнезе встречались у 17% женщин, искусственные аборты у 37,2%, преждевременные роды у 11,9%, замершие беременности у 9,3%, нарушения оварио — менструального цикла у 38%, 16,7% обследуемых беременных указывали на наличие в анамнезе послеродовых и послебортных осложнений. Особое внимание уделялось течению данной беременности: 17% обследуемых беременных перенесли ОРВИ и грипп на различных сроках, у 9% наблюдался острый или обострение хронического пиелонефрита, 90% имели кольпит. При бактериальном исследовании влагалищных выделений у 85% обследуемых нами беременных женщин определялся вагинальный кандидоз, характеризующийся высокими титрами грибов рода Candida – 10 5 КОЕ/мл у 28,6%, 10 6 КОЕ/мл у 52,3%, более 10 7 КОЕ/мл у 19% беременных. При этом отмечалось резкое снижение уровня лактобацил менее 10 6 КОЕ/мл во всей группе обследуемых женщин – 100%. В составе микробных ассоциаций в невысоких титрах (10 – 10 2 КОЕ/мл) высевались: эпидермальный стафилокок (9,5%), кишечная палочка (11,9%), Str. Pyogenes (4,76%), Str. Viridans (4,76%), Klebsiela рneumoniae (2,4%), Proteus mirabilis (7,14%), Gardnerella vaginalis (11,9%), Enterobacter aeroginoza (4,76%), при абсолютном доминировании грибов рода Candida (100%). При культуральном исследовании биоценоза кишечника у беременных с вагинальным кандидозом выявлены дисбиотические изменения: дефицит нормобиоты (Bifidumbacterium, Lactobacillus менее 100 млн. КОЕ/г), уменьшение общего количества кишечной палочки (47,6%), увеличение количества E.сoli со слабо выраженными патогенними свойствами (4,8%), в 4,8% случаях виявлена гемолизирующая кишечная палочка, в 21,4 % золотистый стафилококк, увеличение количества грибов рода Candida (100%). Из условно-патогенной флоры высевались: enterobacter aerogenos. (9,6%), klebsiela (7,1%), proteus mirabilis (11,9%). При анализе качественного и количественного составов кишечного и вагинального биотопов у беременных групп риска внутриутробного инфицирования обнаружено преобладание высоких титров грибов рода Candida (у 85% беременных в составе влагалищного микроценоза в титрах более 10 5 КОЕ/мл и увеличение количества колоний дрожжеподобных грибов при исследовании кала в 100% случаев). Анализ взаимосвязи дисбиотических состояний кишечника и влагалища выявил кореллятивную зависимость между нарушением кишечного и вагинального биоценозов. Выраженные лабораторные изменения характеризовались незначительной клинической симптоматикой инвазивного диффузного кандидоза кишечника и рецидивирующего вагинального кандидоза. Так, синдром кишечной диспепсии (общая слабость, метеоризм, абдоминальный дискомфорт) был только у 7,1% беременных, обильные творожистые выделения из половых путей беспокоили 12,4%, зуд, жжение, раздражение в области влагалища и наружных половых органов – 5,2%, усиление зуда во время сна или водных процедур – 3,2%. Во время беременности кандидоз часто характеризуется бессимптомным течением и частыми рецидивами, что обусловлено изменениями гормонального баланса, иммуносупрессорным действием высокого уровня прогестерона, присутствием в сыворотке крови фактора иммуносупрессии, связанного с глобулинами. При анализе течения данной беременности у обследуемых нами женщин на фоне инвазивного диффузного кандидоза кишечника и рецидивирующего вагинального кандидоза увеличивался процент угрозы прерывания беременности до 90%, плацентарной недостаточности – 78%, внутриутробной гипоксии плода – 64%. При ультразвуковом исследовании имели место признаки внутриутробного инфицирования, а именно: маловодие в 25% случаев, многоводие – 10%, гиперплазия плаценты – 35%, расширение межворсинчатого пространства – 50%, кистозные и гиперэхогенные включения в плаценте – 28%, наличие в водах гиперэхогенной суспензии – 20%, пиелоэктазии, гиперэхогенные и расширенные петли кишечника у плода в 19% случаев. Всем обследуемым женщинам проводилось доплерометрическое картирование с оценкой маточно-плацентарного, плодово-плацентарного кровотока, изучались кривые скорости кровотока с определением их индексов в левой и правой маточной артериях, в пуповинной артерии и средней мозговой артерии плода. В 62,4% случаев наблюдалось снижение плодово-плацентарного кровообращения в комплексе с патологией плаценты, многоводием. При проведении кардиотокографии установлена прямая зависимость между степенью инфицированности кишечника и родовых путей грибами рода Candida и кардиотокографическими изменениями состояния плода. Если у женщин с невысокими титрами грибкового обсеменения родовых путей (до 10 5 КОЕ/мл) изменения в кардиотокограмме встречаются в 11,9% наблюдений, то при значительном инфицировании (10 6 – 10 8 КОЕ/мл) в четыре раза чаще. Анализ проведенного микробиологического исследования кишечного и влагалищного биотопов у беременных групп риска внутриутробного инфицирования показал значительное преобладание кандидозной инфекции в указанных микроценозах. Кандидоз осложняет течение беременности, значительно влияет на состояние фетоплацентарного комплекса, что доказывает проведенное нами исследование. Беременные и роженицы с инвазивным диффузным кандидозом кишечника и рецидивирующим вагинальным кандидозом могут становиться источником как внутриутробного так и постнатального инфицирования. По научным данным, при отсутствии противокандидозного лечения 10% детей, рожденных с малой массой тела, страдают кандидемией в результате интестинальной персорбции грибов. Возбудитель может поражать различные органы и системы плода, но чаще ограничивается пуповиной, кожными покровами, слизистой рта, кишечника и бронхолегочной системы. За последнее время частота кандидоза среди новорожденных выросла с 1,9% до 15,6% (увеличилась в 8 раз). Эффективность проведенного лечения оценивалась микроскопическими и микробиологическими исследованиями. В мазках и бактериологическом посеве вагинальных выделений у 88,4% обследуемых беременных нити мицелия и дрожжевые клетки не обнаруживались, отмечалось достоверное увеличение количества лактобацил (более 10 6 КОЕ/мл), уменьшение уровня условно-патогенной флоры. При исследовании кишечного биотопа у 91% беременных нарушений микробиоценоза не выявлено, отмечался достаточный уровень бифидо- и лактобактерий, грибы рода Candida обнаруживались в допустимих минимальных концентрациях. Клинически отмечалось улучшение общего состояние, исчезновение симптомов кишечной диспепсии, уменьшение или полная ликвидация влагалищных выделений, гиперемии или отечности влагалища, жжения и зуда. При изучении состояния фетоплацентарного комплекса после проведеного лечения отмечалось улучшение показателей кардиотокоргамм и биофизического профиля плода. У всех обследуемых женщин беременность завершилась срочными родами, осложнений течения родов и ухудшения состояния плода не наблюдалось, по шкале Апгар все дети оценивались удовлетворительно 8-9 баллов. Дополнительно проводилось исследования микрофлоры кишечника у новорожденных детей обследуемых родильниц. У 85% новорожденных после проведенной комплексной противогрибковой терапии с целью профилактики внутриутробного инфицирования не было обнаружено нарушений кишечного биоценоза. 1. Основными факторами риска внутриутробного инфицирования плода являются урогенитальные инфекции у матери, хронические очаги инфекции в организме женщины, их обострение во время беременности, инфекционные заболевания в период гестации. Следует обращать внимание на наличие отягощенного акушерско-гинекологического анамнеза (хронические воспалительные заболевания, эндоцервицит, кольпит, невынашивание и недонашивание беременности, бесплодие, нарушения оварио-менструального цикла). 2. Учитывая наличие достоверной связи между осложненным течением беременности, возможностью внутриутробного инфицирования плода и дисбиотическими нарушениями кишечного и влагалищного биоценозов, необходимо проводить микробиологическое исследование вагинальной микрофлоры для своевременного лечения и профилактики внутриутробного инфицирования. 3. Candida spp как компонент условно-патогенной микрофлоры кишечника является наиболее часто выявляемым инфекционным агентом у беременных групп риска развития внутриутробного инфицирования плода. 1. И.С. Сидорова, И.Н. Черниенко, А.А. Сидоров. Особенности течения и ведения беременности при внутриутробном инфицировании плода.//Рос. вестник перинатологии и педиатрии. 2006. — №3. – С.18-20. 2. Акопян Т.Э. Бактериальный вагиноз и вагинальный кандидоз у беременных (диагностика и лечение): Дисс… канд. мед. наук. — М. — 1998. — 141 с. 3. Антонов В.Б., Мирзабалаева А.К., Шевяков М.А. Диагностика сочетанных микотических поражений органов пищеварения и гениталий у женщин // Вестник дерматологии и венерологии. -1999. — № 2. — С. 18-19. 4. Мирзабалаева А.К. Основные принципы лечения хронического кандидоза гениталий у женщины // Вестник дерматологии и венерологии. — 1994. — № 2. — С. 20-22. 5. Тютюнник В.Л., Орджоникидзе Н.В. Вагинальный кандидоз и беременность // Русский медицинский журнал. — 2001. — Т. 9. — № 19. — С. 833-835. Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции
|