Этиотропная терапия при кандидозе
Кандидоз — инфекционное заболевание, обусловленное дрожжеподобными грибами рода Candida . Клинические проявления микоза широко варьируют от поверхностных, слабовыраженных поражений кожи и слизистых оболочек до тяжелых, угрожающих жизни инвазивных висцер
Кандидоз — инфекционное заболевание, обусловленное дрожжеподобными грибами рода Candida. Клинические проявления микоза широко варьируют от поверхностных, слабовыраженных поражений кожи и слизистых оболочек до тяжелых, угрожающих жизни инвазивных висцеральных форм. Диагностика и терапия кандидоза непроста и часто требует привлечения специалистов различного профиля [1, 4, 8].
Число больных поверхностными и глубокими формами кандидоза в последние десятилетия значительно возросло во всех странах мира. Этот факт связывают со снижением естественной иммунной реактивности организма значительной части населения из-за поражения СПИДом, ятрогенных иммунодефицитов, возникающих при химиотерапии онкологических больных, трансплантации органов, вследствие применения глюкокортикоидов, цитостатиков, антиметаболитов, антибиотиков широкого спектра действия, в том числе в отделениях реанимации и интенсивной терапии [4, 8].
Главным возбудителем кандидоза является Candida albicans, которая, как и другие виды грибов Candida, обнаруживается в норме на слизистых и кожных покровах большинства обследованных, но поражает лишь ослабленный организм. Именно в этом кроется сложность проблемы кандидоза.
Природа возбудителя, его взаимоотношения с макроорганизмом, многие аспекты защиты организма от кандидозной инфекции, генетические механизмы резистентности различных видов Candida spp. к основным антимикотикам, применяющимся в лечении кандидоза, подробно изучена. Установлено, что подавляющее большинство штаммов C. albicans, C. tropicalis, C. parapsilosis чувствительны к флуконазолу, однако у ВИЧ-инфицированных и других иммунокомпрометированных больных с инвазивным кандидозом возможна резистентность C. albicans к азольным соединениям. В то же время большинство штаммов C. krusei и часть штаммов C. Glabrata обнаруживают устойчивость к флуконазолу [8].
Известно, что грибы рода Candida сапрофитируют на коже и слизистых оболочках, не вызывая заболевания и лишь при повреждении наружных покровов, снижении местного иммунитета они могут проникнуть внутрь, пройдя стадии адгезии, колонизации и инвазии.
Этиотропная терапия любого инфекционного заболевания, в том числе и кандидоза, ставит своей целью удаление (эрадикацию) возбудителя. Однако особенностью кандидоза является то, что грибы рода Candida входят в состав постоянной биоты — нормобиоты, бактериобиоты человека, и легко колонизируют слизистые оболочки, то есть сама эрадикация этого гриба почти никогда не бывает абсолютной и окончательной. Учитывая оппортунистическую природу кандида-инфекции, саму эрадикацию возбудителя связывают с патогенетическими факторами, определяющими клиническую форму и тяжесть инфекции. Это иммунодефициты, нейтропения и другие. Вот что определяет выбор антимикотика, его дозу и длительность терапии.
Лечение может быть направлено на предупреждение гиперколонизации организма грибами рода Candida (при назначении антимикотиков широкого спектра действия и иммуносупрессантов). Местные оральные антимикотики — полиены (нистатин, леворин, микогептин) нерастворимы и почти не всасываются из желудочно-кишечного тракта, поэтому редко могут обеспечить элиминацию Candida. Здесь необходимы пероральные препараты системного действия (флуконазол, итраконазол) или препараты для инъекций, такие как флюцитозин, амфотерицин В, амбизом. Если амфотерицин В вследствие его чрезвычайной нефротоксичности назначается при кандидозе в суточной дозе 0,5 мг/кг массы тела, амбизом в 10 раз и более превышает эту дозу и не имеет противопоказаний к назначению [1, 2, 3, 4, 9, 10]. При лечении кандидозов кожи и слизистых оболочек часто используются антимикотики для наружного применения: полиены (леворин, нистатин, натамицин), производные имидазола (кетоконазол, оксиконазол, эконазол, тиоконазол, клотримазол, миконазол, изоконазол, бифоназол, амиказол), триазолы (терконазол), аллиламины (нафтифин, тербинафин), морфолины (аморолфин), прочие препараты (производные унденциленовой кислоты, анилиновые красители и др.).
Одно только перечисление антикандидозных препаратов уже свидетельствует об их множестве и разной степени эффективности, связанной с химической структурой и особенностями фармакокинетики. В частности, наружные средства не всегда создают достаточную концентрацию в подслизистом слое половых путей, глубоких слоях кожи и ее придатках.
В последние годы в России и за рубежом в системной терапии кандидоза с успехом применяется медофлюкон (флуконазол) [2, 3].
Флуконазол (медофлюкон) — противогрибковый препарат из группы триазолов, эффективный при системных и локальных микозах. Флуконазол избирательно подавляет синтез эргостерина клеточной мембраны грибков на уровне образования диметил-эргостатриенола из ланостерина путем ингибирования зависимой от цитохрома Р-450 реакции С14-альфа-демитиляции. Этот путь биосинтеза стеролов характерен только для грибов. За счет более высокого сродства к ферментам, катализирующим синтез эргостерина у грибов, чем к ферментам, катализирующим образование холестерина у человека, селективность действия флуконазола на грибы рода Candida, дерматофиты и возбудители глубоких микозов в 10 000 раз выше, чем на клетки макроорганизма.
Спектр фунгистатического действия флуконазола: Candida albicans, некоторые штаммы Candida nonalbicans (C. guilliermondii, C. pseudotropicalis, C. torulopsis, C. kefyr, C. stellatoidea), Cryptococcus neoformans, Microsporum spp., Trichophyton spp., Blastomyces dermatitidis, Coccidioides immitis, Histoplasma capsulatum.
При пероральном и внутривенном применении фармакокинетика флуконазола сходная. При приеме внутрь биодоступность около 90%. Прием пищи не влияет на абсорбцию препарата. Максимальная концентрация достигается через 0,5 — 1,5 ч. После приема 150 мг она составляет 2,44 — 3,58 мкг/мл. Концентрация в крови прямо пропорциональна принятой дозе. Равновесная концентрация устанавливается к 4 — 5-му дню при приеме 1 раз в сутки. При использовании в первый день двойной дозы она достигается ко второму дню. Связь с белками плазмы 11 — 12%. Объем распределения приближается к общему объему воды в организме. Концентрации флуконазола в слюне, мокроте, суставной и перитонеальной жидкостях, вагинальном секрете, грудном молоке аналогичны таковым в плазме крови. Концентрация в ликворе составляет 50 — 90% (в среднем 70 — 80%) уровня в плазме крови, при менингите — до 93%. В роговом слое кожи, эпидермисе, дерме, потовой жидкости и моче концентрации достигают значений, в 10 раз превышающих концентрацию в плазме крови. Концентрация в роговом слое кожи после 12-дневного применения в дозе 50 мг 1 раз в сутки составляет 73 мкг/г. Концентрация в ногтях после 4-месячного применения в дозе 150 мг 1 раз в неделю составляет 4,05 мкг/г в здоровых и 1,8 мкг/г в пораженных ногтях. Препарат определяется в ногтях в течение 6 месяцев после завершения терапии. Т1/2 27 — 30 ч. Биотрансформации не подвергается. Экскретируется почками, на 80% — в неизмененном виде. Клиренс флуконазола пропорционален клиренсу креатинина. Концентрация флуконазола в плазме крови может быть уменьшена с помощью диализа (на 50% в течение 3 ч).
Медофлюкон применяется внутрь 1 раз в сутки (утром).
Дозы для взрослых:
- При кандидемии, диссеминированном кандидозе — 400 мг в первые сутки и 200 — 400 мг — в последующие дни. Продолжительность лечения 7 — 14 дней и более.
- При кандидозе кожи — 50 — 100 мг 1 раз в сутки или 150 мг 1 раз в неделю в течение 2 — 6 недель.
- При орофарингеальном кандидозе — 50 мг в сутки в течение 7 — 14 дней.
- При кандидозе другой локализации (кандидурии, кандидозном эзофагите и неинвазивном бронхолегочном кандидозе) — 50 — 150 мг в сутки в течение 14 — 30 дней.
- При онихомикозе — 50 мг 1 раз в сутки или 150 мг 1 раз в неделю в течение 3 — 6 месяцев при поражении ногтей пальцев рук и 6 — 12 месяцев — при поражении ногтей пальцев ног (до замещения инфицированного ногтя).
- При кандидозном баланопостите или вагинальном кандидозе — 150 мг однократно, при кандидозном вульвовагините — 50 мг в сутки в течение 7 дней или 150 мг двукратно, при хроническом рецидивирующем (3 — 4 раза в год или чаще) кандидозном вульвовагините 150 мг 3 — 4 раза в сутки с 3 — 7-дневными интервалами, иногда до 12 раз с месячными интервалами.
- При глубоких эндемических микозах — 200 — 400 мг в сутки ежедневно до 2 лет: 11 — 24 мес. при кокцидиомикозе, 2 — 17 мес — при паракокцидиомикозе, 1 — 16 мес. — при споротрихозе, 3 — 17 мес — при гистоплазмозе.
- При криптококковом менингите, криптококковых инфекциях другой локализации — 400 мг в первые сутки и 200 — 400 мг в последующие дни. Продолжительность лечения 7 — 14 дней, при криптококковом менингите — до 6 — 8 недель.
- Для профилактики грибковых инфекций — 50 — 400 мг в сутки на протяжении всего периода антибактериальной, глюкокортикоидной, цитостатической или лучевой терапии.
Специального подбора доз для пациентов пожилого возраста не требуется, если не угнетена функция почек (клиренс креатинина менее 40 — 50 мл/мин).
У больных с нарушениями функции почек доза должна быть снижена в соответствии со степенью почечной недостаточности.
Пациентам, находящимся на гемодиализе: однократно после каждого сеанса гемодиализа.
Российские авторы [3] приводят собственные данные о применении медофлюкона при различных поражениях, в том числе при висцеральных микозах, обусловленных грибами рода Candida. В частности, опубликованы данные об успешном лечении медофлюконом 9 больных кандидозом кишечника, 11 — полости рта, 3 — пищевода, 18 — вагинальным кандидозом при суточной дозе 50 — 200 мг и длительности курса 14 дней. Отечественные исследователи, оценив эффективность и безопасность препарата, уже в 1996 году назвали медофлюкон безусловным достижением в лечении кандидоза и рекомендовали его для лечения поверхностных и висцеральных форм микоза не только в стационаре, но и в амбулаторных условиях.
К такому же выводу пришли и авторы, проводившие исследования медофлюкона в Московском центре глубоких микозов [2]. По их данным, из 79 больных кандидозным бронхитом, получавших в течение 2 недель 100 — 400 мг медофлюкона в сутки, излечено 74,7%, улучшение наступило у 22,8%, при кандидозной пневмонии выздоровело 66,75%, улучшение отмечено у 33,3%, эрадикация возбудителя — в 97,5 — 100%.
В дерматовенерологии медофлюкон наиболее часто применяется при лечении урогенитальных кандидозов, кандидоза слизистой оболочки полости рта, онихомикозах [4, 6, 7, 8].
Данные, приведенные из литературы, и наш опыт применения медофлюкона при кандидозном вульвовагините и онихомикозе свидетельствуют о его высокой эффективности, хорошей переносимости и безопасности, что делает флуконазол препаратом выбора при лечении различных форм кандидоза слизистых оболочек, кожных покровов и внутренних органов.
В. М. Лещенко, доктор медицинских наук, профессор
Городской микологический центр, Москва
Н.В. БЕЛОБОРОДОВА, доктор медицинских наук, профессор, главный научный сотрудник академической группы академика РАМН Ю.Ф. Исакова.
При участии Ж.И. АРХИПОВОЙ, кандидата медицинских наук, НИИ детской гематологии. Серьезные экологических изменения, происходящие на планете в последние десятилетия, не могли не сказаться на состоянии микроэкологии и иммунореактивности современного человека.
В этом - одна из глобальных причин роста грибковых заболеваний, которыми сегодня, по данным Всемирной организации здравоохранения, страдает каждый пятый житель планеты. Чаще проявлениями грибковых заболеваний являются различные локальные поражения кожи, ногтей, слизистых оболочек полости рта, кишечника, уретры и влагалища, однако при серьезных нарушениях иммунореактивности организма может наступить генерализация процесса, и тогда грибковые заболевания приобретают жизнеугрожающий характер.
На фоне достижений современной медицины, увеличения продолжительности жизни наиболее ослабленных больных (глубоконедоношенные дети, пациенты с опухолями и иммунодефицитами) в лечебных учреждениях наблюдается широкое распространение инвазивных микозов, которые составляют до 12% в этиологической структуре внутрибольничных инфекций и до 40% в структуре инфекционной летальности. Ученые из Центра контроля заболеваемости (Атланта, США) называют кандидоз внутрибольничной эпидемией последнего десятилетия, так как заболеваемость им иммунокомпрометированных больных возросла в 11 раз.
Колонизация слизистых грибами Candida у практически здоровых людей колеблется от 15 до 40% и может возрасти до 80% на фоне какой-либо патологии в условиях длительной госпитализации, но инвазивный микоз у них не развивается благодаря большому количеству защитных механизмов против грибковой инфекции. Защитные механизмы, не связанные с иммунной системой, включают барьеры в виде кожи и слизистых, а также конкурентные взаимодействия с нормальными бактериями, которые обеспечивают защиту от кандидоза и других микозов посредством соревнования за пищу и, возможно, посредством локальной продукции веществ с антифунгальной активностью. Само по себе разрушение барьеров химической травмой, ожогом или операцией, как и нарушение нормального биоценоза кишечника после длительного применения антибиотиков широкого спектра действия, крайне редко приводит к развитию системного микоза, но вызывает предпосылки для этого в виде локального избыточного накопления грибов в тех местах, где действие физиологических барьеров нарушено.
Общеизвестными факторами риска возникновения грибковой инфекции являются длительная антибиотикотерапия и снижение защитных сил организма. В нормальном организме нейтрофилы, макрофаги и эозинофилы фагоцитируют и убивают бластоспоры кандид, а альвеолярные макрофаги и нейтрофилы способны блокировать прорастание спор аспергилл. Нейтрофилы и моноциты уничтожают также псевдогифы Candida и гифы Aspergillus. Поэтому первыми кандидатами на развитие диссеминированного кандидоза и аспергиллеза являются больные с количественными и функциональными дефектами нейтрофилов, особенно в условиях депрессии Т-клеточного звена иммунной сиcтемы. К специфическим условиям относится лекарственная нейтропения на фоне лечения цитостатиками, особенно глубокая ( 3 ) или длительная (>14 дней нейтрофилы 3 ). Глубоким дефектом Т-клеточной системы объясняется предрасположенность к развитию микозов при СПИДе.
У пациентов с онкогематологическими заболеваниями к появлению специфических факторов риска инвазивного микоза приводит терапия. На современном этапе она обязательно включает мощные цитостатики, глюкокортикоиды и антибиотики широкого спектра действия. Помимо возникновения нейтропении цитостатики приводят к разрушению кожных и слизистых барьеров, глюкокортикоиды угнетают Т-лимфоциты и макрофаги, антибиотики нарушают биоценоз кишечника. Неудивительно, что в онкогематологических стационарах инвазивные микозы становятся все возрастающей проблемой.
Барьер №1 - конкурентное взаимодействие грибов с бактериями нормальной микрофлоры хозяина
Барьер №2 - целостность кожи и слизистых
Барьер №3 - фагоцитоз и иммунологические реакции
Основные факторы, способствующие разрушению барьеров
№1 - неадекватная (избыточная) антибиотикотерапия
№2 - повреждение эпителия (механическое, токсическое, воспалительное), замедление регенерации, авитаминоз
№3 - снижение иммунореактивности под влиянием цитостатиков, стероидных гормонов
Еще в 80-е годы грибковые инфекции возникали в основном на фоне длительной госпитализации, продолжительной антибиотикотерапии и повторных курсов химиотерапии. Средняя продолжительность периода от момента установления диагноза онкогематологического заболевания до развития грибкового осложнения составляла 19 месяцев. В настоящее время все чаще грибковые инфекции стали наблюдаться на ранних этапах лечения цитостатиками. Это связано как с агрессивностью режимов полихимиотерапии, так и с широким применением современных супермощных антибиотиков.
Важно отметить, что инвазивные грибковые поражения могут развиваться не только у больных при явнымх дефектах иммунореактивности, но и у пациентов с любыми хирургическими заболеваниями в случае осложненного течения послеоперационного периода, реанимационных мероприятий, интенсивной терапии, длительной искусственной вентиляции легких. Мы наблюдали таких пациентов после тяжелых комбинированных травм, после повторных операций по поводу абдоминального сепсиса, после кардиохирургических, нейрохирургических операций и др. В этих случаях предрасполагающим моментом является совокупность факторов, снижающих барьерную функцию слизистых оболочек (стресс, нарушения гемодинамики, гипоксия, длительная невозможность энтерального питания и др.) в сочетании с массивной комбинированной антибиотикотерапией, к сожалению, необходимой у больных высокого риска по жизненным показаниям. Забегая вперед, следует отметить, что даже при выделении грибов из крови или очагов инфекции при проведении целенаправленной противогрибковой терапии у таких пациентов не представляется возможным отказаться от одновременного введения антибиотиков в связи с высокой опасностью септического шока.
Самым частым видом микоза является кандидоз. В списке возбудителей кандидоза лидирующее место занимает Candida albicans. Этим видом грибов вызывается более 80% кандидозов. Однако инфекция может быть вызвана и другими видами: С. tropicalis, С. parapsilosis, С. krusei, С. lusitaniae, Torulopsis glabrata.
Кандидоз в зависимости от степени поражения может быть классифицирован как поверхностный и глубокий. Поверхностный кандидоз включает кожный, орофарингеальный, мочеполовой и характеризуется поражением соответствующих слизистых. Наиболее опасен глубокий кандидоз, составляющий основной спектр кандидозных инфекций у иммунокомпрометированных больных, который может быть классифицирован как фунгемия, диссеминированный кандидоз и кандидоз отдельных органов.
Инвазивное кандидозное поражение желудочно-кишечного тракта (ЖКТ). Считается общепризнанным, что ЖКТ является основным эндогенным резервуаром Candida, откуда происходит проникновение грибов в кровь (феномен транслокации) и последующее распространение инфекции по организму. Однако у больного с агранулоцитозом локальное поражение ЖКТ грибами рода Candida не ограничивается хорошо описанной в литературе ролью "ворот" для диссеминации, а само по себе может вызвать жизнеугрожающие состояния: прогрессирование поражения быстро приводит к множественной инфильтрации или некрозам всей толщи стенки пищеварительного канала, вызывая такие тяжелые осложнения, как кишечная непроходимость, перитонит, желудочно-кишечное кровотечение, вплоть до летального исхода.
Поражение легких. Грибы рода Candida часто высеваются из респираторных секретов, однако клиническое значение таких высевов в большинстве случаев невелико, так как колонизация ротовой полости и верхних дыхательных путей приводит к контаминации мокроты. Более того, легочная инфекция грибами Candida обычно возникает в результате гематогенного распространения, и мокрота у таких больных не отделяется вовсе. Симптомы кандидозной пневмонии схожи с клиническими проявлениями бактериальной пневмонии, но носят более непостоянный характер. Обращает на себя внимание несоответствие выраженных нарушений дыхания скудным аускультативным и рентгенологическим признакам. Рентгенологические нарушения могут ограничиваться изменениями корня и усилением сосудистого рисунка, почти в половине случаев наблюдается рентгенонегативная кандидозная пневмония. В финале заболевания может развиться диссеминация по обоим легочным полям. Рентгенологически этот процесс характеризуется появлением множественных "мигрирующих" облаковидных теней. Сегодня для диагностики поражения легких у иммунокомпрометированных больных наиболее широко используется бронхоальвеолярный лаваж с последующим микробиологическим исследованием.
Поражение кожи встречается в 5-10% случаев острого диссеминированного кандидоза. Классически оно имеет вид плотных, приподнимающихся над поверхностью узлов 0,5-1 см в диаметре, розово-красного цвета, не исчезающих при надавливании. Однако у большинства больных изменения на коже представляют собой просто папулезную или пятнисто-папулезную сыпь, часто неотличимую от медикаментозной.
Изменения на коже и инфильтраты мягких тканей часто становятся информативным материалом для идентификации возбудителя, так как поверхностное расположение делает их удобными для биопсии. Сочетание посева с гистологическим исследованием значительно увеличивает этот показатель. Следует иметь в виду, что поражения кожи при кандидозе затрагивают дерму, в то время как поверхностный слой эпидермиса остается интактным, поэтому клиницист должен быть очень внимателен при заборе материала. При гистологическом исследовании обычно находят псевдомицелий грибов, фибрин и небольшие геморрагии в сочетании с отеком стенки сосудов и периваскулярной ткани.
Поражение ЦНС. Кандидозный менингит встречается относительно редко, наиболее характерен для новорожденных и недоношенных детей, а также как вторичное осложнение при шунтирующих нейрохирургических вмешательствах. В случае развития у имунокомпрометированных больных имеет исключительно агрессивное течение. Поражение оболочек головного мозга характеризуется достаточно ярко выраженными общемозговыми и менингеальными симптомами, а также нейтрофильным или лимфоцитарным плеоцитозом в ликворе - в зависимости от степени нейтропении. Candida имеет низкую высеваемость из ликвора, при морфологическом исследовании ликвора друзы гриба или псевдомицелий обнаружить, как правило, не удается, клинические симптомы (лихорадка, головная боль) не специфичны, поэтому грибковая природа менингита у больных с нейтропенией редко распознается при жизни. Внутримозговые абсцессы, связанные с Candida, могут вызывать очаговую неврологическую симптоматику, соответствующую их локализации.
Поражение сердца. Клиника кандидозного эндокардита не отличается от клиники бактериального, сопровождается длительной лихорадкой и формированием вегетаций на клапанах сердца. Особенностью этой локализации является частое сочетание с фунгемией: хотя бы однократный высев Candida из крови имеют до 80% больных кандидозным эндокардитом. На фоне иммунодефицита могут развиваться грибковые микроабсцессы в миокарде, что иногда проявляется аритмиями. Возможна закупорка грибковыми тромбоэмболами кардиальных артерий с развитием ишемии и сердечной недостаточности.
Хронический диссеминированный кандидоз (ХДК). Наиболее важный маркер ХДК - поражение печени и селезенки. Именно микроабсцессы в этих органах определяют хронический характер течения болезни. Термины "ХДК" и "гепатолиенальный кандидоз" в литературе являются синонимами. Клинически ХДК проявляется увеличением печени и селезенки на фоне длительной лихорадки. Иногда заболевание сопровождается желтухой или болями в правом подреберье. В крови отмечаются высокий лейкоцитоз и выраженная гипербилирубинемия (в основном за счет прямой фракции) в среднем у половины больных. Уровень трансаминаз повышается непостоянно и не более, чем в 3 раза. Наблюдения позволяют сказать, что в целом у большинства больных поражение печени грибами выглядит как холестатический гепатит. Такая особенность приводит к тому, что ХДК часто ошибочно принимается за токсическое поражение цитостатиками, особенно при отсутствии характерных изменений на УЗИ. Кандидозные микроабсцессы в паренхиматозных органах выглядят при ультразвуковом исследовании и компьютерной томографии как гипоэхогенные очаги, поэтому многие клиницисты считают обнаружение этих характерных изменений диагностическим критерием, подтверждающим инвазивную грибковую инфекцию.
Кандидемия. Многие авторы утверждают, что Candida spp., высеянная из крови, редко является контаминантом и должна быть принята во внимание как патоген практически во всех случаях. Фунгемия обнаруживается примерно в 30% случаев диссеминированного кандидоза и имеет важное диагностическое значение, так как служит основным прижизненным доказательством инвазивного кандидоза. Повторная (стойкая) кандидемия может быть результатом инфицирования центрального венозного катетера или проявлением деструктивного поражения глубоких тканей.
С момента возникновения проблемы грибковых инфекций в 60-70-е гг. огромные усилия медиков всего мира были направлены на разработку методов диагностики этих опасных осложнений, так как ранняя диагностика остается основным критическим моментом, определяющим успех в ведении больного с инвазивной инфекцией. Однако до настоящего времени от 20 до 75% случаев инвазивных микозов диагностируется лишь на аутопсии.
Кроме классических микробиологических методов серьезным подспорьем в лабораторной диагностике сегодня является определение маркеров кандидоза - Д-арабинитола и маннозы - методом газовой хроматографии. Даже при трудной локализации очага, недоступного для биопсии и посева, обнаружение высокого уровня маркеров в крови или спинномозговой жидкости позволяет подтвердить диагноз кандидоза, кроме того, в динамике объективно оценить эффект противогрибковой терапии.
Профилактика и лечение. Широко распространено мнение о необходимости одновременно с антибиотиками принимать нистатин, что гарантирует от грибковых осложнений. Действительно, нистатин препятствует массивному размножению кандид на слизистых ЖКТ. Однако крайне важно учитывать, что этот препарат не всасывается при приеме внутрь, то есть не способен воздействовать на клетки грибов, находящиеся вне просвета кишечника. Поистине революционным событием в этиотропной терапии кандидоза следует считать появление препарата флуконазола, наиболее известного под торговым названием дифлюкан. Хорошая биодоступность препарата обеспечивает высокую эффективность практически при любой локализации процесса - от распространенных кожных поражений до менингита. Почти всегда рекомендуется прием препарата внутрь за исключением редких случаев крайне тяжелого состояния больного, когда препарат вводят внутривенно. Благодаря отсутствию токсичности и низкой частоте побочных реакций флуконазол применяется даже у недоношенных детей. Очень важно правильно соблюдать режимы дозирования (см. табл.).
| Пациенты | Показания и дозы флуконазола | ||
| Новорожденные и дети раннего возраста | кандидоз кожи и слизистых 5-6 мг/кг 1 раз в день 5 дней | грибковый сепсис 10 мг/кг 1 раз в день 10-14 дней | грибковый менингит 15 мг/кг 1 раз в день 10-14 дней |
| Взрослые | кандидоз кожи и слизистых 50 мг 1 раз в день 5 дней | вагинальный кандидоз 150 мг однократно (!) | кандидемия, диссеминированный кандидоз 200-400 мг 1 раз в день 2-4 недели |
Когда терапия флуконазолом не дает эффекта, следует думать о кандидозе, вызванном природно резистентными видами кандид, например C.krusei. В этих случаях рекомендуется противогрибковая терапия эффективным, но потенциально токсичным препаратом амфотерицин В (относительно менее высокой токсичностью характеризуется препарат с торговым названием фунгизон). Лечение проводится только в стационаре под тщательным лабораторным контролем. Дозы амфотерицина В из-за опасности нефротоксических реакций не должны превышать 0,5-1 мг/кг в сутки внутривенно один раз в день или через день. При наличии микроабсцессов в печени, головном мозге и других органах наиболее эффективными являются липосомальные формы амфотерицина В (амфоцил и др.), которые, однако, малодоступны из-за высокой стоимости.
Таким образом, в настоящее время актуальность своевременной диагностики и раннего лечения кандидоза чрезвычайно высока.
Высказанная нобелевским лауреатом И.И. Мечниковым столетие назад идея о ведущей роли микробных сообществ в сохранении здоровья и формировании долголетия человека, современниками воспринималась, мягко говоря, как несерьезная. Но спустя десятилетия ученые с завидной регулярностью вновь и вновь обращаются к первоначальной трактовке тезиса великого отечественного биолога 1-2 и его исследованиям возможности восстановления микробиоты кишечника при помощи молочнокислой палочки.
В системе человек/микроорганизм, общее количество человеческих клеток составляет 10 13 , а микробных – 10 14 -10 15 (около 2 кг веса). 3 И каждый из этих миллиардов (сто биллионов-биллиард!) микроорганизмов функционирует, метабилизирует внутри макроорганизма, то есть человека. Без сомнения, эта армада микробов не может не оказывать определенного воздействия на организм хозяина. 4
В последние годы появилось много работ, рассматривающих организации сложных сообществ микроорганизмов – биопленки, сбалансированные по видовому и функциональному составу.
Без сомнения, эта микроэкологическая система чрезвычайно сложная (по количественному и качественному составу микроорганизмов), филогенетически сложившаяся, представляет огромный интерес для фундаментальной науки.
Нарушения состава нормальной микроэкологической системы сегодня принято называть дисбактериозом (дисбиозом), то есть состоянием, при котором нарушается состав и численность микрофлоры. Исчезают базовые анаэробы (или резко снижается их число) – бифидобактерии, бактероиды, лактобациллы. Растет число аэробов (в первую очередь условно-патогенных и патогенных). Как правило, дисбиотические изменения исчезают (самовосстановление) вскоре после устранения причины, вызвавшей их (стресс, сопутствующие заболевания, хирургическое вмешательство, приобретенные или наследуемые нарушения иммунной регуляции, медикаментозное воздействие, влияние радиации, тяжелых металлов и др.). Но при длительном воздействии провоцирующего фактора может формироваться состояние дисбиоза, появляются клинические симптомы.
Количественный бактериологический анализ вагинального сообщества здоровых женщин показал, что в 1 г. вагинальной жидкости содержится 10 8 клеток аэробных и 10 9 клеток анаэробных бактерий. 6 Ведущие микроорганизмы – Lactobacillus, Peptococcus, Bacteroides, Staphilococcus epidermidis, Corinebacterium spp., Peptostreptococcus spp., Eubacterium. Это доминирующие микроорганизмы, чья концентрация – более 10 5 КОЕг.
При таком представлении о характере взаимоотношений в системе человек / микробиота становятся понятными трудности, возникающие при лечении, к примеру, пациентов с кандидозом.
Увеличение частоты и тяжести ряда инфекционных заболеваний, латентное течение и хронизация воспалительных процессов, связываемые многими специалистами с нарушениями микробиоты или дисбактериозами, заставляют клиницистов искать новые и эффективные способы их коррекции. А фармакологам предлагать им для этого эффективные средства. И примером такого современного средства может быть противогрибковый препарат, предназначенный для терапии вульвовагинального кандидоза (ВВК) с пребиотиком – Экофуцин ® (АВВА РУС АО, Россия).
ВВК обусловлен избыточным ростом дрожжеподобных грибов рода Candida. Но за последнее десятилетие его частота практически удвоилась – достигнув 30–45% в структуре инфекционных поражений вульвы и влагалища. До 70–75% женщин в течение жизни имеют хотя бы один эпизод ВВК, при этом в 5–10% случаев заболевание становится рецидивирующим (около 3 млн. случаев в год). 7-10
ВВК негативно влияет на качество жизни, психологическое состояние и сексуальную активность женщин, требуя немедленного лечения и учета высокого риска рецидива.
Как уже следует из названия, этиологический фактор заболевания – грибы рода Candida (Candida albicans – доминирующий возбудитель заболевания, выявляемый у 90% больных ВВК; также представители Candida non-albicans, выявляемые, как правило, при рецидивирующем ВВК, протекающем на фоне других заболеваний), причем в последние годы наблюдается явная тенденция к увеличению распространения ВВК, обусловленного именно видами Candida non-albicans. 7-8 Эти микроорганизмы – представители нормального микробиома человека, то есть присутствующие в здоровом организме в качестве либо симбионтов, либо комменсалов вместе с лактобациллами.
Но при воздействии экзогенных и эндогенных факторов, о которых уже говорилось ранее, при беременности (увеличении гликогена в эпителии влагалища), при снижении резистентности организма формируется ощутимый дефицит лактобактерий и увеличивается количество С. albicans, начинают проявляться ее патогенные свойства, провоцирующие начало и развитие заболевания. 11-19 При этом эксперты отмечают сложности в понимании патогенеза заболевания: штаммы C. albicans, выделенные у больных ВВК и у здоровых носителей, по ряду биохимических характеристик существенно не различаются. Таким образом, основная роль принадлежит не столько свойствам возбудителя, сколько состоянию макроорганизма и его микробиома. 13-14
Традиционно целью медикаментозного лечения ВВК является эрадикация возбудителя. Большинство случаев поддается терапии местными противогрибковыми средствами и антисептиками. Интравагинальные формы ЛС безопасны (системная абсорбция практически отсутствует), быстро обеспечивают купирование симптомов, а высокие концентрации антимикотиков на поверхности слизистой уменьшают вероятность развития устойчивости.
Экофуцин ® – антибиотик полиенового ряда с действующим веществом натамицин, оказывающий фунгицидное действие на грибы и дрожжи, связываясь со стеролами клеточной мембраны гриба, активен в отношении большинства дрожжеподобных грибов, особенно Candida albicans и Candida glabrata, часто обнаруживаемых у пациенток с ВВК.
Тем не менее, даже адекватная этиотропная терапия не всегда позволяет предупредить рецидивы заболевания. 15-16 Это, в частности, может быть связано с тем, что самостоятельное восстановление микробиоты влагалища не всегда возможно. Предупредить обострения можно, восстановив вагинальный биотоп. Поэтому важным аспектом терапии ВВК становится восстановление нормальной микрофлоры влагалища, чтобы физиологические механизмы колонизации слизистой сапрофитами способствовали подавлению роста патогенных грибов. 17 Как известно, важным (и доминирующим) компонентом резидентной микрофлоры влагалища выступают молочнокислые бактерии (L. acidophilus, L. plantarium, L. casei и др.). Именно они препятствуют росту болезнетворных микроорганизмов, выступая в роли антагонистов грибов рода Candida, но не в случае угнетенного и ослабленного микробиома.
Ученые давно обратили на это внимание. И в Европе врачи рекомендуют применение свечей с лактобактериями (пробиотик) для местного применения. Особенно эта форма актуальна для беременных женщин с ВВК.
Препараты, содержащие живые бактерии и предназначенные для коррекции разнообразных дисбиотических сдвигов (пробиотики), нашли широкое распространение и в нашей стране. Безопасность их использования – достаточно хорошо установленный факт. Но клинические исследования пробиотиков пока показывают лишь кратковременный эффект. По данным Кохрейновского обзора (2017 г.), пробиотики в краткосрочной перспективе несколько улучшают эффективность антимикотического средства и значимо снижают частоту рецидивов, но только в течение 1 месяца. 20 Длительного протективного влияния авторы не обнаружили.
А с расширением спектра показаний для их назначения стала появляться информация о том, что их положительный эффект даже при длительном применении нередко носит транзиторный характер. Одной из главных причин этих неудач многие авторы считают чужеродность для человека входящих в их состав микроорганизмов, высокую видовую, индивидуальную и анатомическую специфичность автохтонной микрофлоры пациентов (из более 10 видов лактобацилл, обнаруживаемых во влагалищах, не удается определить ни одного вида, который бы присутствовал у всех женщин). 18
Некоторые специалисты считают, что коллективный иммунитет биопленки практически сводит на нет результат коррекции дисбактериозов пробиотиками. Несомненно, они создают эффект, но не всегда и не такой, как предполагалось. Возможно, правы те авторы, кто считает, что каждый пациент имеет свой уникальный (индивидуальный) штаммовый пейзаж индигенной микробиоты, постоянство которого обеспечивает иммунная система индивидуума. Он генетически детерминирован. 19
Кроме того, широкое лечебно-профилактическое применение пробиотиков имеет еще один ограничивающий фактор – экономический, связанный с достаточно высокой стоимостью препаратов.
Механизмы положительного влияния молочнокислых бактерий и бифидобактерий на организм: 6
- ингибирование роста потенциально вредных микроорганизмов в результате продукции антимикробных субстанций; конкуренции с ними за рецепторы адгезии и питательные вещества; активации иммунно-компетентных клеток и стимуляции иммунитета;
- стимуляция роста представителей облигатной микрофлоры в результате продукции витаминов и других ростостимулирующих факторов; нормализации рН, окислительно-восстановительного потенциала ; нейтрализация токсинов;
- восстановление и оптимизация функционирования биопленки;
- изменение микробного метаболизма, ведущего к повышению или снижению синтеза и активности бактериальных ферментов и, как следствие, продукции соответствующих метаболитов (например, ЛЖК, глютамина, аргинина, витаминов, пептидогликанов и т. д.), обладающих способностью местно или после проникновения в кровь и другие биологические жидкости макроорганизма непосредственно вмешиваться в метаболическую активность клеток соответствующих органов и тканей. Модулировать его морфокинетические характеристики, физиологические функции, биохимические и поведенческие реакции.
Альтернативным и более перспективным подходом, направленным на восстановление микробиоты, можно считать использование пребиотиков, которые, являясь питательной средой для размножения собственной нормофлоры, способны длительно стимулировать и поддерживать ее рост. 22 Это препараты немикробного происхождения, относящиеся к различным фармакотерапевтическим группам, но обладающие общим свойством – способностью оказывать позитивный эффект на организм хозяина путем селективной стимуляции роста или активизации метаболической функции нормальной микробиоты.
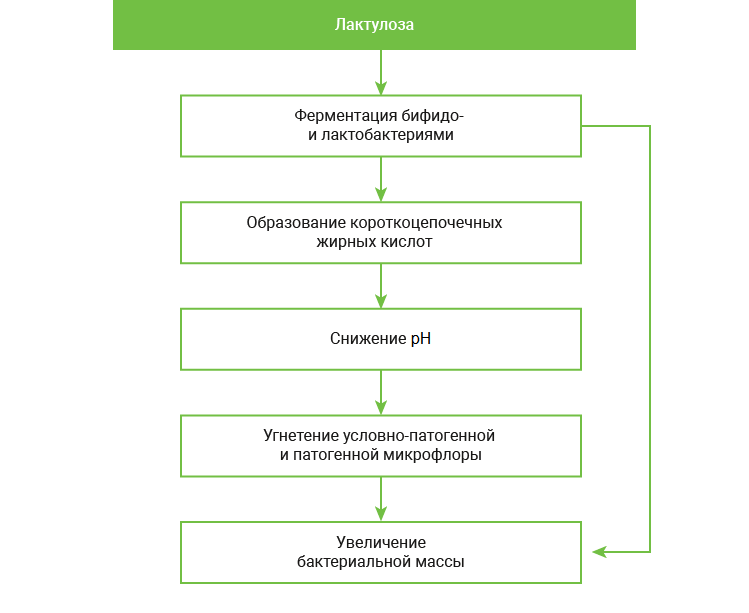
В недавно опубликованной работе авторы изучили in vitro реакцию лактобацилл, кандид и др. на различные пребиотики. По полученным данным, лактулоза наиболее активно и избирательно стимулирует лактобациллы влагалища, включая L. crispatus. Было также доказано, что C. albicans не усваивают лактулозу, оставаясь без питания. На этом основании ученые рекомендовали включать этот дисахарид в комбинированную терапию ВВК и при остром процессе, и при долечивании. 23
Именно лактулоза стала вторым компонентом препарата Экофуцин ® (100 мг натамицина и стимулятор роста нормальной микрофлоры влагалища – пребиотик лактулоза в дозировке 300 мг).
Комплексное действие этого отечественного препарата Экофуцин ® (суппозитории вагинальные), его эффективность и безопасность были продемонстрированы в многоцентровом открытом сравнительном рандомизированном исследовании, проведенном в клинических центрах Санкт-Петербурга и Омской государственной медицинской академии. 24
В исследование вошли пациентки в возрасте от 18 до 45 лет с острым кандидозным вагинитом/вульвовагинитом. В 1-й группе (n = 36), основной, наблюдаемые принимали Экофуцин ® , во – 2-й (n = 36), контрольной, препарат зарубежного производства с действующим веществом натамицин (100 мг), но без пребиотика. Длительность терапии – 6 дней.
Эффективность и безопасность исследуемых препаратов оценивали по результатам осмотра, лабораторного исследования, по данным дневников пациенток. Контрольные визиты проводили на 4, 7 и 37-й (± 2) день от начала лечения.
Результаты исследования: 24 комбинация противогрибкового препарата натамицина и пребиотика в составе интравагинальных свечей способствует более быстрому достижению клинической и микробиологической ремиссии, т.е. полной элиминации возбудителя, а также приводит к интенсивному росту лактобактерий (содержание вагинальных Lactobacillus spp. до начала терапии значимо не различалось – 0,3 и 0,6 lg КОЕ/мл; а на 37-е сутки достоверно большее количество молочнокислых палочек было зарегистрировано в группе комбинированного лечения: 4 lg КОЕ/мл по сравнению с 2,1 lg во 2-й, контрольной, группе, разница почти в 100 раз), являющихся основными конкурентами дрожжеподобных грибов во влагалищной микробиоте.

Исследование продемонстрировало хорошую переносимость Экофуцина ® пациентками, побочных эффектов в ходе проведенного исследования не было зарегистрировано. 24
- активно устраняет грибы рода Candida (Candida albicans и Candida non-albicans);
- восстанавливает микробиоту влагалища, повышая уровень лактобактерий, и предотвращает развитие рецидивов заболевания;
- может применяться с первых дней беременности и при различной сопутствующей патологии, т. к. отсутствует системное действие;
- удобство применения – 1 раз в день;
- входит в стандарты лечения кандидоза.
Подводя итоги, следует еще раз подчеркнуть, насколько важным физиологическим партнером организма-хозяина является микробиота половых органов женщин. Она гомеостатична, участвует в обменных процессах на слизистой и защите от внешних патогенов. В то же время она может проявлять враждебность, если ее состав нарушен.
Терапия кандидоза, заболевания, вызванного грибами рода Candida и чья патогенная активность спровоцирована подобными нарушениями, с учетом новых научных знаний о взаимосвязях системы человек / микробиота, должна быть комплексной и включать не только элиминацию возбудителя, но и восстановление естественного защитного барьера. Оба этих направления лечения были успешно учтены создателями противогрибкового препарата с пребиотиком Экофуцин ® , предназначенного для адекватной терапии кандидоза. Эффективный и безопасный, он сокращает срок лечения заболевания, предотвращает развитие его рецидивов, делая вагинальное использование лактулозы вместе со стандартным местным лечением противогрибковыми препаратами перспективным направлением в терапии ВВК.
Читайте также:


