Препараты для этиотропной терапии герпеса
Generic synthetic acyclic nucleosides in causal treatment of herpes simplex relapses
Актуальность. Появление на отечественном фармацевтическом рынке воспроизведенных ациклических синтетических нуклеозидов требует оценки их эффективности и безопасности для разработки дальнейших рекомендаций по применению в клинической практике. Цель исследования — провести изучение эффективности и безопасности новой формы валацикловира, а также комплаентности лечению. Материал и методы. Проведено изучение эффективности и безопасности препарата Валвир при купировании рецидивов простого герпеса (ПГ). У всех обследованных пациентов отмечалось тяжелое течение герпетической инфекции с частотой рецидивов не менее 6—8 раз в год. В основном симптомы проявлялись в виде ограниченного зуда. Валвир назначался в стадии предвестников по 500 мг (1 таблетка) 2 раза в сутки в течение 5 дней. Результаты. Отмечено, что во всех случаях начала приема препарата на стадии предвестников ПГ вирусный процесс прерывался и клинические проявления не развивались. Все пациенты отметили положительную настроенность на терапию в дальнейшем, часть больных выразили готовность к пролонгированному приему препарата. Заключение. Валвир является высокоэффективным средством для купирования рецидивов простого герпеса с хорошим профилем безопасности.
Ключевые слова: простой герпес, лечение, ациклические нуклеозиды, валацикловир, Валвир.
Relevance. Launching of generic synthetic acyclic nucleosides to the Russian pharmaceutical market requires an assessment of their efficacy and safety in order to develop further recommendations for application in clinical practice. Objective. To study efficacy and safety of a new form of valaciclovir as well as treatment compliance. Material and methods. Efficacy and safety of Valvir in arresting herpes simplex relapses were studied. All the examined patients had severe herpetic infections with a relapse rate of at least 6—8 times a year. Limited itching was the main symptom. Valvir was administered at the premonitory phase at a dose of 500 mg (1 tablet) BID for 5 days. Results. In all cases of administration of the drug, the viral process was stopped at the premonitory phase of GS and no clinical manifestations occurred. All patients were positively disposed to further therapy; some patients expressed willingness to prolonged drug intake. Conclusion. Valvir is highly effective in arresting herpes simplex relapses and has a good safety profile.
Key words: herpes simplex, treatment, acyclic nucleosides, valacyclovir, Valvir.
Этиотропная терапия простого герпеса (ПГ) является общепризнанным подходом к лечению острых проявлений вирусной инфекции и профилактике ее обострений, входя во все международные стандарты и рекомендации. Основанием для этого служат многочисленные многоцентровые плацебо-контролируемые рандомизированные исследования, а также многолетний положительный опыт применения противовирусных средств при лечении пациентов с различными формами ПГ. Современные этиотропные противогерпетические препараты (ацикловир, валацикловир, фамцикловир) по уровню доказательности относятся к группе А [1, 2].
Однако только в 1974 г. появление первого современного аналога ациклических естественных нуклеозидов — ацикловира — позволило сделать значительный шаг вперед в этиотропной терапии герпетической инфекции. Механизм противогерпетического действия ациклических нуклеозидов, по сравнению с другими противовирусными препаратами, во многом уникален. Если опустить фармакологические тонкости, то он базируется на следующем. Во-первых, ациклические нуклеозиды комплементарны исключительно ферментам ВПГ, что обусловливает их высочайшую избирательность по отношению к вирусу без вмешательства в биохимические процессы свободных от него клеток организма. Во-вторых, герпесвирусная тимидинкиназа (гуанилаткиназа) связывается с химиопрепаратами в тысячу раз быстрее, чем клеточная — это обеспечивает накопление действующего вещества исключительно в инфицированных клетках и объясняет отсутствие мутагенных, тератогенных или цитотоксических свойств, даже при их длительном приеме. В-третьих, ДНК-полимераза герпесвирусов всегда ошибочно включает фосфорилированные ациклические нуклеозиды в концевые участки синтезируемых новых вирусных ДНК вместо естественного дезоксигуанозинтрифосфата, в результате чего нарушается репликация возбудителя.
Следующим шагом, позволившим повысить эффективность этиотропной терапии и ее комплаентность, стал синтез двух предшественников ациклических синтетических нуклеозидов — валацикловира (L-валиновый эфир ацикловира) и фамцикловира (пероральная форма препарата-предшественника пенцикловира).
Препарат валацикловир по сравнению с ацикловиром имеет более высокую биодоступность (54%) и длительность полувыведения (10—20 ч). Это в свою очередь позволяет снизить кратность приема препарата до 2 раз в сутки, что значительно удобней для пациентов.
В период действия патента единственный препарат валацикловира выпускался под торговой маркой валтрекс. Его эффективность, высокий профиль безопасности и удобство применения неоднократно показаны в многочисленных исследованиях [4—6]. Именно эти исследования позволили валацикловиру занять достойное место в терапии и профилактике герпесвирусных инфекций.
Материал и методы
Для оценки эффективности и безопасности препарата Валвир нами проведено его изучение при купировании рецидивов ПГ. Под наблюдением находились 30 пациентов, из них 19 женщин и 11 мужчин в возрасте от 25 до 46 лет. У всех пациентов отмечалось тяжелое течение герпетической инфекции с частотой рецидивов не менее 6—8 раз в год. По локализации высыпаний ПГ у 21 из них была генитальная форма инфекции, у 6 — глютеальная и у 3 — лабиальная. Все пациенты ранее, иногда неоднократно, получали лечение ациклическими синтетическими нуклеозидами, в том числе и валацикловиром, что позволяло ретроспективно оценить сравнительный клинический эффект и безопасность терапии. Диагноз ПГ ставился на основании типичной дерматологической картины. У всех пациентов обострение начиналось с появления предвестников различной степени выраженности. Симптомы инициальных проявлений рецидива носили разнообразный характер, но в основном проявлялись в виде ограниченного зуда.
Дизайн исследования
Для получения наиболее объективных результатов по эффективности и безопасности препарата Валвир было предусмотрено его назначение на стадии предвестников. Для этого на амбулаторном приеме пациентам с частыми рецидивами ПГ предлагалось при появлении первых признаков предвестников нового обострения начать лечение ациклическим нуклеозидом. В случае согласия пациента препарат Валвир выдавался на руки с подробной инструкцией по способу его применения. Схема и дозы были обычными — по 500 мг (1 таблетка) 2 раза в сутки в течение 5 дней. Также пациенту выдавался дневник наблюдения, в котором он должен был отмечать наличие симптоматики, ее выраженность, а также фиксировать динамику развития герпесвирусного процесса. Выраженность симптоматики оценивалась в баллах (от 0 до 3). В качестве симптомов фиксировались типичные предвестники рецидива ПГ: гиперемия, отечность, пузырьки, корочки и местные субъективные ощущения. В дневнике наблюдения пациент также отмечал переносимость лечения, фиксируя в нем любые побочные действия терапии в случае их возникновения. В случае рецидива пациенты сообщали о нем по телефону, а после окончания курса лечения им назначали визит. На визите мы вместе с пациентами подробно анализировали дневник наблюдений, уточняли детали и еще раз фиксировали их внимание на возможных побочных или нежелательных эффектах лечения. Также мы просили пациентов дополнительно оценить комплаентность терапии. С этой целью пациенты отвечали на вопросы, которые позволяли оценить удовлетворенность и удобство проведенного лечения. Ответы на каждый из вопросов был градуирован в баллах (от 1 до 5). Более высокая оценка соответствовала большей удовлетворенности пациента.
Результаты исследования
Данные проведенного наблюдательного несравнительного исследования показали, что во всех случаях, когда прием препарата, согласно своему механизму действия, начинался на стадии предвестников, герпесвирусный процесс прерывался и клинические проявления не развивались. Оценка динамики клинических симптомов в баллах показывала, что через 12 ч после первого приема валацикловира интенсивность субъективной симптоматики, присущей явлениям предвестников, снижалась у 36% пациентов до 1 балла, у 64% — до 2 баллов. До начала лечения у всех больных выраженность различного рода местных реакций оценивалась в 3 балла. На 2-й день терапии у 8 (26,6%) пациентов сохранялись слабо выраженные субъективные явления, а также развивалась небольшая гиперемия. Однако все эти проявления полностью исчезали к 3-му дню лечения. Формирование патогномоничной для ПГ стадии пузырьков не было ни в одном из случаев. Данные клинических результатов исследования представлены на рис. 1. При анализе переносимости терапии валацикловиром и развитии нежелательных или побочных эффектов лечения нетипичных случаев не отмечалось. У 2 пациентов возникали ощущения тошноты, а 1 больная отмечала незначительные головные боли, однако это не потребовало отмены препарата. Все описанные выше реакции укладываются в спектр побочных эффектов, присущих ациклическим синтетическим нуклеозидам.
Рис. 1. Данные результатов клинической эффективности Валвира.
При анализе комплаентности терапии, который базировался на оценке ответов на вопросы пациентов, было отмечено, что все больные удовлетворены результатами лечения. Это было связано с тем, что пациенты впервые были правильно ориентированы на своевременное начало приема противовирусного препарата. Ранее они начинали лечение при уже сформировавшихся пузырьках. Также все пациенты отметили значительное повышение качества жизни, так как быстрое купирование процесса на ранних стадиях обострения не нарушало их нормальной жизнедеятельности. Интересные данные были получены при оценке удобства терапии. Около половины пациентов высоко оценили этот пункт, вторая же половина высказывалась в пользу сокращения кратности приема препарата, так как 2-кратный прием был им не совсем удобен. Благодаря полученному эффекту от проведенного лечения все пациенты отметили положительную настроенность на лечение в дальнейшем. Более того, часть больных выразили готовность к пролонгированному приему препарата. Данные по изучению комплаентности терапии представлены на рис. 2.
Рис. 2. Результаты изучения комплаентности терапии Валвиром.
| Удовлетворенность результатом терапии | 5 баллов - 100% |
| Повышение качества жизни | 5 баллов - 87%; 4 балла - 13% |
| Удобство терапии | 5 баллов - 56%; 4 балла - 32%; 3 балла - 12% |
| Настроенность на терапию в дальнейшем | Да - 60%, Нет - 40% - выбор в пользу пролонгированного приема |
Заключение
В результате проведенного исследования было доказано, что препарат Валвир является высокоэффективным средством для купирования рецидивов ПГ и имеет хороший профиль безопасности.
При начале приема Валвира на стадии предвестников он быстро купирует клинические проявления инфекции, что говорит об остановке репликации ВПГ и препятствию в большинстве случаев развития герпетических высыпаний. По оценке пациентов, препарат Валвир значительно повышает качество жизни за счет быстрого прекращения развития герпесвирусного процесса, что дает возможность больным спокойно жить со своим заболеванием и не испытывать от него физического и морального дискомфорта.
В статье представлены современные подходы к назначению терапии при острых проявлениях герпесвирусной инфекции, а также к выбору препаратов в целях профилактики ее обострений.
В статье представлены современные подходы к назначению терапии при острых проявлениях герпесвирусной инфекции, а также к выбору препаратов в целях профилактики ее обострений.
Герпесвирусные инфекции (ГВИ) широко распространены в мире. В частности, в Европе частота встречаемости достигает 50–80%, в странах Азии – до 90–100% [1]. Свыше 90% населения планеты инфицированы вирусом простого герпеса (ВПГ). До так называемой сексуальной революции прослеживалась четкая зависимость между типом ВПГ и локализацией высыпаний: ВПГ 1-го типа чаще связывали с локализацией в области лица, ВПГ 2-го типа – с генитальной локализацией. В последние годы подобная зависимость утратила актуальность из-за возросшей популярности орогенитальных контактов.
Входными воротами для инфекции служат поврежденные слизистые оболочки и кожа. После инфицирования ВПГ восходит по периферическим нервам до ганглиев, где сохраняется на протяжении жизни. Обратите внимание: в большинстве случаев инфицирование начинается в детском возрасте. При латентной форме ВПГ 1-го типа персистирует в ганглиях тройничного нерва, ВПГ 2-го типа – в ганглиях крестцового сплетения. При активации вирус распространяется по нерву к первоначальному очагу поражения.
Среди врачей разных специальностей бытует мнение, что только тяжелые формы рецидивирующих ГВИ кожи или слизистых оболочек, инфекционный мононуклеоз, ветряная оспа и опоясывающий герпес требуют применения специфических этиотропных препаратов. Кроме того, часто необоснованно назначают различные иммуномодулирующие препараты в виде монотерапии. Отсутствие этиотропного лечения и наличие сопутствующих заболеваний и состояний, которые расцениваются как провоцирующие факторы, угнетающие иммунный ответ (аутоиммунные заболевания, заболевания желудочно-кишечного тракта и эндокринной системы, острые и хронические воспалительные заболевания органов малого таза, психотравма и хронический стресс, воздействие ультрафиолетового излучения, употребление алкоголя, гормональные циклы, медицинские инвазивные вмешательства, злокачественные новообразования и иммуносупрессивная терапия при их лечении), снижают эффективность терапии, приводят к частым рецидивам заболевания и распространению ГВИ в популяции.
Клинические формы проявления ГВИ крайне разнообразны. Только при поражении кожи и слизистых оболочек выделяют [2]:
- первичную инфекцию;
- герпетический стоматит (первичный герпес лица и полости рта);
- первичный герпес половых органов;
- первичный герпес другой локализации;
- герпес новорожденных;
- герпетическую экзему Капоши;
- первичный герпес на фоне иммунодефицита;
- рецидивы;
- герпес лица и полости рта;
- герпес половых органов;
- рецидивирующий герпес иной локализации;
- рецидивирующий герпес на фоне иммунодефицита;
- хронический язвенный герпес;
- диссеминированную инфекцию;
- диссеминированное поражение кожи;
- генерализованный герпес (диссеминированное поражение внутренних органов и кожи).
Герпесвирусные инфекции классифицируют по степени тяжести [3]:
- легкое течение (частота рецидивов один-два раза в год, ремиссия не менее шести месяцев);
- среднее (частота рецидивов от трех до пяти раз в год, ремиссия не менее трех месяцев);
- тяжелое (частота рецидивов более шести раз в год, ремиссия от нескольких дней до шести недель);
- бессимптомное.
Диагностика ВПГ представляет большую медико-социальную проблему, поскольку клинические проявления разнообразны и зависят от множества причин: типа вируса, генетической устойчивости человека к ВПГ, тяжести и длительности заболевания, состояния иммунного статуса, механизма инфицирования, вирусной нагрузки, возраста пациента, давности заболевания, наличия сопутствующей патологии.
Алгоритм диагностики ГВИ включает:
- общеклиническое обследование;
- сбор иммунологического, аллергологического, дерматологического и инфекционного анамнеза;
- осмотр дерматолога, аллерголога-иммунолога, офтальмолога, гинеколога, невролога и других профильных специалистов;
- диагностику методом полимеразной цепной реакции (ПЦР) в режиме реального времени (определение ДНК вируса простого герпеса (1-го или 2-го типа) в крови, слюне, моче, содержимом везикул, соскобе со дна эрозии, слизистой уретры, стенок влагалища и цервикального канала, конъюнктивы глаз). Учитывая высокую диагностическую значимость данного метода и зависимость смертности новорожденных от виремии, вызванной ВПГ 1-го и ВПГ 2-го типов, некоторые исследователи рекомендуют использовать ПЦР для лабораторного скрининга на генерализованную герпетическую инфекцию среди детей высокого риска и женщин репродуктивного возраста;
- серологическую диагностику: анализ крови на IgM и IgG к ВПГ методом иммуноферментного анализа (ИФА). Наличие антител свидетельствует об инфицировании, но не всегда позволяет связать клинические проявления инфекции с вирусом герпеса: у части бессимптомных носителей выявляются высокие титры антител, тогда как у ряда пациентов с выраженной симптоматикой титры антител остаются низкими. Использование ИФА целесообразно при исследовании парных сывороток, полученных с интервалом 7–10 дней. Показателем первичной инфекции считается четырехкратное увеличение антител класса IgG к ВПГ;
- цитоморфологические методы (проведение световой микроскопии биоматериала после его окрашивания на предметном стекле);
- иммунофлуоресцентный анализ (используется в основном в научных исследованиях).
В клинической практике для постановки диагноза ВПГ обычно ограничиваются данными анамнеза и клинических проявлений болезни, а также выявлением ДНК ВПГ методом ПЦР в отделяемом из высыпаний, когда диагноз из-за локализации поражений или анамнестических данных вызывает сомнения.
В ряде случаев генитальная локализация ГВИ трудно диагностируется. Только в 20% случаев диагноз верен. 20% пациентов – вирусоносители, которые никогда не имели клинических симптомов или признаков заболевания. Нередко при рецидивах ВПГ генитальной локализации, протекающего в атипичной форме (без выраженных клинических признаков), диагноз кандидоза ошибочен. И наоборот: при заболеваниях, протекающих с язвенными поражениями (сифилисе, болезни Бехчета и др.), ставят диагноз герпеса.
Положительные результаты исследования методом ПЦР подтверждают наличие у пациента генитального герпеса, требующего лечения. Отрицательный результат теста не исключает диагноз, поскольку недостаточное количество материала, его потери при транспортировке в лабораторию и быстрое заживление очага инфекции способны привести к ложноотрицательному результату. В таких ситуациях исследование проводится два-три раза с интервалом две – четыре недели [4].
Полностью элиминировать вирус герпеса из организма не представляется возможным. Поэтому терапия герпетической инфекции направлена на блокаду репродукции вируса.
Противовирусная терапия наиболее эффективна в фазе репликации вируса. При обострении хронической инфекции, вызванной ВПГ, показана противовирусная терапия в комбинации с иммунопрепаратами на фоне патогенетической и симптоматической терапии.
Этиотропная терапия ГВИ считается общепризнанным подходом к лечению острых проявлений инфекции и профилактике ее обострений. Современные этиотропные противогерпетические препараты (ацикловир, валацикловир, фамцикловир) по уровню доказательности относятся к группе A [5]. Молекула валацикловира по сравнению с таковой ацикловира характеризуется более высокой биодоступностью (54%) и длительностью полувыведения (10–20 часов). Это позволяет снизить кратность приема препарата до двух раз в сутки и увеличить приверженность пациентов терапии.
Механизм действия противогерпетических препаратов заключается в угнетении синтеза вирусной ДНК и репликации вирусов за счет конкурентного ингибирования вирусной ДНК-полимеразы.
Последнее время на российском фармацевтическом рынке появляется большое количество препаратов валацикловира. Форма выпуска – таблетки, покрытые пленочной оболочкой, в стандартной дозе 500 мг (валацикловира гидрохлорида гидрат 611,70 мг), а также в дозе 1000 мг (валацикловира гидрохлорида гидрат 1223,40 мг). Клиническую эффективность валацикловира у пациентов с хронической рецидивирующей ГВИ изучали в исследовании [6].
Выделяют два основных способа применения противовирусных химиопрепаратов: эпизодическое назначение (при необходимости, обострениях ГВИ) и пролонгированная терапия. В первом случае препарат назначают коротким курсом 5–10 дней, во втором пациенты принимают препарат ежедневно в течение нескольких месяцев или лет не только для купирования данного рецидива, но и для профилактики последующих обострений [7–9].
Показаниями для назначения супрессивной терапии являются:
- тяжелое течение с частыми обострениями;
- отсутствие продромального периода;
- особые обстоятельства (отпуск, свадьба и т.д.);
- использование иммуносупрессивной терапии;
- наличие психосексуальных расстройств;
- предотвращение риска передачи инфекции.
У пациентов с тяжелой ВПГ-инфекцией в большинстве случаев не наблюдается стойкого и значимого клинического эффекта в ответ на эпизодические курсы комбинированной терапии (противовирусные и иммунотропные, общеукрепляющие средства). Как правило, таким пациентам показаны длительные курсы противовирусных препаратов (в частности, ацикловир, валацикловир, фамцикловир) [10].
При использовании супрессивной схемы лечения дозы препаратов зависят от клинического течения рецидивов генитального герпеса. Если количество рецидивов не более десяти в год, суточная доза валацикловира составляет 500 мг. При количестве рецидивов свыше десяти в год валацикловир используют в дозе 1000 мг.
В лечении ГВИ легкого и среднетяжелого течения широко используются иммуномодулирующие препараты, интерфероны (ИФН), индукторы интерферона, а также витаминотерапия. При тяжелых формах ГВИ целесообразно внутривенное введение иммуноглобулина.
При тяжелом и длительном течении ВПГ-инфекции в случае курсового использования названных препаратов в качестве монотерапии отмечается недостаточный клинический эффект. При длительном приеме развиваются побочные и нежелательные эффекты. ИФН представляет собой только часть противовирусной защиты иммунной системы и не может заменить другие ее звенья при их несостоятельности. Использование иммунокорректоров без оценки иммунного статуса, индивидуального подбора и контроля их действия бывает малоэффективно или способно приводить к усилению иммунной дисфункции либо гипореактивности ряда звеньев иммунитета вследствие неадекватной стимуляции. Назначение препаратов для местного применения (мази, содержащие ацикловир, Эпиген интим спрей (глицирризиновая кислота) и др.) носит вспомогательный характер, поскольку пузырьковые высыпания на коже лишь одно из проявлений тяжелой ВПГ-инфекции.
Как показывают данные литературы и накопленный нами опыт, вирус герпеса способен реплицировать в других клетках и органах (в орофарингеальной области, лимфоузлах, слизистой прямой кишки и т.д.).
К врачу аллергологу-иммунологу обратилась пациентка М. 32 лет с жалобами на пузырьковые высыпания на слизистой оболочке красной каймы губ, болезненность в области высыпаний, головную боль, нарушение сна, утомляемость, раздражительность.
Анамнез заболевания. Аналогичные симптомы беспокоят в течение пяти лет. Высыпания локализуются в области носогубного треугольника. Частота рецидивов – от шести до восьми раз в год. В течение полугода обострения ежемесячные. В 2013 и 2015 гг. – два эпизода герпетического кератита (заключение офтальмолога на руках). Неоднократно обращалась к дерматологу по месту жительства – курсы ацикловира 200 мг пять раз в сутки в течение трех – пяти дней с кратковременным эффектом. Кроме того, использовалась местная противовирусная терапия в виде мазей. Настоящее обострение в течение трех дней связывает со стрессом на работе (полгода работает на новом месте, рабочий график ненормированный). Самостоятельно применяла местную терапию без значимого эффекта.
Объективно. Состояние удовлетворительное. Температура тела 36,7 ºС.
На слизистой оболочке красной каймы верхней губы слева сгруппированные пузырьковые высыпания с серозным содержимым, желтоватые корочки, мокнутие.
Лабораторная диагностика. Выявлена ДНК ВПГ 1-го типа методом ПЦР из содержимого везикулы.
Консультация невролога. Астеноневротический синдром. Назначен Атаракс 25 мг по 1/2 таблетки на ночь в течение трех недель. Соблюдение режима труда и отдыха. Во время повторной консультации принято решение об отмене препарата.
Консультация оториноларинголога. Хронический тонзиллит, простая форма, стадия ремиссии. Рекомендован курс промывания лакун миндалин № 10.
Пациентке рекомендована супрессивная терапия препаратом валацикловир 1000 мг один раз в сутки шесть месяцев. Соблюдение указаний невролога, оториноларинголога. Повторная консультация через два с половиной – три месяца.
Пациентка повторно явилась на прием через три месяца. Жалоб не предъявляла. На фоне проводимого лечения рецидивов ГВИ не отмечалось. Со слов больной, стрессовый фон на работе уменьшился, сон нормализовался (отменила Атаракс месяц назад).
Через два месяца после завершения курса супрессивной терапии жалобы отсутствовали. Рецидивов ГВИ не наблюдалось.

В своей практической деятельности врачи многих специальностей встречаются с заболеваниями, вызванными вирусами семейства Herpesviridae, которые широко распространены в человеческой популяции. Они способны поражать практически все органы и системы организма хозяина, вызывая латентную, острую и хроническую формы инфекции при этом, спектр клинических проявлений, развитие которых они обусловливают, чрезвычайно широк [7]. Особого внимания заслуживает рецидивирующая форма герпетической инфекции (ГИ), относящаяся к числу наиболее распространенных психосоматических кожных заболеваний. Хроническое течение, зуд, частая локализация и характер высыпаний на лице или интимно значимых участках кожного покрова сопровождаются изменениями эмоциональной сферы. В свою очередь, состояния стресса, восприятие самим пациентом проявлений болезни оказывает влияние на интенсивность и частоту рецидивов простого герпеса (ПГ) [24].
Многочисленные исследования в области проблемы ГИ, особенно вызванные вирусами простого герпеса (ВПГ) 1 и 2 типов, не теряют своей актуальности в настоящее время [21, 16].
Серьёзной проблемой является высокая инфицированность здорового населения, преимущественно молодого, трудоспособного возраста. В мире ежегодно заражаются от 16 до 800, а в России – от 40 до 80 человек на 100 тыс. населения. В настоящее время заболеваемость ПГ крайне высока, по статистике ВОЗ, она занимает второе место среди вирусных поражений, уступая лишь гриппу. ВПГ-1 инфицировано около 90 % взрослого населения планеты, распространенность ВПГ-2 колеблется от 7 до 40 %. В США ежегодно регистрируется до 98 млн случаев лабиального герпеса и 20 млн случаев рецидивирующего герпеса гениталий, 500 тыс. случаев офтальмогерпеса и более 5 тыс. случаев герпетического энцефалита, около 1 тыс. случаев герпеса новорожденных. По мнению ведущих специалистов, в нашей стране ежегодная заболеваемость герпесом губ составляет 10 млн, герпесом кожи – 1 млн, офтальмогерпесом – 250 тыс. случаев. Рецидивирующими формами герпеса страдают от 10 до 20 % населения, а ежегодный прирост увеличивается на 15–17 % [3, 13, 23].
Литературные данные свидетельствуют, что большинство населения Земли инфицировано ВПГ-1, ВПГ-2 или тем и другим вирусом одновременно. Первичная инфекция, ассоциированная с ВПГ-1 или ВПГ-2, может протекать в клинически выраженной форме в очаге инфицирования (например, в орофациальной или генитальной области) либо как бессимптомная или нераспознанная инфекция. Генитальная форма простого герпеса может быть связана с ВПГ-1, так же как и лабиальная форма – с ВПГ-2. После первичного инфицирования у 50–75 % больных отмечается рецидивирующее течение простого герпеса. В течение первых 12 месяцев после инфицирования ВПГ-2 рецидив возникает у 80 % пациентов, ВПГ-1 – у 55 % [15, 26].
Современная медицина не располагает методами лечения, позволяющими элиминировать ВПГ из организма человека. Целью лечения герпеса является: 1) подавление репродукции ВПГ в период обострения (купирование рецидива); 2) снижение частоты и длительности рецидивов заболевания, тяжести их течения; 3) формирование адекватного иммунного ответа и его длительное сохранение с целью блокирования реактивации ВПГ в очагах персистенции.
Всё разнообразие методов терапии и профилактики обострения герпесвирусных инфекций можно сгруппировать в направления этиотропного, патогенетического и симптоматического лечения с применением химиотерапии, иммунотерапии и комплексного лечения [1, 7, 11].
Большое внимание уделяется антигерпетическим соединениям растительного происхождения, природным антиоксидантам, адаптогенам из лекарственного растительного сырья и витаминно-минеральным комплексам, ввиду изменения иммунного статуса пациентов [14, 19].
Патогенетическая терапия направлена на нормализацию функции иммунной системы организма, в том числе на активацию системы интерфероновой защиты, как правило, связанная с применением интерферонов (ИФН), индукторов ИФН и иммуномодуляторов. Специфическая иммунотерапия состоит в применении герпетической вакцины, хотя ряд исследователей считает, что надежды, возлагаемые на специфическую вакцинопрофилактику, не оправдали себя [11, 19]. Иммунотропные препараты, обладающие активностью против вируса герпеса, разнообразны и представлены в таблице.
Иммунотропные препараты, обладающие активностью против вируса герпеса
Использование противовирусной химиотерапии велико при лечении рецидивирующих форм простого герпеса с поражением кожи и слизистых оболочек. В лечении простого герпеса с применением противогерпетических химиопрепаратов можно выделить два принципиально отличающихся друг от друга подхода: 1) эпизодическое лечение – прием ациклических нуклеозидов (АН) в момент рецидива в терапевтических дозах при соблюдении кратности и длительности лечения; 2) супрессивная терапия – длительный, иногда многолетний, постоянный прием препаратов АН вне рецидива в более низких дозах [9, 25].
Согласно проведенным исследованиям, биодоступность (per os) противогерпетических препаратов из группы ациклических нуклеозидов возрастает следующим образом: ацикловир – 20 %, валацикловир – 54 % и фамцикловир – 77 % [24]. Тем не менее применение ацикловира по-прежнему остаётся востребованным среди врачей и пациентов в настоящее время, и одновременно ведутся исследования по увеличению растворимости ацикловира [5] и синтезу его производных [8].
В разные годы предпринимались многочисленные попытки повысить эффективность лечения ПГ путем комбинированной терапии. С этой целью использовались различные сочетания средств иммунного влияния, а также препаратов, отличающихся по этиопатогенетическому механизму действия [20].
Возможно сочетанное использование противовирусной терапии и глюкокортикостероидов. Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир + преднизолон значительно быстрее купирует острую боль и возвращает пациента к обычной жизнедеятельности в случае постгерпетической невралгии [2].
Наружные средства дополняют системную противовирусную терапию. Многочисленные наблюдения подтверждают, что в случае назначения таблетированных форм ациклических нуклеозидов на стадии предвестников в сочетании с наружной противовирусной терапией значительно чаще удается полностью прервать дальнейшее развитие рецидива или наблюдать его абортивное течение [20].
Местная терапия противовирусных лекарственных средств при герпесе кожи и слизистых оболочек требуется для уменьшения отёка, экссудации, боли и зуда, ускорения заживления язвочек и эрозий и сокращения длительности выделения вируса на участках поражения [22]. Применение данных лекарственных форм начинают при появлении первых признаков активации инфекции (чувство жжения, зуд и т.д.) и продолжают вплоть до эпителизации эрозий. Рано начатое местное лечение может предотвратить развитие везикул.
В комплексную терапию пациентов с простым герпесом необходимо включать местные противовирусные средства, способствующие стабилизации и разрешению процесса [12].
При анализе ассортимента противовирусных средств на российском рынке установлено, что большинство противовирусных препаратов выпускается в виде твёрдых лекарственных форм – 66 %, в виде мягких лекарственных форм – 22 %, а в форме жидких – 12 % [22], лидером же является ацикловир [6].
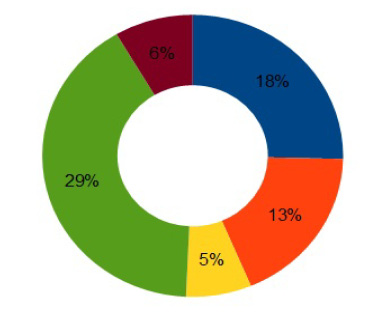

Ассортимент лекарственных форм, содержащих ацикловир
Следует отметить, что современная фармакотерапия герпеса эффективно уменьшает его клинические проявления, положительно влияет на психическое состояние пациентов и приобретает комплексный подход. Несмотря на различные достижения в лечении герпеса, ацикловир по-прежнему играет значительную роль в данном направлении и привлекает внимание исследователей по созданию комбинированных препаратов. В связи с чем актуальными являются исследования по разработке лекарственной формы комбинированного состава, обладающей противогерпесным эффектом – медицинские карандаши.
Рецензенты:
Степанова Э.Ф., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Хаджиева З.Д., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Читайте также:


