Опоясывающий герпес и изменения анализов крови
Герпес-вирусные инфекции (от греч. herpes — ползучий) — группа инфекционных заболеваний, вызываемых представителями семейства герпес-вирусов (Herpesviridae). Антигенных серотипов, выделенных от человека, восемь: вирус простого герпеса 1-го и 2-го типов, вирус ветряной оспы — опоясывающего герпеса или вирус герпеса человека 3-го типа, вирус герпеса человека 4-го типа — вирус Эпштейна–Барр (ВЭБ) — вызывает инфекционный мононуклеоз; вирус герпеса человека 5-го типа — цитомегаловирус (ЦМВ), вирус герпеса человека 6-го, 7-го типов — вызывают внезапную экзантему и синдром хронической усталости, вирус герпеса человека 8-го типа ассоциирован с саркомой Капоши [1]. Все герпес-вирусы являются ДНК-содержащими и сходны по морфологии, типу нуклеиновой кислоты, способу репродукции в ядрах инфицированных клеток.
В РФ сохраняется высокий уровень детской инфекционной заболеваемости [2]. Отмечается возрастание роли инфекций, вызванных вирусами цитомегалии, ВЭБ, герпеса 1-го, 2-го, герпеса 6-го и 8-го типов. Среди детской популяции герпетическая инфекция широко распространена. Так, 70–90% детей 3-летнего возраста имеют достаточно высокий титр вируснейтрализующих антител к вирусу простого герпеса 1-го типа [3]. Эти инфекции у детей часто принимают хроническое течение вследствие персистенции возбудителя и формирования необратимых изменений в органах и системах.
За последние пять лет увеличилось число детей в возрасте до одного года, умерших от генерализованных вирусных инфекций [4]. Велика роль герпес-вирусных инфекций, особенно цитомегаловирусной, в формировании перинатальной патологии и младенческой смертности. Риск развития внутриутробной инфекции зависит от характера взаимоотношений между организмом беременной женщины и микроорганизмом (первичное заражение во время беременности или реактивация ранее приобретенной инфекции).
Проблема врожденной инфекционной патологии является приоритетной для России [5].
Иммуногенез герпес-вирусной инфекции. Длительное нахождение герпес-вируса в организме человека становится возможным благодаря сложной стратегии противоборства и ускользания от иммунной системы хозяина. В достижении этого состояния можно выделить три пути стратегии возбудителя:
Вирус простого герпеса. В инфицированных клетках вирус простого герпеса образует внутриядерные включения и гигантские клетки, оказывает выраженное цитопатическое действие, проявляющееся округлением и образованием многоядерных клеток. Вирус является слабым индуктором интерферона, в связи с чем инактивация вирусной ДНК внутри клеток не наступает и он сохраняется внутри клеток длительное время, периодически вызывая рецидивы заболевания.
ЦМВ. Сущность проблемы ЦМВ-инфекции в том, что последняя относится к так называемым оппортунистическим инфекциям, клинические проявления которых возможно в условиях первичного или вторичного иммунодефицита.
ЦМВ поражает разнообразные клетки, чаще всего лейкоциты (лимфоциты, моноциты), эпителиальные клетки (дыхательных путей, слюнных желез, почек). С клеток крови ЦМВ с большим постоянством переходит на эндотелий, тропизм к которому у него весьма выражен. Поврежденные эндотелиальные клетки постоянно обнаруживаются в токе крови при активной/реактивированной ЦМВ-инфекции. Повреждение эндотелия сосудов имеет собственное патогенетическое значение в формировании органных поражений, так как вызывает ишемию или кровоизлияния в различные ткани [6].
В раннем неонатальном периоде (0–7 дней) у детей с ЦМВ-инфекцией наблюдались симптомы интоксикации, серый колорит кожи, выраженная мышечная гипотония, большая первоначальная потеря массы тела, синдром рвоты или срыгиваний, признаки угнетения ЦНС. В позднем неонатальном периоде (от 7 дней до одного мессяца) анализ клинических проявлений острой ЦМВ-инфекции выявляет поражение многих органов и систем. Так, у всех детей обнаруживаются гипоксически-ишемическая энцефалопатия с трансформацией синдрома угнетения в синдром гипервозбудимости, проявления анемии, патологическая гипербилирубинемия, увеличение печени и селезенки.
ВЭБ относится к подсемейству бета-герпес-вирусов. Вирусный геном заключен в нуклеокапсид, который покрыт гликопротеидным тегументом gp350, являющимся фактором рецепторного взаимодействия [7]. Проникновение вируса в В-лифоциты осуществляется через рецептор этих клеток CD21-рецептор к C3d-компоненту комплемента. ВЭБ-инфекция широко распространена среди людей, причем первичное инфицирование, как правило, происходит в антенатальном или детском возрасте, но манифестация ВЭБ-инфекции в виде отчетливых клинических проявлений инфекционного мононуклеоза в большинстве случаев происходит в школьном возрасте при различного рода иммунопатологических реакциях. Манифестация инфекции в виде инфекционного мононуклеоза может осложняться поражением печени, слизистой оболочки желудка, ткани почек, лимфоидного аппарата.
Особый характер взаимодействия микро- и макроорганизма при хронических персистирующих инфекциях обусловливают трудности лабораторной диагностики. Обнаружение возбудителя не может быть единственным критерием подтверждения диагноза. Необходима комплексная оценка клинических и лабораторных данных для постановки диагноза.
Цель исследования. Определить клинические особенности течения персистирующих герпес-вирусных инфекций у детей и оценить значимость комплекса лабораторных исследований, в том числе показателей общей иммунологической реактивности у больных при персистирующем у них инфекционном процессе.
Материал и методы исследований. Под наблюдением находилось 63 пациента в возрасте от одного месяца до 7 лет, из них детей до одного года было 25, от одного года до трех лет — 22 и старше трех лет — 15 больных. Среди обследованных детей преобладали пациенты первых двух лет жизни — 47 детей (74,6%) и старше двух лет было 15 больных (25,4%).
Результаты. В клинической диагностике персистирующих инфекций у детей следует отводить первостепенное значение неблагополучию акушерского анамнеза матерей больных детей.
Беременность и роды были осложненными у большинства матерей наблюдаемых детей, чаще всего у них отмечались гестозы и угроза выкидыша, рождение недоношенных, в родах гипоксия плода, преждевременная отслойка плаценты, кесарево сечение и др. У 32 женщин из 63 (50,7%) были различные соматические заболевания (хронический пиелонефрит, кольпит, анемия, аутоиммунный тиреоидит и др.). При обследовании беременных женщин было выявлено как моноинфицирование (у 30 из 63–47,6%), так и сочетания инфекций (у 16 из 63–25,4%). Наиболее часто обнаруживались герпес-вирусы и цитомегаловирусы (суммарно у 27 женщин из 63–43%) и реже другие возбудители — хламидии, микоплазмы (у 11 беременных — 17,4%). Высокая частота вышеуказанных осложнений свидетельствует о несомненной роли инфекции как отягощающего фактора в течение гестационного периода и родов.
Заподозрить внутриутробную или персистирующую инфекцию у детей можно было по высокой степени поражения у детей различных органов и систем: ЦНС (71,4%), органов дыхания (88,8%), желудочно-кишечного тракта (95,2%), поражению глаз (31,7%), лимфатического аппарата (15,9%).
В процессе наблюдения за детьми в недалеком прошлом все дети обследовались на состояние микробиоценоза кишечника.
У всех детей обнаруживались нарушения как в основных компонентах биоценоза, так и в составе условно-патогенной флоры. Следует отметить, что у всех пациентов проводилась коррекция микробиоценоза повторными курсами пре- и пробиотиков, однако восстановления микрофлоры до нормобиоценоза не наблюдалось ни у одного пациента. Следовательно, без выявления и адекватного лечения основного заболевания не удается курировать дисбиотические нарушения в организме ребенка.
Закономерен вопрос о правильности выбора комплекса диагностики внутриутробной и персистирующей инфекции у детей. В зависимости от возраста пользуются разными методами диагностики. Важное значение отводится сбору семейного анамнеза. Диагностика внутриутробных инфекций у детей должна опираться на клинические проявления как общего характера, так и на типоспецифические ее признаки, а также основываться на анализе комплекса лабораторных методов обследования [8].
При оценке клинических анализов крови у наблюдаемых детей обращали на себя внимание значительные отклонения в различных показателях гемограммы: выраженная анемизация (у 31,7% пациентов), нейтропения (у 19%), лимфоцитоз (у 27%), лейкопения с лимфоцитопенией (36,5%), ускорение СОЭ (у 27%), что в совокупности свидетельствовало о наличии воспалительного процесса в организме с выраженным снижением иммунореактивности у детей.
При скрининговом серологическом обследовании методом ИФА на внутриутробные инфекции у детей наиболее часто выявлялись положительные титры типоспецифических антител класса IgM и/или IgG к герпес-вирусам. Диагностические титры антител класса IgM и IgG определялись к ЦМВ (у 9 детей), к HV 1-го, 2-го типа (у 9 детей). Антитела к антигенам ВЭБ обнаруживались у 20 детей, из них у 10 детей были антитела класса IgG к раннему антигену ВЭБ и антитела класса IgM к капсидному антигену ВЭБ, что свидетельствовало об активной фазе ВЭБ-инфекции. Остальные 10 пациентов имели антитела класса IgG к нуклеарному (ядерному) антигену ВЭБ, что расценивалось как поздняя стадия инфекции.
У детей при персистирующем течении с реактивацией инфекции, которое чаще возникало после провоцирующих воздействий (ротавирусные диареи, ОРВИ, профилактические прививки) ПЦР-тесты при исследовании биосубстратов: кровь, осадок мочи, секрет из зева давали положительные результаты с последующим нарастанием титра типоспецифических антител по данным ИФА.
Совокупность проведенных исследований позволила выделить у обследованных больных следующие формы инфекций: моноинфекции были у 21 пациента — 31,8% (ЦМВ — у 5 детей, HV 1-го, 2-го типа — у 6 детей и ВЭБ — у 10), у 42 детей из 63 (68,2%) обнаруживались микст-инфекции. У 23 детей была ассоциация ЦМВ с герпес-вирусами (у 9 детей с HV 1-го, 2-го типа, у 3 детей — с HV 6-го типа и у 11 детей — с C. albicans и хламидиями). Микст-формы герпеса 1-го, 2-го типа были выявлены у 9 больных, у них были ассоциации с микоплазмами и хламидиями. Ассоциации ВЭБ были обнаружены у 10 детей (5 больных имели ассоциацию с ЦМВ, пациента — с HV 6-го типа и 2 больных — с Yersinia pseudotuberculosis).
Из 63 больных у 21 (33,3%) с моноинфекцией течение заболевания расценивалось как латентное (с ЦМВ-инфекцией у 5 и HV 1-го, 2-го типа у 6) и как персистирующее (у 10 детей с ВЭБ-инфекцией). У 14 детей из 42 с микст-инфицированием (у 1/3) было персистирующее течение инфекционного процесса (у 3 детей с ЦМВ-инфекцией в ассоциации с HV 6-го типа и у 11 детей с ЦМВ-инфекцией в ассоциации с C. albicans и хламидиями). У 28 детей из 43 (у 2/3) наблюдалось персистирующее течение с реактивацией инфекции (у 9 детей с ЦМВ-инфекцией в ассоциации с HV 1-го, 2-го типа; у 9 детей с HV 1-го, 2-го типа в ассоциации с хламидиями или микоплазмами и у 10 детей с ВЭБ инфекцией в ассоциации с ЦМВ, HV 6-го типа и ВЭБ в ассоциации с Y. pseudotuberculosis).
Коэффициент фагоцитарной защиты у детей с моноинфицированием и микст-формами герпесвирусной инфекции оказался достоверно сниженным по сравнению со средневозрастной нормой для здоровых детей (0,634 ± 0,05 усл. ед. и 0,540 ± 0,03 усл. ед. соответственно при норме 0,946 ± 0,03, Р1–2 и Р2–3 0,05). Недостаточность защиты клеточно-фагоцитарного звена иммунитета играет важную роль в патогенезе герпес-вирусных инфекций, что должно учитываться в лечении этих заболеваний.
Отклонение величины показателя ИЛМП имело противоположную направленность, она оказывалась достоверно повышенной как при моноинфекции, так и при микст-формах герпес-вирусных инфекций по сравнению с контролем (Р1–3 и Р2–3 0,05. Увеличение показателя ИЛМП у детей с герпес-вирусной инфекцией еще раз подтверждает лимфотропность вирусных антигенов.
ЛИИ оказался достоверно повышенным у больных с микст-формами герпес-вирусной инфекции по сравнению со средневозрастной нормой в контроле (Р2–3 0,05), они имели лишь тенденцию к повышению. Однако при оценке индивидуальных показателей ЛИИ у детей с моноинфицированием герпес-вирусами выявились существенные особенности. У 13 детей из 21 (61,9%) ЛИИ был ниже возрастной нормы, что отражало фазу положительной анергии к совершенно определенному антигену. Это свидетельствует, что организм защищен сейчас только от специфических антигенов, однако он остается уязвимым в отношении других патогенов, то есть низкий индекс интоксикации отнюдь не указывает на полное благополучие организма.
Полученные результаты исследований подтверждают выраженность иммунного дисбаланса как в клеточно-фагоцитарном звене иммунитета, так и в гуморальном, а также свидетельствуют о значимости эндогенной интоксикации у больных с микст-формами герпес-вирусной инфекции и уязвимости иммунной защиты у детей и при моноинфицировании.
Клинический пример. Андрей С., 2 года 5 мес., поступил в стационар с жалобами на высокую температуру — 39 °С, однократную рвоту, сниженный аппетит и жидкий стул 5 раз в сутки. Болен в течение двух недель ОРВИ, получил амбулаторно симптоматическое лечение. К концу второй недели ухудшилось состояние, рецидив лихорадки — 39 °C и дисфункция кишечника. Направлен на госпитализацию.
Анамнез жизни. От первой беременности, протекала с угрозой выкидыша, нефропатией, преэклампсией в родах. Во время беременности перенесла ОPВИ с лимфаденитом. Обследование на пренатальные инфекции, обнаруживались антитела класса IgG к антигенам ЦМВ и вирусу герпеса 1-го, 2-го типа. Лечение не проводилось. Роды в срок, масса при рождении 3500 г, длина 51 см. К груди приложен сразу, сосал активно, грудное вскармливание до года, прикормы вводились в 5 и 6 месяцев. Адаптация к пище нормальная. В массе прибавки достаточные, в 2 г. 5 мес — масса 14 кг 810 г, рост 93 см.
Состояние здоровья в течение первого года жизни неблагополучное. Длительно держалась желтуха, в возрасте 3 недель: общий билирубин — 315,1 мкмоль/л, непрямой — 297,3 мкмоль/л, прямой — 17,8 мкмоль/л. Одновременно с желтухой был неустойчивый стул. В 1-месячном возрасте неврологом установлен диагноз перинатального поражения ЦНС, гипоксическо-ишемического генеза, гипертензионный синдром.
К возрасту 6 мес были обнаружены изменения в гемограмме: гемоглобин — 112 г/л, эритроциты — 4,2 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, сегментоядерные нейтрофилы — 12%, лимфоциты — 67%, моноциты — 12%, эозинофилы — 8%, базофилы — 1%, СОЭ — 3 мм/час. В повторных анализах крови во 2-м полугодии продолжала выявляться нейтропения. Консультирован гематологом, установлен диагноз доброкачественной нейтропении детского возраста. В 10 мес в анализе крови выявлена анемия (гемоглобин — 107 г/л, эритроциты — 3,81 × 10 12 /л, цветовой показатель — 0,84, тромбоциты — 280 × 10 9 /л, сегментоядерные нейтрофилы — 11%, лимфоциты — 76%, моноциты — 90%, эозинофилы — 3%, базофилы — 1%). Гематологом назначено лечение Сорбифером дурулесом, курс 1 месяц.
Осмотрен ортопедом: отмечено ограниченное отведение бедер. В один год на УЗИ органов брюшной полости определялся перегиб в области шейки желчного пузыря, холестаз. Осмотр генетика: диагностирована недифференцированная дисплазия соединительной ткани с поражением костно-мышечной системы. В 1 г. 5 мес перенес острый энтероколит неуточненной этиологии, госпитализировался в стационар на 10 дней, получал лечение метронидазолом и Энтеролом. В течение 1,5 лет переносит частые ОРВИ с повышением температуры до 38,8 °С в течение 3–4 дней и катаральными явлениями.
Объективные данные. При последней госпитализации отмечались явления назофарингита в течение 5 дней, лихорадка до 39 °С 2 дня, кожные покровы без сыпи. При осмотре — гиперемия зева и увеличение подчелюстных, передних и заднешейных лимфоузлов, стул учащенный до 3 раз в сутки, с 5 дня лечения — оформленный. ЛОР-врачом диагностирован хронический тонзиллит и аденоидит, в фазе обострения.
Обследование. В мазке из зева — высев гемолитического стрептококка. Посевы на патогенную кишечную флору отрицательные. ИФА на ротавирус — отрицательный. Реакция непрямой гемагглютинации (РНГА) с кишечными диагностикумами — отрицательные.
Гемограмма при поступлении: гемоглобин 104 г/л, эритроциты — 3,7 × 10 12 /л, цветовой показатель — 0,85, лейкоциты — 6,4 × 10 9 /л, палочкоядерные нейтрофилы — 4%, сегментоядерные — 72%, лимфоциты — 18%, моноциты — 4%, эозинофилы — 2%, СОЭ — 4 мм/час.
Гемограмма в динамике: гемоглобин — 109 г/л, эритроциты — 3,4 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, палочкоядерные нейтрофилы — 19%, сегментоядерные — 42%, лимфоциты — 28% (широкоплазменные лимфоциты), моноциты — 8%, плазматические клетки — 1%, эозинофилы — 2%, СОЭ — 13 мм/час. В дальнейшем — красная кровь оставалась без динамики, число лейкоцитов не изменялось, нарастал лимфоцитоз до 43% (широкоплазменные формы), моноцитов до 12%, СОЭ повысилась до 20 мм/час.
Анализ мочи без отклонений от нормы (пятикратно). В биохимическом анализе крови — умеренная гипоальбуминемия, печеночные пробы — в норме. ИФА на специфические антитела к антигенам ЦМВ класса IgM — отрицательный, класса IgG — положительный. Маркеры ДНК-ЦМВ в осадке мочи и в секрете из зева методом ПЦР не найдены. ИФА на специфические антитела к хламидийному антигену (Chlamydia pneumoniae) — положительный в титре 1:80. Маркеры ДНК Ch. pneumoniae в мазке из носоглотки методом ПЦР — положительный. ИФА с микоплазменным антигеном — IgM и IgG — отрицательные, с герпес-вирусами 1-го, 2-го типа — IgM и IgG отрицательные. ИФА на специфические антитела к антигенам ВЭБ: IgM к капсидному антигену — отрицательный, IgG к раннему антигену — положительный и IgG к ядерному антигену (IgGNA) — положительный (> 0,5 ед.). Совокупность данного анализа была индикатором активной фазы мононуклеозной инфекции.
После проведенного обследования ребенку была назначена адекватная комплексная терапия (Cумамед, Ликопид с последующим переходом на Виферон, витамины А, Е, Пиридоксин, пробиотики — курс Примадофилуса). Наблюдение за ним продолжается.
Выводы
- В пользу диагностики персистирующих инфекций у детей свидетельствует отягощенный акушерско-гинекологический и соматический анамнез, а также инфекционный фактор беременных женщин.
- Заподозрить внутриутробное инфицирование у детей раннего возраста можно по высокой степени поражения различных органов и систем: ЦНС, органов дыхания, пищеварения, лимфатического аппарата.
- Диагностика внутриутробных инфекций должна базироваться на клинических проявлениях болезни и основываться на комплексе лабораторных и иммунологических методов исследования с их оценкой в динамике (в 1 мес, 3 мес, 6 мес и в 1 год жизни).
- Правильность выбора комплекса клинических и лабораторных тестов (ИФА в динамике, ПЦР-тесты с различными биосубстратами) приводит к своевременной диагностике внутриутробных инфекций и позволяет выявить моноинфицирование или микст-формы при их длительной персистенции.
- Для суждения о состоянии общей иммунологической реактивности детей с персистирующими герпесвирусными инфекциями может использоваться оценка интегральных показателей (КФЗ и ИЛМП): чем меньше величина КФЗ, тем больше выражен риск прорыва защитного барьера на пути инфекции.
- Наиболее неблагоприятное персистирующее течение имеют микст-формы герпесвирусной инфекции (ЦМВ, герпес, ВЭБ) или их сочетания с внутриклеточными возбудителями.
Литература
Ф. Н. Рябчук, кандидат медицинских наук, доцент
З. И. Пирогова, кандидат медицинских наук, доцент
СПбМАПО, Санкт-Петербург
Вирусом герпеса заражено практически все население нашей планеты. Существует несколько видов герпеса, и если одни не особенно опасны, то другие могут создать серьезные проблемы со здоровьем, а в определенных ситуациях, например при беременности, последствия деятельности вируса могут стать фатальными.
Масштабы проблемы и роль диагностики герпеса
Герпес можно назвать самым распространенным вирусным заболеванием в мире. Заразиться им очень просто — он может передаваться при любых контактах (поцелуях, половом акте), во время родов от матери к ребенку, бытовым путем, иногда — воздушно-капельным. К моменту достижения взрослого возраста герпесом заражен практически каждый.
Попадая в кровь, вирус может жить в организме годами, никак не проявляя себя. Но рано или поздно он дожидается момента, когда наша иммунная система слабеет. Спусковым крючком может стать серьезная болезнь, стресс, переутомление и хроническая нехватка сна, переохлаждение, гормональная перестройка, словом, практически любая встряска для организма.
Проявления герпеса зависят от типа вируса.
Существует 8 типов герпеса:
- Герпес 1-го типа. Самый распространенный тип. Именно он вызывает появление зудящих пузырьков, наполненных жидкостью, на губах, языке, слизистых оболочках рта. Иногда за несколько часов перед появлением пузырьков человек чувствует повышение температуры и слабость, хотя очень часто вирус атакует без предупреждения.
Многие считают, что избавиться от герпеса невозможно. И в этом утверждении есть доля истины — но лишь доля. Да, на сегодняшний день нельзя полностью уничтожить вирус в организме. Но можно подавить его деятельность настолько, что проявления не будут вас беспокоить. Лечение обычно комбинированное, используются противовирусные препараты, средства, укрепляющие иммунитет, используются также физиотерапевтические методы (озонотерапия и другие), а при обострении — местные обезболивающие и противовирусные средства.
Диагностировать и лечить герпес необходимо, и это особенно важно для тех, кто готовится стать родителями. Взрослым вирус герпеса причиняет дискомфорт, но для новорожденных детей он может быть смертельно опасным.
Диагностика герпеса разделяется на два этапа — врачебный осмотр и лабораторные исследования, цель которых — найти и идентифицировать вирус герпеса в крови и других биоматериалах.
Зачастую уже при осмотре доктор в состоянии определить, с каким именно типом герпеса он имеет дело. Однако визуальные признаки могут ввести в заблуждение, например, генитальный герпес может походить на сифилис, а для некоторых типов герпеса внешние проявления вообще не характерны. Поэтому врач обязательно направит вас на анализы на герпес.
Лабораторные методы — основа диагностики герпеса. Они позволяют определить наличие вируса даже с том случае, если он неактивен, а также установить тип возбудителя и его концентрацию.
Анализы на герпес следует сдавать регулярно, даже если никаких проявлений болезни нет, — это нормальная мера контроля состояния здоровья. Но в некоторых случаях анализы на герпес обязательны.
- во время планирования и ведения беременности;
- перед подготовкой к трансплантации органов;
- при появлении на коже пузырьков и высыпаний, причину которых сложно определить во время осмотра.
Лабораторная диагностика герпеса включает в себя несколько видов анализов. Какой анализ на герпес необходим в каждом конкретном случае, решает лечащий врач. Иногда для полной уверенности потребуется пройти несколько разных исследований.
- Полимеразная цепная реакция (ПЦР) . Доступный и чрезвычайно простой метод, который позволяет быстро выявить вирус даже в том случае, если его концентрация в крови крайне мала. Методом ПЦР можно исследовать практически любой биоматериал. В основе ПЦР лежит метод многократного копирования части ДНК возбудителя болезни и последующей идентификации вируса и его типа.
- Иммуноферментный анализ (ИФА) . При помощи этого метода можно выявить наличие антител IgM и IgG (качественный ИФА) и подсчитать их концентрацию (количественный ИФА). При обострении высоко содержание IgM, а в хронической стадии — IgG. Таким образом, этот способ дает возможность установить фазу болезни.
- Реакция иммунофлюоресценции (РИФ) . При этом методе биоматериал обрабатывается особым веществом, под воздействием которого антигены начинают светиться и их можно быстро обнаружить при микроскопическом исследовании. Этот способ хорошо работает в том случае, если концентрация возбудителя в крови высока.
- Культуральный метод . Точный и надежный метод, единственным существенным минусом которого является долгое ожидание результатов. При исследовании культуральным методом биоматериал переносится на питательную среду. Вирус начинает активно захватывать здоровые клетки и исследователь, наблюдая за их изменениями, получает возможность идентифицировать вирус. Ложноположительный или ложноотрицательный результат при использовании культурального метода почти исключен, но результата приходится ждать 1–2 недели.
- Серологический метод . Самый распространенный и доступный метод диагностики герпеса, определяющий антитела класса G. Часто назначают при подозрении на герпес 2-го типа (генитальный герпес). Биоматериалом для этого исследования является кровь из вены.
- Иммунограмма . Это не столько анализ на герпес или какой-либо другой вирус, сколько проверка работы иммунной системы. Специалист исследует кровь из вены и определяет общее количество иммунных клеток, а также их соотношение. Этот анализ позволяет определить, каких иммуноглобулинов не хватает. Иммунограмму назначают для подбора правильной терапии для стимуляции защитной системы организма.
- Дот-гибридизация . Метод, во многом похожий на ПЦР — он также направлен на выявление ДНК возбудителя. Способ диагностики можно использовать даже тогда, когда внешних проявлений болезни еще нет.
- Вульвокольпоцервикоскопия . Этот метод относится к качественным и применяется для диагностики генитального герпеса у женщин. Врач осматривает слизистые оболочки влагалища и шейки матки при помощи специального микроскопа — он дает не очень большое увеличение, однако этого достаточно для того, чтобы увидеть характерные для герпеса высыпания.
Стоимость анализов на герпес значительно различается в разных частных лабораториях Москвы, поэтому мы приводим средние расценки.
ПЦР-анализ обойдется примерно в 900–1500 рублей, если анализ проводится на все типы герпеса, и в 300–500 рублей, если анализ проводится на какой-то один тип. ИФА стоит в среднем 750–900 рублей, РИФ — 450–700 рублей.
К стоимости самого анализа нужно добавить и стоимость забора биоматериала — в среднем 200–300 рублей за забор крови и 300–400 рублей за забор мазка.
Традиционный список анализов при герпесе включает в себя ПЦР, ИФА и РИФ. Дополнительные исследования назначаются в том случае, если даже эти три метода в совокупности дали неоднозначный результат, что бывает достаточно редко.

Чтобы результаты анализов были точными, обращайтесь в крупные лаборатории, где строго контролируется весь процесс — от забора биоматериала до проведения исследования. Кроме того, самим пациентам важно соблюдать правила подготовки к анализам. Они достаточно просты — за 8 часов до забора биоматериала нельзя есть и пить (исключение — обычная вода), употреблять алкоголь, заниматься спортом, желательно оградить себя от стрессовых ситуаций.
Что такое опоясывающий герпес (опоясывающий лишай)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 12 лет.

Определение болезни. Причины заболевания
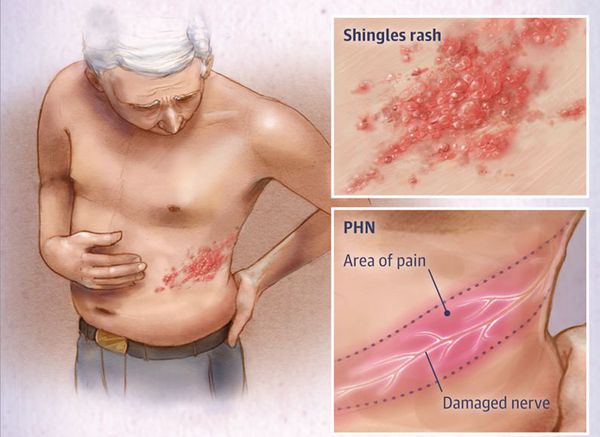
Опоясывающий герпес (опоясывающий лишай) — это инфекционное заболевание, которое возникает у людей, переболевших ветряной оспой. Его вызывает вирус Varicella zoster (вирус ветряной оспы), который активизируется из латентного состояния и поражает задние корешки спинного мозга, межпозвоночные нервные узлы (ганглии) и кожу.
Клинически характеризуется умеренно выраженным синдромом общей инфекционной интоксикации, везикулёзной сыпью по ходу чувствительных нервов, вовлечённых в процесс, и выраженными болями.
Семейство — Herpesviridae (от греч. herpes — ползучий)
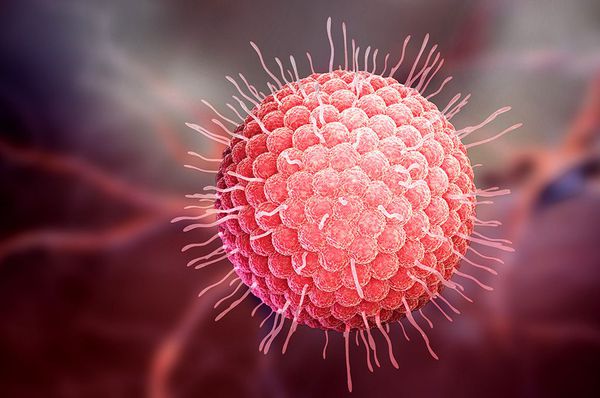
Вид — вирус герпеса 3 типа — Varicella zoster (VZV, HHV-3).
Varicella zoster — ДНК-содержащий клеточно-ассоциированный вирус овальной формы. В диаметре он достигает 120-179 нм. Покрыт липидной оболочкой с гликопротеиновыми шипиками. Имеет антигены как снаружи, так и внутри (сердцевинные антигены). Их количество и качество непостоянно. Других вариантов патогена не найдено.
После того, как человек перенёс ветряную оспу, вирус ретроградным обратным путём перемещается по отросткам нервных клеток (аксонам) к ганглиям. Там он пожизненно сохраняется в латентном состоянии. Антигены вируса на поверхности инфицированных нейронов отсутствуют. Это не позволяет иммунной системе распознать данные клетки.
Для животных непатогенен. Очень неустойчив во внешней среде, изменяется при нагревании. Солнечная радиация, свежий воздух при проветривании, стандартные дезинфицирующие средства и жирорастворители убивают вирус почти мгновенно [1] [2] [5] [7] [9] [10] .
Заболеванию подвержены люди, которые перенесли ветряную оспу (как правило, давно) при снижении иммунореактивности организма. К ним относятся пожилые, беременные, ВИЧ-инфицированные, люди после стресса или трансплантации органов — получающие иммуносупрессивную терапию (подавление нежелательных реакций иммунной системы) и другие иммунодепрессированные контингенты.
Так как заболевание развивается из-за реактивации вируса, уже находящегося в организме, опоясывающий герпес называют эндогенной болезнью.
Заболевание не носит массовый характер. У него нет чёткой сезонности. Чуть чаще болеют женщины и представители белой расы.
Люди с опоясывающим герпесом являются источником распространения вируса и могут быть опасны в плане заражения ветряной оспой у ранее не болевших людей, особенно детей.
В среднем заболеваемость находится на уровне 10-12 случаев на 1000 человек старше 60 лет. В последнее десятилетие наблюдается рост заболеваемости в более младших возрастных группах.
У ВИЧ-инфицированных опоясывающий герпес — достаточно частое проявление при снижении уровня СД4 (белых кровяных телец) ниже 0,5 на 10 9 /л. При отсутствии прогрессирующей иммуносупрессии повторные рецидивы наблюдаются редко (не более 5 % случаев) [1] [3] [5] [7] [10] .
Симптомы опоясывающего герпеса
Инкубационный период в привычном понимании отсутствует, так как опоясывающий герпес — это не первичная инфекция. Может пройти вся жизнь, а манифестация так и наступит, хотя вирус в организме присутствует.
Предугадать развитие болезни сложно. Её начало и проявления широко различаются и зависят от степени тяжести. Заболеванию может предшествовать стресс, травма или ОРЗ.
Выделяют симптоматику отдельных форм опоясывающего лишая.
Эта форма начинается с продромы — лёгкое недомогание, нарушения чувствительности, умеренные болевые ощущения в местах будущих высыпаний. Этот период длится до семи дней. Затем боли становятся выраженными, появляется лихорадка, умеренно выраженный синдром общей инфекционной интоксикации. Иногда боли усиливаются даже при дуновении ветра (т.н. аллодинические боли — от неболевых раздражителей).
Через 3-10 дней в этих местах на фоне покраснения появляется везикулёзная сыпь. При этом интенсивность боли обычно снижается. Сыпь возникает с одной стороны, ограниченная областью иннервации одного сенсорного ганглия. Везикулы имеют тенденцию к группировке.
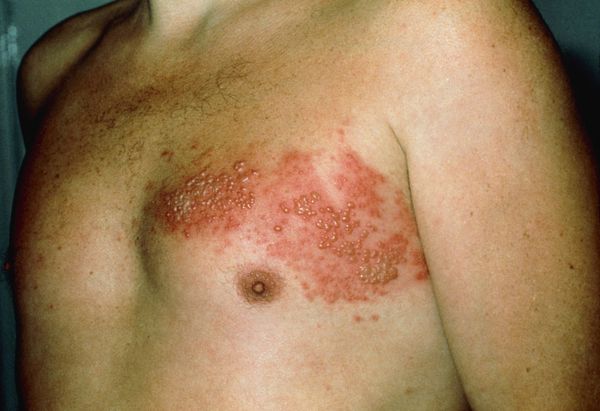
В дальнейшем содержимое везикул мутнеет, иногда вскрывается. Через 4-5 дней от появления сыпи появляются корочки. Они исчезают на 2-4 неделе болезни.
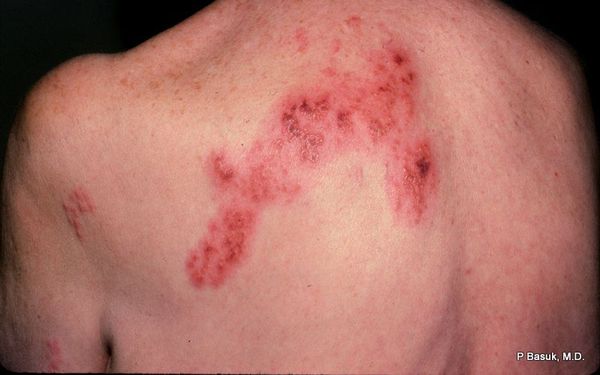
Разрешаются в ысыпания бесследно, но только при отсутствии расчёсов и глубоких воспалительных повреждений. А вот болевые феномены могут сохраняться длительно, иногда до года. Это требует своевременной противовирусной терапии и купирования боли.
В целом боли при опоясывающем герпесе достаточно выраженные, усиливаются при движении, прикосновении (даже незначительном). Их можно расценить как острые (с продромы и до одного месяца), подострые (1-4 месяца) и хронические (более 4 месяцев – постгерпетическая невралгия – типичная нейропатическая боль). Характер болей может быть различным – постоянным и спонтанным, чаще жгучим, давящим. Иногда боли сравнивают с ударом тока. Они могут причинять значительные физические страдания больным, нарушать сон, изматывать пациента.
Локализация болей и сыпи соответствует проекции поражённых нервов.
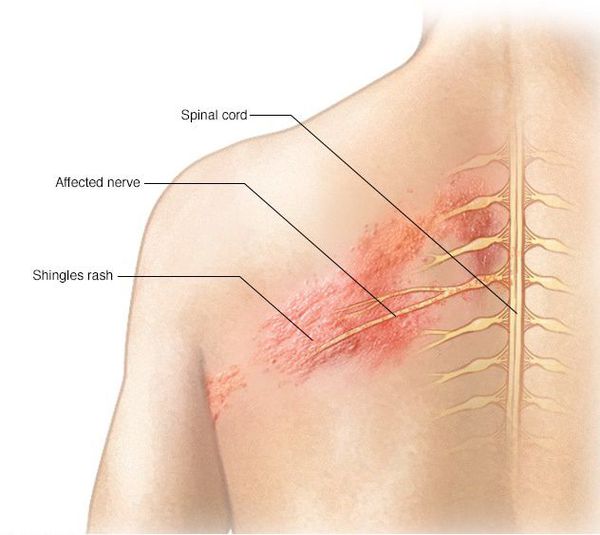
Высыпания появляются на лице, носе и глазах. Это связано с поражением тройничного нерва и гассерова узла. Сыпь распространяется от уровня глаза до теменной области, резко прерывается по срединной линии лба. Иногда процесс затрагивает глаз.
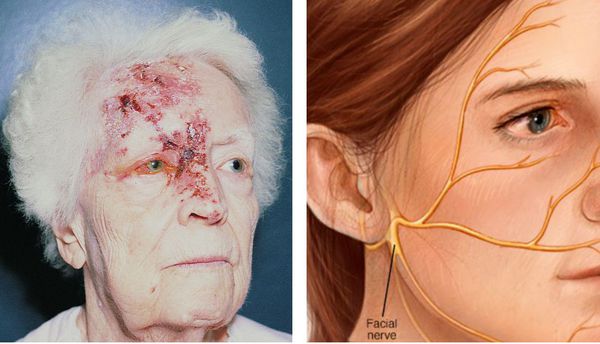
Поражается коленчатый узел. При этом захватывается ушная раковина, наружный слуховой проход. Может возникнуть паралич лицевого нерва и лицевой мускулатуры — т.н. синдром Ханта. Теряется вкусовая чувствительность.
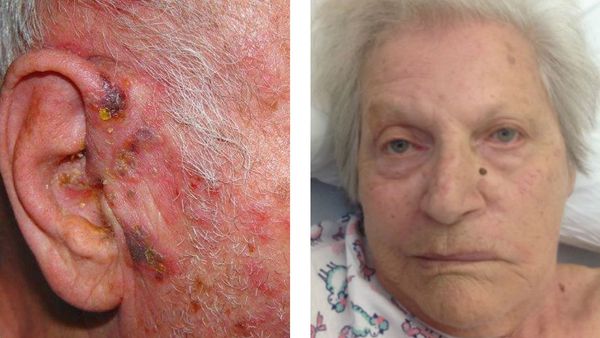
Возникает глубокое поражение кожи. Формируются грубые рубцы, иногда с геморрагическим пропитыванием содержимого — геморрагическая форма. Чаще всего развивается у пожилых людей с отягощённым соматическим анамнезом — сахарным диабетом, язвенной болезнью и т. д.
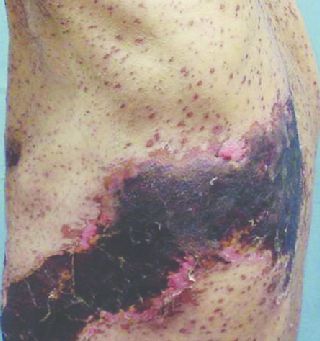
Чаще наблюдается при расположении сыпи на голове. Повышается температура, возникают головные боли, тошнота и рвота, не приносящая облегчения, менингеальный синдром, нарушения сознания, кома. Летальность при этом состоянии — свыше 60 %.
Возникает при СПИДе. Высыпания распространяются по всему кожному покрову. Часто при этом поражаются внутренние органы — лёгкие, мозг, печень, почки. Прогноз неблагоприятный.
Характерные высыпания отсутствуют, но есть явный болевой синдром. Диагностика крайне затруднительна. Из-за очень позднего диагноза лечение сводиться лишь к купированию боли. Применение противовирусных препаратов в отсроченный период явно не влияет на процесс.
У беременных опоясывающий герпес (при отсутствии ВИЧ) обычно не имеет каких-либо отличий. Он не влияет на течение беременности и не вызывает поражения плода/ребёнка [2] [3] [6] [8] [10] .
Патогенез опоясывающего герпеса
Даже спустя много лет после перенесённой ветряной оспы вирус сохраняется в межпозвоночных нервных узлах и задних корешках спинного мозга. Под воздействием провоцирующего фактора (ВИЧ, стресса, приёма иммунодепрессантов, онкологии, радиации, пересадки органов и других) он активизируется и выходит из нервных клеток. Продвигаясь по аксонам чувствительных нервных стволов (чаще межрёберных, тройничного нерва) до кожного покрова, вызывает характерное поражение кожи — болезненную везикулёзную сыпь.
Такой процесс происходит у людей с наличием специфических антител класса G в низких концентрациях и сниженным уровнем клеточного иммунитета.
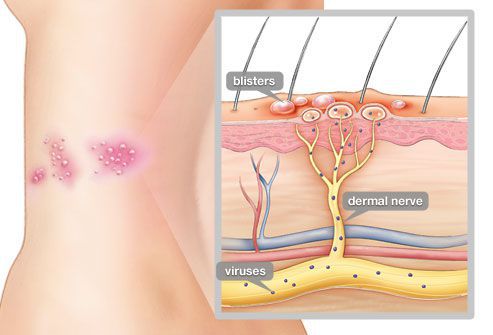
Патоморфологические изменения кожи напоминают изменения при простом герпесе:
- возникает внутриклеточный и межклеточный отёк эпидермиса;
- в верхних отделах росткового слоя образуются пузырьки;
- происходит баллонирующая дегенерация и дистрофия цитоплазмы — клетки шиповатого слоя округляются, увеличиваются и отделяются друг от друга и разрушаются;
- появляются гигантские клетки, которые содержат несколько ядер, в том числе с эозинофильными включениями.
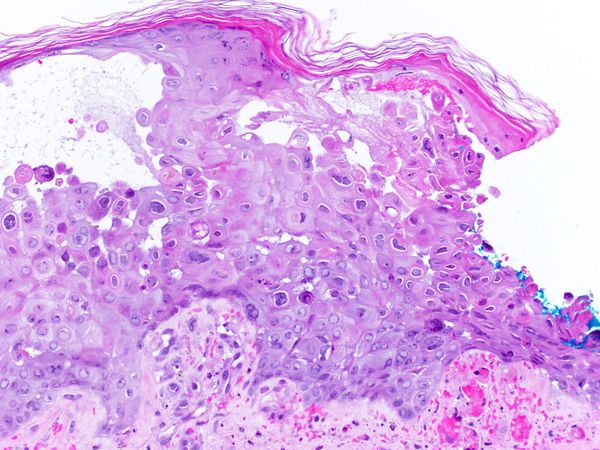
В патогенезе болезни ведущими являются не эпителиотропные свойства вируса, а нейротропные. Из-за часто повторяющихся болевых стимулов, частичного повреждения миелиновой оболочки, покрывающей аксоны и нейроны, и участков чувствительных нервов вирус повышает чувствительность ноцицепторов центральной нервной системы [1] [2] [5] [7] [10] .
Классификация и стадии развития опоясывающего герпеса
МКБ-10 (Международная классификация болезней) выделяет семь вариантов опоясывающего герпеса (B02):
- B02.0 — опоясывающий лишай с энцефалитом;
- B02.1 — опоясывающий лишай с менингитом;
- B02.2 — опоясывающий лишай с другими осложнениями со стороны нервной системы: постгерпетический ганглионит узла коленца лицевого нерва, полиневропатия, невралгия тройничного нерва;
- B02.3 — опоясывающий лишай с глазными осложнениями: блефарит, конъюнктивит, иридоциклит, ирит, кератит, кератоконъюнктивит, склерит;
- B02.7 — диссеминированный опоясывающий лишай;
- B02.8 — опоясывающий лишай с другими осложнениями;
- В02.9 — опоясывающий лишай без осложнений.
По клинической картине выделяют две основные формы заболевания:
- Типичная (без осложнений и с осложнениями):
- эритематозная — покраснения;
- везикулёзная — покраснение с образованием везикул (пузырьков);
- пустулёзная — покраснение, везикулы, нагноение пузырьков;
- буллёзная — тяжело протекающая форма с появлением на коже пузырей, наполненных экссудатом, впоследствии нередко нагнаивающихся.
- Атипичная (без осложнений, с осложнениями):
- абортивная — наблюдается лишь гиперемия, иногда возникают папулы, но без везикул, т. е. без пузырьков;
- геморрагическая — содержимое везикул пропитывается кровью;
- гангренозная — с некрозом тканей;
- генерализованная — обширные высыпания, поражающие несколько участков кожи;
- диссеминированная (в т. ч. у ВИЧ-инфицированных) — обширные высыпания с поражениями внутренних органов; крайне неблагоприятный прогноз;
- опоясывающий герпес с поражением органа зрения (офтальмогерпес с развитием кератита, эписклерита, иридоциклита) и неврита зрительного нерва;
- опоясывающий герпес с поражением слизистой полости рта, глотки, гортани, ушной раковины и слухового прохода.
По степени тяжести заболевание может быть:
Осложнения опоясывающего герпеса
- Поперечный миелит — острое воспаление серого и белого вещества одного или нескольких прилегающих сегментов спинного мозга. Возникают головные, шейные и спинные боли. Затем добавляется чувство слабости, опоясывающей скованности груди и живота — двигательные параличи, задержка мочи и кала. Для диагностики проводится МРТ и анализы ликвора.
- Менингоэнцефалит — резкое повышение температуры, сильная головная боль, тошнота, рвота, менингеальный симптомы, нарушение сознания. Диагностируется с помощью МРТ и анализов ликвора. Прогноз неблагоприятный.
- Офтальмогерпес — покраснение, нарушение зрения, боль в глазу. В итоге приводит к глаукоме и слепоте.
- Отит — боли в ухе, повышение температуры тела, выделения из уха, нарушения слуха. Может привести к глухоте.
- Ганглионеврит — воспаление нервного ганглия с относящимися к нему нервными стволами. Сопровождается выраженными стреляющими, жгучими болезненными ощущениями, которые возникают из-за малейших воздействий на поражённый очаг. Возникает в основном у пожилых больных при отсутствии своевременного лечения.
- Бактериальная суперинфекция — нагноение участков высыпаний.
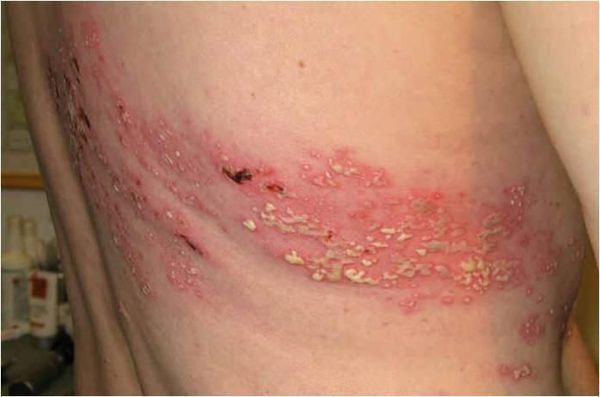
- Диссеминация у больных СПИДом — распространение вируса. Приводит к бронхиту, эзофагиту, гастриту, колиту, циститу, миозиту, перикардиту, плевриту, перитониту, пневмонии, гепатиту, миокардиту и артриту[1][4][9][10] .
Диагностика опоясывающего герпеса
- Клинический анализ крови: нормоцитоз (нормальные размеры эритроцитов) или лейкопения (сниженное количество лимфоцитов). При присоединении вторичной флоры возможен нейтрофильный лейкоцитоз — чрезмерно повышенный уровень нейтрофилов. СОЭ в норме или повышена.
- Биохимический анализ крови: как правило, без существенных отклонений, зависит от распространённости процесса и наличия сопутствующих заболеваний.
- ИФА-диагностика крови: выявление повышенного титра IgG антител как маркера инфицирования вирусом, нарастание титра в 4 раза, иногда появление IgM к вирусу ветряной оспы.
- ПЦР биологического материала (отделяемого высыпаний, ликвора, крови): выявление ДНК вируса.
- Экспресс-методы — изучение под микроскопом мазков-отпечатков из высыпаний: обнаруживаются гигантские многоядерные клетки — симпласты — с внутриядерными включениями и специфические антигены с моноклональными антителами. Проводится в основном в научных целях.
- Общий анализ мочи неинформативен [1][2][5][7][9][10] .
- везикулёзный осповидный риккетсиоз — пребывание на очаговой территории, факт укусу клеща, первичный аффект, панваскулит (воспаление стенок сосуда), генерализованная лимфаденопатия;
- инфекция простого герпеса — одиночные пузырьки, чаще в области губ и половых органов, отсутствие явных болей;
- ветряная оспа — контакт с больным ветряной оспой или опоясывающим герпесом, отсутствие ветряной оспы в прошлом, единичные несливающиеся везикулы по всему телу, отсутствие болей в местах высыпаний;
- энтеровирусная инфекция — теплое время года, преимущественное поражение кистей и стоп, в основном папулёзные элементы сыпи, часто в совокупности с синдромом поражение ЖКТ;
- укусы блох и клопов — яркая зудящая сыпь — папулы, гиперемия в местах укусов — первичные аффекты, наличие элементов в основном на открытых участках кожи;
- болевая форма терапевтических заболеваний до характерных высыпаний — стенокардия, инфаркт, печёночная и почечная колики — заключение делается на основании характерных изменений биохимии, УЗИ и ЭКГ;
- рожистое воспаление — отсутствие везикул, характерный вид пламени [1][3][4][10] .
Лечение опоясывающего герпеса
Пациентов с тяжёлыми формами опоясывающего герпеса необходимо госпитализировать в инфекционный стационар. Остальные больные при отсутствии серьёзных сопутствующих состояний могут лечиться на дому.
В первую очередь показан приём препаратов прямого противогерпетического действия (на основе ацикловира) в высоких дозировках. Он снижает выраженность и длительность инфекционного и постинфекционного (болевой синдром) процесса.
Начать такое нужно как можно раньше — не позднее семи дней от начала болезни и трёх дней от появления сыпи.
При применении препаратов в более поздние сроки их эффективность резко снижается, так как вирус уже достиг пика своего развития и вызвал каскад иммунонейропатологических реакций.
Использование местных средств против герпеса — мазей и кремов — оказывает слабый терапевтический эффект.
Для подсушивающего, местного антисептического действия используют любой местный антисептик подобного рода — цинковые болтушки, растворы бриллиантового зелёного.
При обширных поражениях, сопровождающихся выраженной воспалительной реакцией, используются противовоспалительные средства, глюкокортикостероиды и противоаллергические препараты.
При выраженных болях (ганглионевритах) стандартные противоболевые средства (НПВС) малоэффективны, поэтому предпочтение следует отдавать антиконвульсантам центрального действия и антидепрессантам. Физиотерапия ослабляет болевые ощущения. Приём витаминов, БАДов и т. п. явного значения не имеет [1] [2] [3] [8] [10] .
Прогноз. Профилактика
При неосложнённых и локализованных формах болезни прогноз благоприятный. При развитии ганглионевритических болей может существенно снизиться качество жизни на достаточно длительный срок (до года), а при менингоэнцефалитической и диссеминированной формах — на ещё более серьёзный срок, нередки летальные исходы.
Профилактика болезни в очаге не проводится. После пребывания больного в палате для дезинфекции достаточно проветрить помещение (при диссеминированных формах).
В целях неспецифической профилактики опоясывающего герпеса нужно постараться вести здоровый образ жизни, сбалансировано и полноценно питаться, избегать стрессовых ситуаций.
В качестве специфической профилактики используются вакцины против ветряной оспы — "Варилрикс" и "Окавакс". Их можно делать как до болезни ветряной оспы (детям и неболевшим взрослым), так и после (пожилым людям с риском реактивации вируса).
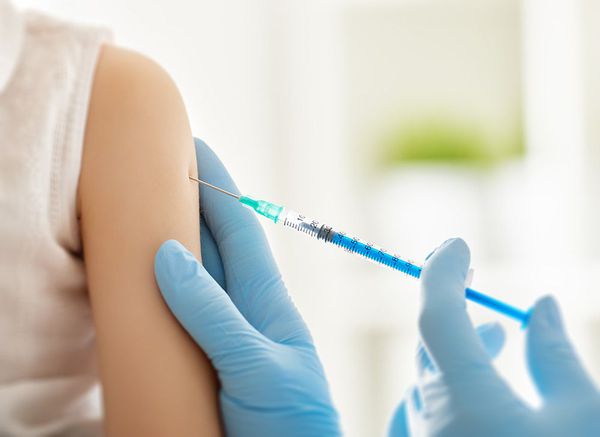
В США для вакцинации взрослых используют вакцину Zostavax (в России не зарегистрирована). Она позволяет снизить риск развития опоясывающего герпеса на 51 %, а риск постгерпетической невралгии — на 67 % [1] [7] [10] .
Читайте также:


