Неовир при лечении генитального герпеса

В своей практической деятельности врачи многих специальностей встречаются с заболеваниями, вызванными вирусами семейства Herpesviridae, которые широко распространены в человеческой популяции. Они способны поражать практически все органы и системы организма хозяина, вызывая латентную, острую и хроническую формы инфекции при этом, спектр клинических проявлений, развитие которых они обусловливают, чрезвычайно широк [7]. Особого внимания заслуживает рецидивирующая форма герпетической инфекции (ГИ), относящаяся к числу наиболее распространенных психосоматических кожных заболеваний. Хроническое течение, зуд, частая локализация и характер высыпаний на лице или интимно значимых участках кожного покрова сопровождаются изменениями эмоциональной сферы. В свою очередь, состояния стресса, восприятие самим пациентом проявлений болезни оказывает влияние на интенсивность и частоту рецидивов простого герпеса (ПГ) [24].
Многочисленные исследования в области проблемы ГИ, особенно вызванные вирусами простого герпеса (ВПГ) 1 и 2 типов, не теряют своей актуальности в настоящее время [21, 16].
Серьёзной проблемой является высокая инфицированность здорового населения, преимущественно молодого, трудоспособного возраста. В мире ежегодно заражаются от 16 до 800, а в России – от 40 до 80 человек на 100 тыс. населения. В настоящее время заболеваемость ПГ крайне высока, по статистике ВОЗ, она занимает второе место среди вирусных поражений, уступая лишь гриппу. ВПГ-1 инфицировано около 90 % взрослого населения планеты, распространенность ВПГ-2 колеблется от 7 до 40 %. В США ежегодно регистрируется до 98 млн случаев лабиального герпеса и 20 млн случаев рецидивирующего герпеса гениталий, 500 тыс. случаев офтальмогерпеса и более 5 тыс. случаев герпетического энцефалита, около 1 тыс. случаев герпеса новорожденных. По мнению ведущих специалистов, в нашей стране ежегодная заболеваемость герпесом губ составляет 10 млн, герпесом кожи – 1 млн, офтальмогерпесом – 250 тыс. случаев. Рецидивирующими формами герпеса страдают от 10 до 20 % населения, а ежегодный прирост увеличивается на 15–17 % [3, 13, 23].
Литературные данные свидетельствуют, что большинство населения Земли инфицировано ВПГ-1, ВПГ-2 или тем и другим вирусом одновременно. Первичная инфекция, ассоциированная с ВПГ-1 или ВПГ-2, может протекать в клинически выраженной форме в очаге инфицирования (например, в орофациальной или генитальной области) либо как бессимптомная или нераспознанная инфекция. Генитальная форма простого герпеса может быть связана с ВПГ-1, так же как и лабиальная форма – с ВПГ-2. После первичного инфицирования у 50–75 % больных отмечается рецидивирующее течение простого герпеса. В течение первых 12 месяцев после инфицирования ВПГ-2 рецидив возникает у 80 % пациентов, ВПГ-1 – у 55 % [15, 26].
Современная медицина не располагает методами лечения, позволяющими элиминировать ВПГ из организма человека. Целью лечения герпеса является: 1) подавление репродукции ВПГ в период обострения (купирование рецидива); 2) снижение частоты и длительности рецидивов заболевания, тяжести их течения; 3) формирование адекватного иммунного ответа и его длительное сохранение с целью блокирования реактивации ВПГ в очагах персистенции.
Всё разнообразие методов терапии и профилактики обострения герпесвирусных инфекций можно сгруппировать в направления этиотропного, патогенетического и симптоматического лечения с применением химиотерапии, иммунотерапии и комплексного лечения [1, 7, 11].
Большое внимание уделяется антигерпетическим соединениям растительного происхождения, природным антиоксидантам, адаптогенам из лекарственного растительного сырья и витаминно-минеральным комплексам, ввиду изменения иммунного статуса пациентов [14, 19].
Патогенетическая терапия направлена на нормализацию функции иммунной системы организма, в том числе на активацию системы интерфероновой защиты, как правило, связанная с применением интерферонов (ИФН), индукторов ИФН и иммуномодуляторов. Специфическая иммунотерапия состоит в применении герпетической вакцины, хотя ряд исследователей считает, что надежды, возлагаемые на специфическую вакцинопрофилактику, не оправдали себя [11, 19]. Иммунотропные препараты, обладающие активностью против вируса герпеса, разнообразны и представлены в таблице.
Иммунотропные препараты, обладающие активностью против вируса герпеса
Использование противовирусной химиотерапии велико при лечении рецидивирующих форм простого герпеса с поражением кожи и слизистых оболочек. В лечении простого герпеса с применением противогерпетических химиопрепаратов можно выделить два принципиально отличающихся друг от друга подхода: 1) эпизодическое лечение – прием ациклических нуклеозидов (АН) в момент рецидива в терапевтических дозах при соблюдении кратности и длительности лечения; 2) супрессивная терапия – длительный, иногда многолетний, постоянный прием препаратов АН вне рецидива в более низких дозах [9, 25].
Согласно проведенным исследованиям, биодоступность (per os) противогерпетических препаратов из группы ациклических нуклеозидов возрастает следующим образом: ацикловир – 20 %, валацикловир – 54 % и фамцикловир – 77 % [24]. Тем не менее применение ацикловира по-прежнему остаётся востребованным среди врачей и пациентов в настоящее время, и одновременно ведутся исследования по увеличению растворимости ацикловира [5] и синтезу его производных [8].
В разные годы предпринимались многочисленные попытки повысить эффективность лечения ПГ путем комбинированной терапии. С этой целью использовались различные сочетания средств иммунного влияния, а также препаратов, отличающихся по этиопатогенетическому механизму действия [20].
Возможно сочетанное использование противовирусной терапии и глюкокортикостероидов. Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир + преднизолон значительно быстрее купирует острую боль и возвращает пациента к обычной жизнедеятельности в случае постгерпетической невралгии [2].
Наружные средства дополняют системную противовирусную терапию. Многочисленные наблюдения подтверждают, что в случае назначения таблетированных форм ациклических нуклеозидов на стадии предвестников в сочетании с наружной противовирусной терапией значительно чаще удается полностью прервать дальнейшее развитие рецидива или наблюдать его абортивное течение [20].
Местная терапия противовирусных лекарственных средств при герпесе кожи и слизистых оболочек требуется для уменьшения отёка, экссудации, боли и зуда, ускорения заживления язвочек и эрозий и сокращения длительности выделения вируса на участках поражения [22]. Применение данных лекарственных форм начинают при появлении первых признаков активации инфекции (чувство жжения, зуд и т.д.) и продолжают вплоть до эпителизации эрозий. Рано начатое местное лечение может предотвратить развитие везикул.
В комплексную терапию пациентов с простым герпесом необходимо включать местные противовирусные средства, способствующие стабилизации и разрешению процесса [12].
При анализе ассортимента противовирусных средств на российском рынке установлено, что большинство противовирусных препаратов выпускается в виде твёрдых лекарственных форм – 66 %, в виде мягких лекарственных форм – 22 %, а в форме жидких – 12 % [22], лидером же является ацикловир [6].
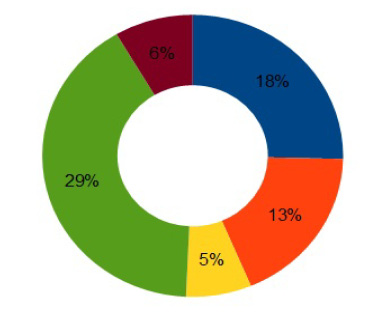

Ассортимент лекарственных форм, содержащих ацикловир
Следует отметить, что современная фармакотерапия герпеса эффективно уменьшает его клинические проявления, положительно влияет на психическое состояние пациентов и приобретает комплексный подход. Несмотря на различные достижения в лечении герпеса, ацикловир по-прежнему играет значительную роль в данном направлении и привлекает внимание исследователей по созданию комбинированных препаратов. В связи с чем актуальными являются исследования по разработке лекарственной формы комбинированного состава, обладающей противогерпесным эффектом – медицинские карандаши.
Рецензенты:
Степанова Э.Ф., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Хаджиева З.Д., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Изобретение относится к медицине, а именно к венерологии, предназначено для амбулаторного лечения больных с рецидивирующим генитальным герпесом. Предложено комплексно применять противовирусный препарат валтрекс, иммуномодулирующий препарат неовир и препарат, воздействующий на микрофлору мочеполового тракта - ацилакт. Больным назначают валтрекс по 0,5 г 2 раза в день, курс 5 дней, одновременно назначают неовир по 250 мг внутримышечно, 10 инъекций в два этапа, первые шесть инъекций с интервалом 48 часов, последние четыре инъекции с интервалом 7 дней, после окончания приема валтрекса назначают ацилакт в виде влагалищных свечей по 5 доз ежедневно, на ночь, в течение 10 дней. До и после назначения терапии у пациенток для оценки биоценоза полового тракта определяют лизоцимную активность влагалища, рН влагалища, флору с подсчетом общего микробного числа (методом посева на кровяной агар). Способ позволяет увеличить сроки ремиссии в 4-5 раза у 75,9% пациентов, что более выражено, чем при применении известного способа. 1 табл.
Изобретение относится к медицине, а именно к венерологии, предназначено для амбулаторного лечения больных с рецидивирующим генитальным герпесом (РГГ).
Ведущее значение в патогенезе герпесвирусной инфекции принадлежит интерфероновому звену иммунной системы, о чем свидетельствуют проведенные рядом авторов исследования (Джумиго П.А., 1990г., Куратулаев К.Н., 1991 г., Халдин А.А., 1995 г., Сухих Г.Т., Ванько Л.В., Кулаков В.И., 1997 г.).
Известен способ лечения РГГ с использованием комплексного этиологического и патогенетического лечения, направленного на угнетение репродукции вируса простого герпеса и на повышение иммунологической реактивности организма. В качестве противовирусного препарата применяют ацикловир, фамцикловир, алпизарин, рибамидил, метисазон. Для иммунокоррекции используют интерлок, реаферон, полудан, неовир, ридостин, тактивин и др. (Владимирова Е.В. Герпетическая инфекция кожи и слизистых оболочек. Вестник дерматологии и венерологии 1997; 2: 45-51).
Однако известные методы лечения РГГ обладают ограниченным положительным эффектом, т.к. увеличивают сроки ремиссии в 2-2,5 раза только у 75% больных.
Известен препарат неовир. Препарат вызывает при парентеральном введении быстрое образование в организме высоких титров эндогенных интерферонов. В результате в клетках формируется состояние резистентности к вирусам, а также индуцируются иммунные реакции, направленные на уничтожение вируса и пораженных клеток.
Известен препарат валацикловир (валтрекс), предназначенный для пероральной терапии герпетических инфекций. Использование данного препарата позволяет сократить длительность рецидива до 4,8 дней, но он не оказывает влияние на продолжительность ремиссии.
Известен препарат ацилакт. Ацилакт представляет собой микробную массу живых ацидофильных лактобактерий, которые обладают высокой антагонистической активностью в отношении широкого круга патогенных и условно-патогенных микробов, что определяет корригирующее влияние препарата при нарушениях бактериоциноза гениталий.
Целью изобретения является увеличение сроков ремиссии у женщин с РГГ.
Указанная цель достигается путем комплексного применения противовирусного препарата валтрекса, иммуномодулирующего препарата неовира и препарата, воздействующего на микрофлору мочеполового тракта - ацилакта.
Изобретение реализуется следующим образом.
Пациентам с РГГ во время рецидива (первые 48-72 часа) назначают валтрекс 0,5 г 2 раза в день в течение 5 дней, курсовая доза 5 г, одновременно назначают неовир по 250 мг внутримышечно 10 инъекций в два этапа, первые шесть инъекций с интервалом 48 часов, последние четыре инъекции с интервалом 7 дней (непосредственно перед инъекцией препарат разводится 1,5 мл 0,5% раствора новокаина). После окончания приема валтрекса назначают ацилакт в виде влагалищных свечей по 5 доз ежедневно, на ночь, в течение 10 дней.
До назначения и после терапии у пациенток для оценки биоценоза полового тракта определяют лизоцимную активность влагалища (Казаков А.В., Телякова Г. В. , Щербакова Н. В. Способ экспресс-диагностики воспалительного процесса женской половой сферы. 1990 г. ), рН влагалища, флору с подсчетом общего микробного числа (методом посева на кровяной агар).
Приводится таблица с собственными данными динамики лизоцимной активности и рН влагалища.
Результаты сравнительного анализа до и после лечения свидетельствуют, о том, что под влиянием терапии рН влагалища нормализуется с увеличением лизоцимной активности.
Использование предлагаемого способа поясняется следующими примерами.
Больная С., 27 лет. Диагноз: Рецидивирующий генитальный герпес, тяжелая форма течения. Страдает PГГ 3 года. Рецидивы продолжительностью 8-10 дней возникали 1 раз в 1-1,5 месяца. Для лечения во время рецидива больная использовала наружные подсушивающие средства, противовирусные мази, растительные адаптогены, витаминотерапию. Под действием лечения рецидив разрешался на 2-3 дня быстрее, но на сроки ремиссии терапия не влияла.
При клинико-лабораторном обследовании указанными методами в мочеполовом тракте обнаружен гемолитический стафилококк, негемолитический стрептококк, стрептобактерии, общее микробное число 10 7 , лизоцимная активность - отрицательная, рН влагалища - 5,0.
Во время рецидива больной был назначен валтрекс 0,5 г 2 раза в день в течение 5 дней, курсовая доза 5 г, одновременно с неовиром по 250 мг внутримышечно 10 инъекций в два этапа, первые шесть инъекций с интервалом 48 часов, последние четыре инъекции с интервалом 7 дней. После окончания приема валтрекса был назначен ацилакт в виде влагалищных свечей по 5 доз ежедневно, на ночь, в течение 10 дней. На фоне лечения субъективные ощущения в виде жжения, болезненности в месте высыпаний регрессировали за 2 дня, высыпания за 4 дня. После проведенной терапии общее микробное число в половом тракте снизилось до 10 5 , флора - лактобактерии, коринебактерии, лизоцимная активность влагалища 5 мм, рН влагалища- 4,0. Побочных реакций и осложнений не отмечалось. Ремиссия продолжается 5 месяцев.
Больная П., 25 лет. Диагноз: Рецидивирующий генитальный герпес, среднетяжелая форма течения. Страдает РГТ 5 лет. Рецидивы продолжительностью 5-7 дней возникали 1 раз в 2-3 месяца. Для лечения во время рецидива больная принимала ацикловир по 200 мг 5 раз в день, 5 дней. На фоне приема препарата происходил регресс высыпаний за 4 дня, но на сроки ремиссии терапия не влияла.
При клинико-лабораторном обследовании указанными методами в мочеполовом тракте обнаружен негемолитический стрептококк, стафилококк, стрептобактерии, общее микробное число 10 6 , лизоцимная активность - отрицательная, рН влагалища - 5,0.
Во время рецидива больной был назначен валтрекс 0,5 г 2 раза в день в течение 5 дней, курсовая доза 5 г, одновременно с неовиром по 250 мг внутримышечно 10 инъекций в два этапа, первые шесть инъекций с интервалом 48 часов, последние четыре инъекции с интервалом 7 дней. После окончания приема валтрекса был назначен ацилакт в виде влагалищных свечей по 5 доз ежедневно, на ночь, в течение 10 дней. На фоне лечения субъективные ощущения в виде жжения, зуда в месте высыпаний регрессировали за 1 день, высыпания за 3 дня. После проведенной терапии общее микробное число в половом тракте снизилось до 10 5 , флора - лактобактерии, дифтероиды, коринебактерии, лизоцимная активность влагалища 4 мм, рН влагалища 4,0. Побочных реакций и осложнений не отмечалось. Ремиссия продолжается 12 месяцев.
Предложенным способом и применяя для контроля эффективности указанные методы, в УрНИИ ДВ и И пролечена 21 пациентка с РГГ, контрольная группа - 16 человек. Во время лечения побочных явлений выявлено не было. У 75,9% пациентов сроки ремиссии увеличились в 4-4,5 раза (от 4 до 12 месяцев), у 24,1% пациентов в 2,5 раза (от 3 до 10 месяцев), длительность рецидива с 7-10 дней сократилась до 3-4 дней (в 2,4 раза).
Для оценки состояния микробиоценоза половых путей и влияния предлагаемого способа лечения на его коррекцию (для увеличения сроков ремиссии, сокращения длительности рецидива) у пациентов определяют до начала лечения и после его окончания лизоцимную активность влагалища (указанным методом), рН влагалища, общее микробное число и виды микроорганизмов (посев отделяемого половых путей на кровяной агар).
До лечения у пациенток с РГГ преобладал сдвиг рН влагалища в щелочную среду при отрицательной лизопимной активности влагалища, общее микробное число 10 4 -10 5 у 57,1% пациентов, 10 6 - у 28,6%, 10 7 - у 14,3%, во флоре преобладали стрептобактерии, гемолитический стрептококк и стафилококк, негемолитический стрептококк при низком содержании лактобактерий, что свидетельствует о нарушенном биоценозе полового тракта.
После терапии у 100% пациенток наблюдалась нормализация рН влагалища (3,8-4,2), лизоцимная активность влагалища до 2 мм у 47,6% пациенток, от 2 до 4 мм - у 28,6%, более 4 мм - у 19%, общее микробное число сохранилось в преимущественном значении 10 4 -10 5 (у 52,4% пациенток), однако в генитальном тракте не обнаруживался гемолитический стрептококк и стафилококк, значительно увеличился процент присутствия лактобактерий.
Применение предлагаемого способа лечения РГГ у женщин позволяет увеличить сроки ремиссии в 4-4,5 раза у 75,9% пациенток, что более выражено, чем при применении известного способа.
Способ лечения рецидивирующего герпеса у женщин, включающий применение противовирусных и иммуномодулированных препаратов, отличающийся тем, что больным назначают валтрекс по 0,5 г 2 раза в день, курс 5 дней, одновременно назначают неовир по 250 мг внутримышечно, 10 инъекций в два этапа, первые шесть инъекций с интервалом 48 часов, последние четыре инъекции с интервалом 7 дней, после окончания приема валтрекса назначают ацилакт в виде влагалищных свечей по 5 доз ежедневно, на ночь, в течение 10 дней.
Рецидивирующий генитальный герпес. Роль герпетической инфекции в развитии простатита.
М.Э. Запольский, А.И. Фролова, Л.П. Квитко, К.А. Борисова, В.И. Бойко, В.В. Соломаха
Областной кожно-венерологический диспансер, г. Одесса
В статье изучены причины и методики лечения хронического воспаления предстательной железы вирусной этиологии. Разработан этиопатогенетически обоснованный метод лечения простатитов, ассоциированных с вирусом простого герпеса. Обоснована необходимость включения в стандартные схемы лечения простатитов противовирусных препаратов с высоким профилем безопасности и выраженным иммуномодулирующим действием.
Ключевые слова: вирус герпеса, простатит, Неовир.
Герпесвирусные инфекции (ГВИ) разделяют на три подгруппы:
Альфа-вирусы:
- Herpes simplex virus-1 (HSV-1);
- Herpes simplex virus-2 (HSV-2);
- Varicella zoster virus (VZV).
Бета-вирусы:
- Cytomegalovirus (CMV);
- Human herpesvirus 6 (HHV-6);
- Human herpesvirus 7 (HHV-7).
Гамма-вирусы:
- Epstain-Barr virus (EBV);
- Human herpesvirus 8 (HHV-8).
При попадании вируса в организм человека инфекционный процесс может протекать по нескольким направлениям:
- первичное поражение - острая воспалительная реакция с поражением кожи, слизистых оболочек или внутренних органов (характерно для всех видов герпесвирусных инфекций);
- латентное течение - находящийся в организме вирус долгое время не проявляется клинически. Возможны лишь слабовыраженные симптомы, проходящие сами собой (характерно для всех видов герпесвирусных инфекций);
- рецидивирующее течение - периоды рецидивов заболевания сменяются более или менее длительными периодами ремиссий (наиболее типично для HSV-1, HSV-2, CMV, VZV);
- течение по типу медленной инфекции - медленно прогрессирующее заболевание с постепенно (иногда годами) нарастающими клиническими проявлениями (наиболее характерно для: CMV, HHV-6, HHV-7, EBV, HHV-8) [1, 6].
Герпетические инфекции участвуют в канцерогенезе, вызывают острые, подострые и хронические энцефалиты, синдром хронической усталости, являются фактором эндотелиального повреждения при атеросклерозе, влияют на течение беременности [4, 8, 10, 12, 14].
Метаморфоз клеток, пораженных вирусом герпеса, связан с формированием мононуклеарных гранулем, очагов интерстициального фиброза, а позже - некроза и зон кальцификации. Нейротоксическое действие ГВИ приводит к снижению синтеза клеточной ДНК, уменьшению активности метаболических процессов в нейронах, замедлению гликолиза, окислительного фосфорилирования, нарушению активности ферментов цикла Кребса. Все это способствует ускорению процессов апоптоза, изменению фенотипических свойств клеток, формированию хронического воспалительного процесса во многих органах [9].
провоцирующий фактор \ возрастная группа
Обострение соматических заболеваний
Трансплантация органов, иммуносупрессивная терапия
50 лет и старше
Как и многие другие персистирующие инфекции, герпесвирусы способствуют развитию иммунодефицитных состояний. До настоящего времени нет единой концепции в отношении характера иммунных нарушений при ГВИ. Сохраняющиеся пожизненно вируснейтрализующие антитела, несомненно, препятствуют распространению вируса, но не устраняют патогенного воздействия вируса на организм человека в целом. Как показывает практика, количество ви- руснейтрализующих антител не всегда свидетельствует об истинной картине герпетического процесса и возможности его последующего прогрессирования [4, 7, 11, 15].
Все изложенное выше свидетельствует об актуальности рассматриваемой проблемы и о важности дальнейшего изучения патологических состояний, обусловленных прямым и опосредованным действием герпесвирусов. Известные сегодня сведения об иммунопатогенезе, клинических проявлениях, диагностике и терапии герпесвирусных инфекций требуют дальнейшего изучения и внедрения новых методов терапии и профилактики ГВИ
В последние годы участились случаи хронических воспалительных процессов наружных половых органов и органов малого таза герпесвирусной этиологии у мужчин в виде хронического уретрита, цистита, дизурии, простатита [6]. В настоящее время в зависимости от распространенности генитального герпеса выделяют три степени тяжести поражения наружных половых органов и органов малого таза:
1- степень - рецидивирующее поражение наружных половых органов (наружный, внутренний листок крайней плоти, головка полового члена, губки мочеиспускательного канала, ствол полового члена) (рис. 1-2).
2- степень - рецидивирующее поражение наружных половых органов в сочетании с герпетическим уретритом, циститом (острым или рецидивирующим), приходящие дизурические расстройства, связанные с активацией генитального герпеса.
Установить диагноз герпетического поражения органов малого таза и, в частности, предстательной железы на основании клинических и лабораторных данных не просто, так как воспалительные процессы мочевого пузыря, предстательной железы, могут быть связаны и с другими вирусными, бактериальными инфекциями. Диагностика затрудняется и ростом атипичных форм рецидивирующего генитального герпеса, когда характер высыпаний видоизменяется и имитирует симптомы других заболеваний (до 20%) [9, 16].
МАТЕРИАЛЫ И МЕТОДЫ
Под нашим наблюдением находились 78 мужчин в возрасте от 25 до 53 лет, страдающих рецидивирующим генитальным герпесом. При их обследовании хронический простатит был выявлен у 43 пациентов (55,2%). Причем у 38 из них (48,7%) простатит не был ассоциирован с патогенной бактериальной флорой и был оценен нами как простатит с возможной вирусной этиологией. Частота рецидивов герпетической инфекции в группе наблюдения составляла в среднем 4,7 эпизода за год.
Пациенты, страдающие уретропростатитом, ассоциированным с ГВИ (всего 38 больных), условно были разделены на две группы: основную (20 больных) и контрольную (18 больных).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Микроскопическое исследование секрета предстательной железы пациентов, находившимся под нашим наблюдением, показало умеренное увеличение лейкоцитов (до 20-30 в поле зрения), снижение количества лецитиновых зерен, увеличение слизи, рН 8-8,5, повышение содержания амилоидных телец. Методом ПЦР во всех случаях выявлен вирус герпеса 1-го или 2-го типа. Данные клинических и лабораторных исследований подтвердили вирусную этиологию простатитов у пациентов, находившихся под нашим наблюдением.
Больные основной группы получали противогерпетическую терапию, включавшую Неовир до 10 инъекций на курс, ацикловирсодержащий препарат 10 дней, макролидный антибиотик (по показаниям) до 10 дней, а также свечи с нестероидными противовоспалительными средствами (НПВС) до 14 дней.
Пациенты контрольной группы принимали блокаторы ДНК-полимеразы в виде ацикловирсодержащих препаратов, продолжительностью до 10-14 дней, макролидные антибиотики до 10 дней, биогенные стимуляторы, противовоспалительные свечи от 10 до 14 дней (табл. 2).
Клиника кожных и венерических болезней Саратовского государственного Медицинского Университета.
Опыт применения препарата эпиген в терапии больных генитальным герпесом.
Бакулев А.Л., Сувернева Е.В., Марченко В.М.
Герпетическая инфекция является одной из самых распространенных у человека. По данным ВОЗ, около 90% населения земного шара инфицировано вирусом простого герпеса; у 10-20% из них имеют место те или иные клинические проявления герпетической инфекции. Одной из клинических разновидностей простого герпеса считается генитальный герпес, который в настоящее время признан как ЗППП. Как правило, первичное инфицирование вирусом происходит в период активной сексуальной жизни. Резервуаром для инфекции служит мочеполовой тракт у мужчин и канал шейки матки у женщин. В практической работе принято различать первичный эпизод генитального герпеса (протекающий более тяжело и продолжительно по времени) и рецидивирующий генитальный герпес.
Большая распространенность генитального герпеса, отсутствие высокоэффективных и удобных в применении средств и методов терапии заболевания обуславливают необходимость поиска новых надежных лекарственных препаратов (прежде всего для наружного применения). Такие широко применяемые лекарственные средства, как оксолиновая, теброфеновая, флореналевая мази, крем ацикловира, бонафтоновая мазь, а также препараты Гевизош, Виру-мерц, Триаптен - не лишены недостатков. Данные препараты оказываются эффективными только на начальных этапах заболевания. При наличии влажных эрозий, выраженного отека дополнительно приходится использовать примочки с антисептическими растворами. Мазевая основа вышеназванных средств не всегда удобна для использования пациентами, ведущими активный образ жизни.
В этой связи, расширение арсенала и поиск новых, достаточно эффективных средств, применяемых для лечения генитального герпеса, представляется актуальной и перспективной проблемой.
Нами была проведена апробация лекарственного средства ЭПИГЕН фирмы "Laboratorios Cheminova International" (Испания). Препарат ЭПИГЕН выпускается в виде аэрозоля для наружного применения в баллончиках под давлением. Важным достоинством лекарственного препарата является его высокая биодоступность, что выгодно отличает эпиген от других наружных противовирусных средств, приготовленных на мазевой основе.
Во флаконе содержится 125 мл водного раствора, содержащего основное действующее вещество - активированную 0,1% глицирризиновую кислоту. Противовирусное действие глицирризиновой кислоты связано с тем, что ее молекула непосредственно взаимодействует с вирусами, что приводит к:
Противовирусное действие глицирризиновой кислоты связано с ингибированием фермента киназы Р, что ведет к подавлению фосфорилирования клеточных и кодируемых вирусом белков в инфицированных клетках.
Важным представляется тот факт, что глицирризиновая кислота оказывает свое действие в концентрациях, нетоксичных для нормально функционирующих клеток человека. Наконец, являясь продуктом переработки и активации натурального водного экстракта корня Солодки голой, глицирризиновая кислота при системном действии обладает способностью к стимуляции функциональной активности надпочечников.
Целью нашего исследования явилось установление эффективности препарата ЭПИГЕН при наружном применении в качестве средства терапии генитального герпеса.
Под наблюдением находилось 23 пациента (15 женщин и 8 мужчин) с клиническими проявлениями генитального герпеса. Среди наблюдавшихся преобладали лица в возрасте от 16 до 35 лет. Критерием для отбора больных явились: выраженные проявления заболевания; отсутствие противопоказаний к назначению эпигена и согласие самих пациентов.
У 11 больных заболевание манифестировало впервые. У 12 человек патология носила рецидивирующий характер (до 6 рецидивов в год) в сроки от нескольких месяцев до 9 лет. При этом основную группу составили лица с длительностью процесса до 1 -3 лет.
Клиническая картина генитального герпеса характеризовалась очагами эритемы, отека и высыпаниями сгруппированных везикул, эрозий и поверхностных трещин на гениталиях. Субъективно пациенты отмечали чувство жжения, болезненность и малоинтенсивный зуд в очагах.
У всех больных ЭПИГЕН распыляли над эффлоресценциями каждые 4 часа в количестве, достаточном для полного покрытия пораженных участков кожи. Аэрозоль наносили на кожу с расстояния 5-7 см от очага поражения. После нанесения препарат оставался на коже до полного высыхания. Курс лечения составлял 5-7 дней.
Эпиген в виде монотерапии получали 18 пациентов, в сочетании с индуктором эндогенных интерферонов неовиром - 5 человек (с рецидивирующим характером генитального герпеса). При этом неовир назначался по 2 мл внутримышечно (на курс 5 инъекций).
В результате проведенной терапии эпигеном у всех больных был констатирован отчетливый терапевтический эффект. Уже на 1-2 день лечения прекращалось появление новых герпетических эффлоресценций на коже. Одновременно пациенты отмечали исчезновение субъективных ощущений в очаге (прекращение чувства жжения; зуда; болезненности). В эти же сроки происходила частичная эпителизация эрозий и поверхностных трещин. На 3-4 дни от начала терапии эпигеном нами констатировано значительное уменьшение местных воспалительных явлений в виде уменьшения эритемы, отека кожи в очагах поражений, частичного разрешения везикул и дальнейшей полной эпителизации эрозий. К 5-6 дням терапии имело место исчезновение герпетических высыпаний и местных воспалительных изменений на коже.
Параллельное назначение иммуномодулятора неовира способствовало более быстрому исчезновению герпетических высыпаний и местных воспалительных изменений на коже гениталий (в среднем на 1-2 дня).
Клинические результаты лечения оценивались по следующим критериям: клиническое разрешение (полное исчезновение клинических, видимых признаков болезни); значительное улучшение (исчезновение везикулезных эффлоресценций и субъективных ощущений на фоне заметного уменьшения местных воспалительных явлений); улучшение (некоторое уменьшение симптомов заболевания и субъективных ощущений); отсутствие эффекта; ухудшение (усиление клинических проявлений заболевания).
Исследование проведено на репрезентативном материале, включавшем 23 пациентов с herpes simplex progenitalis.
Клиническое излечение наблюдалось у 73,9% наблюдавшихся больных (в том числе у 10 пациентов с первым эпизодом генитального герпеса и у 7 лиц с рецидивирующим характером патологического процесса). Значительное улучшение констатировано в 17,4% случаев (в этой группе преобладали больные с рецидивом герпетической инфекции). Наконец, улучшение достигнуто в 8,7% случаев с рецидивирующими высыпаниями на коже гениталий. Случаев отсутствия терапевтического эффекта и ухудшений в течении заболевания в процессе терапии эпигеном нами зафиксировано не было.
Переносимость препарата всеми больными была хорошей. Побочных явлений и аллергических реакций в процессе терапии эпигеном отмечено не было. Отсутствие побочных эффектов связано, по всей вероятности, с использованием в качестве активного компонента растительного (а не синтетического вещества) в виде водного экстракта корня солодки голой, тщательным подбором других ингредиентов и нейтральной рН аэрозоля.
Эпиген хорошо впитывался в кожу гениталий, не пачкал белье, одежду, при необходимости легко удалялся с поверхности кожи с помощью простого ватно-марлевого тампона. При использовании лекарственного средства нам не пришлось прибегать к окклюзионным повязкам. Форма выпуска в виде аэрозоля явилась наиболее оптимальной при локализации везикулезных элементов на слизистых оболочках влагалища, что свидетельствует об адаптированности эпигена именно для генитального герпеса.
Препарат удобен и комфортен в применении; может использоваться пациентами, ведущими активный образ жизни, легко дозируется. Вышеперечисленные качества позволяют широко использовать препарат в амбулаторных условиях.
Таким образом, аэрозоль ЭПИГЕН является высокоэффективным лекарственным препаратом для наружного лечения как манифестного, так и рецидивирующего генитального герпеса кожи и слизистых оболочек. Назначение эпигена при herpes simplex progenitalis позволяет достичь выраженного терапевтического эффекта у подавляющего большинства больных в короткие сроки.
Препарат удобен и комфортен в практическом применении, хорошо переносится пациентами, не вызывает побочных эффектов и может широко использоваться в амбулаторной практике.
Широкое использование эпигена позволит расширить арсенал современных противовирусных препаратов для наружного лечения простого герпеса гениталий.
Комбинация эпигена с современным иммуномодулятором неовиром способствует потенциированию противовирусного эффекта и эффективна при рецидивирующем характере генитального герпеса.
Дальнейшие научные исследования по использованию эпигена в виде монотерапии и в сочетании с другими противовирусными и иммуноактивными средствами должны быть направлены на уточнение влияния лекарственных препаратов на состояние иммунного статуса и естественной реактивности организма.
Читайте также:


