Чем избавиться от зуда после опоясывающего герпеса

Заболевание, возникающее в результате поражения корешков нервов вирусом опоясывающего герпеса.
В классическом варианте боли возникают после перенесенного опоясывающего герпеса (Varicella zoster) в месте высыпаний. Возможен дебют заболевания с невропатических болей. Характерны высокоинтенсивные приступообразные боли на фоне нарушений чувствительности (аллодиния, гипалгезия, гиперестезия, гиперпатия).
Постгерпетическая невралгия: как избежать осложнений
Увеличение заболеваемости опоясывающим герпесом (Herpes zoster) может быть связано с повышением в популяции числа лиц со сниженным иммунитетом и естественным старением населения. С возрастом уменьшается уровень антител к вирусу, провоцирующему заболевание, что сказывается на распространенности опоясывающего герпеса у людей в старшей возрастной группе.
К факторам риска, оказывающим влияние на развитие постгерпетической невралгии, относятся пожилой возраст, принадлежность к женскому полу, интенсивность боли в острый период, выраженность кожных высыпаний.
Постгерпетическая невралгия – осложнение опоясывающего герпеса. При реактивации вирус Herpes zoster, который остается в организме в спящем состоянии после перенесенной в детском возрасте ветряной оспы, вызывает образование типичной везикулярной сыпи и боль в области иннервации соответствующего нервного корешка. Чаще всего сыпь локализуется на туловище (50%), голове (20%), верхних и нижних конечностях (15%). Высыпания располагаются строго по ходу нервного ствола. Как правило, процесс носит односторонний характер. При ослаблении функции иммунной системы есть шанс рецидива опоясывающего лишая.
Выделяют три временны́х периода появления болевого синдрома:
- – острая герпетическая невралгия: боль продолжается с начала возникновения сыпи до 30 дней;
- – подострая герпетическая невралгия: боль возникает в период с 30 по 120 день после возникновения сыпи;
- – постгерпетическая невралгия: в этом случае боль сохраняется более 120 дней от последнего момента высыпаний.
Постгерпетическая невралгия относится к наиболее часто встречающимся хроническим болевым синдромам, причиной которых является поражение центральной и периферической нервной системы вирусом Herpes zoster.
Кроме боли пациенты также предъявляют жалобы на интенсивный кожный зуд, чаще возникающий в области головы и шеи, который может появиться как до, так и после острого периода. Также возможна полная потеря болевой и тактильной чувствительности.
У большинства пациентов боль уменьшается в течение года, однако у части больных она сохраняется годами и даже в течение всей жизни (чаще при дебюте заболевания в возрасте старше 50 лет). В течение жизни боль может менять свою продолжительность и интенсивность.
Постгерпетическая невралгия ухудшает качество жизни пациентов, особенно пожилого возраста, приводит к снижению социальной активности, ограничивает повседневные действия (например, одевание и водные процедуры). Происходят изменения в психоэмоциональной сфере, пациенты испытывают повышенную тревогу и трудности с концентрацией внимания. Выявляются депрессии и неврозоподобные состояния. Заболевание оказывает негативное влияние на физическое состояние пациента, вызывая хроническую усталость, нарушение режима сна и отдыха, снижение аппетита.
Постановка диагноза опоясывающего герпеса, как правило, не вызывает особого труда, однако при этом возможно осуществление лабораторной диагностики для определения генетического материала вируса в содержимом пузырьков или ликворе методом полимеразной цепной реакции.
Лечение включает в себя два ключевых направления: противовирусную терапию и купирование болевого синдрома. Это касается и острого периода, и стадии постгерпетической невралгии. Препаратами выбора являются противогерпетические препараты, блокирующие репликацию вируса. Эффект от лекарственной терапии наиболее выражен, если начать лечение в первые 72 часа от начала высыпаний. Исследования показали, что данные препараты снижают боль, связанную с опоясывающим герпесом, и риск развития постгерпетической невралгии.
- – трициклические антидепрессанты;
- – антиконвульсанты;
- – опиоидные анальгетики;
- – пластырь с лидокаином;
- – капсаицин.
Следует отметить, что в настоящее время местный препарат капсаицин используют редко, поскольку в начале лечения возможно усиление боли за счет активации ноцицептивных волокон.
Вакцинация против опоясывающего герпеса может назначаться людям старше 60 лет, которые перенесли ветряную оспу, но не рекомендуется людям с ослабленным иммунитетом или получающим цитостатическую терапию.
Важно помнить о необходимости проведения полного курса назначенной терапии для уменьшения риска рецидивов. В группе риска пациентов старше 60 лет эффективно назначение комбинации противовирусных препаратов и кортикостероидов. Таким образом, своевременно начатое лечение позволяет успешно купировать болевой синдром и предупредить развитие такого осложнения опоясывающего герпеса, как постгерпетическая невралгия.
Про опоясывающий лишай знают немногие. Он вызван вирусом герпеса третьего типа (Herpes Zoster), который является причиной ветряной оспы у детей и отличается сильной болью и зудом. Для нормализации состояния проводят комплексную терапию. В курс входят также препараты, снимающие боль и зуд, принося тем самым облегчение больному. Методы народной медицины занимают в лечении не последнюю роль. Но перед применением какого-либо препарата рекомендуется сначала проконсультироваться с врачом.
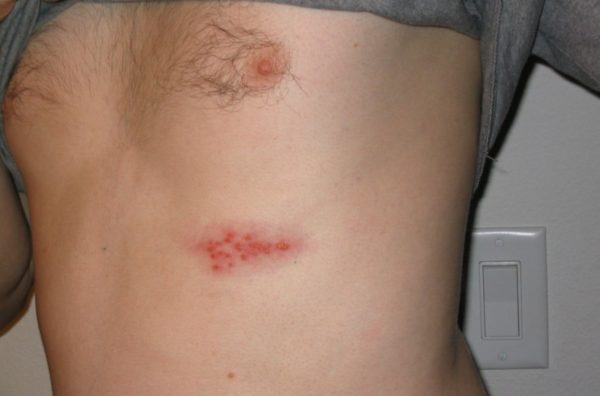
Кожный зуд: его причины
Возбудителем опоясывающего лишая считается Varicella Zoster – вирус герпеса третьего типа, он же провоцирует ветряную оспу у детей. Во взрослом возрасте он может активизироваться и проявиться:
Самый распространённый – на теле, в местах основных нервов.
Внешний вид высыпаний
На ранней стадии заболевания возникают боль и покалывание. Потом в этом месте появляются пузырьки, наполненные лимфатической жидкостью. Больной может ощущать дискомфорт при прикосновении к определённым участкам кожи, гиперчувствительность в воспалённых местах, соприкасаясь кожей с холодными предметами или при трении об одежду.

В том месте, где локализуется возбудитель, возникает нестерпимая боль в мышцах, сильное раздражение нервных окончаний и изнуряющий зуд. После того, как пузырьки лопаются, вытекает жидкость. Лучше вытирать её ватным тампоном и все терапевтические процедуры проводить в медицинских перчатках, иначе герпес может перекинуться на другие участки тела.
Каждый пузырёк содержит тысячи возбудителей, поэтому человек считается заразным на протяжении всей стадии образования везикул.
После вскрытия везикул образуется корка соломенно-жёлтого цвета, которая возвышается над кожей. Она трудно отделяется от кожи до тех пор, пока эпидермис под ней не подвергнется процессу регенерации. Если корку постоянно удалять, возникают кровоточащие раны и заживление затягивается на несколько недель. На этой стадии везикулы могут образоваться вновь на новом участке.
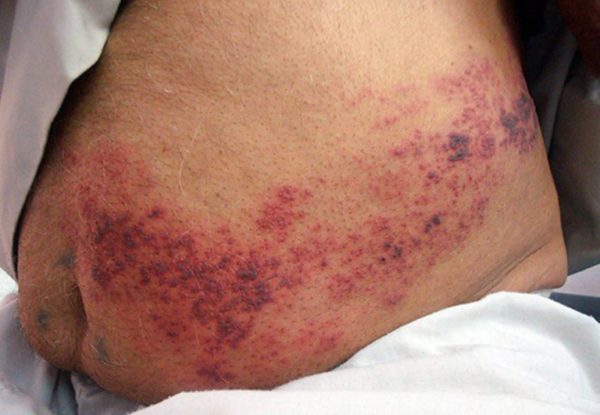
Герпес нельзя вылечить, но можно уменьшить неприятные ощущения в несколько раз и укрепить иммунную систему во избежание рецидивов. В этом помогут различные примочки, мази и методы народной медицины.
Как облегчить зуд
Такой неприятный симптом появляется одним из первых и не даёт покоя. Он сопровождается ещё жжением, покалыванием и болью. Сразу следует отметить, что пузыри нельзя давить и расчёсывать. Это приведёт к ещё большему распространению сыпи, долгому выздоровлению и вероятному осложнению в виде присоединившейся бактериальной или грибковой инфекции.

- Как только пациент почувствовал зуд, он может воспользоваться собственной серой из ушей. Её нужно извлечь из уха ватной палочкой и нанести на поражённую кожу, предварительно очистив место воспаления. Повязку накладывать не нужно.
- Можно применить любую зубную пасту, нанеся её тонким слоем на зудящий участок. Неприятные симптомы заметно утихают.
- Справиться с зудом поможет Корвалол или Валокордин. На чистый ватный тампон нужно нанести капли и смазать зудящую кожу.
- Носить необходимо только свободную одежду, без грубых швов, из хлопчатобумажных тканей, тем самым исключая трение и дальнейшее раздражение кожного покрова.
- Делать холодные примочки или класть грелку, наполненную льдом.

Медикаментозные препараты для устранения зуда
Воспользоваться аптечными средствами нужно в первые 24 часа после начала ощущения дискомфорта. При опоясывающем лишае лечение назначает терапевт или врач общей практики. При необходимости к нему присоединяется иммунолог, так как частые рецидивы герпеса – серьёзный звонок о хронических нарушениях в иммунной системе.
Опоясывающий лишай считается взрослым заболеванием, однако встречаются случаи и среди грудничков. Скорее всего, они получили вирус внутриутробно или по родовым путям.
В любом случае вирус герпеса Варицелла Зостер поражает нервные клетки. При неграмотном лечении это может быть очень опасно, поэтому за врачебной помощью нужно обращаться немедленно. Только специалист может принимать решение при выборе лекарственных средств.
Все крема, мази и гели применяются в комплексной терапии лечения заболевания для местного использования:
- Противовирусные препараты. Все наружные средства впитываются на 25% и проникают в кровоток. Их действующее вещество ацикловир способно воздействовать на штаммы вирусов, блокируя их активность. Тем самым уменьшается зуд и прекращается воспаление кожи с последующим образованием пузырьков. К ним относятся Ацикловир, Валтрекс, Валацикловир, Вектавир, Фенистил, Пенцивир. Применяют одно из средств 4-6 раз в день, в зависимости от интенсивности проявления симптомов и эффективности лечения.
- Обезболивающие мази и крема. Гель Лидокаин, который обладает местным замораживающим эффектом и хорошо снимает зуд.
- Противовоспалительные. Самая известная, хорошо зарекомендовавшая себя мазь – Матарен Плюс. Это обезболивающее и антибактериальное средство. Используют её 3-4 раза в день.

Народная медицина
Иногда народные методы помогают ничуть не хуже аптечных средств. Только перед применением нужно обязательно проконсультироваться с врачом.
- Прожаренная луковица. При сильном зуде прожаренный лук рекомендуется прикладывать к пораженной герпесом коже.
- Аптечная ромашка. Одну чайную ложку растения залить 200 мл крутого кипятка и остудить до комнатной температуры. При помощи стерильной марли делать примочки и аккуратно смазывать сыпь.
- Лист алоэ. Взять лист растения, разрезать вдоль пополам. Приложить их местом среза к зудящей сыпи и зафиксировать. Лучше делать это на ночь.

Вирус герпеса III типа может быть неопасен, если вовремя начать грамотное медикаментозное лечение. Нужно помнить, что курс терапии назначает врач. Испытывать на себе, а тем более на малышах, различные методы лечения запрещено. Для младенцев существует своя схема терапии. Так как герпес не излечивается, главная цель – избежать осложнений.
Постгерпетическая невралгия (ПГН) – часто встречающееся осложнение острого эпизода опоясывающего лишая, плохо поддающееся лечению и купированию состояния в связи с высокой степенью тяжести заболевания и его затяжной длительностью. Уровень специфических антител к вирусу Varicella zoster снижается с возрастом, что, вероятно, в значительной мере влияет на распространенность опоясывающего герпеса в старших возрастных группах. ПГН хорошо знакома специалистам в области иммунологии, поскольку они часто сталкиваются с ней в своей практике.
Опоясывающий лишай – одна из наиболее распространенных неврологических проблем; в США частота данного заболевания достигает до 1 млн новых случаев ежегодно (Oxman, 2005). Несмотря на то, что точные показатели встречаемости ПГН в США неизвестны, по данным исследований она предположительно составляет от 500 тыс. до 1 млн случаев в год (Bennett, 1997).
Основными факторами риска развития ПГН после эпизода опоясывающего герпеса являются следующие (Jung et al., 2004; Dworkin et al., 1998):
- пожилой возраст;
- сильная боль во время острого периода опоясывающего герпеса;
- тяжелая форма сыпи.
ПГН называют боль в зоне одного или нескольких дерматомов, которая сохраняется 120 и более дней от момента появления сыпи (Volpi, 2005). Эта боль может носить характер стимулзависимого постоянного жжения, пульсации или эпизодического острого, подобного удару током ощущения, а также характеризуется симптомами тактильной стимулзависимой аллодинии (возникновением боли после неболевого воздействия) и гипералгезии (возникновением сильной боли после воздействия слабого болевого раздражителя) (Dworkin, Portenoy, 1996). Кроме того, некоторые пациенты испытывают миофасциальную боль вследствие спазма мышц. Иногда наблюдается хронический зуд.
Более чем у 90% лиц с ПГН наблюдается аллодиния, встречающаяся в участках, где чувствительность относительно сохраняется (Bowsher, 1995). У пациентов также отмечается спонтанная боль в участках, где чувствительность потеряна или ухудшена. В данной статье рассмотрена доказательная база применения препаратов для лечения острого опоясывающего герпеса и ПГН, а также предложены стратегии профилактики опоясывающего герпеса.
Лечение острого опоясывающего герпеса: раннее начало терапии
Лечение острого опоясывающего лишая, основанное на доказательствах, включает противовирусные и аналгезирующие средства.
Противовирусные препараты подавляют репликацию вируса и оказывают положительное воздействие на острую и хроническую боль. Ацикловир (800 мг, 5 раз в день), валацикловир (1000 мг, каждые 8 часов) и фамцикловир (500 мг, каждые 8 часов) обычно применяют для лечения опоясывающего лишая. Все три препарата имеют сопоставимые профили эффективности и безопасности. Согласно метаанализу исследования пациентов в возрасте старше 50 лет, которым назначали ацикловир или плацебо, боль сохранялась в 15% случаев в группе ацикловира по сравнению с 35% группы плацебо (Dworkin, 2001). Также оценивали продолжительность болевого синдрома, сравнивая терапию фамцикловиром и плацебо. В результате у пациентов, принимавших плацебо, непроходящая боль отмечалась в течение 163 дней, тогда как у леченных фамцикловиром – 63 дней (Tyring, 1995).
На основании представленных фактов, антивирусные средства настоятельно рекомендуются для лечения опоясывающего лишая, особенно больным с повышенным риском развития ПГН. Противовирусную терапию необходимо начинать на протяжении 72 часов от начала высыпания. К сожалению, отсутствуют достоверные сведения, подтверждающие эффективность противовирусного лечения, примененного спустя трое суток после появления высыпания. Однако в неконтролируемом испытании была исследована эффективность ацикловира, который больные начали принимать до и по истечении 72 часов; различия в постоянстве боли между группами были незначительными, в связи с чем можно предположить, что эффект ацикловира проявляется даже при применении по прошествии трех дней (Kurokawa, 2002). В клинической практике диагноз опоясывающего лишая часто не ставится в течение 72 часов после возникновения симптомов. В связи с этим важно определять пациентов, для которых антивирусное лечение может быть эффективным, даже если оно начато относительно поздно, когда заболевание уже возникло. В особенности это имеет значение при глазном герпесе, поскольку в этом случае вирус может распространяться и по истечении трех дней (Zaal, 2001).
На практике для лечения боли, связанной с опоясывающим лишаем, применяют аналгезирующие средства, начиная с опиоидов короткого действия в сочетании с ацетаминофеном или нестероидными противовоспалительными препаратами. При неэффективности обычных аналгезирующих средств можно добавлять габапентин или прегабалин, а также трициклические антидепрессанты (ТЦА). Режим применения болеутоляющих препаратов должен быть скорректирован с учетом индивидуальных потребностей пациента. Если не удается контролировать боль, или побочные реакции невыносимы, рассматривают хирургические методы лечения, которые, однако, малоэффективны. К ним прибегают как к последнему варианту при отсутствии эффекта всех других мер. Адекватное купирование болевого синдрома в острой стадии заболевания может снижать риск развития стойкой ПГН.
Кортикостероиды обычно не рекомендуются в плановом порядке для лечения опоясывающего лишая. Однако иногда их применяют у пожилых пациентов с нормальным иммунитетом, в случае если антивирусная терапия и аналгезирующие средства не облегчают боль. В двух двойных слепых контролируемых исследованиях при приеме комбинации ацикловира и кортикостероидов в течение 21 дня уровень ПГН не снижался. Некоторая польза отмечалась с точки зрения возвращения пациентов к обычной повседневной активности и улучшения сна после отмены болеутоляющей терапии (Wood, 1994; Whitley, 1996).
Лечение ПГН, основанное на доказательствах
Медикаментозное лечение ПГН включает антиконвульсанты, ТЦА, опиоиды и средства местного применения. Инвазивные вмешательства имеют ограниченное, но важное значение в терапии боли при ПГН в клинической практике.
Блокаторы кальциевых каналов габапентин и прегабалин являются безопасными и относительно хорошо переносимыми препаратами. Они могут использоваться в качестве средств первой линии для лечения ПГН, начиная с минимальной дозы и повышая ее путем титрования. Габапентин одобрен Управлением по контролю над пищевыми продуктами и лекарственными средствами США (FDA) для терапии ПГН. Стартовая доза составляет 100-300 мг вечером, по мере необходимости доза увеличивается на 100-300 мг каждые 3-5 дней до максимальной, которая составляет 1800-3600 мг/сут. Суточная доза делится на 3-4 приема. В двух больших рандомизированных контролируемых исследованиях прием габапентина ассоциировался со статистически значимым уменьшением выраженности болевого синдрома, вследствие чего отмечалось улучшение сна и качества жизни (Rice, 2000). Побочные эффекты данного препарата включают сонливость, головокружение, периферические отеки, нарушение зрения и равновесия при ходьбе.
Поскольку габапентин экскретируется почками, необходимо с осторожностью использовать его у больных почечной недостаточностью. Уровень клиренса габапентина линейно связан с таковым креатинина и снижен у лиц пожилого возраста, а также у пациентов с нарушением функции почек. Следовательно, у таких больных необходимо корректно подбирать дозу габапентина и частоту приема препарата. У пациентов на гемодиализе уровень габапентина в плазме крови можно поддерживать на постоянном уровне путем приема 200-300 мг препарата спустя 4 часа после каждого сеанса диализа (Wong, 1995).
Не так давно FDA было разрешено применение габапентина пролонгированного действия при ПГН. Поводом для такого решения стали результаты 12-недельного основного исследования и двух дополнительных (2012).
В мультицентровом двойном слепом рандомизированном контролируемом плацебо исследовании в параллельных группах оценивали эффективность, безопасность и реакцию на габапентин пролонгированного высвобождения. Начальная рекомендованная доза составила 600 мг/сут в течение 3 дней, начиная с 4-го дня – 600 мг два раза в день, эффективной оказалась доза 1200 мг/сут. Согласно полученным данным, габапентин пролонгированного действия улучшает биодоступность активного вещества и поэтому снижает уровень отрицательных воздействий по сравнению с обычным габапентином.
В целом полученные доказательства весьма неоднозначны. В двух рандомизированных контролируемых исследованиях, посвященных габапентину пролонгированного действия, было показано преимущество препарата при применении дважды в день (600 мг утром и 1200 мг на ночь) по сравнению с однократным приемом дозы 1800 мг и плацебо для уменьшения интенсивности и специфического характера боли (Irving et al., 2009; Jensen et al., 2009). Однако в другом испытании габапентин замедленного высвобождения в дозе 1800 мг/сут не продемонстрировал превосходства по сравнению с плацебо (Wallace, 2010).
Прегабалин также утвержден FDA для лечения ПГН. Эффективный диапазон дозы составляет 150-600 мг/сут. По сравнению с плацебо прегабалин обеспечивал более высокий уровень облегчения боли и улучшал показатели сна у 776 пациентов с ПГН (Frampton, 2005). Нежелательные эффекты включают увеличение массы тела, головокружение и сонливость. Необходимо медленно титровать дозу препарата у лиц пожилого возраста.
Другие антиконвульсанты – блокаторы натриевых каналов, такие как топирамат, ламотриджин, карбамазепин, окскарабазепин, леветирацетам и вальпроевая кислота, не одобрены FDA при ПГН. Однако эти препараты могут быть вариантом выбора для пациентов с ПГН, у которых традиционная терапия оказалась неэффективной. В 8-недельном рандомизированном контролируемом исследовании пациенты в качестве лечения получали дивалпроекс натрия (вальпроевая кислота и вальпроат натрия) по 1000 мг/сут. В результате отмечалось значительное облегчение боли по сравнению с плацебо (Kochar et al., 2005). Среди побочных явлений могут иметь место головокружение, выпадение волос, головная боль, тошнота и диарея.
ТЦА, такие как амитриптилин, дезипрамин и нортриптилин ингибируют захват норадреналина и серотонина, а также блокируют натриевые каналы; возможно, существует другой, неизвестный пока, механизм их действия. Несмотря на то, что амитриптилин – наиболее изученный ТЦА при ПГН, имеющиеся доказательства и клинический опыт предполагают, что нортриптилин и дезипрамин обладают сопоставимой эффективностью и лучше переносятся (Watson, 1998; Dworkin et al., 2007).
Нортриптилин и дезипрамин рекомендуется принимать лицам с ослабленным иммунитетом и пожилым пациентам. Терапию целесообразно начинать с 10-25 мг/сут вечером, титруя в зависимости от переносимости каждые две недели до 75-150 мг/сут. Нежелательные эффекты включают сухость во рту, усталость, головокружение, седативное действие, задержку мочеиспускания, ортостатическую гипотензию, увеличение массы тела, нарушение зрения, удлинение интервала QT, запор и половую дисфункцию.
Что касается применения селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСН), у пациентов с ПГН используют дулоксетин и венлафаксин в связи с их доказанной эффективностью в лечении диабетической нейропатии и других нейропатических болевых состояний. Дулоксентин назначают в дозе 60-120 мг/сут в два приема в случае отсутствия ответа на ТЦА или их непереносимости. В 12-недельных двойных слепых рандомизированных контролируемых плацебо исследованиях (2011) изучали прием дулоксетина по 60 мг/сут и 60 мг два раза в день для лечения диабетической периферической нейропатии. Были сделаны выводы, что доза 120 мг была безопасной и эффективной, однако не так хорошо переносилась, как 60 мг/сут.
Необходимо периодически исследовать функции печени у больных, применяющих дулоксетин. При назначении венлафаксина рекомендуемая доза составляет 75-225 мг/сут (Rowbotham et al., 2004).
Опиоидные анальгетики рекомендуются как препараты второй и третьей линии при ПГН. Побочные реакции включают тошноту, зуд, седативный эффект, спутанность сознания, запор, гипогонадизм, а также риск развития толерантности и привыкания.
В двойном слепом перекрестном исследовании оценивали болеутоляющую эффективность орального оксикодона. Лечение привело к значительному снижению аллодинии, стойкости болевого синдрома и спонтанной пароксизмальной боли. Использование оксикодона показало хорошие результаты в общей эффективности и снижении инвалидизации по сравнению с плацебо (Watson, Babul, 1998).
В рандомизированном перекрестном испытании комбинация габапентина и морфина превосходила любое из лекарственных средств относительно избавления от боли при ПГН (Gilron et al., 2005).
Атипичный опиоид трамадол обладает слабым эффектом агониста ?-опиоидных рецепторов и ингибирует обратный захват серотонина и норадреналина. Необходимо избегать его применения у больных с припадками судорог в анамнезе. Рекомендуемая максимальная доза составляет 400 мг/сут. Также можно использовать трамадол пролонгированного действия. В рандомизированном контролируемом плацебо исследовании трамадол обеспечивал превосходящее облегчение боли и улучшал качество жизни у пациентов с ПГН (Boureau et al., 2003).
Тапентадол – слабый агонист ?-опиоидных рецепторов; ингибирование обратного захвата норадреналина более выражено, чем ингибирование обратного захвата серотонина. Это лекарственное средство также доступно в форме замедленного высвобождения. Рекомендуемая максимальная доза составляет 600 мг/сут.
Местное лечение препаратами при ПГН связано с относительно меньшим количеством побочных явлений в сравнении со средствами, которые применяются перорально, поскольку их системная абсорбция минимальна.
Лидокаин доступен в виде трансдермального пластыря и местной гелеобразной мази. FDA одобрило применение пластыря с 5%-ным лидокаином для терапии ПГН. Лидокаин, блокатор натриевых каналов, можно использовать для лечения пациентов с клиническими признаками аллодинии. Пластырь можно разрезать, чтобы форма соответствовала зоне поражения; максимально возможно применять три пластыря одновременно в течение 12 часов, затем необходим 12-часовой перерыв. В случае эффективности пластырь можно оставить до 18 часов (Hermann et al., 2005).
В двух открытых нерандомизированных проспективных исследованиях у пациентов, которые применяли лидокаин в виде пластыря, уменьшилась интенсивность боли и улучшилось качество жизни.
Если по какой-то причине нет возможности приобрести пластырь лидокаина или есть трудности при его использовании, рекомендуется 5%-ный гель лидокаина.
Крем местного применения, содержащий капсаицин, выпускается в двух концентрациях: 0,025 и 0,075%. Активное вещество красного перца чили капсаицин действует как агонист ванилоидных рецепторов. Рекомендуемая дозировка – 3-4 раза в день. Начальное применение вызывает жжение, которое усиливается, однако повторное приводит к уменьшению боли и гипералгезии. В 6-недельном слепом параллельном исследовании, сопровождаемом 2-летним открытым последовательным испытанием, было показано, что при местном использовании крема с капсацином в концентрации 0,075% боль снижалась у 64% пациентов, тогда как при приеме плацебо – у 25% (таблица) (Watson et al., 1993).
 |
Исследователи рассмотрели несколько интервенционных методов терапии ПГН в случае резистентности к медикаментозному лечению. Ретроспективные испытания показали, что блокада симпатических узлов обеспечивает краткосрочное уменьшение боли у 40-50% пациентов с ПГН. Кроме того, межреберная нервная блокада обеспечивала длительное облегчение боли у лиц с грудной ПГН (Doi et al., 2002). Введение метилпреднизолона нейроаксиально интратекально оправдано у пациентов с тяжелой ПГН, поскольку представляет высокий риск неврологических осложнений. В клинической практике это вмешательство не рекомендуется (Kotani et al., 2000). Стимуляцию спинного мозга изучали проспективно в описании серии случаев 28 пациентов (Harke et al., 2002). Долгосрочное облегчение боли наблюдалось в 82% случаев. Стимуляцию спинного мозга у лиц с длительно сохраняющейся ПГН следует рассматривать при резистентности к обычному лечению. При применении криотерапии в случае лицевой боли при невралгии существенного эффекта не отмечено (Barnard, 1981). В других испытаниях наблюдалось краткосрочное действие метода у 11 из 14 пациентов, которые подверглись криотерапии межреберных нервов при грудной форме ПГН (Jones, 1987).
Результаты использования инъекций ботулинического токсина типа А представлены на собрании Американской академии лечения боли (2010). Было описано, что подкожная инъекция ботулинического токсина типа А уменьшала боль у лиц с ПГН по сравнению с инъекциями лидокаина и плацебо. Облегчение боли отмечалось через 1 неделю и сохранялось в течение 90 дней (Xiao, Hui, 2010).
Для лечения ПГН было описано и использовано множество хирургических вмешательств, однако ни один не рекомендуется применять в клинической практике.
Профилактика опоясывающего герпеса и ПГН
Очевидно, предотвращение ПГН связано с предупреждением опоясывающего лишая. Известно несколько способов предотвращения последнего:
- прививание детей вакциной против ветряной оспы, чтобы предотвратить первичную инфекцию (Marin et al., 2007);
- использование иммуноглобулинов Varicella zoster рекомендовано Консультативным комитетом по проблемам вакцинации (ACIP) у лиц с ослабленным иммунитетом, а также у серонегативных пациентов, которые недавно контактировали с больным ветрянкой или опоясывающим лишаем;
- назначение вакцины против опоясывающего лишая пациентам в возрасте старше 60 лет (Harpaz et al., 2008); FDA одобрило ее использование лицам в возрасте 50-59 лет, но ACIP не изменил свои рекомендации (Centers for Disease Control and Prevention, 2011).
На сегодняшний день есть возможность снизить заболеваемость опоясывающим лишаем и ПГН, так же как и более эффективно лечить постгерпетическую боль. Достижения последних лет включают разработку вакцины против опоясывающего лишая, а также консенсус о том, что противовирусная терапия и агрессивное лечение боли могут уменьшить тяжесть ПГН.
Помимо этого, важными являются идентификация эффективных методов лечения ПГН и признание ПГН в качестве модели для исследования нейропатической боли.
Подготовила Ярина Шутко
Читайте также:


