Анаферон и прививка от кори
В. П. Вавилова, А. М. Вавилов, А. Х. Черкаева
Кемеровская государственная медицинская академия, Кемерово, Российская Федерация
С целью оценки эффективности применения Анаферона детского для подготовки и проведения вакцинации против пневмококка детей с хроническими заболеваниями носоглотки было проведено проспективное рандомизированное сравнительное исследование (декабрь 2011 г.-апрель 2015 г.), в котором приняло участие 994 детей в возрасте 2-5 лет. В основной группе (507 детей) за 10 дней до начала вакцинации пневмококковой конъюгированной вакциной (ПВК13) начинался прием Анаферона детского (АнД, релиз-активный препарат с противовирусным и иммуномодулирующим действием) продолжительностью 40 дней. В группу сравнения были рандомизированы 487 детей, которым вакцинация ПВК1 3 проводилась без применения Анаферона детского. Эффективность применения Анаферона детского оценивали по изменению частоты развития острых респираторных инфекций (ОРИ), частоты развития осложнений ОРИ и частоты обострения хронических заболеваний ЛОР-органов. Дополнительно анализировалось общее содержание клеточных элементов и соотношение их субпопуляций, активность лизоцима и секреторного иммуноглобулина класса А (sIgA) в назальном секрете.
В период с 3 по 10 день исследования, в группе сравнения у 58 детей (1 1,9%) были зарегистрированы признаки ОРИ, что сделало невозможным проведение у них вакцинации. В группе детей, получавших АнД, в данный период случаев ОРИ зафиксировано не было, и вакцинация всем детям была проведена вовремя. В первый месяц после введения вакцины в основной группе заболело 15 детей (4,9%), а в группе сравнения - 37 детей (7,6%) (p = 0,001). В течение 1 2 месяцев в основной группе регистрировалась заболеваемость ОРИ на уровне 1686,4 на 1000 (855 эпизодов инфекции), против 2086,2 на 1000 (1016 случаев ОРИ), p = 0,02. В основной группе за период наблюдения в 3 раза большей была доля детей, у которых не было отмечено ни одного эпизода респираторной инфекции (p = 0,001), в 1,2 pаза меньшей - доля детей, болевших ОРИ повторно (p = 0,001), в частности, - в 1,6 раза меньшей - доля детей, перенесших по 2 эпизода ОРИ (p = 0,001). Так же за указанный период в основной группе по отношению к группе сравнения было зафиксировано на 25% меньше случаев развития осложнений ОРИ и обострений хронической ЛОР-патологии (острый отит, острый бронхит, пневмония, хронический гайморит), p = 0,061. Отмечено положительное влияние АнД на активность лизоцима, уровень sIgA, и состав клеточных элементов назального секрета (более быстрая нормализация показателей по сравнению с группой сравнения). Исследование продемонстрировало хорошую переносимость комбинированного применения АнД и ПВК1 3, безопасность их применения у детей с хроническими заболеваниями носоглотки и целесообразность применения Анаферона детского для подготовки и проведения вакцинации против пневмококковой инфекции.
Ключевые слова: вакцинация, Анаферон детский, пневмококковая конъюгированная вакцина, дети дошкольного возраста, хронические заболевания носоглотки, местный иммунитет
New Arguments in favor of the Release Active Antiviral Drug to Prepare Children for Vaccination
V P. Vavilova, A. M. Vavilov, A. H. Chercaeva
Kemerovo Medical Academy, Kemerovo, Russian Federation
Release-active drug with a dual mechanism of action used for pre-immunization against pneumococcal vaccination in children with chronic nasopharyngeal infection A prospective, randomized comparative study involving 994 children of 2 to 5 years of age was conducted (from December 2011 to April 2015) to assess the efficacy of Anaferon for Children for pre-immunization and an aid to pneumococcal vaccine treatment in children with chronic nasopharyngeal diseases. Patients in the test group (507 children) started to receive Anaferon for Children (AnC, release-active antiviral and immunomodulatory drug) 1 0 days prior to vaccination with a pneumococcal conjugate vaccine (PCV1 3) and continued the treatment for 40 days. 487 children were randomized into the comparator group receiving the PCV1 3 vaccine alone, without Anaferon for Children. The efficacy of Anaferon for Children was assessed by measuring the incidence of acute respiratory infections (ARI) and exacerbations of chronic ENT disease developed by study patients. In addition, total cell counts and subset ratios were obtained and activity of lysozyme and secretory immunoglobulin A was analyzed in nasal fluids.
Between days 3 to 10 of study, ARI signs were reported in 58 children (1 1.9%) in the comparator group, thus making vaccination impossible in these subjects. In AnC group, no ARI cases were observed within the same period and all the children received the vaccine as scheduled. During the first month post vaccination, 1 5 cases of illness were recorded (4.9%) in the group of test treatment and 37 (7.6%) (p = 0.001) in the comparator group. The incidence rates of ARI recorded in study patients for a period of 1 2 months was 1 686.4 per 1 000 (855 infection episodes) in the test group vs. 2086.2 per 1 000 (1016 ARI cases) in the comparator group (p = 0.02). Based on the data obtained over the follow-up period, patients in the test group demonstrated a 25% decrease in the incidence of ARI exacerbations or exacerbations of chronic ENT pathology (e.g., acute otitis, acute bronchitis, pneumonia, chronic maxillary sinusitis) as compared to the comparator group (p = 0.061); the percentage of children developing no respiratory infections was increased in this group by 3 times (p = 0.001) and the number of recurrent ARI episodes was reduced by 1.2 times (p = 0.001), including a decrease of 1.6 times in the number of children with two recurrent ARI episodes (p = 0.001). AnC was noted to have a beneficial effect on lysozyme activity, sIgA level and cell count distribution in nasal fluids (normalized more rapidly compared to the comparator group). The study showed good tolerability and safety of the combination of AnC and PCV1 3 vaccine for the children with chronic nasopharyngeal diseases and advisability of Anaferon for children application for preparation to immunization and vaccination against pneumococcal infection.
Keywords: vaccination, anaferon for kid, pneumococcal conjugate vaccine, preschool children, chronic nasopharyngeal diseases, local immunity
Постоянный рост заболеваемости ЛОР-органов у детей дошкольного и младшего школьного возраста стал характерной и весьма тревожной тенденцией. Данные эпидемиологических и статистических исследований последних лет свидетельствуют об увеличении числа хронических воспалительных заболеваний, обусловленных Streptococcus pneumoniae, играющего ведущую роль в возникновении основных форм пневмококковой инфекции (острых средних отитов, синуситов, гайморитов, бронхитов и пневмонии) [1,2]. Опыт мировой практики по иммунопрофилактике против пневмококковой инфекции показывает, что эта категория пациентов в первую очередь нуждается в вакцинации [3].
За последнее время достигнут прогресс в отношении специфической профилактики респираторных инфекций у данной категории больных. Доказано, что вакцинация с помощью пневмококковых конъюгированных вакцин является методом выбора для профилактики респираторной патологии у таких детей [4].
С клинической точки зрения вакцинация детей с различными заболеваниями носоглотки, составляющих наибольшую долю группы часто и длительно болеющих острыми респираторными вирусными инфекциями (ОРВИ) детей, в состоянии здоровья безопасна, однако напряженность иммунного ответа у них ниже, чем у практически здоровых детей. На фоне вакцинации происходит накопление провоспалительных цитокинов, что вызывает появление симптомов общих вакцинальных реакций (лихорадка, интоксикация). Одновременно с этим возможно формирование антител класса IgE к антигенам вакцины, что может приводить к развитию аллергических реакций при повторном применении вакцины [5]. На фоне применения вакцин происходит снижение выработки ИФН-α, обладающего противовирусной активностью, что наиболее выражено у часто болеющих детей. В поствакцинальном периоде у данной группы пациентов в течение длительного времени могут сохраняться транзиторные иммунодефицитные состояния. Именно поэтому для иммунизации детей с хронической респираторной патологией показано применение иммуномодулирующих препаратов с целью обеспечения формирования адекватного поствакцинального иммунитета. Кроме того, сочетанное применение методов специфической и неспецифической профилактики дает максимальный профилактический эффект по снижению заболеваемости частых ОРИ. При этом врачу необходимо сделать правильный выбор препарата с учетом не только нозологической формы заболевания, но и в некоторых случаях, исходных показателей иммунного статуса. При правильном подборе иммуномодулирующего препарата и схемы его введения можно получить быстрый и полноценный иммунный ответ на вакцинацию у данной группы пациентов.
В настоящее время накоплен определенный опыт по применению ряда иммуномодулирующих препаратов для подготовки к проведению специфической профилактики. Из них привлекают внимание препараты, обладающие двойным механизмом действия (противовирусным и иммуномодулирующим), к которым относится Анаферон детский.
Анаферон детский создан на основе антител к интерферону гамма (ИФН-γ), находящихся в препарате в релиз-активной форме. Благодаря прямому влиянию на конформацию молекул ИФН-γ и рецептора к ИФН-γ, Анаферон детский повышает их фукциональную активность. При этом, Анаферон действует на продукцию ИФН избирательно, в зависимости от того, есть ли вирус в организме. При профилактическом приеме препарат активирует лишь незначительные количества молекул ИФН-γ (производятся иммунокомпетентными клетками организма даже в здоровом состоянии), что вместе с влиянием на рецепцию обеспечивает высокую готовность организма к быстрому развитию защитных противовирусных реакций (активация макрофагов, естественных киллеров и т.д.). Действуя в начале и разгаре вирусной инфекции, Анаферон детский значительно повышает продукцию ИФН (не только ИФН-γ, но и ИФН-α/ß). При этом противовирусное и иммуномодулирующее действие препарата становятся заметным вследствие того, что намного большее количество активированных молекул ИФН-γ быстрее связывается с активированными рецепторами и успешнее реализует свои биологические функции. На этапе реконвалесценции, когда вирус (как непосредственный естественный индуктор ИФН-α/ß и опосредованно - ИФН-γ) уже элиминирован, продукция этих видов ИФН уменьшается до нормальных уровней. При этом, Анаферон детский не оказывает стимулирующее влияние на систему ИФН, но как было показано в целом ряде исследований, способствует сохранению на более высоком уровне способности клеток к продукции ИФН-γ и ИФН-α/ß, то есть, приводит к повышению функционального резерва и устойчивости организма к ре- и суперинфекциям. Такое физиологическое действие Анаферона детского не предполагает развитие гиперстимуляции и ее последствий, а также предотвращает формирование гипореактивности системы ИФН 7.
Анаферон детский широко используется в педиатрии и применяется как для лечения, так и для профилактики ОРВИ, гриппа, парагриппа, вирусов простого герпеса 1 и 2 типов, др. герпесвирусов (вызывающих ветряную оспу, инфекционный моно-нуклеоз). Кроме того, экспериментально и клинически установлена эффективность в отношении вируса клещевого энцефалита, энтеровирусов, аденовируса, РС-вируса, рото- и коронавируса. Особенно важным является возможность использования его у детей уже с первого месяца жизни. Отличительной особенностью препарата является отсутствие нежелательных побочных реакций и высокий профиль безопасности. Кроме того, препарат не вызывает привыкания, избыточной стимуляции и истощения иммунной системы при регулярном приёме. Безопасность Анаферона детского подтверждена при проведении его всестороннего доклинического и клинического изучения и мониторинга безопасности на протяжении более 1 3 лет [9].
Анаферон детский имеет обширную базу данных по исследованиям, проведенным по современным стандартам доказательной медицины (многоцентровые рандомизированные исследования с двойным слепым плацебо контролированием) в авторитетных и лицензированных исследовательских центрах, подтверждающих его эффективность и безопасность. Так, совместное применение Анаферона детского и вакцины от гриппа способствует увеличению процента детей, имеющих защитные титры антител против вакцинных штаммов. Известна эффективность его применения у пациентов с патологией почек, при вторичных иммунодефицитных состояниях, в лечении острых кишечных вирусных инфекций, а также у детей с сопутствующей патологией, ограничивающей возможность применения фармакотерапевтических способов профилактики ОРВИ данной категории пациентов. У детей с атопическими заболеваниями профилактическое применение Анаферона детского способствует снижению заболеваемости ОРИ в 2-2,5 раза, сокращается частота обострений аллергических заболеваний - атопического дерматита в 3,2 раза, бронхиальной астмы в 3,8 раза, аллергического ринита в 2 раза. Отмечены положительные изменения со стороны местного иммунитета: повышение уровня секреторного IgA в слюне, снижение обсемененности рото- и носоглотки патогенными вирусами, выявлено повышение уровня ИФН-γ в 2 раза. Доказано уменьшение количества ОРВИ в программах сопровождения противогриппозной вакцинации у детей с туберкулезной инфекцией, что способствует более гладкому течению поствакцинального периода, предупреждению развития осложнений и обеспечивает позитивное влияние на специфическое антителообразование. Имеются данные о целесообразности включения Анаферона детского в программу ведения часто болеющих детей с патологией лимфоглоточного кольца. В итоге, у данной категории пациентов в 2,5 раза снижается заболеваемость ОРИ [6, 1 0-1 6].
Учитывая вышеперечисленные факторы, Анаферон детский был выбран нами в качестве препарата для неспецифической профилактики ОРИ до и во время проведения вакцинации против пневмококковой инфекции у детей, имеющих хронические очаги инфекции в носоглотке.
Основной целью работы явилась оценка возможностей применения Анаферона детского для подготовки к проведению вакцинации против пневмококковой инфекции детей с хроническими заболеваниями носоглотки пневмококковой конъюгированной вакциной (ПКВ13). Дополнительно изучали влияние сочетанного применения Анаферона детского и ПКВ13 на частоту развития типичных бактериальных осложнений ОРИ и частоту обострения хронической ЛОР-патологии, а также на состояние системы местного иммунитета в носоглотке.
Материалы и методы исследования
В исследование вошли 994 пациента в возрасте от 2 до 5 лет, у которых в анамнезе в 100% случаев имелись хронические очаги инфекции в носоглотке. Исследуемые были рандомизировано распределены в основную группу (507 детей) и в группу сравнения (487 детей). В основной группе за 10 дней до начала вакцинации ПКВ13 начинался прием Анаферона детского продолжительностью 40 дней. В группе сравнения дети были вакцинированы ПКВ13 без применения Анаферона детского.
Критерии включения: возраст 2-5 лет; наличие хронических заболеваний носоглотки (аденоидит, фарингит, тонзиллит, рецидивирующий средний отит); рецидивирующие острые респираторные инфекции (более 5 раз в год); добровольное письменное информированное согласие родителей на проведение вакцинации, прием Анаферона детского и участие в исследовании.
Критерий невключения: наличие признаков острых и/или обострения хронических заболеваний на момент включение в исследование (кроме заболеваний, отраженных в критериях включения); прием иммунотропных и противовирусных препаратов в последние 4 недели до начала исследования.
Для изучения параметров местного иммунитета была сформирована 3-я группа (п = 50) практически здоровых детей (эпизодически болеющие дети, посещающие детские дошкольные образовательные учреждения, не имеющие в анамнезе хронической патологии в носоглотке и болеющие ОРВИ Вакцинацию осуществляли по рекомендованным схемам с учетом возраста ребенка, с учетом противопоказаний на момент начала иммунизации и получения информированного согласия родителей. Контроль состояния привитого ребенка осуществлялся в течение 3-4 сут. после иммунизации.
В случае развития ОРИ, детям из обеих групп назначалась стандартная симптоматическая и патогенетическая терапия, к которой по показаниям добавлялась антибиотикотерапия. Кроме того, дети основной группы получали лечебную дозу анаферона детского по следующей схеме:
в первые сутки лечения - по 1 таблетке 8 раз в день (первые 2 часа через каждые 30 минут - 5 приемов, затем - по 1 таблетке 3 раза через равные промежутки времени до наступления ночного сна);
со вторых суток и далее по 1 таблетке 3 раза в день на весь острый период до выздоровления.
Лечебные курсы назначались при каждом ОРИ, развивавшемся в период проведения исследования. На протяжении первых 40 дней исследования дети основной группы по окончанию лечения с применением лечебных доз исследуемого препарата вновь переводились на профилактический режим приема. Начиная с 41 дня исследования дети из обеих групп не получали противовирусных и/или иммуномодулирующих препаратов для профилактики; в случае развития ОРИ применялись симптоматические и патогенетические препараты, а дети основной группы для лечения каждой ОРИ в составе комплексной терапии получали лечебный курс Анаферона детского.
Эффективность Анаферона детского для подготовки к проведению специфической профилактики против пневмококка оценивали по доле детей, заболевших к моменту начала вакцинации (в течение первых 10 дней до вакцинации) и в течение первого месяца после. Безопасность препарата оценивалась по частоте случаев нежелательных реакций и побочных эффектов. Учитывая, что наиболее распространенными формами пневмококковой инфекции являются острый бронхит, острый средний отит, гайморит и неинвазивная пневмония, клинико-эпидемиологическую эффективность комбинированного применения Анаферона детского и ПКВ13 мы оценивали путем сравнения числа эпизодов названных заболеваний, развившихся за предыдущий год и за период 12 месяцев после проведенной вакцинации. По данным результатов анализа медицинской документации (медицинская карта, форма №112/у) выявлялись случаи развития, продолжительность заболевания, выраженность клинических симптомов.
Таблица 1. Общая характеристика детей, включенных в исследование
К сожалению, люди часто забывают, что именно благодаря вакцинации человечество смогло защититься само и защитить животных от многих инфекций и вирусов, которые раньше просто убивали. В историческом масштабе все это случилось не так уж давно, но спустя 200 лет люди ставят под сомнение одно из важнейших научно-практических достижений человечества, позволившее почти вдвое увеличить продолжительность жизни.
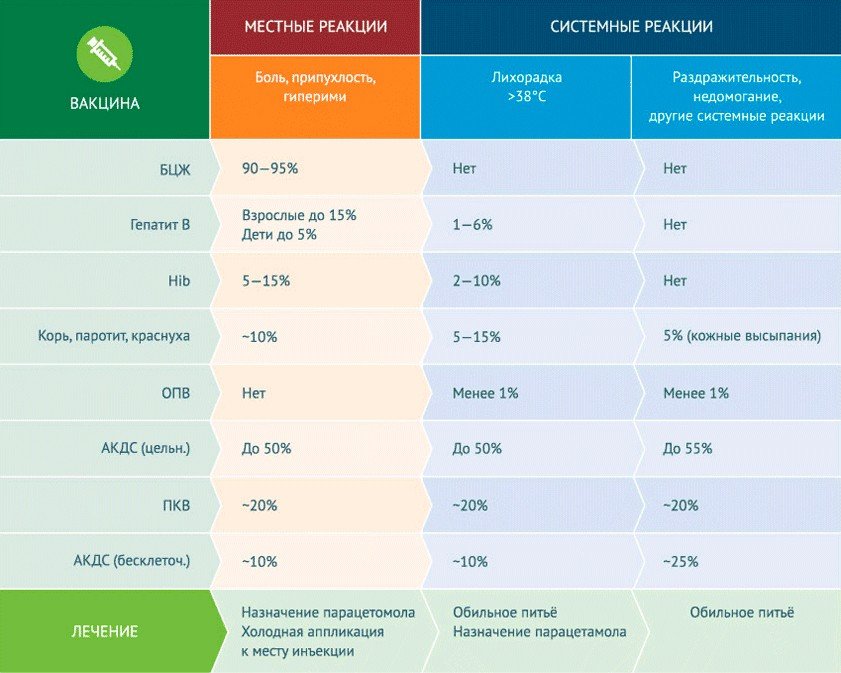
Сегодня детям в первые годы жизни ставят прививки от бактериальных инфекций (туберкулеза, пневмококковой и гемофильной инфекции, АКДС – коклюша, дифтерии, столбняка), от вирусных инфекций (гепатита B, полиомиелита, кори, паротита, краснухи). Это живые или инактивированные вакцины? Как вы относитесь к комплексным вакцинам?
Государство финансирует не самые дорогие варианты вакцин: как правило, из одной ампулы прививают от четырех до десяти детей. Все процедуры проводятся в перчатках, исключительно одноразовыми шприцами, поэтому это не приводит к микробному загрязнению вакцины. Более того, медсестра обязана показать, как она берет упаковку со шприцем, вскрывает ее, наполняет шприц и проводит вакцинацию. Дело в том, что главный фактор риска при вакцинации – это сам момент введения. Надо надежно дезинфицировать место укола, а затем провести все процедуры так, чтобы и шприц не стал причиной инфекции. После укола место введения тоже нужно дезинфицировать и держать ватку на месте инъекции минут пять после укола – пока не свернется кровь.

Вектор развития на сегодня таков, что специалисты стараются делать комплексные сочетанные вакцины, потому что с уменьшением числа инъекций уменьшается и количество возможных побочных реакций организма. При этом должно быть экспериментально доказано, что компоненты этих вакцин друг другу не мешают. Сейчас есть даже пентавакцины, когда одним шприцом вводят сразу пять вакцин (против коклюша, дифтерии, столбняка, полиомиелита и инфекции, вызываемой гемофильной бактерией – считаю этот тренд очень положительным.
И я бы не ставил вопрос о том, какая вакцина лучше, живая или инактивированная. Для некоторых возбудителей просто невозможно получить живую вакцину – не удается сделать ослабленный штамм с хорошими иммуногенными параметрами.
Все бактериальные вакцины из рекомендуемого списка – инактивированные, кроме вакцины против туберкулеза. Вакцины от полиомиелита существуют в двух вариантах: живая, которую закапывают в рот, и инактивированная, которую вводят с помощью инъекции (делать это нужно 2-3 раза). В США сейчас в основном перешли на инактивированную вакцину против полиомиелита, потому что там уже больше десяти лет не циркулируют природные штаммы вируса. Ведь когда человеку закапывают живую вакцину, то содержащийся в ней вирус частично выходит с фекалиями, и до шести месяцев этот вирус может циркулировать во внешней среде. Когда мы полностью искореним вирус полиомиелита из человеческой популяции, то весь мир перейдет на инактивированную вакцину. Но живую вакцину все равно нужно будет сохранить на всякий случай, так как существуют родственные полиомиелиту штаммы энтеровирусов человека и животных, которые могут у человека вызвать полиомиелитоподобные заболевания.
Единственная долговременно применяемая вакцина, в эффективности которой есть сомнения, – это живая вакцина против туберкулеза. Дело в том, что вакцинный штамм микобактерии туберкулеза был изначально получен еще в начале XX в., и за прошедшую сотню лет заметно изменился. Это не означает, что он стал опасным для человека, но есть данные, что его вакцинные свойства заметно снизились.
Какие осложнения бывают после прививок, и после каких чаще? Существует ли по этому вопросу достоверная статистическая информация?
Поствакцинальные осложнения – это длительные изменения в организме после введения прививки, повлекшие за собой нарушение здоровья. К счастью, они весьма редки. В России официальный учет и контроль осложнений в результате вакцинации осуществляется с 1998 г., и сейчас эти данные можно найти в открытом доступе. Например, есть сайт япривит.рф, который курируют несколько организаций, в том числе Минздрав РФ, где много доступной объективной информации.
Если внимательно изучить статистику, то становится очевидным, что риск осложнений после вакцинации в тысячи раз меньше, чем риск осложнений после перенесенных заболеваний, и любая прививка во многие сотни раз безопаснее заболевания, от которого она защищает.

Чаще всего появление поствакцинальных осложнений связано с индивидуальными нарушениями иммунной системы. Так, частота вакцин-ассоциированного полиомиелита у детей первого года жизни с первичным иммунодефицитом более чем в 2 тыс. раз превышает таковую у детей со здоровой иммунной системой. Но, повторюсь, если ребенок с иммунодефицитом встретится с неослабленным вирусом, то он получит тяжелое заболевание с гораздо более серьезными осложнениями и даже угрозой для жизни.
Можно понять, но не оправдать и тех родителей, которые отказываются от вакцинации, потому что хотят оградить ребенка от опасности. И я прекрасно понимаю, почему на многих так повлияла публикация Э. Уэйкфилда, которая во многом и породила феномен антивакцинаторства (кстати, существуют и ВИЧ-диссиденты, которые отрицают существование этого заболевания). Уэйкфилд провел всего одно исследование о связи прививки против кори с развитием аутизма, которое было опубликовано в 1998 г. в уважаемом медицинском журнале TheLancet. И если в 1997 г. в Англии и Уэльсе были привиты против кори, краснухи и паротита 91,5% двухлетних детей (соответственно, на следующий год было зарегистрировано всего лишь 56 лабораторно подтвержденных случаев кори), то после выхода статьи Уэйкфилда родители начали массово отказываться от вакцинации. В результате в 2008 г. корью заболело уже 1370 детей.
На публикацию Уэйкфилда обратило самое серьезное внимание британское медицинское сообщество. Ряд лабораторий несколько лет безуспешно старались обнаружить схожие взаимосвязи в других группах детей. После чего группа специалистов, полтора года проверяя первичные данные и методику исследования Уэйкфилда, доказала, что исследование было проведено некорректно, а полученные им результаты не воспроизводятся. Выяснилось, что Уэйкфилд работал с больными детьми, с инвалидами, имеющими генетические нарушения и дефекты психики, которых к тому же опрашивали в отсутствие родителей и медперсонала. Журнал исключил эту статью из публикаций (она есть в интернете, но перечеркнута красным RETRACTE), а Главный медицинский совет Великобритании лишил Уэйкфилда права заниматься медицинской практикой. Так что в самой Великобритании эта история закончилась, а само имя Уэйкфилда ассоциируется лишь с обманом.
Особенно мне не понятен аргумент родителей, что организм должен сам бороться с болезнями. Во времена, когда вакцин не существовало, очень много детей умирало от обычных детских инфекций, например, от той же кори. Можно почитать хотя бы про детей Льва Толстого и Федора Достоевского: сколько их родилось, и сколько дожило до 10 лет. Сегодня нормальные родители вряд ли спокойно отнесутся к смерти в раннем детстве половины своих детей.
Так как же родителям принимать решение о вакцинации?
К вопросу вакцинации ребенка нужно подходить серьезно, решение должно быть обдуманным и взвешенным, в том числе в отношении выбора времени и типа вакцины. Нужно исходить из индивидуальных особенностей организма, учитывать противопоказания, возможные аллергические реакции. Не следует перегружать ребенка физическими и эмоциональными нагрузками перед и сразу после вакцинации, и ни в коем случае не прививать ребенка во время болезни или сразу после выздоровления: нужно подождать 1—2 недели, а не бежать сломя голову ставить прививку по расписанию. За процедурой вакцинации нужно наблюдать, следить, чтобы строго соблюдались правила асептики.
Поэтому на вопрос, стоит ли отказываться от каких-то прививок, отвечу так: если нет серьезных противопоказаний, я бы не стал этого делать. Даже если у ребенка слабый иммунитет, для него гораздо опаснее встреча с настоящей болезнью, чем с вакциной против нее.
ГРИПП И ВАКЦИНАЦИЯ Если с детскими болезнями организм не всегда может справиться самостоятельно, то с гриппом он борется вполне успешно. Нужно ли в таком случае прививаться от гриппа?
Динамика процессов, происходящих в организме при гриппе, была отслежена в исследовании 1972 г. на шести добровольцах, зараженных этим вирусом. Оказалось, что концентрация вируса максимальна на 1—5 дни болезни. Концентрации антител-иммуноглобулинов класса М (IgM), обеспечивающих первичный иммунный ответ, начинают расти через неделю после начала заболевания, когда самого вируса уже нет. И только на 14 день появляются антитела-иммуноглобулины класса G (IgG), обеспечивающие долговременную защиту (Fields Virology… 2013).
То есть организм, конечно, может бороться с вирусом самостоятельно, но вы или ваш ребенок потеряете как минимум пять дней здоровой жизни. У пожилых людей высок риск осложнений после гриппа, особенно в случае сердечных заболеваний: смертность после гриппа у людей, перенесших инфаркт миокарда, повышается в десять раз. Согласно статистическим данным, в США через 1—2 месяца после заболевания гриппом умирает ежегодно до 35 тыс. пожилых людей. Поэтому этой группе населения настоятельно рекомендуют вакцинироваться (в США эта процедура платная).
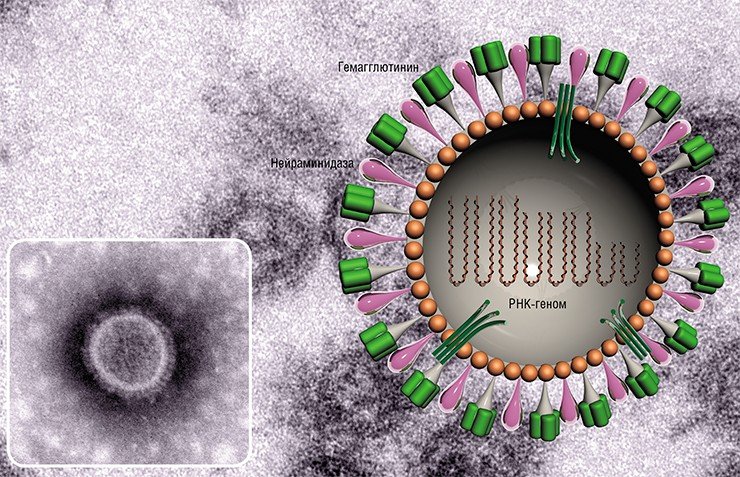
Прививка от гриппа не входит в Национальный календарь прививок для всех взрослых. Она обязательна только для определенных групп населения, поэтому в этом вопросе у человека больше свободы выбора. Отмечу, что процент привитых от гриппа в России больше, чем в Китае и Европе, и это дает определенный эффект. Так, в 2016 г. в России гриппом болели меньше, чем в мире, хотя такая картина наблюдается не всегда.
Композиции вакцин против гриппа составляют в зависимости от того, какие штаммы преобладали в эпидемии предыдущего года. Создавая вакцину для России, ученые и специалисты учитывают, что циркуляция тех или иных типов и субтипов вируса, и их соотношение в разных странах различаются.
Время анализа любым из методов составляет несколько часов. Правда, его цена будет в 5—10 выше, чем вакцины в медицинском центре, причем пробу надо брать на 2-5 день болезни, что не всегда возможно. А главное, в точной диагностике этого заболевания нет особого смысла: принцип лечения любого типа гриппа одинаков, и начинать его надо как можно раньше.
Кагоцел в инструкции по применению описан как индуктор интерферона. Такие препараты известны давно. Реклама советует применять таблетки Кагоцел при различных простудных заболеваниях и, более того, советует принимать их постоянно. Но известно, что применять препараты с интерфероном лучше не более недели (за исключением случаев вирусных гепатитов и некоторых форм рака). А индукторы интерферона при гриппе вряд ли стоит применять, потому что свой, эндогенный (выработанный самим организмом в ответ на вирусную инфекцию) интерферон в организме больного достигает максимума на 3 день после инфекции. Выше этого уровня его индукторами вряд ли можно поднять.
Я советую для лечения и экстренной профилактики:
– Oseltamivir (Тамифлю-Tamiflu) или Zanamivir (Реленца–Relenza) – ингибиторы вирусного фермента нейраминидазы;
– Препараты на основе мазевой интраназальной формы рекомбинантного интерферона человека – ингибиторы процесса образования вирусных РНК и белков;
– Ремантадин – ингибитор ионных каналов, образованных вирусным белком М2. Он применяется еще с начала 1980-х гг., поэтому, к сожалению, сегодня свыше 80% штаммов гриппа к нему устойчивы.
И надо помнить, что, несмотря на вакцинацию и помощь лекарственных препаратов, которые вы будете принимать при заражении гриппом, человеческий организм не приобретает пожизненный иммунитет к этому заболеванию. Вирус гриппа постоянно меняется, и предсказать его эволюцию со стопроцентной точностью почти невозможно. Многое можно предугадать, но любой биоинформатик предложит вам несколько вариантов эволюции вируса – однозначного ответа не будет. Поэтому единственное, что пока остается человечеству для защиты от гриппа, – это вакцинация и профилактика в разгар эпидемии
Читайте также:


