Рахманина надежда алексеевна коронавирус







480 руб. | 150 грн. | 7,5 долл. ', MOUSEOFF, FGCOLOR, '#FFFFCC',BGCOLOR, '#393939');" onMouseOut="return nd();"> Диссертация, - 480 руб., доставка 1-3 часа, с 10-19 (Московское время), кроме воскресенья
Автореферат - бесплатно , доставка 10 минут , круглосуточно, без выходных и праздников
Рахманина Надежда Алексеевна. Клинико-эпизоотологические особенности и диагностика инфекционного перитонита кошек : диссертация. кандидата ветеринарных наук : 16.00.03 Москва, 2007 212 с. РГБ ОД, 61:07-16/127
Введение к работе
До недавнего времени в нашей стране не существовало лабораторных методов выявления инфекционного перитонита кошек и диагноз ставили на основании характерных клинических и патологоанатомических признаков, описанных в иностранной литературе Выявление вирусоносительства и латентного течения инфекции в связи с этим было невозможным.
Наибольшую угрозу инфекционный периюнит представляет для питомников со скученным содержанием животных, распространенность инфекции повышав гея из года в год (Сулимов А А , 2004 і )
Цели и задачи исследования. Целью настоящих исследований явилось изучение особенностей клинического проявления инфекционного перитонита кошек, выделение изолятов вируса инфекционного перитонита кошек, изучение некоторых их биологических свойств, освоение методов диагностики болезни, проведение анализа полученных эпизоотических данных
Цель работы определяла основные задачи исследований
Выделить изоляты вируса инфекционного перитонита кошек, изучить их биологические свойства Депонировать штамм вируса для получения диагностических сывороток.
Изучить изменение уровня антител у кошек на разных стадиях болезни и определить диагностический титр в РИГА
Изучить возможность использования МФА для обнаружения вируса инфекционного перитонита кошек в клиническом материале от больных кошек и секционном — от павших
4 Изучить возможность использования йодно-агглютинационного теста
(ИАТ) и теста Ривалта как экспресс-методов диагностики ИПК
5 Изучить особенности клинического проявления и патанатомических изме
нений при ИПК Изучить заболеваемость инфекционным перитонитом кошек
разных пород и возраста, проанализировать сезонность при этой инфекции.
Определен оптимальный способ конъюгации эритроцитов вирусом ИПК Оптимизированы условия постановки и учета результатов РИГА и МФА, предложенных для прижизненной и посмертной диагностики инфекционного перитонита кошек Для экспресс-диагностики болезни рекомендовано использование неспецифических, но достоверных методов йодно-агглютинационного теста и проба Ривалта
Практическая значимость. Практическая ценность работы определяется введением в лабораторную практику методов диагностики инфекционного перитонита кошек РНГА и МФА Практикующим ветврачам рекомендовано использование теста йодной агглютинации и пробы Ривалта для диагностики ИПК уже при клиническом обследовании подозрительных по заболеванию животных
Основные положения диссертационной работы, выносимые на защиту.
Результаты изучения биологических свойств вируса инфекционного перитонита кошек его патогенные, антигенные и культуральные свойства
Применение методов РИГА, МФА, ЙАТ и пробы Ривалта для диагностики инфекционного перитонита кошек
Результаты изучения клинических и эпизоотологических особенностей инфекционного перитонита кошек
Структура и объем диссертации. Диссертация изложена на Л IJL листах машинописного текста и содержит разделы - введение, обзор литературы, материалы и методы, результаты собственных исследований, обсуждение, выводы, список литературы, практические предложения и приложения Работа иллюстрирована 22 таблицами, 8 рисунками, 24 фотографиями Список лигературы включает 253 источника, в том числе 232 - зарубежных авторов


Автореферат диссертации по ветеринарии на тему Клинико-эпизоотологические особенности и диагностика инфекционного перитонита кошек
На правах рукописи
РАХМАНИНА Надежда Алексеевна
КЛИНИКО-ЭПИЗООТОЛОГИЧЕСКИЕ ОСОБЕННОСТИ И ДИАГНОСТИКА ИНФЕКЦИОННОГО ПЕРИТОНИТА КОШЕК
16.00.03- ветеринарная микробиология, вирусология, эпизоотология, микология с микотоксикологией и иммунология
АВТОРЕФЕРАТ диссертация на соискание ученой степени кандидата ветеринарных наук
Научный руководитель — доктор ветеринарных наук, профессор, Заслуженный деятель науки РФ Уласов Валентин Ильич
ГНУ Всероссийский НИИ охотничьего хозяйства и звероводства им. проф. Б М. Житкова РАСХН (ВНИИОЗ, I .Киров)
Московская обл , п Биокомбината)
Ученый секретарь диссертационного с кандидат ветеринарных наук, доцент заслуженный ветеринарный врач РФ
1 ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ.
До недавнего времени в нашей стране не существовало лабораторных методов выявления инфекционного перитонита кошек и диагноз ставили на основании характерных клинических и патологоанатомических признаков, описанных в иностранной литературе Выявление вирусоносительства и латентного течения инфекции в связи с этим было невозможным.
Наибольшую угрозу инфекционный периюнит представляет для питомников со скученным содержанием животных, распространенность инфекции повышается из года в год (Сулимов А А , 2004 I )
Цели и задачи исследования. Целью настоящих исследований явилось изучение особенностей клинического проявления инфекционного перитонита кошек, выделение изолятов вируса инфекционного перитонита кошек, изучение некоторых их биологических свойств, освоение методов диагностики болезни, проведение анализа полученных эпизоотических данных Цель работы определяла основные задачи исследований
1 Выделить изоляты вируса инфекционного перитонита кошек, изучить их биологические свойства Депонировать штамм вируса для получения диагностических сывороток.
2 Изучить изменение уровня антител у кошек на разных стадиях болезни и определить диагностический титр в РИГА
3 Изучить возможность использования МФА для обнаружения вируса инфекционного перитонита кошек в клиническом материале от больных кошек и секционном — от павших
4 Изучить возможность использования йодно-агглютинационного теста (ЙАТ) и тсста Ривалта как экспресс-методов диагностики ИПК
5 Изучить особенности клинического проявления и патанатомических изменений при ИПК Изучить заболеваемость инфекционным перитонитом кошек разных пород и возраста, проанализировать сезонность при этой инфекции.
Определен оптимальный способ конъюгации эритроцитов вирусом ИПК Оптимизированы условия постановки и учета результатов РИГА и МФА, предложенных для прижизненной и посмертной диагностики инфекционного перитонита кошек Для экспресс-диагностики болезни рекомендовано использование неспецифических, но достоверных методов йодно-агглютинационного теста и проба Ривалта
Практическая значимость. Практическая ценность работы определяется введением в лабораторную практику методов диагностики инфекционного перитонита кошек РНГА и МФА Практикующим ветврачам рекомендовано использование теста йодной агглютинации и пробы Ривалта для диагностики ИПК уже при клиническом обследовании подозрительных по заболеванию животных
Основные положения диссертационной работы, выносимые на защиту.
- Результаты изучения биологических свойств вируса инфекционного перитонита кошек его патогенные, антигенные и культуральные свойства
- Применение методов РИГА, МФА, ЙАТ и пробы Ривалта для диагностики инфекционного перитонита кошек
- Результаты изучения клинических и эпизоотологических особенностей инфекционного перитонита кошек
Структура и объем диссертации. Диссертация изложена на ^ листах машинописного текста и содержит разделы- введение, обзор литературы, материалы и методы, результаты собственных исследований, обсуждение, выводы, список литературы, практические предложения и приложения Работа иллюстрирована 22 таблицами, 8 рисунками, 24 фотографиями Список литературы включает 253 источника, в том числе 232 - зарубежных авторов
2 СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ 2.1.Материалы и методы.
Животные. Для выделения изолятов вируса использовали асцитные жидкости и селезенки 14 котят 3-12 мес возраста, подозрительных по заболеванию ИПК Для постановки биопробы - 16 беспородных котят 2-6 месячного возраста В опыте по применению различных методов диагностики ИПК на разных сроках после инфицирования использовались 12 беспородных интакт-ных котенка 2-х месячного возраста Для определения чувствительности к возбудителю болезни и изучения антигенных свойств изолятов вируса ИПК были использованы 20 кроликов породы шиншилла массой 2,5- 3 кг, 20 морских свинок массой 250-300 г и 80 белых мышей массой 14-16г Получение гипериммунных сывороток к вирусу инфекционного перитонита кошек проводили на 30 кроликах массой 2,5-3 кг
Клинический и секционный материал от 812 подозрительных по заболеванию кошек и 3-х манулов был исследован методами РИГА, МФА, ЙАТ и пробой Ривалта Результаты исследований легли в основу анализа клинико-эпизоотологических особенностей инфекционного перитонита
Для идентификации изолятов коронавируса кошек была использована специфическая гипериммунная сыворотка, полученная от доктора J Chappius (Франция)
Культуры клеток. При поиске чувствительных тест-систем для репродукции вируса и определения его инфекционности использовали первичные и субкультуры клеток почек котенка и перевиваемые культуры клеток CrFK и FS, полученные из музея клеточных культур нашего Центра
Питательные среды и растворы. В качестве ростовых сред для первичных и субкультур клеток применяли общепринятые в вирусологии питательные среды в соотношениях, оптимальных для каждой из них
Для выделения изолятов вируса инфекционного перитонита кошек
использовали асцитнуго жидкость от 14 спонтанно заболевших котят и 12 селезенок от этих животных, которые пали или были эвтаназированы
Принадлежность изолятов к коронавирусу кошек подтверждали путем электронно-микроскопических исследований, постановкой биопробы на котятах, а также исследованиями в РИГА с использованием специфической сыворотки к инфекционному перитониту кошек (Франция)
Подготовка клинического и патматериала к исследованиям селезенки от подозрительных по заболеванию животных гомогенизировали, разводили раствором Хенкса в соотношении 1 10 и осветляли центрифугированием при 1500 об/мин в течение 15 минут Супернатант подвергали микрофильтрации с использованием фильтров Миллипор (0 0,45 и 0,22 мкм)
Морфологические свойства изолятов вируса ИПК изучали путем электронной микроскопии, проведенной совместно с с н с Лотте В.Д (Институт вирусных препаратов им О Г Анджапаридзе АМН РФ)
Препараты для просмотра в электронном микроскопе готовили из осадка, полученного при ультрацентрифугировании (при 40000 об /мин в течение 2 часов) микрофильтрата селезенки, ресуспендированного в фосфатном буфере (рН 7,0) В качестве контрастирующего вещества применяли 2% водный раствор фосфорновольфрамовой кислоты (рН 6,0-7,0)
Для постановки биопробы формировали 4 группы по 4 котенка 2-6 месячного возраста Двум котятам из каждой группы вводили внутрибрюшинно, и двум - орально по одному из 3-х изолятов вируса в объеме 3,0 см3. Одна группа котят служила контрольной- животным теми же способами инъецировали микрофильтрат гомогената селезенки здорового котенка За клиническим состоянием животных наблюдали 8 недель
При изучении патогенных и антигенных свойств вируса ИПК на лабораторных животных его тканевые изоляты активностью 5,0 ^ ИД 50/см3 вводили кроликам, морским свинкам и белым мышам внутрибрюшинно
или подкожно в объемах 2,0, 1,0 и 0,5см3 соответственно Еженедельно получаемые сыворотки крови исследовали в РНГА, мазки-отпечатки крови и фекалий -МФА
Изучение культуральных свойств вируса. Первично - трипсинизиро-ванные культуры клеток и перевиваемые клеточные линии готовили и поддерживали в лаборатории
Использовали стационарный метод культивирования и заражение моно-слойных культур клеток, выращенных на покровных стеклах, помещенных в пенициллиновые флаконы Посадочная концентрация первично - трипсинизи-рованных культур клеток - 250±100 тыс кл/см3, а перевиваемых - 150+50 тыс кл /см3 Результаты накопления вируса оценивали, используя МФА Для этого покровные стекла с монослоем клеток извлекали из пенициллиновых флаконов на разных сроках после инфицирования, фиксировали монослой ацетоном, окрашивали его полученной нами люминесцентной сывороткой в течение 30 мин при температуре 37°С, отмывали от красителя ФСБ рН 7,2 и просматривали в люминесцентном микроскопе Контролем служили аналогичные препараты с незараженным монослоем клеток
Гипериммунизация кроликов выполнялась по двум схемам При первой - тканевой очищенный микрофильтрацией вирус ИПК (5,0 ^ ИД 50/см3) вводили животным четырехкратно еженедельно внутримышечно в объеме 1,0см3, а затем, однократно в той же дозе внутривенно Во втором варианте вирус инъецировали в объеме 1,0 см3 с таким же количеством неполного адъюванта Фрейнда в область подколенных лимфоузлов, а через 2 месяца -без адъюванта внутривенно в объеме 0,25см3 Всех кроликов тотально обескровливали через 2 недели после заключительной инъекции антигена Полученные сыворотки исследовали на стерильность, специфичность, активность (РНГА) и отсутствие неспецифических реакций с вирусами ПЖ, ИРТ, КВК
Изготовление набора для диагностики инфекционного перитонита кошек в РНГА. Формалинизацию и танизацию эритроцитов барана проводили по стандартной методике Экспериментально подбирали оптимальные ус-
ловия для сенсибилизации эритроцитов К их суспензиям 2, 5, 10% концентрации добавляли антиген (5,0 ^ ИД 50/см3) в соотношении 1 5 Смесь инкубировали 30 минут в термостате при температурных режимах 37°С и 22°С, после чего трижды отмывали ФБР с рН 7,2 Титр антител в сыворотках крови определяли по их максимальному разведению, вызывавшему торможение ге-магглютинации
Тест йодной агглютинации (ЙАТ). На чистое, обезжиренное спирт-эфиром предметное стекло наносили каплю сыворотки или экссудата и добавляли каплю йодного реактива Сразу после перемешивания компонентов проводили учет результатов реакции При положительном - в капле образуются темно-коричневые хлопья, а при отрицательном - капля остается прозрачной (без хлопьев и осадка) и имеет цвет йодного реактива Сомнительными считали пробы с выпадением мелкокрошковатого осадка
Тест Ривалт а. Для выполнения теста использовали 2,0% раствор уксусной кислоты, в пробирку с которой вносили каплю исследуемого экссудата Отрицательная проба характеризовалась растворением капли При положительном тесте капля экссудата сохраняет очертания и некоторое время может держаться вверху пробирки или медленно опускаться вниз в форме медузы, оставляя за собой линейный след
Статистическая обработка результатов исследований.
При анализе и обобщении результатов исследований использовали методы статистической обработки, общепринятые в биологии Вычисление среднегеометрических показателей титров антител и антигенов (х), стандартные отклонения (т) этих показателей производили с использованием компьютерной программы Excel В качестве доверительного интервала был выбран уровень вероятности Р= 0,95 (уровень значимости р-0,05)
2.2. Результаты собственных исследований
Выделение и идентификация изолятов инфекционного перитонита кошек. Из 26 образцов асцитной жидкости и гомогенатов селезенок, полученных от больных и павших кошек с подозрением на заболевание ИПК, в результате электронной микроскопии в трех были обнаружены вирусные частицы диаметром приблизительно 100 нм , морфологически сходные с коронави-русом Эти изоляты вируса были обозначены, как №№ 1, 2 и 3 и использованы в дальнейших исследованиях
Постановка биопробы с использованием трех изолятов вируса ИПК показала, что их внутрибрюшинное введение всегда вызывало развитие клинических проявлений болезни увеличение объема живота, угнетение, дегидратацию, ремитирующую лихорадку (до 40,5°С) У одного животного наблюдали симптомы поражения нервной системы ригидность конечностей, опи-стотонус, гиперестезию Наименьший инкубационный период (14-28 суток) и падеж в ранние сроки (22 - 31-е сутки) отмечен у котят, зараженных изолятом вируса №3. При пероралыюм введении изолятов вируса №1 и №2 в течение 8 недель (срок наблюдения) не выявили каких - либо клинических признаков болезни У одного котенка, зараженного тем же способом изолятом вируса №3, отмечали угнетение, истощение, лихорадку У всех павших или эвтанази-рованных по окончании опыта котят, обнаружены типичные для ИПК патана-томические изменения органов разной степени выраженности Котята кон-
трольной группы остались клинически здоровыми, после их эвтаназии патологических изменений внутренних органов не выявлено
Приготовление эрнтроцитарного диагностикума. Изолят вируса № 3 был использован нами для конъюгации эритроцитов, проведенной с суспензиями эритроцитов 2-10% концентраций, при разных температурных режимах и экспозициях Установлено, что оптимальные условия конъюгирования эритроцитов антигеном вируса ИПК следующие смешивание 5%-ной суспензии танизированных эритроцитов с микрофильтратом тканевого вируса ИПК в соотношении 1 5, инкубировние смеси в течение 30 минут в термостате при температуре 37°С
Контроль приготовленного диагностикума проводили на отсутствие самоагглютинации Его специфичность подтверждали с полученной из Франции стандартной сывороткой, титр с которой в РНГА составил 1 512 РНГА с сыворотками, содержащими антитела к вирусам ПЛК, КВК и ИРТ показали отрицательный результат
Для изучения паюгенности и антигенности изолятов вируса ИПК для лабораторных животных их вводили интактным кроликам, морским свинкам и белым мышам внутрибрюшинно или подкожно Тем же видам животных контрольной группы инъецировали микрофильтрат гомогената селезенки здорового котенка
Результаты опыта показали, что однократное введение вируса ИПК не вызывало каких-либо клинических признаков болезни у этих животных При исследовании мазков крови и фекалий МФА вирусовыделения у них не обнаружено Как подкожное, так и внутрибрюшипное введение изолятов вируса вызвало накопление антител, которое было максимальным на 21 сутки и составило, в частности, при инъекции изолята № 3 у кроликов - 6,9 log2 (РНГА), у морских свинок - 6,6 log2 и белых мышей - 6,3 log2
Таким образом, установлено, что изолят №3 вируса инфекционного перитонита кошек обладал наибольшей патогенностью для котят и антигенно-стью для лабораторных животных Этот изолят был типирован в лаборатории
При изучении условий хранения, обеспечивающих стабильность инфек-ционности вируса установлено, что при температуре минус 70°С, снижение его титра за каждый год хранения составляло в лиофилизированных образцах приблизительно 1,0 ^ ИД 5 О/см , в замороженных -1,0-1,5 ^ ИД 50/см3. При температурном режиме минус 19°С инфекционная активность вируса снижалась на 1,5-2 ,0 ИД 50/см3 ежегодно
Для получения гипсриммунпых сывороток использовали тканевой, очищенный микрофильтрацией штамм вируса ИПК Багира активностью 5,0 % ИД 50/см3 , который вводили двум группам по 15 интактных кроликов по двум выше описанным схемам
Более высокую - 7,0 -10,0 активность в РНГА показали сыворотки крови, полученные от кроликов, иммунизированных способом с использованием эффекта "иммунной памяти" Полученные сыворотки прошли контроль стерильности и отсутствия неспецифической активности с антигенами вирусов ПЛК, ИРТ и КВК и были использованы при постановке РНГА как позитивные контрольные, а так же для изготовления диапюстикума МФА Установлено чго, хранение специфических сывороток в лиофилизированном состоянии при температуре от 4°С до -19°С и в замороженном при -19°С в течение 2 лет снижает их титр не более, чем на 2,0 1о§2 (РНГА)
Диагностика инфекционного перитонита кошек в РНГА. При исследовании в РНГА проб сывороток крови и асцитных жидкостей от 812 кошек в 319 образцах клинического материала титр составил 1 256 и выше (табл 1)
Результаты диагностики инфекционного перитонита кошек в РНГА
Количество Титр в РНГА Диагноз на ИПК
животных При первом исследовании При повторном исследовании Первичный Окончательный
319 1 256-1 4096 н/и Положительный
118 1 32-1 128 1 4 - 1 32 Сомнительный Отрицательный
22 1-32-1 128 1 256 - 1 1024 Сомнительный Положительный
353 Рахманина, Надежда Алексеевна :: 2007 :: Москва
1.1. Актуальность темы
1.2. Цели и задачи исследования
1.3. Научная новизна
1.4. Практическая значимость
1.5. Апробация работы
1.6. Основные положения диссертационной работы, выносимые на защиту
1.7. Публикации научных исследований
1.8. Структура и объем диссертации
1. ОБЗОР ЛИТЕРАТУРЫ
1.1. СВЕДЕНИЯ О ВОЗБУДИТЕЛЕ БОЛЕЗНИ
1.1.1. Историческая справка. Этиология болезни
1.1.2. Таксономическое положение вируса ИПК
1.1.3. Антигенные разновидности и родство вируса ИПК с другими представителями этого рода
1.2. ХАРАКТЕРИСТИКА БОЛЕЗНИ
1.2.1. Эпизоотологические данные
1.3. БИОЛОГИЧЕСКИЕ СВОЙСТВА ВИРУСА ИПК
1.3.1. Выделение изолятов вируса и экспериментальное заражение.
1.3.2. Морфология вируса ИПК
1.3.3. Культуральные свойства вируса ИПК
1.3.4. Чувствительность вируса к физико-химическим факторам.
1.4. ДИАГНОСТИКА ИНФЕКЦИОННОГО ПЕРИТОНИТА
1.4.1. Клинические признаки болезни
1.4.2. Паталогоанатомические изменения
1.4.3. Биохимические методы диагностики ИПК
1.4.4. Серологические методы диагностики
1.4.5. Сопоставление методов диагностики коронавирусной инфекции кошек
1.5. СРЕДСТВА ПРОФИЛАКТИКИ КОРОНАВИРУСНОЙ
1.5.1. Специфическая профилактика ИПК.
1.5.2. Профилактические мероприятия
2. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ
2.1. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
2.2. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
2.2.1. ИЗУЧЕНИЕ БИОЛОГИЧЕСКИХ СВОЙСТВ ВИРУСА ИНФЕКЦИОННОГО ПЕРИТОНИТА КОШЕК
2.2.1.1.Выделение и идентификация изолятов вируса инфекционного перитонита кошек
2.2.1.2.Изучение чувствительности лабораторных животных к вирусу ИПК при экспериментальном заражении
2.2.1.3.Изучение культуральных свойств вируса инфекционного перитонита кошек
2.2.1 АИзучение стабильности вируса инфекционного перитонита кошек к хранению в разных условиях
2.2.2. ДИАГНОСТИКА ИНФЕКЦИОННОГО ПЕРИТОНИТА КОШЕК
2.2.2.1 .Получение гипериммунных сывороток на кроликах.
2.2.2.2.Изготовление конъюгированных антигеном ИПК эритроцитов. Диагностика инфекционного перитонита кошек в РИГА
2.2.2.3. МФА при диагностике инфекционного перитонита кошек.
2.2.2.4. Биохимические и гематологические исследования.
2.2.2.5.Экспресс-диагностика ИПК в реакции йодной агглютинации
2.2.2.6. Экспресс-диагностика ИПК с использованием теста Ривалта
2.2.2.7. Диагностика инфекционного перитонита кошек на разных сроках после экспериментального заражения
2.2.2.8. Сравнительная оценка методов диагностики инфекционного перитонита кошек
2.2.2.9. Клиническая и патологоанатомическая диагностика.
Эпизоотологический анализ полученных результатов
-
5.0 Рейтинг 2733 Просмотра
Инфекционный перитонит кошек
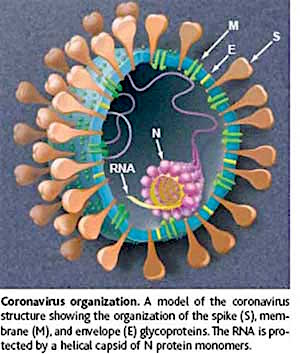
ИПК поражает животных семейства кошачьих, и помимо домашних и диких кошек может встречаться у львов, гепардов, ягуаров, тигров, леопардов, каракалов и т.д.
Первые официальные упоминания об этом недуге появились в Соединенных Штатах в 1960 году, но существует мнение, что болезнь появилась немного раньше 50-х. Причина внезапного появления ИПК не известна. Резкое увеличение заболеваемости животных между 1950 и 1975 в Америке совпало с усиленным интересом к кошкам как к домашним животным, увеличению количества кошек в городах, интенсивным выведением новых пород, племенным разведением.
В России в связи с повышением за последние десятилетия интереса к разведению и содержанию племенных животных и созданием в нашей стране кошачьих питомников, заболеваемость кошек ИПК резко увеличивается с каждым годом.
ИПК - это инфекционное заболевание, возбудителем которого является коронавирус. Среди всех коронавирусов (поражающих других животных и человека) вирус ИПК уникален тем, что поражает клетки иммунной системы кошек. ИПК является медленной инфекцией, которая может месяцами, а иногда и годами развиваться у животных без видимых клинических признаков. Эта болезнь на данный момент считается неизлечимой и практически в 100% случаев заканчивается гибелью животного. В литературе описываются единичные случаи самоизлечения. Вероятно, столь высокая чувствительность к ИПК обусловлена генетически. Если это так, можно полагать, что ИПК для кошек - сравнительно новое заболевание, и у вида не было еще достаточного времени для генетической адаптации, т.е. генетический отбор не привел к появлению популяции кошек с повышенной устойчивостью к ИПК. Проявления ИПК разнообразны. В большинстве случаев болезнь спорадически возникает и поражает отдельных животных. В популяции кошек может не проявляться смертности от ИПК в течение нескольких лет, а затем внезапно возникают несколько случаев в быстрой последовательности. Болезнь может временно исчезать, чтобы вновь появиться через месяцы или годы.
Раньше считалось, что у кошек существует две болезни, вызываемые коронавирусом: коронавирусный энтерит и ИПК. Однако не стоит путать эти инфекционные заболевания. При изучении этих двух вирусов выяснилось, что они почти не отличаются друг от друга генетически, но имеют разные биологические характеристики. При коронавирусном энтерите поражаются клетки эпителия тонкого кишечника, и основным клиническим симптомом является расстройство желудочно-кишечного тракта. Вирус ИПК поражает клетки иммунной системы (макрофаги) и разносится по всему организму, поражая практически все органы и приводящий животное к летальному исходу в 100% случаев. Наиболее вероятно, что вирус ИПК появился в результате естественной мутации вируса энтерита и его существование как нового биотипа связано с определенным генетическим дефектом (своего рода эволюция вируса). Согласно зарубежным сообщениям, кошки заразившиеся и переболевшие коронавирусным энтеритом являются вирусоносителями и дополнительными источниками ИПК. Это так же подтверждают и наши исследования.
Согласно проведенным нами исследованиям ИПК - заболевание одинаково поражающее как котов, так и кошек. Он опасен для животных всех возрастов. Отмечается, что заболеваемость и смертность чистопородных кошек от инфекционного перитонита наиболее высока в возрасте от 1 месяца до года. У беспородных кошек этот пик приходится на возраст от 7лет и старше. Считается, что ИПК это болезнь прежде всего породистых животных, однако согласно нашим наблюдениям беспородные кошки болеют также, как и породистые. Отмечена частая заболеваемость кошек британской и русской голубой пород. Животные голубого и серого окраса менее устойчивы к заболеванию, чем животные, имеющие природный окрас.
Название болезни дано условно, потому что при многообразии клинических признаков наиболее частым является перитонит (воспаление брюшной полости).
Различают две основные формы инфекционного перитонита: влажную - эффузионную и сухую - неэффузионную. Влажная форма характеризуется выпотом жидкости в перитонеальную (брюшную) или плевральную (грудную) полость. Сухая форма не сопровождается накоплением жидкости, а только поражениями внутренних органов: почек, кишечных лимфатических узлов, печени, поджелудочной железы, селезенки, а также возможно воспаление головного и спинного мозга и радужной оболочки глаза. Начальные симптомы при влажной и сухой формах неспецифичны и могут быть пропущены при осмотре и наблюдении. Наши исследования подтверждают, что влажная форма ИПК встречается чаще, так асцит (выпот в брюшной полости) наблюдается более чем в 60% случаев. При этом хотелось бы отметить, что он далеко не всегда сопровождается угнетением и отказом от корма. Но все же, в большинстве случаев, вялость, угнетение и отказ от корма сопровождает течение болезни, и даже иногда может быть ее единственным клиническим проявлением. Не исключено, что рвота и понос тоже могут быть признаками ИПК. У некоторых животных отмечается желтуха. Иногда возможно кратковременное повышение температуры тела. Почти всегда при ИПК мы можем говорить об увеличении селезенки, но это сложно обнаружить при клиническом осмотре. Все эти признаки могут проявляться как в совокупности, так и отдельно. Поражение плевральной (грудной) полости у исследованных нами животных встречалось реже. Однако при этом у больного отмечаются хрипы, кашель, отдышка, на рентгеновских снимках видно поражение легких, характерное для пневмонии.
В единичных случаях при ИПК может затрагиваться центральная нервная система (головной и спинной мозг), в этом случае у животных наблюдаются параличи, судороги, поведенческие изменения (агрессия, пассивность) и т.д.
Большая группа животных, исследованных нами, не имела никаких признаков болезни (прекрасный аппетит, нормальная активность) и обследовалась нами по просьбе хозяев после контактов с другими, возможно больными особями, к сожалению, многие из этой группы кошек оказались больны. Очень часто инфицированные животные вообще не имеют клинических признаков болезни, что говорит о возможной скрытой или латентной форме. Кроме того, мертворожденный приплод или гибель потомства в первые дни жизни тоже может являться симптомом ИПК.
Все возможные пути передачи ИПК до конца не изучены, и вызывают много споров. На данный момент известны два пути проникновения вируса в организм: внутриутробное и оральное заражение. То есть, вирус может передаваться от кошки к котятам через плаценту, а возможно и через молоко. Кошки, которые являются бессимптомными переносчиками неизбежно инфицируют большинство своих котят перед рождением или в течение первых 5 недель жизни, почти все эти инфицированные котята либо погибают, либо остаются здоровыми, но становятся скрытыми, хроническими или активными переносчиками вируса. Очень часто такие кошки приносят мертворожденный приплод. Иногда инфекция существует в питомниках в скрытой форме у клинически здоровых кошек. Животные-переносчики ИПК чаще встречаются в питомниках и среди домашних кошек, чем в дворовых сообществах.
Экспериментально вирус был обнаружен в моче и в фекалиях больных животных, следовательно оральное заражение может происходить как непосредственно от одного животного к другому, так и через общую миску, подстилку, туалет. Возможна ли передача болезни воздушно-капельным путем пока не ясно.
На сухих поверхностях вирус может сохраняться в опасном состоянии 2-3 дня при благоприятных условиях. Вирус ИПК не стойкий и не выдерживает действия высоких температур и большинства общепринятых средств дезинфекции (в том числе хозяйственного мыла).
Вопрос о возможном заболевании вашего животного ИПК может поставить ветеринарный врач при клиническом осмотре в случае схожих симптомов болезни. Особенно может насторожить жидкость в брюшной полости, увеличенный объем живота, увеличение селезенки при пальпации. Более точно коронавирусная инфекция диагностируется в лабораторных условиях с помощью серологических реакций (ИФА, РНГА). Для анализа необходима сыворотка крови или асцитная жидкость (из брюшной полости). В настоящее время в нашей стране широко используется метод ПЦР (полимеразная цепная реакция). Есть методы диагностики, которые проводятся посмертно: патологоанатомическое исследование, гистология срезов пораженных тканей и т.д.
За рубежом разработана и используется вакцина против ИПК кошек в виде капель, которые закапывают в нос. По сообщению иностранных авторов, она эффективна только для животных, никогда не имевших контакта с коронавирусом, что должно подтверждаться перед вакцинацией с помощью лабораторных анализов. В противном случае эта вакцина, может ухудшить состояние животного и ускорить развитие ИПК. В нашей стране эта вакцина пока не исследована.
Из ряда источников иногда мы можем получать сведения о том, что применение различных антибиотиков и кортикостероидов является успешным при лечении ИПК. К сожалению, практика показывает, что применение кортикостероидов (преднизолона) дает временное улучшение после которого заболевание наоборот обостряется. На данный момент эффективного лечения ИПК в мировой практике пока не найдено. Однако не исключено, что в некоторых случаях может произойти самовыздоровление животного. Причины этого неизвестны, но нет уверенности, что клинически выздоровевшее животное полностью избавилось от вируса и не перешло в стадию скрытого носительства, с последующим возможным возобновлением болезни.
При первом же подозрении на заболевание ИПК, прежде всего, нужно изолировать животное от сородичей. Если на основании клинических симптомов и лабораторных исследований вашему питомцу поставили диагноз ИПК, то вы должны понимать, что прогноз не благоприятный. Но если состояние животного не критическое, заболевание не приносит ему мучения и есть возможность оградить его от контакта с другими кошками, то не стоит подвергать животное эутаназии. Пока это целесообразно, можно применять симптоматические средства терапии и обеспечить животному хороший уход и полноценное питание. Ваша забота может оттянуть дальнейшее развитие и исход болезни.
Если заболевшая кошка рожает жизнеспособный приплод, то практикуется ранний отъем от матери, но при этом надо учитывать, что котята могут быть заражены внутриутробно и вероятнее всего являются переносчиками болезни. Животные, которые находились в контакте с больным, подвергаются клиническому наблюдению и проведению анализа их сыворотки крови и кала несколько раз с интервалом в 3 месяца для того, что бы выявить болезнь и вирусоносительство на ранней стадии и не допустить дальнейшего ее распространения.
Если неблагоприятным по ИПК оказывается питомник, то его владельцы должны проявить благоразумие, и независимо от проявления животными признаков болезни, все кошки, коты и котята не должны передаваться в частные руки и другие питомники, так как все они рассматриваются как источники болезни по отношении к другим кошкам.
Вероятность возникновения болезни трудно прогнозировать. Поэтому ее профилактика состоит в соблюдении гигиенических мер, обеспечении полноценного кормления, сокращении количества контактов вашей кошки с животными того же семейства, недопущении стрессов, недопущении сопутствующих инфекций и инвазий.
Читайте также:


