Вильпрафен солютаб при стафилококке
Аннотация научной статьи по клинической медицине, автор научной работы — Боковой А.Г., Таратина М.Э., Маккавеева Л.Ф., Лыкова Е.А., Дегтярева В.А.
В двух сопоставимых по возрасту и тяжести пневмоний группах детей (100 детей, получавших вильпрафен и 98 детей, получавших аугментин и цефалоспорины) проведены исследования динамики основных клинических симптомов и показано, что вильпрафен по клинической эффективности не уступает аминопенициллинам и цефалоспоринам. Выявленные этиологические факторы пневмоний встречались с одинаковой частотой в обеих группах и не влияли существенно на результат лечения. Показано, что вильпрафен оказывал менее повреждающее действие на кишечную микрофлору больных по сравнению с аминопенициллинами и цефалоспоринами.
Похожие темы научных работ по клинической медицине , автор научной работы — Боковой А.Г., Таратина М.Э., Маккавеева Л.Ф., Лыкова Е.А., Дегтярева В.А.
Джозамииин как антибиотик выбора в комплексном лечении больных пневмониями
А. Г. Боковой, М. Э. Таратина, Л. Ф. Маккавеева, Е. А. Лыкова, В. А. Дегтярева, Н. А. Гришина
Центральная клиническая больница ФГУ УДПРФ, Москва.
В двух сопоставимых по возрасту и тяжести пневмоний группах детей (100 детей, получавших вильпрафен и 98 детей, получавших аугментин и цефалоспорины) проведены исследования динамики основных клинических симптомов и показано, что вильпрафен по клинической эффективности не уступает аминопенициллинам и цефалоспоринам. Выявленные этиологические факторы пневмоний встречались с одинаковой частотой в обеих группах и не влияли существенно на результат лечения. Показано, что вильпрафен оказывал менее повреждающее действие на кишечную микрофлору больных по сравнению с аминопенициллинами и цефалоспоринами.
Ключевые слова: дети, вильпрафен, аугментин, клафоран, цедекс, пневмонии, кишечная микрофлора
Вопросы рациональной антибиотикотерапии детей с пневмониями, осложняющими течение ОРВИ, в настоящее время являются не менее актуальными, чем более 50 лет назад, когда клиническое применение пенициллина только открывало эру активного воздействия на многие бактериальные возбудители, вызывавшие различные поражения дыхательной системы человека.
Несмотря на общеизвестные успехи антибактериальной терапии, два постоянно идущих процесса: возникновение все новых резистентных штаммов микроорганизмов и повреждающее действие антибиотиков на макроорганизм (токсическое, аллергическое, им-муносупрессивное, антимикробное по отношению к аутохтонной микрофлоре) постоянно поддерживают спрос на все новые виды и формы антибактериальных средств, в частности при инфекционной патологии дыхательной системы у детей.
В комплексе современных методов лечения широко используются антибиотики пенициллинового ряда (пенициллин, оксациллин, феноксиметилпенициллин, аминопенициллины и др.), линкомицин, аминоглико-зиды (гентамицин, канамицин, амикацин и др.), цефалоспорины 2-го, 3-го и 4-го поколений, фторхино-лоны и т. д.
В последние 10 лет в клинической практике педиатров России получает все большее распространение использование макролидов, производных бывшего антибиотика резерва — эритромицина. Макропен, рулид, кларитромицин, сумамед и другие антибиотики этого ряда уже довольно распространены в наших аптеках, однако, до настоящего времени в педиатрии нет четких рекомендаций по применению этих препаратов при конкретных нозологических формах инфекционных заболеваний, особенностям их действия у детей, характеристик по динамике клинико-лабораторных данных в сравнении с действием других антибиотиков.
Существуют лишь отдельные работы, основанные на небольшом числе наблюдений об эффективности джозамицина у детей, больных пиелонефритом в активной фазе и гломерулонефритом, выделяющих из зева и носа бета-гемолитический стрептококк группы А, а также указания об эффективности этого антибиотика при инфекциях дыхательной системы у детей [1, 2].
Между тем, в практике педиатров европейских стран вильпрафен уже более 30 лет широко применяется при острых инфекционных заболеваниях верхних и нижних отделов респираторного тракта: фарингитах, ларингитах, ангинах, бронхитах и пневмониях, а так-
же других инфекционных заболеваниях. Благодаря широкому спектру антимикробного действия, охватывающему практически все стрептококки, стафилококки, гемофильную палочку, нейссерии, микоплазму, хла-мидии и кампилобактер, некоторые анаэробы, клинически выраженный успех при применении этого антибиотика отмечается у 97,1% леченных детей при сравнительно низкой частоте побочных эффектов — не более 5,14% [3, 4].
Материалы и методы исследования
В детском инфекционном боксированном отделении в 2002, 2003 и 2004 годах было пролечено 198 детей с очаговыми и сегментарными пневмониями, осложнившими течение ОРВИ. Это были дети преимущественно в возрасте от 3 до 12 лет (164 из 198 больных). 176 из 198 больных поступили в отделение на первой неделе от начала ОРВИ и 22 — на 8—12 день ОРВИ с появлением клинических признаков начинающейся пневмонии : повторное повышение температуры, появление дыхательной недостаточности, интоксикации, изменение характера кашля, появление укорочения перкуторного звука в легких и затем — преимущественно односторонних влажных мелкопузырчатых хрипов у большинства больных.
Этиологический диагноз ОРВИ ставился на основании комплексной оценки данных эпиданамнеза, особенности клинических проявлений, характерных для определенных групп вирусных инфекций, РИФ в мазках со слизистой ротоглотки и серологических данных в РТГА и РСК по определению динамики антител к антигенам следующих респираторных вирусов: гриппа А1, А2 и В (26 больных); парагриппа 1, 2 и 3 типов (19 больных); аденовирусов (9 больных); энте-ровирусов (6 больных); респираторно-синцитиальных вирусов (4 больных). Таким образом, этиологический диагноз ОРВИ был установлен у 64 из 198 детей (32,3%).
Таблица 1. Результаты микробиологических исследований этиологии пневмоний у детей, получавших вильпрафен и другие антибиотики
Группы детей, получавших антибиотики Мазки из зева количественным методом
Зеленящий стрептококк до 106, гемо-фильная палочка до 103 Зеленящий стрептококк до 104, сапрофитные нейссерии до 102 Зеленящий стрептококк до 106, золотистый стафилококк до 104 Эпидермальный стафилококк до 105, клебсиелла, серрация и др. Посев отрицательный
Группа А 36 15 5 19 25
Группа Б 32 22 4 11 29
В группе, получавшей вильпрафен через рот было 100 детей (группа А). Следует отметить, что у 16 из них вильпрафен назначался после аугментина, амок-сиклава, цефотаксима, цедекса. Возрастной состав больных и тяжесть пневмоний в этой группе не отличались от таковых у 98 детей (группа Б), получавших по поводу пневмоний аугментин и цефтибутен через рот (42 ребенка) и цефотаксим внутримышечно (56 детей).
Результаты изучения этиологии пневмоний у детей групп А и Б представлены в таблицах 1 и 2.
Несмотря на относительное значение исследований микрофлоры зева количественным методом в определении этиологии пневмонии у каждого данного больного, при групповом анализе этих данных очевидно, что в обеих группах, как у детей, получавших вильпрафен, так и получавших аугментин, цефтибутен и цефотаксим, преобладали одни и те же микроорганизмы (табл. 1).
Это, прежде всего, зеленящий стрептококк в концентрациях до 106, его сочетания с гемофильной палочкой (до 10?), сапрофитными нейссериями (до 102), золотистым стафилококком (до 104), условно-патогенными энтеробактериями (клебсиелла, сер-рация и др. — до 104).
Аналогичные данные были получены (см. табл. 2) и при серологических исследованиях в реакции непрямой иммунофлуоресценции (РНИф) и при иммунофер-ментном анализе (ИфА) титров антител в динамике заболеваний к пневмотропным возбудителям — стрептококкам группы А, пневмококкам, гемофильной палочке, хламидиям (суммарн. АТ) и микоплазме пневмония. Из таблицы следует, что наиболее часто в обеих группах были отмечены повышенные титры антител к стрептококкам группы А (1 : 128—1 : 512), пневмококкам (1 : 64—1 : 128), хламидии трахоматис и микоплазме пневмония (1 : 64—1 : 512) — соответственно у 53 детей, получавших вильпрафен и у 42 — получавших аугментин, цефотаксим и цефтибутен. Реже отмечалось незначительное нарастание титров антител к гемофильной палочке.
В случаях нарастания титров антител к указанным микроорганизмам можно более объективно судить об этиологии пневмоний у обследованных детей. Однако, практическая значимость этих исследований в настоящей работе состоит в том, что они свидетельствуют
06 одинаковом распределении этих возбудителей в двух группах больных, получавших вильпрафен через рот и иные антибиотики также через рот или внутримышечно.
Статистическую обработку материала проводили с помощью программы Microsoft Excel. Был применен метод вариационнного анализа с определением средней арифметической (М) и ошибки средней (т). Достоверность различия средних определялась по критерию Стъюдента (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Длительность антибактериальной терапии у большинства детей обеих групп составляла в среднем
7 дней и лишь у отдельных больных (8 детей группы А и 6 детей группы Б) увеличивалась до 10 дней в случаях достоверного выявления микоплазменной этиологии пневмоний.
Клиническая оценка результатов применения антибиотиков в обеих группах базировалась на сопоставлении динамики основных симптомов заболеваний. Полученные результаты исследований представлены в таблице 3.
Таблица 2. Результаты серологических исследований этиологии пневмоний у детей, получавших вильпрафен и другие антибиотики
Группы детей, получавших антибиотики и титры антител в РНИф Серология РНИФ, ИфА
Стрептококк гр. А 1 : 128—1 : 512 Пневмококки 1 : 64—1 : 128 Хламидия суммарн. АТ, Микоп-лазма пневмония 1 : 64—1 : 512 Гемофильная палочка 1 : 64—1 : 128 Титры антител не выявлены
Группа А 19 16 18 4 43
Группа Б 14 18 10 3 55
Таблица 3. Сравнительная характеристика продолжительности основных симптомов пневмоний в днях у детей, получавших вильпрафен (группа А) и аугментин, цефтибутен и цефотаксим (группа Б)
Эти данные свидетельствуют о том, что продолжительность основных клинических симптомов пневмоний у детей, получавших вильпрафен практически не отличалась от таковых у больных, получавших аугментин и цефалоспорины. Так, на 3—4 день применения антибиотиков в обеих группах исчезала лихорадка и температура тела у подавляющего большинства детей колебалась лишь в пределах субфебрильных величин. Длительность интоксикации (бледность кожных покровов, вялость, слабость ребенка, снижение аппетита, приглушенность сердечных тонов) у детей обеих групп колебалась в пределах от 4 до 6 дней и средне-статистические показатели ее продолжительности также достоверно не различались в зависимости от применения различных антибиотиков. Средние величины длительности интенсивного кашля и продолжительность выраженных физикальных данных в легких (до существенного уменьшения зоны притупления и укорочения легочного звука, а также исчезновения влажных хрипов в легких) также достоверно не различались у наших больных.
На 3—4 день от начала антибактериальной терапии у большинства детей групп А и Б отмечалось существенное снижение показателей бактериального воспаления в общем анализе крови — снижение и у части детей нормализация числа лейкоцитов, уменьшение нейтрофилов и палочко-ядерного сдвига при торпидных, или даже несколько нарастающих показателях СОЭ.
Частота патологических значений отдельных лабораторных тестов после проведения антибактериальной терапии также существенно не отличалась у детей обеих групп. Так, суммарно патологические изменения в формуле крови (незначительный лейкоцитоз до
12 500, изменения, белой крови с нарастанием нейтрофилов > 50% и палочкоядерных лейкоцитов > 8%), на рентгенограммах легких (усиление сосудистого рисунка, расширение корня легкого на пораженной стороне), а также комбинации незначительных рестрик-тивных и о6структивных явлений при определении функции внешнего дыхания (фВД) были отмечены у 42 больных, получавших вильпрафен и у 39, получавших аугментин и цефалоспорины.
При комплексной оценке остаточных явлений пневмоний ко времени выписки из стационара (физикаль-ные изменения в легких, незначительное подкашлива-ние, субфебрилитет) отмечено, что в группе А они встречались не чаще, чем в группе Б (соответственно у 12 и 14 детей). Среднее пребывание больных в стационаре составило в группе А 12,2 ± 0,4 дня и в группе Б 11,4 ± 0,22 дня, соответственно.
У небольшой части больных (18 из 198) лечение пневмоний проводилось двумя антибиотиками — чаще сочетаниями вильпрафена и цефалоспоринов. При этом, лишь у 2 детей вильпрафен был заменен на кла-форан, а у 12 цефалоспорины были заменены на вильпрафен на 4—5 день от начала лечения вследствие недостаточно выраженного клинического эффекта первоначальной антибиотикотерапии. У 8 из этих 12 детей серологическими методами (РНИф и ИфА сыворотки крови) было показано участие в патогенезе пневмоний хламидий и микоплазм (появление 1дМ-ан-тител к указанным возбудителям).
У 4 больных с тяжелыми формами заболеваний (двусторонняя пневмония в сочетании с отитами и гайморитами) осуществлялось одновременное применение вильпрафена и цефалоспоринов.
У части детей (по 20 больных в каждой группе) было проведено изучение состояния кишечной микрофлоры. В фекалиях больных после завершения анти-биотикотерапии определяли содержание общего количества кишечной палочки (ОККП), гемолитических и лактозонегативных штаммов кишечной палочки (ГКП), содержание лактобактерий (ЛБ), бифидобак-терий (БфБ а также наличие и количественное содержание условно-патогенных бактерий (УПБ) — клебсиелл, протея, грибковой флоры, стафилококков. Из представленных в таблице 4 данных следует, что у больных, получавших аугментин и цефалоспо-рины значительно чаще, чем у больных, получавших вильпрафен, снижалось содержание ОККП 10% и условно-патогенных бактерий (Klebsiella, Proteus, Enterobacter и
Таблица 4. Показатели кишечной микрофлоры у детей, получавших вильпрафен (группа А) и аугментин, цефтибутен, цефотаксим (группа Б)
Группы детей Показатели кишечной микрофлоры
Снижение ОККП 10% Снижение содержания лактобактерий 104
Группа А (n = 20) 3 3 8 4 9
Группа Б (n = 20) 8 8 14 14 13
Симптомы Группа А (n = 100) Группа Б (n = 98)
Длительность лихорадки 3,07 ± 0,08 3,41 ± 0,12
Длительность интоксикации 4,03 ± 0,07 4,13 ± 0,17
Длительность интенсивного кашля 4,44 ± 0,14 3,69 ± 0,19
Снижение выраженности физикальных данных в легких 5,6 ± 0,16 4,9 ± 0,16
Уменьшение воспалительных изменений в общем анализе крови 3,5 ± 0,16 3,01 ± 0,08
■ А. Г. Боковой и ар. ЛжозАМииин как антибиотик выбора в комплексном лечении больных пневмониями
др.) > 104. При этом было также показано существенно более массивное нарастание условно-патогенной микрофлоры.
Таким образом, исследования, проведенные в двух сопоставимых по возрасту, срокам поступления в стационар и тяжести заболевания группах детей, леченных по поводу пневмоний, позволили сделать ряд практически важных выводов о применении вильпрафе-на при данной патологии.
В клинической практике инфекционного отделения широкий антибактериальный спектр вильпрафена позволяет применять его в тех случаях, когда применяются аугментин и цефалоспорины. Наличие у каждого 4-го ребенка в качестве этиологических факторов пневмоний хламидий и микоплазм наиболее чувствительных к макролидам также является фактором, подтверждающим целесообразность применения этих антибиотиков.
У детей, получавших вильпрафен через рот, обратная динамика клинико-лабораторных данных пневмоний, как правило, отмечалась в те же сроки, что и у больных, получавших цефалоспорины через рот и внутримышечно.
Исследования, проведенные у части больных по изучению состояния биоценоза кишечника на фоне антибактериальной терапии, показали, что вильпрафен по сравнению с цефалоспоринами значительно меньше ингибирует кишечную микрофлору, что является важным положительным моментом, особенно у детей раннего возраста.
Практически важным является также положительный терапевтический эффект вильпрафена при очаговых и сегментарных пневмониях, не уступающий таковому при применении цефалоспоринов.
Побочные явления при назначении вильпрафена (сыпи на коже у 3 детей) и цефалоспоринов (сыпи на коже и жидкий стул у 4 детей) отмечались практически с одинаковой частотой).
2. Практическое руководство по антиинфекционной химиотерапии / Под редакцией Л. С. Страчунского и др. — М., 2002.
3. D. Peyramond, Е. Biron, F. Lucht, J. L. Bertrand // Drugs Ex-perim. Clin. Res. — 1982. — V. 8. — № 3. — P. 297—302.
4. G. Privitera, S. Bonino, S. Del Mastro // Intern. J. Clin Pharmacol. Res. — 1984. — V. 4. — № 3. — P. 201—207.
Эффективность Анаферона детского при смешанных инфекциях у детей
Е. А. Дондурей, Л. В. Осидак, Е. Г. Головачева, Г. В. Данини, А. К. Голованова, Ф. А. Габбасова, В. А. Николаева, С. И. Минченко, А. К. Сироткин
ГУ НИИ гриппа РАМН, ДИБ № 5 им. Н. ф. Филатова, Санкт-Петербург
Ключевые слова: дети, индуктор интерферона, острое сочетанное поражение респираторного и ЖК трактов, иммунный статус
Острые респираторные вирусные (ОРВИ) и кишечные инфекции (ОКИ) постоянно сохраняют ведущие позиции в структуре детской инфекционной патологии, занимая 1 и 2 места соответственно [1].
Нередко симптомы этих заболеваний наблюдаются одновременно, но регистрируются по-разному: либо как сопутствующие заболевания, либо симптомы желудочно-кишечной (ЖК) дисфункции расцениваются как проявления интоксикации или дисбиоза и не учитываются в диагнозе вообще [2, 3].
Механизм развития диареи при ОРВИ в настоящее время неизвестен, однако придается большое значение нарушению пищеварительной и секреторной функции тонкой кишки вследствие повреждения вирусами эпите-лиоцитов с развитием осмосекреторной диареи [3—5].
Гастроинтестинальный синдром у детей раннего возраста, по данным наших наблюдений, развивает-
ся примерно в 20% случаев ОРВИ [6]. Практически у 80% пациентов этот симптомокомплекс обусловлен вирусами (рота-, адено-, корона-, энтеро-), не исключено и возможное участие вирусов гриппа. Этиологическим фактором одновременного поражения респираторного и ЖК трактов может служить как моноинфекция, когда возбудитель репродуцируется и в эпителиальных клетках респираторного тракта и кишечника, так и микст инфекция с различной локализацией места репродукции возбудителей [3, 6, 7]. Это обусловливает значимость данной проблемы для детей и необходимость совершенствования методов лечения.
Учитывая полиэтиологичность изучаемой патологии и преимущественно ранний возраст детей, одним из наиболее перспективных путей ее терапии является использование препаратов интерферона, которые, в от-

Рубрика: 11. Прочие отрасли медицины и здравоохранения
Дата публикации: 02.05.2018
Статья просмотрена: 806 раз
Целью работы является продемонстрировать, что бактерии класса стафилококков не поддаются воздействию антибиотиков.
Задачи работы.
1. Определить необходимость антибиотиков.
2. Проанализировать пользу антибиотиков для человека.
3. Проанализировать эффективность использования антибиотиков.
4. Провести эксперимент, который доказывает, что стафилококк не поддаются воздействию антибиотиков.
Для исследования использовалось: наблюдения, фотографирование, сравнительный анализ, работа с источниками информации, проведение экспериментов и анкетирований. Были изучены свойства часто спрашиваемых антибиотиков в аптеках. А так же был проведен эксперимент, который доказывал, что стафилококки не поддаются воздействию антибиотиков широкого спектра пенициллинового ряда.
Анкетирование провизоров
Нужно было выяснить, какие антибиотики чаще всего спрашивают. И выяснилось, это с помощью анкетирования провизоров.Был проведен опрос 23 аптек. Провизорам были заданы следующие вопросы:
1) Часто ли покупатели просят продать антибиотики пенициллинового ряда без рецепта?
2) Можно ли купить антибиотики пенициллинового ряда без рецепта, и в каких случаях?
3) Какие антибиотики пенициллинового ряда чаще всего спрашивали покупатели?
Все аптеки ответили по-разному, поэтому записала только самые спрашиваемые, это амоксиклав и флемоксин.
Народное анкетирование
Был проведен опрос возле аптек города Новосибирска. Чтобы сгруппировать опрошенных людей между собой, воспользовалась теорией психосоциального развития Эрика Эриксона. Юность (18–19 лет), молодость (19–35 лет), взрослость (35–60 лет), старость (от 60 лет).
Всего было опрошено 73 человека. Из опроса стало ясно, что большинство жителей 18–19 лет употребляют антибиотики по назначению врача, 19–35 лет чаще всего самостоятельно назначают себе курс лечения антибиотиками т. к. эта группа людей постоянно спешит. У них нет времени болеть, поэтому они пьют антибиотики чаще всего. 60 и более лет жители пьют курс антибиотиков если им назначил врач.
Подготовка питательной среды для эксперимента
Для проведения опытов с бактериями необходимо подготовиться. Для начала, должны подготовить питательную среду. Именно получение нужных питательных сред и создание оптимальных условий, обеспечивающих рост микроорганизмов в искусственных условиях. Для успешной постановки эксперимента исследователю необходимо выделить чистую культуру и подобрать оптимальную питательную среду для бактерий.
Для приготовления питательной среды, взяла нарезанное мясо говядины предварительно очищенного от костей, жира, сухожилий, пропустила через мясорубку. 500 г полученного фарша заливаю 1 л водопроводной воды, оставляю при комнатной температуре на 12 часов. Затем отжимаю мясо через марлю, и полученный настой кипячу 30 мин, остывший бульон фильтрую через ватный фильтр, довожу бульон до кипения добавляю 2 % агар-агара и кипячу 5 минут, добавляю 0,5 % хлорида натрия. Никаких других солей добавлять не требуется, т. к. они в достаточном количестве уже есть в бульоне. Предварительно перед заливанием питательной среды в чашки, они проходят термическую обработку в духовом шкафу. Заливаю нашу питательную среду в чашки Петри на ¾. Полученный бульон необходимо автоклавировать. У меня нет автоклава, поэтому, я использовала духовой шкаф при 210 градусов.

Рис. 1. Автоклавирование
Рис. 2. Отжимание мяса через марлю

Рис. 3. Фильтрация через ватный фильтр

Рис. 4. Варка питательной среды

Рис. 5. Повторное автоклавирование
Рис. 6. Готовые чашки Петри с питательной средой
Подсадка бактерий вчашки Петри
Один из самых распространенных методов проведения подсадки — это прикосновение пальцев рук к поверхности питательной среды до или после мытья. Было принято решение выращивать колонии с двух образцов:
— с пальцев рук, предварительно санитарно не обработанных(ввиду большего количества бактерий).
—с человеческой слюны, ввиду того, что там находится порядка трех сотен разных видов бактерий.
Рис. 7. Подсадка бактерий с рук

Рис. 8. Подсадка бактерий со слюны
Определение культур бактерий
Культуральные признаки бактерий характеризуются особенностью роста бактерий на плотных и жидких питательных средах. На плотных питательных средах изучаются признаки изолированно от других выросших в чашке Петри колоний бактерий. В зависимости от их положения в среде различают поверхностные и глубинные колонии. Наиболее типично видовые признаки выражены у поверхностных колоний.
а) форма колоний — округлая, неправильная, амебовидная, ризоидная, мицелиальная.
б) размер колонии — точечные (диаметр 1мм), мелкие (диаметр 1–2мм), средние (диаметр 3–4мм), крупные (диаметр более 4мм).
в) край колонии — ровный, волнистый, лопастной, бахромчатый.
г) структура колонии — однородная, мелкозернистая, крупнозернистая, струйчатая, волнистая.
д) профиль колонии — плоский, выпуклый, кратерообразный, конусовидный.
е) консистенция колонии — мягкая, слизистая, тягучая, хрупкая.
При этом форму, профиль, цвет, блеск определяют невооруженным глазом; край и структуру — при малом увеличении микроскопа; консистенцию — прикосновением к ее поверхности петлей; размеры — обычной линейкой.

Рис.9. Форма, профиль, край, структура колоний бактерийформа: а — округлая, б — неправильная, в — амебовидная, г — ризоидная, д — мицелиальная. Профиль: а — плоский, б — выпуклый, в — кратерообразный, г — бахромчатый. Край: а — ровный, б — волнистый, в — лопастной, г — бахромчатый. Структура: а — однородная, б — мелкозернистая, в — крупнозернистая, г — струйчатая, д — волнистая.
По данному алгоритму я определила, что в моих чашках Петри находится золотистый стафилококк, метициллинрезистентный золотистый стафилококк, плесень, стрептококки.
Выделение чистой культуры
Для выделения чистой культуры с чашки Петри нам понадобится: чашки Петри с чистой питательной средой для бактерий, три пробирки, самодельная микробиологическая петля из проволоки, дистиллированной вода, газовая горелка, пипетка или ватная палочка, маска и перчатки для защиты дыхательных путей и кожи рук от бактерий.
Берем микробиологическую петлю, нагреваем ее на газовой горелке до покраснения для дезинфекции, в момент, когда она остывает, ломаем колбу с дистиллированной водой, выливаем ее в пробирку примерно 2–3 мл, взяв микробиологическую петлю, соскабливаем колонию бактерий и помещаем ее в пробирку, тщательно перемешиваем до однородного раствора. Полученный однородный раствор собираем пипеткой и капаем в чашку Петри. Повторяем данный алгоритм до тех пор, пока не пересадим нужные колонии в новые чашки Петри.

Рис. 10. Дезинфекция микробиологической петли
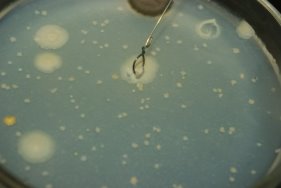
Рис. 11. Сбор колоний в чашку Петри
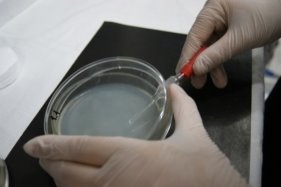
Рис. 12. Пересадка бактерий в чашку Петри
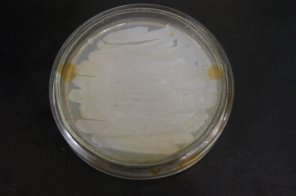
Рис. 13. Конечный результат
Проведение эксперимента сантибиотиками
Для проведения эксперимента с антибиотиками, была необходима информация, о количественном содержании антибиотика в одной таблетке. Затем провести расчеты, чтобы сделать растворы разной концентрации. Благодаря этому мы выясним, при какой концентрации антибиотика бактерии начинают погибать. Антибиотики начинают действовать в крови человека при 1,5–3мг/мл, я буду отталкиваться от этих данных.
Расчеты концентраций антибиотика флемоксин:
Необходимо было приготовить растворы с концентрацией в 10, 30 и 60 % содержания антибиотика, для этого использовали метод разбавления: исходный раствор был получен путем растворения таблетки в 100 мл воды, его концентрация составила 500мг/100мл=5мг/мл. От данного раствора была взята аликвота 1 мл, путем разбавления которой были получены растворы нужной концентрации из расчета: Раствор 1:
50мкг/100мл=0.5мкг/мл (разбавление от исходного раствора до 10 %)
50мкг/29мл=1.6мкг/мл (раствор 30 %)
50мкг/14мл=3.3мкг/мл (раствор 60 %)
50мкг/9 мл=3.3мкг/мл (самый сильный раствор 100 %)

Расчеты концентраций антибиотика амоксиклав квиктаб
Необходимо приготовить растворы с концентрацией в 10, 30 и 60 % содержания антибиотика, для этого использовали метод разбавления: исходный раствор был получен путем растворения таблетки в 200 мл воды, его концентрация составила 1000мг/200мл=5мг/мл. От данного раствора была взята аликвота 1 мл, путем разбавления которой были получены растворы нужны концентраций из расчета:
1000мг/200=5 мг/мл (берем от данного раствора 1 мл, продолжаем расчеты)
50мкг/100мл=0.5мкг/мл (разбавление от исходного раствора до 10 %)
50мкг/29мл=1.6мкг/мл (раствор 30%)
50мкг/14мл=3.3мкг/мл (раствор 60%)
50мкг/9 мл=3.3мкг/мл (самый сильный раствор 100%)

Рис. 15. Стаканы с разной концентрацией антибиотика
Проведение основного эксперимента
После проделанных расчетов, основываясь на минимальной бактерицидной концентрации в крови (1,5–3мкг/мл). Я решила проводить основной эксперимент. Надеваем медицинские резиновые перчатки и маску, чтобы защитить себя от бактерий. Чтобы начать мой основной эксперимент, потребовалось взять чашки Петри, в которых уже находилась пересаженная колония бактерий. Далее разводим антибиотики, как написано в расчетах. Берем пипетки для всех концентраций разные, чтобы растворы не смешивались, и получился чистый эксперимент. Делим чашки Петри на ровные доли маркером по поверхности крышки чашки. Осторожно приоткрываем чашки Петри и капаем разными концентрациями на поверхность питательной среды. В середине у меня условный 100 % раствор, к краям концентрация растворов меняется, далее идет 60 %,30 %,10 %. Ведем наблюдение до того, как появится первый результат. Для выявления точности полученных данных опыт был проведен четыре раза.
Результаты опыта занесены в таблицы:
Наименование
Результат
Время эксперимента
Примечание
Чашка Петри с золотистым стафилококком 1
ничего не наблюдается
Никаких изменений не замечено
ничего не наблюдается
ничего не наблюдается
ничего не наблюдается
Чашка Петри с золотистым стафилококком 2
ничего не наблюдается
Никаких изменений не замечено
ничего не наблюдается
ничего не наблюдается
ничего не наблюдается
Чашка Петри с золотистым стафилококком 3
ничего не наблюдается
Никаких изменений не замечено
ничего не наблюдается
ничего не наблюдается
ничего не наблюдается
Чашка Петри с золотистым стафилококком 4
ничего не наблюдается
Никаких изменений не замечено
ничего не наблюдается
ничего не наблюдается
ничего не наблюдается

Рис. 16. До добавления антибиотиков

Рис. 17. После добавления антибиотиков
Результаты экспериментов. Выводы
По результатам проведенных исследований можно сделать вывод, что стафилококк не поддаются воздействию антибиотиков пенициллинового ряда, а конкретно флемоксином и амоксиклавом. Занимаясь самолечением, люди усугубляют болезнь, параллельно нанося вред собственному организму. Из-за того, что они не могут разобраться в том, было ли заболевание вызвано вирусами или бактериями. Проще говоря, антибиотики теряют свою эффективность. Стафилококки, пневмококки, и даже палочка Коха, возбудитель туберкулёза, имеют резистентность к повсеместно применяемым антибиотикам широкого спектра, что и было доказано в моей работе. Что делает их почти неуязвимыми к лечению. От этого некоторые заболевания плохо поддаются лечению, развиваются тяжёлые септические состояния.
Рекомендации
Бактерии, обладающие резистентностью к антибиотикам, предшествуют медицинскому применению антибиотиков людьми; тем не менее, широкое применение антибиотиков сделало бактерии более резистентными в процессе давления эволюционного отбора.
Причины широкого применения антибиотиков включают: повышение глобальной доступности в течение долгого времени, начиная с 1950-х годов неконтролируемые продажи антибиотиков во многих странах с низким или средним уровнем дохода, где их можно получить без рецепта, что потенциально приводит к применению антибиотиков без предписания врача. Это может привести к возникновению резистентности у любых оставшихся бактерий.
Применение антибиотиков в животноводстве в качестве добавки в корм для скота в малых дозах для стимулирования роста является общепринятой практикой во многих промышленно развитых странах, и, как известно, приводит к повышению уровня резистентности. Выброс большого количества антибиотиков в окружающую среду во время фармацевтического производства за счет ненадлежащей очистки сточных вод повышает риск того, что устойчивые к антибиотикам штаммы будут развиваться и распространяться. Точно неизвестно, способствуют ли бактерицидные вещества в мыле и других продуктах развитию устойчивости к антибиотикам, но они не рекомендуются к применению по другим причинам
Поэтому, я хочу порекомендовать принимать антибиотики только по назначению дипломированного медицинского работника, но также не стесняйтесь спрашивать, действительно ли они вам необходимы. Если вы принимаете антибиотики, всегда заканчивайте полный курс, даже если вы почувствовали себя лучше, так как прекращение приема содействует росту лекарственно устойчивых бактерий
Похожие статьи
3. При приготовлении второго образца (с бактериями, испытавшими влияние антибиотика) в ампуле с водой сначала мы растворяли антибиотик (амоксициллина тригидрат — препарат флемоксин солютаб), затем несколько капель раствора подмешали ко второй части.
Библиографическое описание: Зонтиков Д. Н., Марамохин Э. В. Проблемы стерильности сред и растительных эксплантов культуры in vitro
Наиболее часто в настоящее время используются антибиотики широкого спектра действия: пенициллинового и цефалоспоринового ряда.
Рабочий раствор готовили разведением бактериальной культуры с концентрацией 5 млн. микробных
Селезенку помещали в заранее приготовленную полную питательную среду 199 с добавлением
После застывания геля агарозы чашки инкубировали при 37оС в течение 1 часа.
Приблизительно 20 % от исходного количества антибиотиков разрушается в результате проварки [4,8].
Так, наиболее сильными аллергенами из применяемых в животноводстве антибиотиков являются пенициллин и тилозин.
Определение чувствительности микрофлоры к наиболее часто применяемым антибиотикам и антисептическим веществам производили
Кишечная палочка в монокультуре высеяна у 106 (50,7 %) больных, золотистый стафилококк — у 30 (14,4 %) больных, стрептококк — у 21 (10,0.
11. Практика использования электроактивированных водных растворов в
Основные термины (генерируются автоматически): питательная среда, среда, культивирование бактерий рода
В чашки Петри разливали универсальную питательную среду СПА (сухой питательный агар).
Антибиотикорезистентность: знания, отношения и практики применения антибиотиков пациентами с респираторной патологией.
Знаете ли Вы, что антибиотики убивают бактерии, которые в норме живут на поверхности кожи и в кишечнике.
Чистые культуры для хранения пересевались в пробирки на скошенную агаровую
Удешевление питательной среды для культивирования бактерий.
Среди аэробных микроорганизмов преобладали S. aureus (36 %), коагулазонегативные стафилококки (19,8.
. с введением 3–5 мл физиологического раствора.
на поверхность дифференциально-диагностических питательных сред: агар для анаэробов, среда эндо
часто применяемым антибиотикам и антисептическим веществам производили диско-диффузионным методом.
Читайте также:


