После операции обнаружен золотистый стафилококк
Золотистый стафилококк (Staphylococcus aureus) – грамположительная условно-патогенная бактерия, распространенная повсеместно. В норме золотистый стафилококк могжет находиться у человека на слизистой оболочке носа, в брюшной полости и на коже.
Попав в организм человека, золотистый стафилококк вырабатывает токсины и может стать источником сепсиса при снижении иммунитета, вызывая генерализованные инфекции с очагами воспаления во внутренних органах, коже и костно-мышечной системе.
Основные источники инфекции: здоровые (носители) и больные люди, домашние и сельскохозяйственные животные, а также пища, содержащая золотистый стафилококк и его мощные токсины (чаще всего это сахаросодержащие молочные продукты, мороженное, кондитерские изделия без термообработки, салаты и т.п.).
Дети могут инфицироваться от взрослых стафолококконосителей. У детей грудного возраста возможно выделение стафилококка в посевах фекалий.
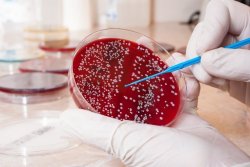
В эпидемиологических целях анализ на выявление патогенного стафилококка обязательно проводят во время ежегодных профилактических осмотров и при предварительных осмотрах для приема на работу в сферы обслуживания населения: медицины, образования, питания и торговли. В данном случае посев выполняется из носа и зева.
При наличии патогенного стафилококка в пробе обследуемого, через 18-24 часа наблюдается рост колоний золотистого цвета. В этом случае обязательно определяется количество стафилококка. Это необходимо врачу для решения вопроса о том, нужно ли проводить лечение.
Наличие золотистого стафилококка не обязательно означает инфекцию, это может быть бессимптомное носительство, например, при посеве мазков из носа и зева носительством считается количество бактерий до 10 3 КОЕ. Однако более высокие показатели говорят о том, что это уже не бессимптомное носительство, а то, что выявленный золотистый стафилококк может являться причиной заболевания.
- Для выяснения бактерионосительства или опасного инфицирования.
- Для подтверждения, что стафилококк является причиной возникшего заболевания (об этом свидетельствуют высокие показатели посева).
- Для определения целесообразности лечения.
- Для контроля за состоянием пациента после проведенного лечения.
Исследование можно пройти по направлению от лечащего врача вашей поликлиники, если есть клинические показания или на платной основе.
Лаборатория клинической микробиологии (бактериологии) Мурманской областной больницы предлагает следующие услуги по обнаружению патогенного стафилококка:
Микробиологическое (культуральное) исследование отделяемого зева на патогенный стафилококк
Микробиологическое (культуральное) исследование отделяемого носа на патогенный стафилококк
Микробиологическое (культуральное) исследование испражнений на стафилококк
Срок выполнения анализа: от 2 до 5 рабочих дней.
Подготовка к исследованию:
- Сбор материала проводится до начала лечения антибактериальными, иммунобиологическими препаратами (общего и местного значения).
- При контроле эффективности лечения (после окончания курса лечения) исследование проводится через 14 дней.
- Мазок из зева собирают натощак или через 3–4 часа после приема пищи.
- Перед взятием мазка из носа нельзя промывать носовые ходы.
- Желательно за 2–3 дня до взятия пробы находиться на диете, исключающей приём продуктов, усиливающих процессы брожения в кишечнике и молочнокислые продукты, а также алкоголь.
- За 3–4 дня до исследования необходимо отменить приём слабительных препаратов, касторового и вазелинового масла и прекратить введение ректальных свечей.
- Фекалии собираются ложечкой в стерильный одноразовый контейнер с завинчивающейся крышкой в количестве не более 1/3 объёма.
- Для получения достоверного результата - пробы фекалий храните в темном месте при температуре не выше 20—25 °С, во избежание чрезмерного размножения кишечной микрофлоры.
- Пробы фекалий не замораживайте.

Хотя новые антибиотики разрабатываются постоянно, пессимистично настроенные эксперты полагают, что выработка устойчивости к ним — это только вопрос времени.
Если верить официальной статистике, количество смертельных случаев от одной из наиболее опасных больничной инфекций — MRSA (метициллин-резистентного золотистого стафилококка) в последние годы значительно увеличилось, а число случаев заражения постоянно растет.
Что такое золотистый стафилококк (MRSA)?
Стафилококки – распространенное семейство бактерий. Они присутствуют у большинства людей и являются частью нормальной микрофлоры кожных покровов, слизистых оболочек и нижнего отдела кишечника. Носительство стафилококка часто встречается и у медицинского персонала.
Заражение стафилококком в больницах и роддомах происходит воздушно-капельным путем и через загрязненные руки медиков. Заразиться можно через открытые раны, ожоги, глаза, кожу, кровь. Возможна передача инфекции с инструментами, катетерами, перевязочным материалом, предметами ухода, а также пищей.
Для лечения MRSA необходимо применение более высокой дозы препаратов, увеличение длительности лечения или использование альтернативного антибактериального средства, к которому данный вид MRSA все еще чувствителен.
Инфицированность MRSA может вызывать широкий спектр симптомов в зависимости от органа, подвергшегося заражению. Признаками заражения являются краснота, отечность и болезненность инфицированного участка. Клинические проявления стафилококковых болезней многообразны – от заболеваний кожи и пневмонии до менингита и сепсиса.
Почему MRSA существует?
Естественный отбор до сих пор является основным принципом развития всего живого. А бактерии живут в этом мире намного дольше, чем мы, поэтому они особенно преуспели в этом. Кроме этого, гены бактерий постоянно видоизменяются, чтобы противостоять основному своему врагу — антибиотику.
Более слабые виды бактерий, столкнувшись с антибиотиком, погибают, в то время как более стойкие просто игнорируют лекарство. Это означает, что в следующий раз вы можете столкнуться уже со стафилококком, который удачно пережил встречу с антибиотиком, а, следовательно, приобрел устойчивость к нему.
Именно поэтому врачи всегда советуют пациентам пропивать весь курс антибиотиков до конца. Если пациент не заканчивает курс лечения, то большинство бактерий умирает, но не все. Выжившие приобретают резистентность (то есть устойчивость) к антибиотикам. А каждая последующая мутация только увеличивает способность бактерий к выживанию.
Применение огромного числа антибиотиков в больницах и роддомах вызывает огромное число мутаций стафилококка, тем самым увеличивая его устойчивость к лекарственным препаратам.
Почему это настолько опасно?
Тот факт, что в больницах стафилококком заражаются чаще, чем вне лечебных учреждений, можно объяснить.
- Во-первых, обитатели больниц обычно более слабы, чем остальное население, что делает их более уязвимыми для инфекции.
- Во-вторых, условия в больницах, где находится большое количество людей на небольших площадях, являются прекрасной средой для передачи инфекций. Инфицированность MRSA может быть очень опасна для ослабленных пациентов и новорожденных, особенно если ее вовремя не распознать и не вылечить правильными антибиотиками.
Каковы перспективы?
Сильную обеспокоенность у врачей вызывают сообщения об увеличении количества инфекций и смертельных случаев из-за MRSA. Может случиться так, что сформируется вид стафилококка, устойчивый ко всем антибиотикам. Уже существует VRSA или ванкомицин-резистентный Staphylococcus Aureus, устойчивый к ванкомицину. А в Великобритании зафиксирован GISA или гликопептид-резистентный Staphylococcus aureus, соответственно устойчивый к гликопептидам.
Хотя новые антибиотики разрабатываются постоянно, пессимистично настроенные эксперты полагают, что выработка устойчивости к ним — это только вопрос времени.
Одна из главных причин появления устойчивых к лекарствам микробов — злоупотребление антибиотиками. Сплошь и рядом встречается назначение врачом антибиотиков пациентам с вирусной инфекцией. При этом антибиотики не оказывают никакого эффекта на вирусы. Зато бактерии в организме от применения антибиотиков прекрасно себя чувствуют — мутируют и размножаются. Поэтому сейчас врачам рекомендовано сократить назначение антибиотиков.
Важным фактором в защите пациентов от MRSA является улучшение гигиенических условий больниц. Ручные осмотры в больницах в настоящее время приносят больше вреда, чем пользы, так как благодаря им разносится инфекция. Решением этой проблемы видится тщательная обработка рук после каждого пациента. Есть также предложение ввести в штат больниц специальную должность медсестры, ответственной за чистоту (в российских ЛПУ обычно эти обязанности возлагаются на старшую медсестру отделения).
Пока врачи ищут способ борьбы с MRSA, число инфицированных неуклонно растет. А многие эксперты сходятся во мнении, что может потребоваться очень крупное научное достижение, родственное открытию пенициллина, для того, чтобы люди получили возможность эффективно противостоять устойчивым бактериям.

Осень – пора частых простуд и вирусных инфекций. Если вы часто болеете, не спешите пить антибиотики. А вдруг ваше заболевание спровоцировал стафилококк? На него антибиотики не действуют, нужно специальное лечение.
“Ангины” и “простуды”
В этой статье речь пойдет о стафилококке – провокаторе множества болезней. Стафилококк – это бактерия, которая обитает на кожном покрове каждого человека без исключения. Также стафилококк любит пребывать в слизистой оболочке, в глотке, в носу и во рту.
При наличии определенных, располагающих к этому условий бактерия может проявлять активность и вызвать воспалительный процесс любого органа или группы органов. Это может быть кожа, нервная ткань, мозг, сердце, пищеварительная система.Чаще всего стафилококк “расцветает” в носоглотке. Отсюда частые “ангины” и “простуды”. На самом деле в носоглотке может быть превышена норма стафилококков, заявляют медики . И если это так, то полоскать ромашкой и пить антибиотики – лишний перевод денег и вред организму.
Стафилококк устойчив к антибиотикам. Здесь нужен особый подход. Попросите у терапевта направление на мазок из носа и горла и сдайте его. Этот анализ (он делается во многих поликлиниках бесплатно) поможет выявить, не превышено ли у вас число стафилококков. Опасность стафилококков состоит в том, что они вырабатывают токсины и ферменты, которые разрушают клетки организма. Эти бактерии разрушительно влияют на соединительные ткани, кожу и подкожную клетчатку. Они вызывают ряд опаснейших заболеваний, среди которых сепсис, токсический шок, расстройства центральной нервной системы, пневмония, гнойные кожные поражения, общая интоксикация организма.
Часто именно со стафилококковой инфекцией связывают осложнения после воспалительных заболеваний и хирургических операций.Стафилококки устойчивы в окружающей среде и имеют достаточно высокую сопротивляемость действию антибиотиков. Поэтому если вы заметили, что у вас часто болит горло и вам не помогают обычные лекарства, сдайте мазок из горла. Возможно, у вас стафилококк, который лечится очень узкой группой препаратов, которые должен назначить врач.
27 штаммов
Стафилококк имеет большое количество штаммов (27), наиболее распространенными и патогенными из которых являются золотистый, эпидермальный, сапрофитный и гемолитический стафилококки. Существуют три вида стафилококка, которые наиболее распространены и вредоносны для человеческого организма.
Сапрофитный стафилококк – чаще всего поражает женщин, вызывая у них воспалительные заболевания мочевого пузыря (цистит) и почек. Бактерии сапрофитного стафилококка локализуются в слоях кожи гениталий и слизистой оболочке мочеиспускательного канала. Из всех видов стафилококка он вызывает наименьшие поражения.
Эпидермальный стафилококк – может обитать на всех слизистых и любом участке кожи человека. При нормальном иммунитете организм справляется с этой бактерией, и она не вызывает каких-либо болезней. Но если каким-то образом эпидермальный стафилококк попадает с кожи в кровь человека со слабым иммунитетом (после хирургической операции), вследствие заражения крови может развиться воспаление эндокарда (внутренней оболочки сердца).
Золотистый стафилококк является самым распространенным и опасным видом. Заражению подвержены в равной степени взрослые и дети, мужчины и женщины. Бактерия может поражать любые органы, провоцируя воспалительные заболевания, количество которых превышает сотню. Это чрезвычайно стойкий и живучий микроорганизм, отмечают медики. Он выдерживает высокие температуры, воздействие прямых солнечных лучей, 100%-го этилового спирта, перекиси водорода и ряда антибиотиков. Золотистый стафилококк становится причиной гнойных поражений кожи – чириев, фурункулов, ячменей.
Он также вызывает большое количество инфекций: стафилококковый сепсис, пневмонию, токсический шок, образование гнойников в мозге, сердце, печени и почках, остеомиелит, пищевое отравление.
От насморка до воспаления легких
Можно выделить следующие, наиболее часто встречающиеся заболевания, вызванные стафилококком: Пиодермия. В результате внедрения бактерии под кожу возникает гнойный воспалительный процесс. В некоторых случаях происходит повышение температуры, могут наблюдаться рвота и тошнота.
Ринит. Вызывая воспалительный процесс в слизистой оболочке носа, бактерия приводит к обильному выделению слизи, которая затрудняет носовое дыхание.
Синусит. Характеризуется воспалительным процессом, локализующимся в придаточных пазухах носа. Чаще других страдают гайморовы и лобные отделы, что приводит к развитию таких болезней, как гайморит или фронтит.
Бронхит. Чаще всего начинается с развития патологического процесса в верхних дыхательных путях с постепенным переходом на гортань, трахею и бронхи. Пневмония. При поражении легочной ткани стафилококковой инфекцией заболевание имеет тяжелое течение. Пищевое отравление, спровоцированное стафилококком, развивается остро.
Внештатный специалист министерства здравоохранения АО по инфекционным заболеваниям Татьяна Аршба пояснила, что стафилококк живет у каждого из нас. И мы с ним сосуществуем вполне мирно, до определенного момента.
Эта информация позволит вам узнать, что представляет собой метициллин-резистентный золотистый стафилококк (МРЗС), как он распространяется и как лечатся вызываемые МРЗС инфекции.
Что представляет собой метициллин-резистентный золотистый стафилококк?
Стафилококк (Staphylococcus) — это вид бактерий, обитающих в окружающей среде, в том числе и на поверхности кожи человека. Метициллин-резистентный золотистый стафилококк (МРЗС) — это стойкий к определенным антибиотикам вид стафилококка. Это означает, что некоторые методы лечения не справятся с ним или будут менее эффективными.
МРЗС может вызывать различные заболевания, например:
В чем состоит разница между колонизацией и инфицированием МРЗС?
Человек может быть либо колонизирован, либо инфицирован МРЗС. Колонизация означает наличие бактерий на коже или в организме человека при отсутствии каких-либо симптомов. Инфицирование означает наличие бактерий на коже или в организме, приводящее к появлению симптомов.
Как распространяется МРЗС?
Большинство инфекций, вызываемых МРЗС, распространяется через прямой контакт с физиологическими жидкостями инфицированного человека, такими как кровь, выделения из раны, моча, стул или мокрота (флегма). Также они могут распространяться через контакт с оборудованием или поверхностями, на которых могут находиться эти бактерии. МРЗС не распространяются при простом контакте, например через прикосновение или объятие.
Кто подвержен риску инфицирования МРЗС?
Заразиться инфекцией, вызываемой МРЗС, с большей вероятностью могут лица:
Каковы симптомы инфекции МРЗС?
Ваши симптомы будут зависеть от места возникновения инфекции и от типа инфекции.
Каковы методы лечения инфекции, вызываемой МРЗС?
Инфекции, вызываемые МРЗС, лечатся антибиотиками, к которым у вызвавших их бактерий нет устойчивости.
Какие меры по изоляции принимаются в больнице, если у меня обнаружена инфекция, вызываемая МРЗС?
Меры по изоляции - это мероприятия, которые мы проводим, чтобы предотвратить распространение инфекции среди пациентов. Если во время пребывания в больнице у вас диагностировали инфекцию, вызываемую МРЗС, или вы подверглись риску заражения этой инфекцией:
- Вас поместят в отдельную палату.
- На вашей двери повесят табличку с информацией о том, что весь персонал и посетители должны вымыть руки с мылом или протереть их спиртосодержащим антисептиком для рук перед входом и после выхода из вашей палаты.
- Весь персонал и все посетители, входящие в вашу палату, должны надеть желтый халат и перчатки. Они выдаются за пределами вашей палаты и могут быть утилизированы в вашей палате.
- Если вы выходите из палаты для проведения исследований, вам следует надеть желтый халат и перчатки или покрыться чистой простыней.
- Если вы выходите из своей палаты, чтобы прогуляться по отделению, вам следует надеть желтый халат и перчатки.
- Вам запрещен доступ в следующие зоны больницы:
- кладовая для продуктов в вашем отделении;
- центр отдыха в M15;
- детские зоны отдыха в M9;
- кафетерий;
- основной вестибюль;
- любые другие зоны общего пользования на территории больницы.
- При соблюдении мер по изоляции у вас в палате могут проводиться сеансы арт-терапии или массажа.
Врач скажет вам, когда можно будет прекратить соблюдать эти меры предосторожности. Это произойдет после того, как вы пройдете курс лечения и у вас исчезнут все симптомы.
Какие меры по изоляции мне следует принять дома, если у меня обнаружится инфекция, вызываемая МРЗС?
Дома обязательно делайте следующее:
Где я могу получить дополнительную информацию о МРЗС?
Если у вас есть вопросы, обратитесь к своему врачу или медсестре/медбрату. Кроме того, для получения дополнительной информации вы можете посетить веб-сайты:
Проблема стафилококковых инфекций на протяжении последних десятилетий является одной из наиболее важных и интересных для медицины, приобретая все большую актуальность. Заболевания, этиологически связанные только с золотистым стафилококком, представлены в патологии человека различными нозологическими формами, относящимися к 11 классам болезням Утрата трудоспособности из-за стафилококковых инфекций превышает таковую от всех острых инфекций, за исключением гриппа (Е.А. Акатов, 1993).
Недостаточно изучены и экологические аспекты стафилококковых инфекций, что свидетельствует о необходимости проведения дальнейших исследований в этом направлении.
Целью настоящего исследования явилось изучение распространенности S.aureus среди практически здоровых людей и больных хирургических и терапевтических стационаров с проведением анализа биологического и молекулярно-генетического типирования этих микроорганизмов.
Материал и методы исследования
Для достижения поставленной цели было проведено обследование 445 практически здоровых людей и 448 больных, находящихся в стационарах г. Волгограда. объектом исследования служили также 50 человек медицинского персонала.
Молекулярно-генетическое исследование с помощью генетического типирования штаммов - плазмидного анализа по методу Т. Маниатис с соавт. (1984) и случайной амплификации полиморфной бактериальной ДНК. Анализ генетического полиморфизма штаммов проведен методом амплификации с произвольными праймерами (J. Marmur, 1998). Кластерный анализ и градиотображение матрикса коэффициентов сходства производили при помощи программ Tree Confor Window v.1.3b.
Полученные результаты и их обсуждение
Изучение носительства стафилококков проводили у жителей, проживающих в 8 различных районах города Волгограда, который был разделен на 3 топодема: северный, центральный и южный.
В ходе исследования выделено и подвергнуто идентификации 545 штаммов микроорганизмов. Анализ полученных данных показал, что частота обнаружения стафилококков на слизистых оболочках передних отделов носовых ходов зависела от региона проживания. Так, в Северном модельном районе золотистый стафилококк обнаруживали у 52,7 % обследуемых, у жителей Центральной части города частота носительства этого микроба составила 44,6 %. В наиболее неблагополучном Южном топодеме показатели носительства достигали 55,1 %.
С целью установления принадлежности штамма к определенному типу, все выделенные культуры S.aureus были дифференцированы нами на резидентные и транзиторные с использованием математической модели дифференции. Полученные данные позволили оценить уровни резидентного бактерионосительства у практически здоровых людей.
В результате проведенных исследований было установлено, что топодемы, имеющие наибольшие показатели экологического неблагополучия, характеризовались высоким уровнем резидентного бактерионосительства. Показатели резидентного бактерионосительства у практически здоровых людей Волгограда в виде ранжированного ряда выглядели следующим образом: северный топодем - 44,7 %, южный - 42,9 %, центральный - 28,2 %. Минимальная величина - 17,1 % была установлена нами для контрольного Центрального района. Данное значение было принято за фоновый уровень бактерионосительства. На основе полученных данных был рассчитан коэффициент резидентного бактерионосительства для всех топодемов, который отражал соотношение уровня резидентного бактерионосительства у людей в исследуемой зоне и аналогичного показателя контрольной (фоновой) зоны. Установлено, что в топодемах с высокой техногенной нагрузкой коэффициенты составили 2,61 (Северный) и 2,51 (Южный).
Полученные данные дают основание утверждать, что в г.Волгограде даже в топодемах с высоким уровнем техногенного воздействия ситуация не является критической, а скорее может быть расценена как угрожающая.
В последние годы участились сообщения о возрастающей роли стафилококков при внутрибольничных инфекциях, в связи с этим представляло интерес изучение колонизации стафилококками слизистой оболочки носовой полости медицинского персонала и пациентов терапевтического и хирургического профиля.
Анализ данных показал, что представители рода Staphylococcus обнаруживались у 79,0 % обследуемых, вегетируя в изучаемом биотопе с различной частотой. В среднем величина обсемененности составила lg 2,06 ± 0,04 КОЕ/см2. Установлено, что для лиц, находящихся в стационаре терапевтического профиля характерна более высокая обсемененность стафилококками (48,85%), чем хирургического (28,5 %), при этом наиболее часто стафилококки контаминировали полость носа медицинского персонала (32,2 % - 32 человека) со средней величиной микробной колонизации lg 2,14 ± 0,12 КОЕ/см2, в то время как у пациентов данные микроорганизмы обнаружены в 16,3 % (13 человек) наблюдений с плотностью обсемененности lg 1,67 ± 0,06 КОЕ/см2
(р
Антибиотики прямо под нашим носом
Немецкие ученые обнаружили новое оружие для борьбы с больничным монстром – мультирезистентным золотистым стафилококком. Долгие годы оно скрывалось не в вечной мерзлоте или Марианской впадине, а прямо под нашим носом. Вернее – в нём.
В последние годы во всем мире увеличилось количество инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. Организмы с множественной лекарственной резистентностью (multidrug-resistant organisms, MDRO), такие как метициллин-резистентный золотистый стафилококк, нечувствительные к ванкомицину энтерококки или резистентные к цефалоспоринам третьего поколения грамотрицательные бактерии, в ближайшие десятилетия могут стать более частыми причинами смерти, чем рак [1].
Несколько лет назад удалось обнаружить, что представители человеческой микробиоты способны производить бактериоцины, поражающие близкородственных бактерий [2]. Например, в 2014 году из человеческого комменсала Lactobacillus gasseri выделили и описали новый синтезируемый рибосомами тиопептидный антибиотик – лактоциллин [3].
Немецкий исследователь Александр Ципперер со своими сотрудниками в июле 2016 года сообщил о том, что обнаружил в человеческом носу бактерию Staphylococcus lugdunensis IVK28, которая подавляет рост метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) [1].
Стафилококки относятся к типичным бактериям-комменсалам, колонизирующим кожу и поверхности слизистых оболочек. Staphylococcus aureus – шаровидные грамположительные бактерии, вырабатывающие каротиноидный пигмент, который придает их клеткам золотистый цвет (рис. 1). Эти микроорганизмы чрезвычайно устойчивы к внешним воздействиям и выживают в воздухе, пыли, почве, продуктах питания, на оборудовании пищевых производств и предметах быта [6, 7].

Рисунок 1. Staphylococcus aureus и лейкоциты. Рисунок с сайта relatedscience.blogspot.ru.
Staphylococcus aureus – бактерия условно-патогенная, проявляющая свои патологические свойства только в благоприятных условиях, а создает их, как правило, ослабление иммунитета носителя. Активная жизнедеятельность стафилококка может привести к разнообразным заболеваниям [5, 7, 8]:
- кожи (прыщи, фурункулы, синдром ошпаренной кожи);
- органов дыхания (плеврит, пневмония);
- костной и соединительной тканей (артрит, остеомиелит);
- нервной системы и органов чувств (отит, менингит);
- сердечно-сосудистой системы (эндокардит, флебит, стафилококковая бактериемия).
Факторы патогенности S.aureus – это микрокапсула, компоненты клеточной стенки, ферменты агрессии и токсины. Микрокапсулы защищают клетки бактерий от фагоцитоза, способствуют их адгезии и распространению по организму хозяина. Составляющие клеточной стенки (например пептидогликан, тейхоевые кислоты и белок А) вызывают развитие воспаления, обездвиживают фагоциты и нейтрализуют иммуноглобулины. Коагулаза, главный фермент агрессии, вызывает свертывание плазмы крови [7, 9].
Наиболее опасны метициллин-резистентные стафилококки (methicillin-resistant S.aureus, MRSA) (рис. 2). Метициллин – это модифицированный пенициллин, с помощью которого еще недавно успешно боролись со стафилококковой инфекцией. MRSA устойчивы не только к метициллину, но и к другим антибиотикам пенициллиновой группы (диклоксациллину, оксациллину, нафциллину и др.), а также к цефалоспоринам.

Рисунок 2 (с сайта thinglink.com). Метициллин-резистентные золотистые стафилококки.
В последнее время выявлены штаммы и с более широким спектром устойчивости: ванкомицин-резистентные (VRSA) и гликопептид-резистентные (GISA) [6, 9, 10].
Штамм S.lugdunensis IVK28 эффективно боролся со своим вредоносным родственником лишь в условиях недостатка железа и только на твердых агаризованных средах (рис. 3, слева). Механизм противостояния был неясен, а потому Ципперер провел транспозонный мутагенез клеток выделенного штамма – чтобы выявить ген, ответственный за синтез смертельного для S.aureus вещества.

В итоге удалось получить мутанта IVK28, который не мог подавлять рост MRSA. Анализ места встройки транспозона показал, что тот нарушил структуру гена предполагаемой нерибосомной пептидсинтетазы (НРПС). Оказалось, что этот ген вместе с другими последовательностями, связанными с биосинтезом антибиотиков, входит в состав оперона размером 30 т.п.н. Это указывало на то, что предполагаемая молекула ингибитора может быть комплексом нерибосомных пептидов.
Оперон методом ПЦР обнаружили во всех культурах S.lugdunensis, а значит, он характерен для всего вида, а не только для штамма IVK28. Однако GC-состав оперона (26,9%) отличался от GC-состава остального генома S.lugdunensis (33,8%), что свидетельствовало о возможном заимствовании этого полезного генетического кластера у других видов бактерий – путем горизонтального переноса.
Оперон состоит из генов lugA, B, C и D, кодирующих пептидсинтетазные белки (см. врезку ниже), а также из других генов, чьи продукты необходимы для синтеза и транспорта нерибосомного пептида.
Чтобы окончательно вменить оперону участие в антибактериальной деятельности S.lugdunensis, наименьший ген (lugD) удалили. Мутант ΔlugD, как и ожидалось, не мог подавлять рост золотистого стафилококка, но когда в него ввели плазмиду с работающим геном lugD, агрессивный фенотип восстановился (рис. 3, в центре и справа).
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.

Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров – белков, ДНК и пептидогликанов [5].
Этот класс пептидов синтезируется в клетках низших грибов и бактерий без участия рибосом. Нерибосомные пептиды (НРП) также встречаются и у высших организмов, которые имеют бактерий-комменсалов [12].
НРП подразделяются на несколько функциональных групп [13]:
- антибиотики (ванкомицин);
- предшественники антибиотиков (ACV-трипептид – предшественник пенициллина и цефалоспорина);
- иммуносупрессоры (циклоспорин);
- противоопухолевые пептиды (блеомицин);
- сидерофоры (пиовердин);
- токсины (HC-токсин);
- сурфактанты (сурфактин).
Каждый модуль состоит как минимум из трех доменов:
- конденсирующего (принимающего пептидную цепь из предыдущего модуля);
- аденилирующего (выбирающего нужную аминокислоту);
- пептидильного (образующего пептидную связь).
Нередко модули включают и другие домены, в том числе эпимеризующий, который преобразует L-аминокислоты в D-формы [14].
По аналогии с триплетным рибосомным кодом для синтеза белка существует и нерибосомный, код НРПС, определяемый 10 остатками аминокислот в субстрат-связывающем кармане аденилирующего домена. От комбинации этих остатков зависит то, какая аминокислота будет встроена в пептид конкретным модулем НРПС. Зная этот код, можно предсказывать субстратную специфичность аденилирующих доменов и даже произвольно изменять ее посредством замены аминокислот в домене [14].
В экспериментах немецких ученых лугдунин действовал не только на метициллин-резистентных стафилококков, но и на гликопротеин-резистентных, и даже на других грамположительных бактерий типа листерии и ванкомицин-резистентного энтерококка (табл. 1). Минимальная ингибирующая концентрация (МИК) нового бактериоцина – 1,5–12 мкг × мл −1 , что говорит о высокой активности вещества. При этом такие концентрации никак не влияли на человеческую сыворотку, не вызывали лизис нейтрофилов или эритроцитов и не ингибировали метаболическую активность моноцитов. Бактериальные же клетки под действием лугдунина в концентрации даже ниже МИК прекращали синтезировать ДНК, РНК, белки и компоненты клеточной стенки. В этом отношении лугдунин напоминает даптомицин, дающий такой же эффект, но способ действия которого пока не изучен. Не было отмечено возникновения резистентности клеток S.aureus к лугдунину даже после их месячного выращивания на малых концентрациях.
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл −1 ) | |||||
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 | |||||
| + 50% человеческой сыворотки крови | 1,5 | ||||||
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 | |||||
| Staphylococcus aureus Mu50 | GISA | 3 | |||||
| Staphylococcus aureus SA113 | 3 | ||||||
| Staphylococcus aureus RN4220 | 3 | ||||||
| Enterococcus faecium BK463 | VRE | 3 | |||||
| Enterococcus faecalis VRE366 | VRE | 12 | |||||
| Listeria monocytogenes ATCC19118 | 6 | ||||||
| Streptococcus pneumoniae ATCC49619 | 1,5 | ||||||
| Bacillus subtilis 168 (trpC2) | 4 | ||||||
| Pseudomonas aeruginosa PAO1 | >50 | ||||||
| Escherichia coli DH5α | >50 | ||||||
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. | |||||||
Испытания в боевых условиях
Как и полагается, способность лугдунина лечить стафилококковые инфекции продемонстрировали in vivo на мышиной модели (рис. 5). У шести мышей сбрили шерсть на спине и, повредив кожу многократным приклеиванием/отклеиванием пластыря, нанесли на это место золотистого стафилококка. Затем кожу обработали мазью, содержащей 1,5 мкг лугдунина, и спустя шесть часов оценили результат. Обработка новым антибиотиком сильно сокращала или даже полностью уничтожала популяцию S.aureus. Причем не только на поверхности кожи, но и в более глубоких ее слоях.

Рисунок 5. Общая схема подхода к идентификации природного антибиотика. Из бактериальных популяций человеческого тела отбирают представителей, которые не могут сосуществовать с интересующими патогенными бактериями. Этих возможных конкурентов тестируют по отдельности на средах с инфекционным агентом. Из культуры, успешно подавляющей рост патогенов, выделяют антибиотик, действие которого проверяют на животных моделях. Рисунок из [5], модифицирован и адаптирован.
Чтобы понять, может ли S.lugdunensis помешать колонизации носовой полости позвоночных животных золотистым стафилококком в естественных условиях, ученые провели следующий эксперимент. В носы хлопковых хомяков ввели два вида смешанных культур (S.aureus + S.lugdunensis IVK28 и S.aureus + S.lugdunensis IVK28ΔlugD) и каждую по отдельности. В контрольных случаях, когда вводили по одному штамму, все три культуры стабильно колонизировали носовую полость. Однако при введении смеси S.aureus + S.lugdunensis IVK28 количество золотистого стафилококка через 5 дней значительно уменьшилось по сравнению со смесью S.aureus + S.lugdunensis IVK28ΔlugD. Этот эксперимент показал, что продукция лугдунина позволяет штамму IVK28 эффективно конкурировать с золотистым стафилококком in vivo.
Оставалось разобраться, предотвращает ли присутствие S.lugdunensis в носу человека колонизацию бактериями S.aureus. Ципперер и его коллеги исследовали мазки из носовых ходов 187 госпитализированных больных. Из них у 60 человек (32,1%) обнаружили золотистого стафилококка и у 17 человек (9,1%) – S.lugdunensis. И только у одного пациента с S.lugdunensis в носу обитал S.aureus. У всех выделенных штаммов S.lugdunensis ПЦР-анализ продемонстрировал наличие lug-оперона, а все обнаруженные штаммы S.aureus оказались восприимчивы к лугдунину.
Лугдунин оказался первым обнаруженным бактериоцином нового класса – макроциклических тиазолидиновых пептидных антибиотиков. Все проверенные штаммы S.aureus (как природные, так и лабораторные) не смогли выработать резистентности к нему. Это дает надежду на то, что лугдунин в будущем станет коммерческим препаратом для борьбы с золотистым стафилококком.
И наконец, сам факт обнаружения нового антибиотика у представителя человеческой микробиоты должен послужить стимулом для активизации поиска других продуцентов бактериоцинов в составе именно таких сообществ. В дальнейшем это поможет медикам успешнее сдерживать наступление мультирезистентных патогенов.
Читайте также:


