Стафилококк золотистый в поджелудочной железе
16 августа 2016
- 9970
- 7,0
- 0
- 6
Структурная формула нового пептидного антибиотика.
Немецкие ученые обнаружили новое оружие для борьбы с больничным монстром — мультирезистентным золотистым стафилококком. Долгие годы оно скрывалось не в вечной мерзлоте или Марианской впадине, а прямо под нашим носом. Вернее — в нём.
В последние годы во всем мире увеличилось количество инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. Организмы с множественной лекарственной резистентностью (multidrug-resistant organisms, MDRO), такие как метициллин-резистентный золотистый стафилококк, нечувствительные к ванкомицину энтерококки или резистентные к цефалоспоринам третьего поколения грамотрицательные бактерии, в ближайшие десятилетия могут стать более частыми причинами смерти, чем рак [1].
Несколько лет назад удалось обнаружить, что представители человеческой микробиоты способны производить бактериоцины, поражающие близкородственных бактерий [2]. Например, в 2014 году из человеческого комменсала Lactobacillus gasseri выделили и описали новый синтезируемый рибосомами тиопептидный антибиотик — лактоциллин [3].
Семейные разборки
Немецкий исследователь Александр Ципперер со своими сотрудниками в июле 2016 года сообщил о том, что обнаружил в человеческом носу бактерию Staphylococcus lugdunensis IVK28, которая подавляет рост метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) [1].
Стафилококки относятся к типичным бактериям-комменсалам, колонизирующим кожу и поверхности слизистых оболочек. Staphylococcus aureus — шаровидные грамположительные бактерии, вырабатывающие каротиноидный пигмент, который придает их клеткам золотистый цвет (рис. 1). Эти микроорганизмы чрезвычайно устойчивы к внешним воздействиям и выживают в воздухе, пыли, почве, продуктах питания, на оборудовании пищевых производств и предметах быта [6], [7].
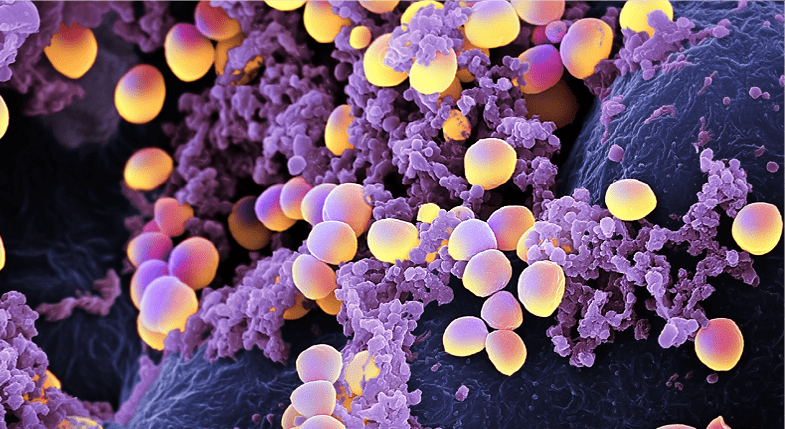
Рисунок 1. Staphylococcus aureus и лейкоциты.
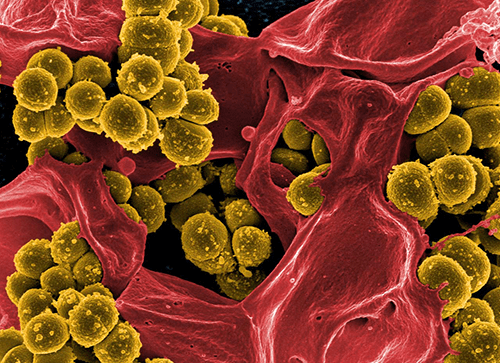
Рисунок 2. Метициллин-резистентные золотистые стафилококки.
Staphylococcus aureus — бактерия условно-патогенная, проявляющая свои патологические свойства только в благоприятных условиях, а создает их, как правило, ослабление иммунитета носителя. Активная жизнедеятельность стафилококка может привести к разнообразным заболеваниям [5], [7], [8]:
- кожи (прыщи, фурункулы, синдром ошпаренной кожи);
- органов дыхания (плеврит, пневмония);
- костной и соединительной тканей (артрит, остеомиелит);
- нервной системы и органов чувств (отит, менингит);
- сердечно-сосудистой системы (эндокардит, флебит, стафилококковая бактериемия).
Факторы патогенности S. aureus — это микрокапсула, компоненты клеточной стенки, ферменты агрессии и токсины. Микрокапсулы защищают клетки бактерий от фагоцитоза, способствуют их адгезии и распространению по организму хозяина. Составляющие клеточной стенки (например пептидогликан, тейхоевые кислоты и белок А) вызывают развитие воспаления, обездвиживают фагоциты и нейтрализуют иммуноглобулины. Коагулаза, главный фермент агрессии, вызывает свертывание плазмы крови [7], [9].
Наиболее опасны метициллин-резистентные стафилококки (methicillin-resistant S. aureus, MRSA) (рис. 2). Метициллин — это модифицированный пенициллин, с помощью которого еще недавно успешно боролись со стафилококковой инфекцией. MRSA устойчивы не только к метициллину, но и к другим антибиотикам пенициллиновой группы (диклоксациллину, оксациллину, нафциллину и др.), а также к цефалоспоринам. В последнее время выявлены штаммы и с более широким спектром устойчивости: ванкомицин-резистентные (VRSA) и гликопептид-резистентные (GISA) [6], [9], [10].
Штамм S. lugdunensis IVK28 эффективно боролся со своим вредоносным родственником лишь в условиях недостатка железа и только на твердых агаризованных средах (рис. 3, слева). Механизм противостояния был неясен, а потому Ципперер провел транспозонный мутагенез клеток выделенного штамма — чтобы выявить ген, ответственный за синтез смертельного для S. aureus вещества.

В итоге удалось получить мутанта IVK28, который не мог подавлять рост MRSA. Анализ места встройки транспозона показал, что тот нарушил структуру гена предполагаемой нерибосомной пептидсинтетазы (НРПС). Оказалось, что этот ген вместе с другими последовательностями, связанными с биосинтезом антибиотиков, входит в состав оперона размером 30 т.п.н. Это указывало на то, что предполагаемая молекула ингибитора может быть комплексом нерибосомных пептидов.
Оперон методом ПЦР обнаружили во всех культурах S. lugdunensis, а значит, он характерен для всего вида, а не только для штамма IVK28. Однако GC-состав оперона (26,9%) отличался от GC-состава остального генома S. lugdunensis (33,8%), что свидетельствовало о возможном заимствовании этого полезного генетического кластера у других видов бактерий — путем горизонтального переноса .
Оперон состоит из генов lugA, B, C и D, кодирующих пептидсинтетазные белки (см. врезку ниже), а также из других генов, чьи продукты необходимы для синтеза и транспорта нерибосомного пептида.
Чтобы окончательно вменить оперону участие в антибактериальной деятельности S. lugdunensis, наименьший ген (lugD) удалили. Мутант ΔlugD, как и ожидалось, не мог подавлять рост золотистого стафилококка, но когда в него ввели плазмиду с работающим геном lugD, агрессивный фенотип восстановился (рис. 3, в центре и справа).
Секретное оружие
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.
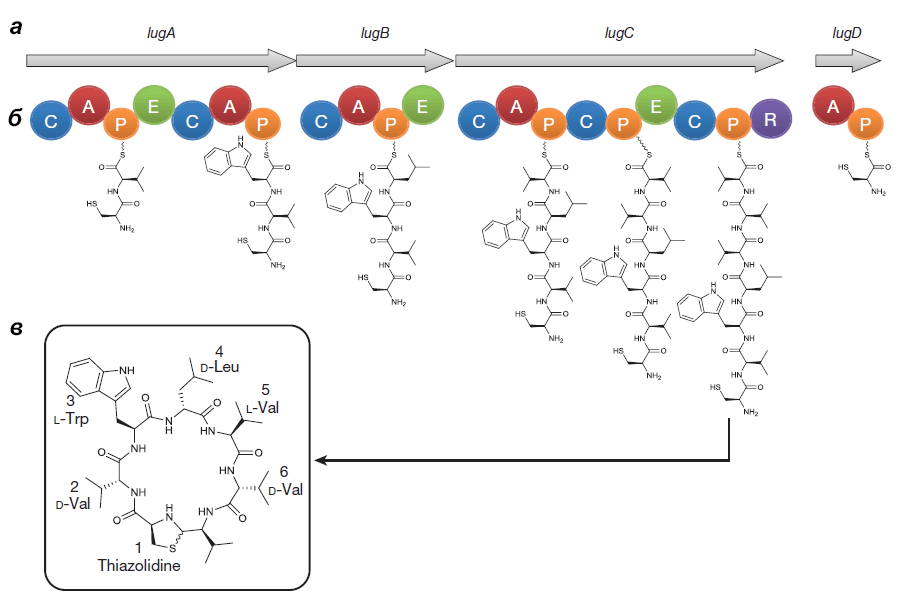
Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров — белков, ДНК и пептидогликанов [5].
Этот класс пептидов синтезируется в клетках низших грибов и бактерий без участия рибосом. Нерибосомные пептиды (НРП) также встречаются и у высших организмов, которые имеют бактерий-комменсалов [12].
НРП подразделяются на несколько функциональных групп [13]:
- антибиотики (ванкомицин);
- предшественники антибиотиков (ACV-трипептид — предшественник пенициллина и цефалоспорина);
- иммуносупрессоры (циклоспорин);
- противоопухолевые пептиды (блеомицин);
- сидерофоры (пиовердин);
- токсины (HC-токсин);
- сурфактанты (сурфактин).
Каждый модуль состоит как минимум из трех доменов:
- конденсирующего (принимающего пептидную цепь из предыдущего модуля);
- аденилирующего (выбирающего нужную аминокислоту);
- пептидильного (образующего пептидную связь).
Нередко модули включают и другие домены, в том числе эпимеризующий, который преобразует L-аминокислоты в D-формы [14].
По аналогии с триплетным рибосомным кодом для синтеза белка существует и нерибосомный, код НРПС, определяемый 10 остатками аминокислот в субстрат-связывающем кармане аденилирующего домена. От комбинации этих остатков зависит то, какая аминокислота будет встроена в пептид конкретным модулем НРПС. Зная этот код, можно предсказывать субстратную специфичность аденилирующих доменов и даже произвольно изменять ее посредством замены аминокислот в домене [14].
В экспериментах немецких ученых лугдунин действовал не только на метициллин-резистентных стафилококков, но и на гликопротеин-резистентных, и даже на других грамположительных бактерий типа листерии и ванкомицин-резистентного энтерококка (табл. 1). Минимальная ингибирующая концентрация (МИК) нового бактериоцина — 1,5–12 мкг × мл −1 , что говорит о высокой активности вещества. При этом такие концентрации никак не влияли на человеческую сыворотку, не вызывали лизис нейтрофилов или эритроцитов и не ингибировали метаболическую активность моноцитов. Бактериальные же клетки под действием лугдунина в концентрации даже ниже МИК прекращали синтезировать ДНК, РНК, белки и компоненты клеточной стенки. В этом отношении лугдунин напоминает даптомицин, дающий такой же эффект, но способ действия которого пока не изучен. Не было отмечено возникновения резистентности клеток S. aureus к лугдунину даже после их месячного выращивания на малых концентрациях.
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл −1 ) |
|---|---|---|
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 |
| + 50% человеческой сыворотки крови | 1,5 | |
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 |
| Staphylococcus aureus Mu50 | GISA | 3 |
| Staphylococcus aureus SA113 | 3 | |
| Staphylococcus aureus RN4220 | 3 | |
| Enterococcus faecium BK463 | VRE | 3 |
| Enterococcus faecalis VRE366 | VRE | 12 |
| Listeria monocytogenes ATCC19118 | 6 | |
| Streptococcus pneumoniae ATCC49619 | 1,5 | |
| Bacillus subtilis 168 (trpC2) | 4 | |
| Pseudomonas aeruginosa PAO1 | >50 | |
| Escherichia coli DH5α | >50 | |
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. | ||
Испытания в боевых условиях
Как и полагается, способность лугдунина лечить стафилококковые инфекции продемонстрировали in vivo на мышиной модели (рис. 5). У шести мышей сбрили шерсть на спине и, повредив кожу многократным приклеиванием/отклеиванием пластыря, нанесли на это место золотистого стафилококка. Затем кожу обработали мазью, содержащей 1,5 мкг лугдунина, и спустя шесть часов оценили результат. Обработка новым антибиотиком сильно сокращала или даже полностью уничтожала популяцию S. aureus. Причем не только на поверхности кожи, но и в более глубоких ее слоях.
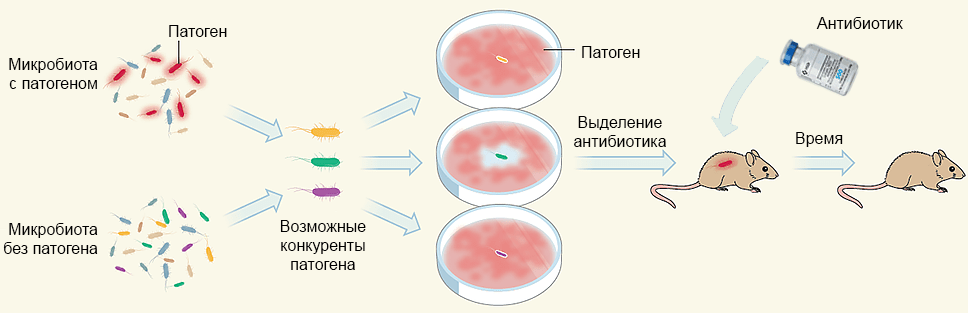
Рисунок 5. Общая схема подхода к идентификации природного антибиотика. Из бактериальных популяций человеческого тела отбирают представителей, которые не могут сосуществовать с интересующими патогенными бактериями. Этих возможных конкурентов тестируют по отдельности на средах с инфекционным агентом. Из культуры, успешно подавляющей рост патогенов, выделяют антибиотик, действие которого проверяют на животных моделях.
[5], рисунок модифицирован и адаптирован
Чтобы понять, может ли S. lugdunensis помешать колонизации носовой полости позвоночных животных золотистым стафилококком в естественных условиях, ученые провели следующий эксперимент. В носы хлопковых хомяков ввели два вида смешанных культур (S. aureus + S. lugdunensis IVK28 и S. aureus + S. lugdunensis IVK28ΔlugD) и каждую по отдельности. В контрольных случаях, когда вводили по одному штамму, все три культуры стабильно колонизировали носовую полость. Однако при введении смеси S. aureus + S. lugdunensis IVK28 количество золотистого стафилококка через 5 дней значительно уменьшилось по сравнению со смесью S. aureus + S. lugdunensis IVK28ΔlugD. Этот эксперимент показал, что продукция лугдунина позволяет штамму IVK28 эффективно конкурировать с золотистым стафилококком in vivo.
Оставалось разобраться, предотвращает ли присутствие S. lugdunensis в носу человека колонизацию бактериями S. aureus. Ципперер и его коллеги исследовали мазки из носовых ходов 187 госпитализированных больных. Из них у 60 человек (32,1%) обнаружили золотистого стафилококка и у 17 человек (9,1%) — S. lugdunensis. И только у одного пациента с S. lugdunensis в носу обитал S. aureus. У всех выделенных штаммов S. lugdunensis ПЦР-анализ продемонстрировал наличие lug-оперона, а все обнаруженные штаммы S. aureus оказались восприимчивы к лугдунину.
Перспективы
Лугдунин оказался первым обнаруженным бактериоцином нового класса — макроциклических тиазолидиновых пептидных антибиотиков. Все проверенные штаммы S. aureus (как природные, так и лабораторные) не смогли выработать резистентности к нему. Это дает надежду на то, что лугдунин в будущем станет коммерческим препаратом для борьбы с золотистым стафилококком.
И наконец, сам факт обнаружения нового антибиотика у представителя человеческой микробиоты должен послужить стимулом для активизации поиска других продуцентов бактериоцинов в составе именно таких сообществ. В дальнейшем это поможет медикам успешнее сдерживать наступление мультирезистентных патогенов.
Микробиологическое исследование, позволяющее выявить инфицированность золотистым стафилококком и определить количество возбудителя.
Золотистые стафилококки (Staphylococcus aureus) – грамположительные условно-патогенные бактерии рода Staphylococcus, являющиеся наиболее частой причиной стафилококковых, в частности внутрибольничных, инфекций. Золотистые стафилококки в норме могут располагаться на коже, слизистой оболочке носа и реже в гортани, влагалище, кишечнике. Они встречаются у 30 % здоровых людей.
Если у человека слабая иммунная система или нарушен нормальный состав микрофлоры, то при повреждении кожи (слизистых оболочек) золотистый стафилококк может приводить к разнообразным местным и системным инфекционно-воспалительным поражениям:
- кожи (карбункулам, импетиго, фолликулиту),
- молочных желез (маститу),
- дыхательных путей и ЛОР-органов (тонзиллиту, гаймориту, отиту, фарингиту, лариноготрахеиту, пневмонии),
- мочевыводящих путей (уретриту, циститу, пиелонефриту),
- пищеварительной системы (энтеритоколиту, аппендициту, перитониту, парапроктиту, холециститу),
- костно-суставной системы (остеомиелиту, артриту).
В отдельных случаях возможна генерализация инфекции с развитием септикопиемии. Производимый золотистым стафилококком энтеротоксин вызывает пищевые отравления и синдром токсического шока. Основные источники инфекции: здоровые (носители) и больные люди, домашние и сельскохозяйственные животные, а также пища, содержащая возбудителя инфекции (чаще всего это сахаросодержащие молочные продукты). Инфицирование может происходить контактным и воздушно-пылевым путем. Возможно аутоинфицирование.
Для идентификации золотистого стафилококка проводится посев клинического материала на питательные среды, где при наличии S. aureus через 18-24 часа наблюдается рост колоний золотистого цвета.
Определение количества бактерий может потребоваться, например, чтобы понять, нужно ли проводить лечение: в некоторых случаях, если количество небольшое, лечение не проводится. Решение о его необходимости зависит от клинических проявлений, а также от количества стафилококка. При небольшом содержании микробов и отсутствии симптоматики лечение может вообще не понадобиться, т. к. и в норме на слизистой могут находиться эти микробы. Стафилококк в кишечнике обнаруживается постоянно, это не повод для лечения, но если его количество превышено, тогда нужны меры (бактерия может вызывать колики и расстройства). Стафилококк в мазке без симптомов вагинита также является нормой, в то время как большие количества стафилококка в мазке, наряду с повышением лейкоцитов, требуют лечения.
Наличие стафилококка не обязательно означает инфекцию, это может быть бессимптомное носительство, например при посеве мазков из носа и зева носительством считается количество бактерий до 103. Однако более высокие показатели говорят нам о золотистом стафилококке как о причине заболевания, и это уже далеко не бессимптомное носительство.
Многое зависит от возраста пациента. Например, золотистый стафилококк в количестве 104 является вполне нормальным показателем для детей старше 1 года, но у грудных детей в таком количестве уже потребует лечения.
В любом случае наличие стафилококка при отсутствии симптомов болезни – еще не повод к назначению лекарств.
Количество стафилококка может определяться до и после лечения. Если выясняется, что рост возбудителя обильный, значит, инфекция набирает обороты, предыдущая терапия была неудачной и срочно требуется новый курс лечения; умеренный и скудный рост микроорганизмов по результатам последних анализов говорит об успешности терапии. Кроме того, в дальнейшем необходимо контролировать количество стафилококков в течение 1 или 2 месяцев после пройденного лечения.
Отмечено также, что после пребывания больных в хирургической клинике стафилококк обнаруживался у них вдвое чаще, чем при поступлении. У больных, поступающих в стационары, наблюдается замена антибиотикочувствительных стафилококков на антибиотикоустойчивые.
Лечение больных стафилококковой болезнью препаратами пенициллина или другими давно применяемыми антибиотиками часто остаётся безрезультатным, поскольку такие препараты нередко только усугубляют тяжесть течения инфекции. Поэтому так важно установить, какие антибиотики будут эффективны при лечении стафилококка.
- Для определения целесообразности лечения.
- Для дифференциации бактерионосительства и опасного инфицирования.
- Для контроля за состоянием пациента после проведенного лечения.
- Для того чтобы подтвердить, что стафилококк является причиной возникшего заболевания (об этом свидетельствуют высокие показатели посева).
Что означают результаты?
Референсные значения: нет роста.
Золотистый стафилококк в мазке в небольших количествах является частью нор¬мальной микрофлоры человека. Значительное повышение стафилококка в мазке может быть симптомом воспалительного процесса, кожных инфекций (угри и пр.) и смертельно опасных заболеваний (пневмония, остеомиелит, эндокардит и др.). Результат посева интерпретирует врач исходя из того, в каком количестве выделены микроорганизмы. Также прилагается заключение о чувствительности стафилококка к различным антибиотикам, в зависимости от которого назначается лечение теми или иными препаратами.
Возможная соматическая патология у больных с неотложными состояниями, связанными с употреблением алкоголя, представлена поражением практически всех органов и систем организма.
Нарушения дыхательной системы при длительном алкогольном воздействии обусловлены повреждением отофарингеальной микрофлоры, нарушением механического и целлюлярного удаления микроорганизмов из легких, снижением гуморального и клеточного иммунитета. Практически всегда у больного с хронической алкогольной интоксикацией развивается хронический бронхит, а при достаточном стаже заболевания — пневмосклероз.
Характерной особенностью пневмоний у больных алкоголизмом является длительное ее течение без четкой клинической картины. Часто отсутствует лихорадка, воспалительные изменения лейкоцитарной формулы. У таких больных пневмонии имеют склонность к абсцедированию.
В случае острой алкогольной интоксикации (ОАИ) чаще всего имеет место аспирационная пневмония.
При алкогольном делирии также высока вероятность аспирационной пневмонии. Кроме того, очень вероятна нозокомиальная пневмония, развитию которой способствует длительная фиксация, седативная и антипсихотическая терапия, приводящая к выраженному нарушению дренажной функция трахеобронхеального дерева.
Особенности лечения пневмонии следующие:
Внебольничные пневмонии чаще всего вызвают Streptococcus pneumoniae и Haemophilus influenzae, Klebsiella pneumoniae, различные энтеробактерии и легионеллы, Chlamydia pneumoniae, Staphylococcus aureus, Mycoplasma spp.Для них характерны постепенное развитие, медленное нарастание клинической картины. Как уже упоминалось, у больных алкоголизмом велика вероятность абсцедирования и эмпиемы плевры.
Антибиотики резерва представлены комбинацией: триметоприм/сульфаметоксазол + макролид.
В случае, когда возбудителем является золотистый стафилококк, назначают пенициллиназоустойчивые пенициллины или ванкомицин.
Аспирационную пневмонию чаще всего вызывают бактероиды, пептострептококки, фузобактерии, энтеробактерии, пневмококки.
Антибиотики резерва представлены комбинацией: клиндамицин + активные в отношении синегнойной палочки аминогликозиды.
Возбудителями госпитальной пневмонии чаще всего являются энтеробактерии (Enterobacter spp, Citrobacter spp.), актинобактерии, синегнойная палочка, легионелла, золотистый стафилококк.
Для злоупотребляющих алкоголем больных рекомендуются следующие препараты: фуразолидон, метронидазол, хлорпропамид, левомицетин, цефалоспорины, сульфаниламиды, обладающие тетурамоподобным действием.
Следует помнить, что изониазид и тетрациклины ускоряют поражение печени [8].
Артериальная гипертензия является наиболее распространенной патологией сердечно-сосудистой системы у злоупотребляющих алкоголем больных.
Прием большого количества алкоголя или алкогольный абстинентный синдром (ААС) часто сопровождаются повышением артериального давления, что способно привести к поражению органов-мишений (гипертоническая энцефалопатия, острое нарушение мозгового кровообращения, острый коронарный синдром, острая сердечная недостаточность, расслаивающая аневризма аорты).
В низких дозах (12–15 г чистого этанола в сутки) этанол улучшает липидный профиль снижения агрегационной способности тромбоцитов. В наибольшей степени это благоприятное влияние выражено у мужчин 50–60 лет при употреблении в вышеприведенных умеренных дозах красного сухого вина.
Одновременно не подлежит сомнению тот факт, что продолжение приема алкоголя на фоне уже имеющейся ИБС ухудшает прогноз заболевания.
У таких больных алкоголь в сочетании с физической нагрузкой может приводить к безболевым инфарктам миокарда, во-первых, вследствие того, что алкоголь сам по себе является анестетиком, а во-вторых, из-за алкогольной невропатии, при которой первыми поражаются чувствительные нервные волокна [9].
Алкогольная кардиомиопатия обычно развивается при злоупотреблении алкоголем в течение более 10 лет (в последнее время прослеживается четкая тенденция к снижению этого срока).
В патогенезе поражения сердца участвуют два механизма: инфильтрация миокарда жировой тканью с дегенерацией кардиомиоцитов и тиаминзависимое поражение вегетативной нервной системы.
Морфологическая картина алкогольной кардиомиопатии складывается из группы патологических проявлений, в число которых входят:

Рисунок 1. Стромальный липоматоз миокарда

Рисунок 2. Дилатированные камеры сердца

Рисунок 3. Гиперэластоз эндокарда левого желудочка. Истончение стенок и дилатация сердца
Поражение слизистой желудка в виде алкогольного гастрита или язвы обусловлено прямым токсическим воздействием не только алкоголя, но и ацетальдегида, образующегося при участии алкогольдегидрогеназы IV типа. Этот фермент находится в слизистой желудка и метаболизирует 19% поступающего этанола, окисляя его до ацетальдегида [9].
Таким образом, злоупотребление алкоголем является независимым фактором риска развития язвенной болезни желудка и двенадцатиперстной кишки, осложняет течение Helicobacter pylory-ассоциированного поражения слизистой, препятствует рубцеванию язвы, способствует ее рецидивированию.
Другие более редкие причины желудочно-кишечного кровотечения у больных с хронической алкогольной интоксикацией — синдром Меллори–Вейса (надрыв слизистой кардиального отдела пищевода в результате упорной рвоты), синдром Берхава (разрыв всех слоев пищевода) и кровотечение из варикозно-расширенных вен пищевода. Синдром Меллори–Вейса и синдром Берхава нередко развиваются на фоне ААС, для которого характерна повторная рвота. Если у больного с клиникой ААС вместо гипертонии регистрируется гипотония, в первую очередь необходимо исключить желудочно-кишечное кровотечение.
Печень. Гепатоцит — основное место, где происходит окисление этанола с образованием ацетальдегида, поэтому основной удар приходится именно на печень. Наибольшие изменения наблюдаются в центролобулярной зоне, в этой же зоне происходит некроз гепатоцитов.
Жировая дистрофия печени — потенциально обратимое состояние, развивается при употреблении 50–60 г чистого этанола ежедневно.

Рисунок 4. Алкогольный жировой гепатоз

Рисунок 5. Алкогольный гепатит

Рисунок 6. Варикозные вены пищевода

Рисунок 7. Цирроз печени. Спленомегалия
Морфологически отмечается накопление жира в гепатоцитах вследствие остановки окисления жирных кислот, вызываемой алкоголем (рис. 4). Наряду с крупнокапельным ожирением гепатоцитов, имеют место перицеллюлярный фиброз вокруг центральных вен, нейтрофильная инфильтрация междольковых, а иногда и внутридольковых (вокруг гепатоцитов) отделов печени, набухание гепатоцитов, отложение в них гиалиновых телец Мэллори [9].
Клиническое течение самого жирового гепатоза обычно бессимптомное. Отмечается увеличение содержания в сыворотке крови g-глутамилтранспептидазы, умеренное повышение активности сывороточных трансаминаз и щелочной фосфатазы. Прекращения приема алкоголя обычно достаточно для полной регрессии заболевания.
Острый алкогольный гепатит (рис. 5) обычно развивается в случае, когда печень не способна метаболизировать индивидуально токсическую дозу этанола. Чаще всего развивается вместе с ААС. Возможно фульминантное (молниеносное) течение заболевания с крайне неблагоприятным прогнозом. При фульминантном гепатите быстро развивается печеночная энцефалопатия, вероятно развитие портальной гипертензии по синусоидальному типу, геморрагического и гепаторенального синдромов.
Лечение острого алкогольного гепатита проводится параллельно с терапией ААС, так как отказ от алкоголя является непременным условием эффективности лечения.
Алкогольный цирроз печени развивается при потреблении 80–100 г этанола в сутки в течение 10–15 лет.
У больных с хронической алкогольной интоксикацией цирроз печени может формироваться на фоне фиброза без промежуточного этапа в виде алкогольного гепатита.
Фиброз развивается в результате трансформации жировых клеток Ито (липоцитов печени) в фибробласты и миофибробласты. Синтез коллагена стимулируется гипоксией и некрозом клеток, а также продуктами перекисного окисления липидов [9].
Так как цирроз печени — необратимое состояние, терапия должна быть направлена на предупреждение и коррекцию осложнений, от которых больные и погибают. Осложнения включают ряд синдромов.
Синдром портальной гипертензии, проявляющийся варикозным расширением вен пищевода (рис. 6), желудка, геморроидального сплетения, кровотечениями из расширенных вен, спленомегалией (рис. 7, 8). Характерно развитие венозных коллатералей передней брюшной стенки.
Лечение предполагает применение:
Желтуха свидетельствует о превалировании процесса разрушения гепатоцитов над процессами регенерации и потому является плохим прогностическим признаком.
Отечно-асцитический синдром проявляется скоплением жидкости в брюшной полости и периферическими отеками.
Синдром печеночной энцефалопатии проявляется нарушением циклов сна и бодрствования, конструктивной апраксией, хлопающим тремором. При прогрессировании нарастают нарушения сознания вплоть до печеночной комы.
Синдром нарушения белково-синтетической функции печени проявляется гипоальбуминемией, гипопротеинемией, кровоточивостью (рис. 9).
Гепаториенальный синдром проявляется прогрессирующей почечной недостаточностью.
Лечение предполагает экстракорпоральную детоксикацию.
Поджелудочная железа. В настоящее время принято считать дебют алкогольного панкреатита потенциально обратимым острым панкреатитом, который, однако, при продолжении алкоголизации ведет к необратимому изменению поджелудочной железы.

Рисунок 8. Мелкоузловой цирроз печени

Рисунок 9. Кровотечение из острых эрозий желудка

Рисунок 10. Индуративный панкреатит с очагами стеатонекроза
Алкоголь и его метаболиты (ацетальдегид) влияют на сфинктер Одди, протоки железы, ацинарные клетки железы, вызывая внутрипротоковую гипертензию. Обычно злоупотребление алкоголем в течение нескольких лет приводит к осаждению белков внутри протоков поджелудочной железы. Со временем отложения белков становятся более распространенными, что вызывает гистологические изменения. Через 3–5 лет развивается первый клинический приступ панкреатита, обусловленный преждевременной активацией ферментов поджелудочной железы. При этом трипсин и фосфолипаза А2 обусловливают некроз тканей, эластаза — разрушение стенок кровеносных сосудов и геморрагический синдром [9].
После первой недели заболевания прежде всего опасны осложнения некроза поджелудочной железы: вторичное инфицирование нежизнеспособных тканей (обычно, грамотрицательная флора), кистоид поджелудочной железы — скопление панкреатической жидкости и тканевого детрита, отграниченное капсулой из фиброзной стенки и сосудов, опасный инфицированием, кровотечением и перфорацией.
Характер течения алкогольного панкреатита непостоянен, в первые годы часто отмечается его рецидивирующее течение, а по мере прогрессирования панкреатита, гибели паренхимы поджелудочной железы заболевание приобретает безрецидивное течение с постоянными болями и функциональными расстройствами: внешнесекреторной панкреатической недостаточностью; скрытым или явным сахарным диабетом, реже — гипогликемическим синдромом; симптомами холестаза; нарушениями дуоденальной проходимости; сегментарной портальной гипертензией; воспалительными и гнойными осложнениями.
Лечение острого алкогольного панкреатита и обострения хронического панкреатита часто приходится проводить одновременно с лечением ААС (часто осложненного алкогольным делирием, что значительно утяжеляет состояние больного и ухудшает прогноз). В таких случаях к терапии по возможности присоединяют транквилизаторы, антипсихотические препараты, β-адреноблокаторы, восполняют дефицит витаминов, прежде всего группы В.
Базовая терапия предусматривает:
Комплекс интенсивной терапии при панкреонекрозе с органной недостаточностью включает современные методы детоксикации, продленной искусственной вентиляции легких, возмещение дефицита жидкости, электролитов, белкового состава крови, устранение анемии, парентеральное и энтеральное зондовое питание, инсулинотерапию.
Показаниями к операции при остром панкреатите являются:
Возможности консервативного лечения в хронической фазе панкреатита ограничены. Поэтому основные усилия должны быть направлены на смягчение болей, рациональную диетотерапию, коррекцию внешне- и внутрисекреторной недостаточности поджелудочной железы (ферментные и сахароснижающие препараты), а также на устранение этиологических факторов панкреатита — воздержание от приема алкоголя.
Проявлениями миоренального синдрома являются рабдомиолиз и острая почечная недостаточность.
Клинически характерны быстро нарастающий деревянистый отек поврежденной конечности, нарушение чувствительности, появление грязно-бурой мочи.
В олигоанурической стадии (до 3 нед) на первый план выступают симптомы уремии. Часто на этой стадии развивается алкогольный делирий. При благоприятном исходе наступает фаза ранней полиурии и восстановления функции почек.
Лечение осуществляется в отделении интенсивной терапии, где имеется возможность проведения экстракорпоральной детоксикации [9].
В. Г. Москвичев, кандидат медицинских наук
Р. Ю. Волохова
А. Л. Верткин, доктор медицинских наук, профессор
МГМСУ, ННПОСМП, Москва
Читайте также:


