Стафилококк в носу азитромицин
Применение трехдневного курса азитромицина в лечении инфекций верхних дыхательных путей у детей: (1)
Применение трехдневного курса азитромицина в лечении инфекций верхних дыхательных путей у детей: picfirst
Кларитромицин в педиатрии: макролиды, эритромицин
Комплаенс антибиотикотерапии инфекций дыхательных путей: Форма выпуска, способ введения, органолептические свойства препарата
Место макролидов в антибактериальной терапии среднего отита у детей: механизм действия клавулановой кислоты
Клиническая и экономическая эффективность коротких курсов азитромицина при остром синусите: азитромицин, ко-амоксиклав, острый синусит, клиническая, бактериологическая эффективность, экономические показатели.
Использование рокситромицина (рулида) в терапии острого бронхита у детей (сравнительное рандомизированное исследование): дети, рокситромицин, рулид, острый бронхит, антибактериальная терапия, комплаенс.
Кандидаинфекция как осложнение антибиотикотерапии у детей: антибиотикотерапия детей, осложнения, кандидоз, дисбактериоз кишечника.
А.М. Запруднов, К.И. Григорьев
Кафедра педиатрии с детскими инфекциями факультета усовершенствования врачей Российского государственного медицинского университета, Москва
Представлены обзор литературы и собственные клинические наблюдения по применению новых макролидов, среди которых особое место занимает азитромицин, составляющий субкласс так называемых азалидов. Уделено внимание новой технологии назначения антибиотикотерапии коротким курсом у детей прежде всего при лечении инфекций верхних дыхательных путей, что оправдано благодаря фармакокинетическим свойствам азитромицина - способности длительно сохраняться в тканях и клетках организма, обеспечивая тем самым антимикробный эффект на продолжении нескольких дней после прекращения приема препарата.
Азитромицин (синоним: сумамед, зитромакс) имеет широкий спектр антимикробной активности и особые фармакокинетические свойства, сочетает высокую активность с хорошей переносимостью у больных любого возраста, что позволяет применять его для лечения многих инфекций у детей.
Состав. Азитромицин синтезирован из молекулы эритромицина А путем введения метилированного азота в положение 9а лактонного кольца. Созданное таким образом 15-членное кольцо обладает принципиально другими характеристиками по сравнению с исходной молекулой, что обусловливает отличие в фармакокинетике препарата, антибактериальной активности, переносимости и лекарственном взаимодействии.
Классификация. Макролиды, получаемые для медицинской практики, классифицируют по строению лактонного кольца (14-членные - эритромицин, рокситромицин, 15-членные - азитромицин, 16-членные - спиромицин, джозамицин, мидекамицин) и по происхождению (природные - эритромицин; полусинтетические - азитромицин, кларитромицин, рокситромицин; пролекарства - эфиры и соли эритромицина, олеандомицина).
Азитромицин превосходит другие препараты по действию на такие грамотрицательные бактерии, как H. influenzae, M. catarrhalis, C. jejuni и P. multocida, умеренно активен против боррелий (Borrelia burgdorferi), возбудителей раневой инфекции при укусах животных (Paseurella multocida, Eikenella corrodens) и некоторых бактероидов, включая Bacteroides fragilis. Он практически не действует на грамотрицательные бактерии семейства Enterobactericeae, Pseudomonas spp. и Acinetobacter spp., поскольку не проникает через клеточную оболочку данных микроорганизмов [4].
Азитромицин, кроме того, активен в отношении Helicobacter pylory, хотя несколько уступает кларитромицину [5] и рокситромицину [6]. Препарат проявляет активность в отношении криптоспоридий, превосходит эритромицин по действию на внутриклеточный комплекс M. avium, который является частым возбудителем оппортунистических инфекций у больных СПИД, ингибирует активность Toxoplazma gonnii и других простейших, однако азитромицин не вызывает их гибели.
Сравнительная противомикробная активность азитромицина и других антибиотиков приведена в табл. 1.
| Таблица 1. Спектр противомикробной активности антибактериальных препаратов различных групп | ||||||||
| Препарат | Микроорганизмы | |||||||
| S.pyogenes | S.pneumoniae | H.influenzae | L.pneumophila | M.pneumoniae | Chlamydia spp. | M.catarrhalis | Staph.aureus | |
| Азитромицин | + | + | + | + | + | + | + | + |
| Пенициллин | + | + | - | - | - | - | ||
| Амоксициллин/Kлавуланат | + | + | + | - | - | - | + | + |
| Цефаклор | + | + | + | - | - | - | + | |
| Цефалексин | + | + | + | - | - | - | - | + |
| Доксициклин | - | + | + | + | + | + | + | + |
| Ципрофлоксацин | - | - | + | + | - | + | + | - |
| Офлаксацин | - | - | + | + | - | + | + | - |
| Примечание. + препарат активен в отношении микроорганизма; активность условная; - препарат неактивен. | ||||||||
Фармакокинетика азитромицина. После приема внутрь макролиды частично разрушаются под действием соляной кислоты желудка. В наибольшей степени это касается эритромицина и олеандомицина. Новые макролиды, особенно азитромицин, характеризуются более высокой кислотостабильностью.
Существенное влияние на биодоступность азитромицина оказывает пища. Одновременный прием азитромицина с пищей уменьшает всасывание на 50%, поэтому препарат принимают за 1 ч до еды или через 2 ч после еды. Пища замедляет скорость абсорбции азитромицина, не влияя на ее объем [7]. Всасывание некоторых макролидов, особенно азитромицина, в желудочно-кишечном тракте может замедляться при приеме антацидов.
При оральном приеме азитромицин быстро проникает в ткани и достигает концентраций, в 10-100 раз превышающих его уровень в сыворотке крови [8]. В дальнейшем высвобождение азитромицина из тканей происходит медленно. Высокие концентрации антибиотика в тканях позволяют использовать режим 3-дневных (в ранних исследованиях 5-дневных) курсов приема препарата при лечении инфекций верхних и нижних дыхательных путей, кожи и мягких тканей, режим однократного приема препарата при лечении хламидийной урогенитальной инфекции.
Пиковые концентрации азитромицина и других макролидов в сыворотке крови при приеме внутрь и величины, отражающие площадь под фармакокинетической кривой, зависят от вида препарата и дозы (табл. 2). С повышением дозы антибиотика его доступность, как правило, увеличивается. Для азитромицина характерны самые низкие концентрации в крови, что теоретически может создавать проблемы при инфекциях, сопровождающихся бактериемией.
| Таблица 2. Сравнительная фармакокинетика азитромицина с другими макролидами [2, 9, 10] | |||||
| Препарат | Доза, мг | Тmax, ч | Сmax, мг/л | AUC, мг/(ч•л) | Т1/2, ч |
| Азитромицин | 500 | 2-3 | 0,4 | 6,7 | 35-54 |
| Kларитромицин | 500 | 2-3 | 0,4 | 18,9 | 5 |
| Эритромицин | 500 | 1-5 | 1,9-3,8 | 5,8-11,2 | 1,5-2,5 |
| Джосамицин | 1000 | 1 | 3,8 | 7,9 | 1,5-2,5 |
| Рокситромицин | 150 | 1-3 | 5,4-7,9 | 53,0-81 | 10,5 |
| Спирамицин | 3000 | 5-10 | 1,6-2,8 | 13,6 | 8 |
| Примечание. Тmax - время достижения пиковой концентрации в крови; Сmax - величина пиковой концентрации; AUC - площадь под фармакокинетической кривой; Т1/2 - период полувыведения. | |||||
Важным элементом фармакокинетики азитромицина, который отмечается довольно часто, является наличие двух пиков концентрации в крови. Феномен второго пика обусловлен тем, что значительная часть препарата, первично депонированная в желчном пузыре, впоследствии поступает в кишечник и всасывается. При применении азитромицина параллельно второму пику в сыворотке отмечается повторный подъем концентрации в других биологических жидкостях, в частности в лимфе [9].
Азитромицин накапливается в миндалинах, среднем ухе, придаточных пазухах носа, легких, бронхо-легочном секрете, альвеолярных макрофагах, плевральной и перитонеальной жидкости, лимфатических узлах, органах малого таза, причем при воспалении проницаемость препарата в соответствующий очаг увеличивается. Концентрация азитромицина, создаваемая в этих органах и средах, превышает МИК90 (минимальная ингибирующая концентрация) для основных патогенов.
Метаболизм и экскреция. Азитромицин метаболизируется в печени, главным образом путем N- и О-деметилирования, при участии цитохрома Р-450 (изоформа CYP3A4) с образованием не обладающих антибактериальным свойством метаболитов. Метаболиты выделяются преимущественно с желчью и далее с фекалиями. Почечная экскреция составляет 5-10%. При нарушении функции почек период полувыведения не изменяется, поэтому коррекции режима дозирования не требуется.
Учитывая эффективность макролидов в детской пульмонологии [14, 15], а также имеющиеся сведения о положительных результатах лечения коротким курсом азитромицина [16, 17], последний был применен в открытом несравнительном исследовании в дозе 10 мк/кг однократно в сутки в течение 3 дней в виде сиропа у 31 больного ребенка (14 мальчиков и 17 девочек) в возрасте от 2 до 14 лет с инфекциями нижних дыхательных путей. Из них у 16 детей был диагностирован острый бронхит, у 12 - острая очаговая пневмония. У 3 детей при первоначальном диапазоне бронхита в дальнейшем был верифицирован коклюш. Сроки наблюдения - 1997-1998 гг. амбулаторно. Диагноз острого бронхита основывался на данных клинической картины заболевания; все случаи острой пневмонии верифицированы рентгенологическим методом. Контрольные рентгенологические исследования проводили в обычные сроки больным с инфильтрацией паренхимы легочной ткани.
До начала лечения брали материал из зева или мокроту для бактериологического анализа и определения чувствительности микроорганизмов к азитромицину методом диффузии в агар с помощью дисков, содержащих азитромицин.
До и после лечения проводили общеклинические анализы крови и мочи, у отдельных больных - биохимическое исследование крови (общий белок, аминотрансферазы, щелочная фосфатаза, креатинин, мочевина, электролиты), у школьников определяли функцию внешнего дыхания.
17 больных детей получили азитромицин в качестве монотерапии, у 14 детей лечение сочеталось с другими лекарственными средствами: бронхолитики (сальбутамол), муколитики (АЦЦ), антипиретики, витамины. Были выполнены следующие условия, касающиеся исключения больных из исследований: непереносимость макролидов, наличие тяжелой бактериальной инфекции, нарушения функции желудочно-кишечного тракта, прием более суточной дозы антибиотика в течение 10 дней до начала лечения.
До начала терапии у всех детей состояние было расценено как среднетяжелое: бронхолегочная местная симптоматика была выявлена у всех детей, температура тела выше 38њС - у 87%, признаки дыхательной недостаточности - у 68%.
В течение 1-3 дней от начала лечения азитромицином у 17 детей отмечался быстрый положительный клинический эффект. Нормализовалась температура тела, исчезли сухие и влажные хрипы, кашель, одышка, неспецифическая симптоматика. На 5-7-й день лечения у большинства больных регистрировалось улучшение общего состояния, а температура тела нормализовалась у 97%. Однако физикальные изменения в бронхах и легких сохранялись у 6% детей (больных пневмонией), кашель - у 45% детей.
После окончания 3-дневного курса лечения азитромицином к 10-му дню у большинства детей полностью отсутствовали клинические симптомы заболевания. У 6 детей сохранялся редкий сухой кашель (табл. 3).
| Таблица 3. Динамика клинических симптомов у детей с инфекциями дыхательных путей, получавших азитромицин (абсолютное число/процент) | ||||
| Симптомы | До лечения | 3-й день лечения | 5-7-й день лечения | 10-й день лечения |
| Kашель | 30/97 | 27/87 | 14/45 | 6/19 |
| Одышка | 14/45 | 10/32 | 3/10 | - |
| Притупление перкуторного звука | 15/48 | 12/39 | 2/6 | - |
| Симптомы интоксикации | 15/48 | 9/29 | 1/3 | - |
| Лихорадка | 9/29 | 4/13 | - | - |
| Субфебрилитет | 12/39 | 5/16 | 1/3 | - |
На основании динамики клинических и рентгенологических признаков была проведена общая оценка эффективности азитромицина: - полное исчезновение всех патологических симптомов, - частичное исчезновение патологических симптомов, - отсутствие положительной динамики или ухудшение. Суммарная клиническая эффективность позволила распределить детей по результатам лечения следующим образом: - у 15 (48%) детей, - у 16 (52%) детей. Эти результаты согласуются с данными врачей Смоленской государственной медицинской академии и Измайловской детской городской больницы Москвы, полученными при изучении клинической эффективности 3-дневного курса азитромицина у детей с заболеваниями органов дыхания [16].
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
Работа посвящена вопросам эффективности лечения хронического синусита. Раскрыты основные принципы и приоритеты в выборе антибактериальной терапии на основе собственного исследования авторов.
Цель исследования: повысить эффективность лечения полипозного синусита с учетом влияния персистирующей стафилококковой инфекции на возникновение и течение этого заболевания.
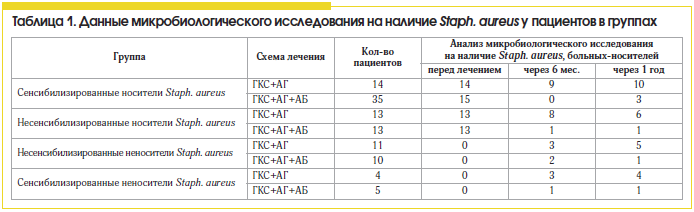
Материал и методы: на основе клинико-лабораторных, иммунологических и аллергологических показателей у 105 пациентов с хроническим полипозным риносинуситом выполнен сравнительный анализ различных схем лечения полипозного синусита (топический стероид и антигистаминный препарат; топический стероид, антигистаминный препарат и антибактериальный препарат, курсом раз в полгода).
Результаты и обсуждение: распространенность среди пациентов с полипозным синуситом персистирующей стафилококковой инфекции составляет 71%, частота встречаемости пациентов, сенсибилизированных к антигенам Staphylococcus aureus, – 55,2%. Установлено, что полипозный синусит, ассоциированный с носительством золотистого стафилококка, сопровождается в 1,5 раза более тяжелым клиническим течением. Эта закономерность объясняется более выраженным эозинофильным воспалением при полипозном синусите, ассоциированном с колонизацией Staph. аureus. Сенсибилизация к Staph. аureus также приводит к увеличению выраженности эозинофильного воспаления при полипозном синусите по сравнению с несенсибилизированными пациентами. Присоединение антибиотика к схеме лечения больных с полипозным синуситом значительно улучшает течение заболевания и в 1,5 раза снижает выраженность эозинофильного воспаления у всех пациентов с полипозным синуситом, и в 2 раза − у носителей и больных, сенсибилизированных к антигенам Staph. аureus.
Заключение: больные полипозным синуситом, сенсибилизированные к антигенам Staph. aureus, более резистентны к стандартной противорецидивной терапии топическими стероидами и антигистаминными препаратами, чем несенсибилизированные пациенты, и требуют проведения бактериологического мониторинга и периодической антибактериальной терапии.
Ключевые слова: полипозный синусит, антибактериальная терапия, золотистый стафилококк, сенсибилизация к золотистому стафилококку, рецидив полипозного синусита, левофлоксацин, хронический синусит, эозинофильное воспаление, антигены стафилококка, лечение полипозного синусита.
Для цитирования: Кунельская Н.Л., Туровский А.Б., Колбанова И.Г., Попова И.А. Антибактериальная терапия хронического синусита. РМЖ. 2016;21:1411-1416.
Antibacterial treatment for chronic sinusitis
Kunel'skaya N.L., Turovskiy A.B., Kolbanova I.G., Popova I.A.
L.I. Sverzhevskiy Scientific Research Institute for Ear, Nose, and Throat Diseases, Moscow
The paper discusses treatment efficacy of chronic sinusitis and uncovers major principles and priorities in antibacterial therapy choice based on authors’ study.
Aim: to improve treatment efficacy of sinusitis with nasal polyps with respect to the effect of persistent Staphylococcus infection on the development and course of the disease.
Patients and methods: the study included 105 patients with chronic sinusitis and nasal polyps who underwent clinical examination and laboratory, immunological, and allergy tests. Comparative analysis of different treatment regimens (topical steroid plus antihistamine or topical steroid plus antihistamine plus antibacterial agent every 6 months) was performed.
Results: the prevalence of persistent Staphylococcus infection among the patients with nasal polyps was 71%. The occurrence of sensitization to Staph. aureus antigens wass 55.2%. It was demonstrated that clinical course of nasal polyps associated with Staph. aureus carriage is more severe due to the eosinophilic inflammation as a result of Staph. аureus colonization. Moreover, sensitization to Staph. aureus antigens enhances eosinophilic inflammation in nasal polyps as compared with non-sensitized persons. Additional antibacterial agent significantly improves disease course and reduces eosinophilic inflammation severity by 1.5-times in all patients with nasal polyps and twice in carriers and persons sensitized to Staph. аureus antigens.
Conclusions: patients with nasal polyps sensitized to Staph. aureus antigens are more resistant to standard treatment with topical steroids and antihistamines than non-sensitized patients thus requiring bacteriological monitoring and periodic antibacterial therapy.
Key words: nasal polyps, antibacterial therapy, Staphylococcus aureus, sensitization to Staphylococcus aureus, recurrence of nasal polyps, levofloxacin, chronic sinusitis, eosinophilic inflammation, Staphylococcus antigens, treatment of nasal polyps.
For citation: Kunel'skaya N.L., Turovskiy A.B., Kolbanova I.G., Popova I.A. Antibacterial treatment for chronic sinusitis // RMJ. 2016. № 21. P. 1411–1416.
В статье изложено антибактериальная терапия хронического синусита

Современное понимание патогенетических основ развития хронического риносинусита (ХРС) позволяет на сегодняшний день отнести эту патологию к гетерогенной группе заболеваний носа и околоносовых пазух, которые характеризуются воспалением и ремоделированием тканей.
В соответствии с европейской классификацией ХРС подразделяется на хронический риносинусит с полипами и хронический риносинусит без полипов [1]. Диагноз ХРС устанавливается при наличии по крайней мере 2-х симптомов из следующих: заложенность носа, носовая секреция и/или постназальный синдром, головные и/или лицевые боли, снижение обоняния в течение более чем 12 нед. за последний год. Согласно последним данным, различные формы ХРС отличаются также процессом ремоделирования верхних дыхательных путей. Гистологически ХРС без полипов характеризуется фиброзом слизистой оболочки и базальной мембраны, в то время как полипозный риносинусит (ПРС) сопровождается выраженным отеком с отложением альбумина и развитием псевдокист.
Процесс ремоделирования слизистой оболочки полости носа и околоносовых пазух при хроническом воспалении создает условия для ослабления защитных механизмов и в большинстве случаев делает ее более восприимчивой к воздействию различных видов микроорганизмов [2].
При хронических синуситах микробная флора отличается большим разнообразием и спектр возбудителей несколько смещается в пользу анаэробной флоры. Так, по данным ряда авторов, в 52% случаев выделяются аэробы (различные стрептококки – 21%, гемофильная палочка – 16%, синегнойная палочка – 15%, золотистый стафилококк и моракселла − по 10%). Анаэробным возбудителям принадлежит 48% случаев (Prevotella – 31%, анаэробные стрептококки – 22%, Fusobacterium − 15% и др.). Выделение энтеробактерий при синуситах может быть объяснено кишечным дисбактериозом, который рассматривается в настоящее время как побочное действие антибиотикотерапии. По причине дефицита бифидобактерий и молочнокислых бактерий происходит беспрепятственное заселение условно-патогенной микрофлорой не только кишечника, но и других сообщающихся с внешней средой полостей организма. Этим же обстоятельством объясняется выявление грибов рода Candida [3].
Т.Н. Леонтьева и соавт. (1988) при обследовании 200 больных ПРС выявили стафилококковую обсемененность слизистой оболочки полости носа у 70,7% больных ПРС и у 81,5% больных полипозно-гнойным риносинуситом (ПГРС). При ПРС выявлялись в основном условно-патогенные штаммы. В 13,7% определялась стрептококковая флора, представленная в большей степени зеленящим стрептококком и встречающаяся одинаково часто как при ПРС, так и при ПГРС. E. сoli высевалась из отделяемого полости носа в 10,5% случаев. По результатам исследования авторы приходят к выводу, что S. aureus способствует более тяжелому течению заболевания с частыми рецидивами. Флора околоносовых пазух (ОНП) как сапрофитирующая, так и патогенная крайне разнообразна, причем микробный пейзаж варьирует в зависимости от тяжести и продолжительности заболевания.
Для возникновения инфекционного процесса ведущее значение, наряду с вирулентностью возбудителя, имеет состояние макроорганизма. Оно определяется сложным комплексом факторов и механизмов, тесно связанных между собой, а также чувствительностью и резистентностью к инфекции. Наиболее значимыми факторами являются неблагоприятный аллергический фон, частые полипотомии полости носа, нерациональное назначение антибактериальных препаратов, как в виде местной терапии, так и в виде общей антибиотикотерапии.
Особое внимание в последнее время уделяется способности микроорганизмов собираться в сообщества, т. е. формировать биопленки. Доказано, что биопленки оказывают серьезное влияние на свойства и потенциальные возможности образующих их патогенов. В первую очередь речь идет о защитном матриксе, своеобразной среде внутри микроколоний, способности микроорганизмов к элементарным видам взаимодействия между собой. В биопленке бактерия способна продуцировать такие факторы устойчивости, которые не продуцируют планктонные микроорганизмы, не говоря о лабораторных штаммах, а матрикс, окружающий микроколонии, служит защитным барьером, благодаря которому бактерии в биопленке более устойчивы к внешнесредовым влияниям и действию защитных факторов организма. Биопленкообразование широко изучено на золотистом стафилококке. Продемонстрировано, что S. aureus может не только обсеменять слизистую полости носа, но и формировать биопленку на слизистой оболочке, в особенности у пациентов с полипами.
Недавние исследования были посвящены изучению роли биопленок в персистенции S. aureus: биопленки выступают в качестве резервуара для микроорганизмов и позволяют им быстро внедряться в слизистую оболочку [4]. Используя флуоресцентную гибридизацию in situ пептидно-нуклеиновых кислот, было продемонстрировано наличие внутриклеточно расположенного S. aureus в ткани полипов от пациентов с аспирин-индуцированными заболеваниями дыхательной системы [5]. Также было выявлено, что данный микроорганизм располагается интраэпителиально в слизистой полипов, но не присутствует в назальном эпителии пациентов с хроническим риносинуситом без полипоза и у здоровых добровольцев. S. aureus не только выживает, но и размножается внутри эпителиальных клеток назальных полипов [6]. Данные исследований подчеркивают способность S. aureus к персистенции в условиях нарушенного механизма защиты слизистой оболочки. Как известно, Th2 сдвиг воспалительной реакции поддерживает программирование так называемых М2 макрофагов в ткани полипов, у которых, как было показано, снижена способность к фагоцитированию и внутриклеточному лизису S. aureus [7].
Кроме того, предполагается, что S. aureus высвобождает энтеротоксин в ткань полипа лишь в небольшом количестве, что приводит к постоянной стимуляции местной иммунной системы и изменению как врожденного [6], так и адаптивного иммунитета [8]. Все это позволяет бактерии в течение длительного времени выживать в пораженных дыхательных путях. Нами было проведено собственное исследованиею
Цель исследования: повысить эффективность лечения ПРС с учетом изученного влияния персистирующей стафилококковой инфекции на возникновение и течение этого заболевания.
В результате проведенного исследования выявлена высокая распространенность среди пациентов ПРС персистирующей стафилококковой инфекции, которая составляет 71%, и высокая частота встречаемости пациентов, сенсибилизированных к антигенам Staph. aureus, – 55,2%. Установлено, что ПРС, ассоциированный с носительством золотистого стафилококка, сопровождается в 1,5 раза более тяжелым клиническим течением, нежели ПРС без носительства (6±0,64 балла и 4±0,84 соответственно) и большей частотой обострений гнойного воспаления ОНП за год (2,7±0,79 и 1,8±0,67 соответственно).
Описанная закономерность объективно объясняется более выраженным эозинофильным воспалением при ПРС, ассоциированным с колонизацией Staph. аureus, чем при ПРС, ассоциированным с инфицированием прочими микроорганизмами (Str. pneumoniae, Str. viridans, Staph. epidermidis, E. coli, K. pneumoniae, H. influenzae, P. аeruginosa), что выражается повышенным количеством эозинофилов в крови (7,98±2,86 и 5,98±3,20 соответственно), в мазках со слизистой оболочки полости носа (13,3±6,20 и 7,87±5,22 соответственно) и средним уровнем эозинофильного катионного протеина (17,5±5,10 и 11,3±6,07 мкг/мл соответственно). Сенсибилизация к Staph. аureus также приводит к увеличению выраженности эозинофильного воспаления при полипозном синусите по сравнению с несенсибилизированными пациентами: повышение количества эозинофилов в крови (8,26±2,97 и 4,32±1,59 соответственно), в мазках со слизистой оболочки полости носа (13,3±5,54 и 4,8±3,89 соответственно) и повышение среднего уровня эозинофильного катионного протеина (17,6±4,66 и 8,0±6,64 мкг/мл соответственно).
В группах, получавших лечение без антибиотика, положительная эрадикация микрофлоры была достигнута только в 28,5% у сенсибилизированных носителей и в 54% случаев – у несенсибилизированных носителей, что можно расценивать как спонтанную эрадикацию возбудителя на фоне нормализации носового дыхания и аэрации в ОНП, при условии отсутствия сенсибилизации (табл. 1). Обращает на себя внимание тот факт, что у всех пациентов, сенсибилизированных к стафилококку, не получавших антибактериальную терапию и не являвшихся носителями, через год был выявлен рост микрооганизма в значимой концентрации (>104). Это свидетельствует о необходимости проведения бактериологического мониторинга у всех сенсибилизированных к стафилококку пациентов.
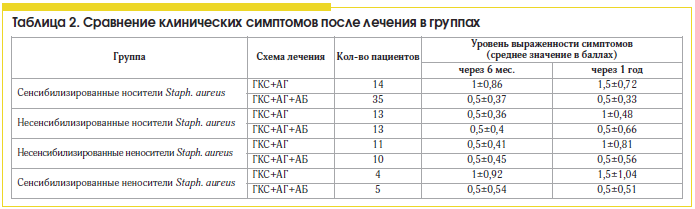
Сравнивая различные схемы лечения ПРС, мы установили, что больные полипозным синуситом, сенсибилизированные к антигенам Staph. aureus, более резистентны к стандартной противорецидивной терапии (табл. 2 и 3) топическими стероидами и антигистаминными препаратами, чем несенсибилизированные пациенты, и требуют проведения антибактериальной терапии.
Как известно, выбор антибиотика зависит от определенных факторов: срока последнего обострения (менее 6 мес.); результатов микробиологического исследования; тяжести течения заболевания; наличия осложнений. Все пациенты с хроническим синуситом в несколько раз чаще применяют антибактериальные препараты, что значительно повышает риск встречи с резистентной флорой. Уже этот фактор служит показанием к назначению антибиотиков, резистентность к которым минимальна.
В этом аспекте понятен повышенный интерес оториноларингологов к респираторным фторхинолонам, в частности к левофлоксацину – высокоэффективному в отношении респираторной флоры, с практическим отсутствием резистентных штаммов в России, который, к тому же в терапевтических концентрациях способствует ингибированию синтеза биопленки.
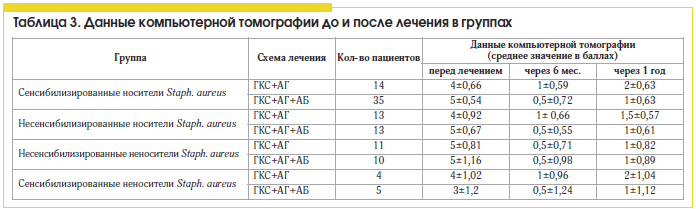
В нашем исследовании применение антибиотиков в составе комплексной терапии ПРС, ассоциированного с персистирующей стафилококковой инфекцией, приводит к статистически достоверному (в 2 раза) уменьшению выраженности эозинофильного воспаления и улучшению клинических показателей заболевания (клинических симптомов, картины компьютерной томографии околоносовых пазух) и снижению частоты гнойных осложнений по сравнению со стандартной противорецидивной терапией.
Фторхинолоны − это полностью синтетические препараты, которые не имеют природного аналога. Одной из последних разработок препаратов данной группы является левофлоксацин. Левофлоксацин обладает быстрым бактерицидным действием, поскольку проникает внутрь микробной клетки и подавляет, так же как и фторхинолоны первого поколения, ДНК-гиразу (топоизомеразу II) бактерий, что нарушает процесс образования бактериальной ДНК. Ферменты клеток человека не чувствительны к фторхинолонам, и последние не оказывают токсического действия на клетки макроорганизма. В отличие от препаратов прежнего поколения новые фторхинолоны ингибируют не только ДНК-гиразу, но и второй фермент, ответственный за синтез ДНК, − топоизомеразу IV, выделенную у некоторых микроорганизмов, прежде всего грамположительных. Считается, что именно воздействием на этот фермент объясняется высокая антипневмококковая и антистафилококковая активность новых фторхинолонов.
Левофлоксацин обладает клинически значимым дозозависимым постантибиотическим эффектом, достоверно более длительным по сравнению с ципрофлоксацином, а также длительным (2−3 ч) субингибирующим действием [9].
Под действием левофлоксацина отмечено повышение функции полиморфноядерных лимфоцитов у здоровых добровольцев и ВИЧ-инфицированных пациентов. Показано его иммуномодулирующее воздействие на тонзиллярные лимфоциты у больных хроническим тонзиллитом. Полученные данные позволяют говорить не только об антибактериальной активности, но и о синергическом противовоспалительном и антиаллергическом действии левофлоксацина. Левофлоксацин характеризуется широким антимикробным спектром, включающим грамположительные и грамотрицательные микроорганизмы, в т. ч. внутриклеточные возбудители [10]. При сравнении эффективности различных антибактериальных препаратов в отношении возбудителей респираторных инфекций было выявлено, что по противомикробной активности левофлоксацин превосходит остальные препараты. К нему оказались чувствительны все штаммы пневмококка, в т. ч. пенициллин-резистентные, при сравнительно более низкой чувствительности пневмококков к препаратам сравнения: офлоксацин − 92%, ципрофлоксацин − 82%, кларитромицин − 96%, азитромицин − 94%, амоксициллин/клавуланат − 96%, цефуроксим − 80%. К левофлоксацину оказались также чувствительны все штаммы моракселлы катаралис, гемофильной палочки и метициллин-чувствительного золотистого стафилококка, 95% штаммов клебсиеллы пневмонии [11]. Важным преимуществом левофлоксацина, наряду с хорошей переносимостью, является возможность однократного приема в течение суток.
Перечисленные характеристики препарата обусловливают чрезвычайно важное в практическом отношении свойство левофлоксацина – высокую комплаентность. Сокращение кратности приема и длительности лечения играют ключевую роль в формировании лучшей приверженности протоколам антибиотикотерапии.
Таким образом, левофлоксацин высокоактивен относительно основных возбудителей бактериального синусита. Как показали исследования, чувствительность пневмококка, гемофильной палочки, моракселлы к левофлоксацину превышает 99%. Отмечается также низкий уровень устойчивости золотистого стафилококка (его метициллин-резистентных штаммов) и других возбудителей синусита.
Читайте также:


