Рассеянный склероз и золотистый стафилококк
МОСКВА, 12 сен – РИА Новости. Люди, страдающие от рассеянного склероза, обладают необычной микрофлорой, "перепрограммирующей" клетки иммунной системы на развитие воспалений в мозге и в других частях тела, говорится в статье, опубликованной в журнале PNAS.
"Мы провели очень простой, даже грубый эксперимент, используя примитивнейшие экстракты микрофлоры. Наши опыты показали, что микрофлора играет ключевую роль в развитии болезни, способствуя созданию среды, в которой постоянно существуют воспаления. В комбинации с определенными мутациями и факторами среды, это заставляет клетки иммунной системы атаковать оболочку нейронов мозга", — пишет Серджио Баранзини (Sergio Baranzini) из университета Калифорнии в Сан-Франциско (США).


Рассеянный склероз — болезнь нервной системы, при развитии которой иммунные клетки начинают атаковать оболочку нервных волокон, так называемый миелин. Без миелина нервы хуже проводят сигнал и начинают "замыкать", что приводит к разным последствиям от легкого онемения конечностей до паралича или слепоты. По статистике ВОЗ, сегодня свыше 2,3 миллиона людей страдает от этой болезни, эффективных способов лечения которой пока не придумано.
Сегодня десятки научных команд по всему миру работают над созданием методов лечения этой болезни, и в прошлом году российские ученые из Института биоорганической химии РАН предложили первую потенциальную "вакцину" от рассеянного склероза, обучающую иммунные клетки не атаковать мозг и не убивать его клетки.
Несмотря на эти успехи, остается не понятным, почему иммунитет начинает считать мозг "врагом". Часть ученых считает, что это связано проникновением инфекций в мозг, а другие считают, что причины развития рассеянного склероза связаны с нарушениями в работе самого организма.
Как выяснили Баранзини и его коллеги, причина развития этих воспалений действительно может быть связана с микробами, но не с "внешними врагами", возбудителями болезнетворных болезней, а со своеобразной бактериальной "пятой колонной" – необычными представителями микрофлоры кишечника.
К такому выводу ученые пришли, проанализировав и сопоставив образцы микрофлоры примерно семи дюжин людей, страдавших от рассеянного склероза, и аналогичного числа здоровых добровольцев.
По словам биологов, микрофлора здоровых и больных людей почти не отличалась, за исключением двух видов бактерий — Akkermansia muciniphila и Acinetobacter calcoaceticus. Оба этих штамма микробов присутствовали в большом количестве в кишечнике людей, страдавших от нейродегенеративной болезни, но при этом их было очень мало в микрофлоре здоровых людей.

Совершив это открытие, биологи проверили, что произойдет, если поместить этих микробов в питательную среду, где живут иммунные клетки, или в кишечник мышей, очищенный от микрофлоры. Как показали эти опыты, микрофлора людей с рассеянным склерозом заставляла так называемые Т-клетки, главных "дирижеров" иммунной системы, выделять целый набор сигнальных молекул, способствующих развитию воспалений и рассеянного склероза, тогда как бактерии здоровых людей не вызывали подобной реакции.
Причиной этого, как считают ученые, могла быть другая бактерия, Parabacteroides distasonis, заставлявшая иммунные клетки вырабатывать вещества, подавляющие воспаления, а не провоцирующие их. Как полагают ученые, лекарства, подавляющие размножение "плохих" бактерий и увеличивающие численность Parabacteroides distasonis, могут быть первым действенным средством для борьбы с рассеянным склерозом.
16 августа 2016
- 9971
- 7,0
- 0
- 6
Структурная формула нового пептидного антибиотика.
Немецкие ученые обнаружили новое оружие для борьбы с больничным монстром — мультирезистентным золотистым стафилококком. Долгие годы оно скрывалось не в вечной мерзлоте или Марианской впадине, а прямо под нашим носом. Вернее — в нём.
В последние годы во всем мире увеличилось количество инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. Организмы с множественной лекарственной резистентностью (multidrug-resistant organisms, MDRO), такие как метициллин-резистентный золотистый стафилококк, нечувствительные к ванкомицину энтерококки или резистентные к цефалоспоринам третьего поколения грамотрицательные бактерии, в ближайшие десятилетия могут стать более частыми причинами смерти, чем рак [1].
Несколько лет назад удалось обнаружить, что представители человеческой микробиоты способны производить бактериоцины, поражающие близкородственных бактерий [2]. Например, в 2014 году из человеческого комменсала Lactobacillus gasseri выделили и описали новый синтезируемый рибосомами тиопептидный антибиотик — лактоциллин [3].
Семейные разборки
Немецкий исследователь Александр Ципперер со своими сотрудниками в июле 2016 года сообщил о том, что обнаружил в человеческом носу бактерию Staphylococcus lugdunensis IVK28, которая подавляет рост метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) [1].
Стафилококки относятся к типичным бактериям-комменсалам, колонизирующим кожу и поверхности слизистых оболочек. Staphylococcus aureus — шаровидные грамположительные бактерии, вырабатывающие каротиноидный пигмент, который придает их клеткам золотистый цвет (рис. 1). Эти микроорганизмы чрезвычайно устойчивы к внешним воздействиям и выживают в воздухе, пыли, почве, продуктах питания, на оборудовании пищевых производств и предметах быта [6], [7].
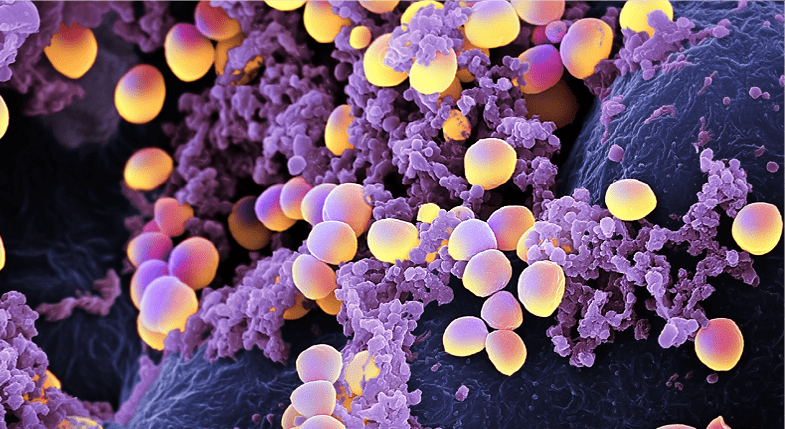
Рисунок 1. Staphylococcus aureus и лейкоциты.
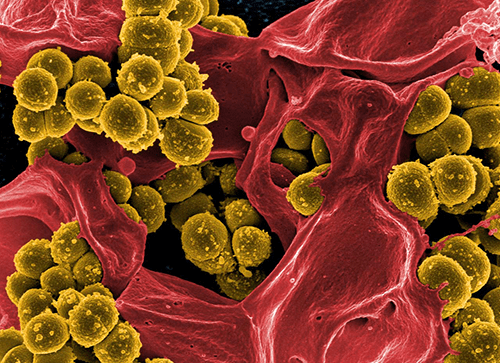
Рисунок 2. Метициллин-резистентные золотистые стафилококки.
Staphylococcus aureus — бактерия условно-патогенная, проявляющая свои патологические свойства только в благоприятных условиях, а создает их, как правило, ослабление иммунитета носителя. Активная жизнедеятельность стафилококка может привести к разнообразным заболеваниям [5], [7], [8]:
- кожи (прыщи, фурункулы, синдром ошпаренной кожи);
- органов дыхания (плеврит, пневмония);
- костной и соединительной тканей (артрит, остеомиелит);
- нервной системы и органов чувств (отит, менингит);
- сердечно-сосудистой системы (эндокардит, флебит, стафилококковая бактериемия).
Факторы патогенности S. aureus — это микрокапсула, компоненты клеточной стенки, ферменты агрессии и токсины. Микрокапсулы защищают клетки бактерий от фагоцитоза, способствуют их адгезии и распространению по организму хозяина. Составляющие клеточной стенки (например пептидогликан, тейхоевые кислоты и белок А) вызывают развитие воспаления, обездвиживают фагоциты и нейтрализуют иммуноглобулины. Коагулаза, главный фермент агрессии, вызывает свертывание плазмы крови [7], [9].
Наиболее опасны метициллин-резистентные стафилококки (methicillin-resistant S. aureus, MRSA) (рис. 2). Метициллин — это модифицированный пенициллин, с помощью которого еще недавно успешно боролись со стафилококковой инфекцией. MRSA устойчивы не только к метициллину, но и к другим антибиотикам пенициллиновой группы (диклоксациллину, оксациллину, нафциллину и др.), а также к цефалоспоринам. В последнее время выявлены штаммы и с более широким спектром устойчивости: ванкомицин-резистентные (VRSA) и гликопептид-резистентные (GISA) [6], [9], [10].
Штамм S. lugdunensis IVK28 эффективно боролся со своим вредоносным родственником лишь в условиях недостатка железа и только на твердых агаризованных средах (рис. 3, слева). Механизм противостояния был неясен, а потому Ципперер провел транспозонный мутагенез клеток выделенного штамма — чтобы выявить ген, ответственный за синтез смертельного для S. aureus вещества.

В итоге удалось получить мутанта IVK28, который не мог подавлять рост MRSA. Анализ места встройки транспозона показал, что тот нарушил структуру гена предполагаемой нерибосомной пептидсинтетазы (НРПС). Оказалось, что этот ген вместе с другими последовательностями, связанными с биосинтезом антибиотиков, входит в состав оперона размером 30 т.п.н. Это указывало на то, что предполагаемая молекула ингибитора может быть комплексом нерибосомных пептидов.
Оперон методом ПЦР обнаружили во всех культурах S. lugdunensis, а значит, он характерен для всего вида, а не только для штамма IVK28. Однако GC-состав оперона (26,9%) отличался от GC-состава остального генома S. lugdunensis (33,8%), что свидетельствовало о возможном заимствовании этого полезного генетического кластера у других видов бактерий — путем горизонтального переноса .
Оперон состоит из генов lugA, B, C и D, кодирующих пептидсинтетазные белки (см. врезку ниже), а также из других генов, чьи продукты необходимы для синтеза и транспорта нерибосомного пептида.
Чтобы окончательно вменить оперону участие в антибактериальной деятельности S. lugdunensis, наименьший ген (lugD) удалили. Мутант ΔlugD, как и ожидалось, не мог подавлять рост золотистого стафилококка, но когда в него ввели плазмиду с работающим геном lugD, агрессивный фенотип восстановился (рис. 3, в центре и справа).
Секретное оружие
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.
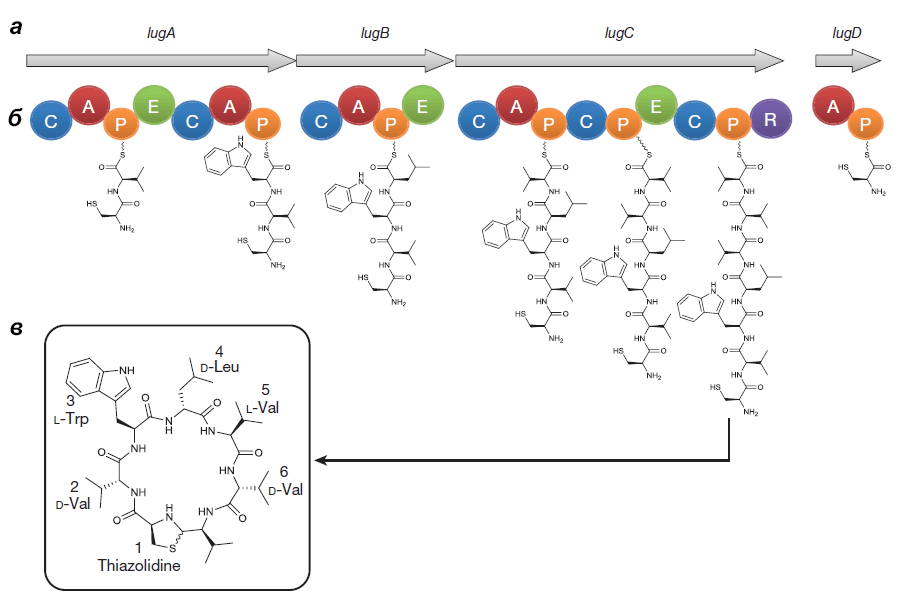
Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров — белков, ДНК и пептидогликанов [5].
Этот класс пептидов синтезируется в клетках низших грибов и бактерий без участия рибосом. Нерибосомные пептиды (НРП) также встречаются и у высших организмов, которые имеют бактерий-комменсалов [12].
НРП подразделяются на несколько функциональных групп [13]:
- антибиотики (ванкомицин);
- предшественники антибиотиков (ACV-трипептид — предшественник пенициллина и цефалоспорина);
- иммуносупрессоры (циклоспорин);
- противоопухолевые пептиды (блеомицин);
- сидерофоры (пиовердин);
- токсины (HC-токсин);
- сурфактанты (сурфактин).
Каждый модуль состоит как минимум из трех доменов:
- конденсирующего (принимающего пептидную цепь из предыдущего модуля);
- аденилирующего (выбирающего нужную аминокислоту);
- пептидильного (образующего пептидную связь).
Нередко модули включают и другие домены, в том числе эпимеризующий, который преобразует L-аминокислоты в D-формы [14].
По аналогии с триплетным рибосомным кодом для синтеза белка существует и нерибосомный, код НРПС, определяемый 10 остатками аминокислот в субстрат-связывающем кармане аденилирующего домена. От комбинации этих остатков зависит то, какая аминокислота будет встроена в пептид конкретным модулем НРПС. Зная этот код, можно предсказывать субстратную специфичность аденилирующих доменов и даже произвольно изменять ее посредством замены аминокислот в домене [14].
В экспериментах немецких ученых лугдунин действовал не только на метициллин-резистентных стафилококков, но и на гликопротеин-резистентных, и даже на других грамположительных бактерий типа листерии и ванкомицин-резистентного энтерококка (табл. 1). Минимальная ингибирующая концентрация (МИК) нового бактериоцина — 1,5–12 мкг × мл −1 , что говорит о высокой активности вещества. При этом такие концентрации никак не влияли на человеческую сыворотку, не вызывали лизис нейтрофилов или эритроцитов и не ингибировали метаболическую активность моноцитов. Бактериальные же клетки под действием лугдунина в концентрации даже ниже МИК прекращали синтезировать ДНК, РНК, белки и компоненты клеточной стенки. В этом отношении лугдунин напоминает даптомицин, дающий такой же эффект, но способ действия которого пока не изучен. Не было отмечено возникновения резистентности клеток S. aureus к лугдунину даже после их месячного выращивания на малых концентрациях.
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл −1 ) |
|---|---|---|
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 |
| + 50% человеческой сыворотки крови | 1,5 | |
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 |
| Staphylococcus aureus Mu50 | GISA | 3 |
| Staphylococcus aureus SA113 | 3 | |
| Staphylococcus aureus RN4220 | 3 | |
| Enterococcus faecium BK463 | VRE | 3 |
| Enterococcus faecalis VRE366 | VRE | 12 |
| Listeria monocytogenes ATCC19118 | 6 | |
| Streptococcus pneumoniae ATCC49619 | 1,5 | |
| Bacillus subtilis 168 (trpC2) | 4 | |
| Pseudomonas aeruginosa PAO1 | >50 | |
| Escherichia coli DH5α | >50 | |
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. | ||
Испытания в боевых условиях
Как и полагается, способность лугдунина лечить стафилококковые инфекции продемонстрировали in vivo на мышиной модели (рис. 5). У шести мышей сбрили шерсть на спине и, повредив кожу многократным приклеиванием/отклеиванием пластыря, нанесли на это место золотистого стафилококка. Затем кожу обработали мазью, содержащей 1,5 мкг лугдунина, и спустя шесть часов оценили результат. Обработка новым антибиотиком сильно сокращала или даже полностью уничтожала популяцию S. aureus. Причем не только на поверхности кожи, но и в более глубоких ее слоях.
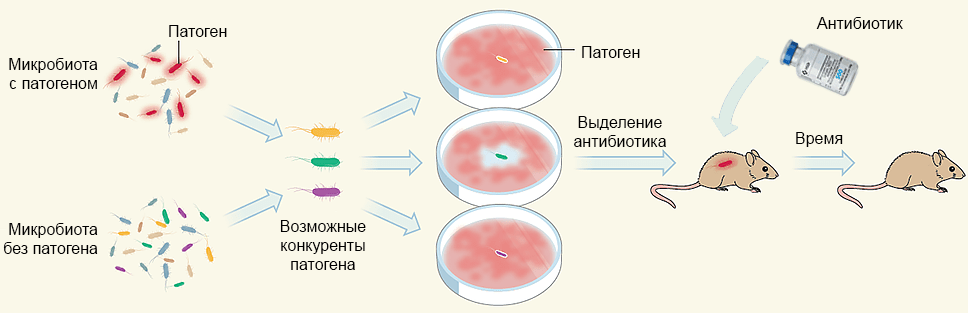
Рисунок 5. Общая схема подхода к идентификации природного антибиотика. Из бактериальных популяций человеческого тела отбирают представителей, которые не могут сосуществовать с интересующими патогенными бактериями. Этих возможных конкурентов тестируют по отдельности на средах с инфекционным агентом. Из культуры, успешно подавляющей рост патогенов, выделяют антибиотик, действие которого проверяют на животных моделях.
[5], рисунок модифицирован и адаптирован
Чтобы понять, может ли S. lugdunensis помешать колонизации носовой полости позвоночных животных золотистым стафилококком в естественных условиях, ученые провели следующий эксперимент. В носы хлопковых хомяков ввели два вида смешанных культур (S. aureus + S. lugdunensis IVK28 и S. aureus + S. lugdunensis IVK28ΔlugD) и каждую по отдельности. В контрольных случаях, когда вводили по одному штамму, все три культуры стабильно колонизировали носовую полость. Однако при введении смеси S. aureus + S. lugdunensis IVK28 количество золотистого стафилококка через 5 дней значительно уменьшилось по сравнению со смесью S. aureus + S. lugdunensis IVK28ΔlugD. Этот эксперимент показал, что продукция лугдунина позволяет штамму IVK28 эффективно конкурировать с золотистым стафилококком in vivo.
Оставалось разобраться, предотвращает ли присутствие S. lugdunensis в носу человека колонизацию бактериями S. aureus. Ципперер и его коллеги исследовали мазки из носовых ходов 187 госпитализированных больных. Из них у 60 человек (32,1%) обнаружили золотистого стафилококка и у 17 человек (9,1%) — S. lugdunensis. И только у одного пациента с S. lugdunensis в носу обитал S. aureus. У всех выделенных штаммов S. lugdunensis ПЦР-анализ продемонстрировал наличие lug-оперона, а все обнаруженные штаммы S. aureus оказались восприимчивы к лугдунину.
Перспективы
Лугдунин оказался первым обнаруженным бактериоцином нового класса — макроциклических тиазолидиновых пептидных антибиотиков. Все проверенные штаммы S. aureus (как природные, так и лабораторные) не смогли выработать резистентности к нему. Это дает надежду на то, что лугдунин в будущем станет коммерческим препаратом для борьбы с золотистым стафилококком.
И наконец, сам факт обнаружения нового антибиотика у представителя человеческой микробиоты должен послужить стимулом для активизации поиска других продуцентов бактериоцинов в составе именно таких сообществ. В дальнейшем это поможет медикам успешнее сдерживать наступление мультирезистентных патогенов.
Доподлинно не известно, что именно вызывает рассеянных склероз. Однако, считается, что виной всему сочетание таких факторов как генетическая предрасположенность, инфекционные агенты и влияние окружающей среды.
Для развития рассеянного склероза необходимо сочетание многих условий, происходящих как внутри организма, так и влияющих извне.
Пол и возраст
Рассеянный склероз может быть диагностирован практически в любом возрасте. Тем не менее, в большинстве случаев болезнь начинает развиваться в возрасте от 20 до 40 лет. Чаще всего рассеянный склероз встречается у женщин детородного возраста (заболевание редко начинается до наступления полового созревания и в климактерическом периоде). У мужчин первые симптомы РС проявляются в возрасте от 15 до 40 лет, при этом заболевание, как правило, имеет более тяжелую форму, и хуже поддается терапии. Примерно четверть больных являются мужчинами. Вероятнее всего, на эту зависимость влияют особенности гормональной системы у мужчин и у женщин.
Наследственный фактор
Нельзя назвать РС наследственным заболеванием, но существует теория, согласно которой, в развитии РС играют роль и гены. На сегодняшний день выявлено около 20-ти генов, которые определяют особенности строения нервной ткани и могут иметь значение в развитии РС. Это подтверждается данными статистики: до 20% больных рассеянным склерозом имеют родственников, больных рассеянным склерозом. Однако, даже в случае имеющейся предрасположенности, рассеянный склероз может не развиться, если этому не будут способствовать и другие предрасполагающие факторы.
Вирусные инфекции
Влияние инфекционных агентов является одним из основополагающих в развитии РС, однако до настоящего момента точно не изучен механизм влияния.
Нет данных, позволяющих считать РС прямым следствием какого-либо определенного перенесенного заболевания. В то же время существуют доказательства, что некоторые возбудители инфекций могут послужить пусковым моментом в развитии рассеянного склероза: ретровирусы, вирусы кори, герпеса, краснухи, эпидемического паротита, вирус Эпштейна-Барра. Есть данные и о возможном влиянии стафилококковой инфекции.
Уровень распространенности:

Где вы живете?
Люди, живущие дальше от экватора более подвержены рассеянному склерозу. Вероятно, виновником этого является витамин D. А точнее его нехватка. Организм вырабатывает витамин D в ответ на солнечный свет. Людям, живущим в северных широтах, не хватает солнечного света, особенно в течение зимних месяцев. Дефицит витамина D связан со множеством заболеваний, в том числе и с рассеянным склерозом.
Тем не менее, рассеянный склероз встречается и в южных странах, пусть и реже. Возможно, на это влияют факторы миграции.
Когда вы родились?
Если вы родились поздней зимой или весной, то уровень витамина D у вашей мамы во время беременности мог быть достаточно низким.
Более того, показано, что риск развития РС также связан с месяцем рождения и является максимальным (для Северного полушария) у лиц, рожденных в апреле, и минимальным у людей, рожденных в октябре. Предполагается, что в случаях, когда большая часть беременности протекает в зимнее время в условиях низкой инсоляции и дефицита витамина D, рожденный ребенок имеет более высокий риск развития РС в будущем.
Курение
Ни для кого не секрет, что курение является вредной привычкой. Но мало кто знает, что курение — установленный фактор развития рассеянного склероза. Чаще болезнь диагностируется у курильщиков. Кроме того, вред от табачного дыма непосредственно влияет на прогрессирования болезни. Причина в том, что курение снижает иммунный ответ T- и В-лимфоцитов, и, как следствие, играет важную роль в развитии воспалительных реакций.
Психоэмоциональные нагрузки и стресс
Исследователи не оспаривают влияние психотравмирующих ситуаций на появление заболевания. По данным статистики, у больных с рассеянным склерозом выявляются высокие показатели тревожности и стресса.
Психоэмоциональное состояние может влиять на физиологические показатели организма. Когда человек испытывает сильный стресс или достаточно долго находится в депрессии, иммунная защита организма снижается.Хронический стресс, как и острая психологическая травма способствуют выработке целого комплекса нейропептидов, особых веществ, способных существенно нарушать биохимические процессы в организме, а также подавлять активность клеток иммунной системы и приводить к состоянию иммунодефицита. В свою очередь, лимфоциты (иммунные клетки), как основное звено в процессе развития рассеянного склероза, проявляют свою активность на фоне сниженного иммунитета, стимулируя развитие демиелинизирующего процесса.
Информация на данном сайте не должна использоваться для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача
Условия использования сайта | Политика в отношении обработки ПДн | Политика Cookies
Мы используем cookie
для персонализации сервисов и удобства пользователей.
Вы можете запретить сохранение cookie в настройках своего браузера. Подробнее.
Аннотация научной статьи по клинической медицине, автор научной работы — Беляева Л.М., Чижевская И.Д.
Обследовано 24 ребенка с системным склерозом (СС) и 41 пациент с ограниченной склеродермией (ОС). Выявлены нарушения липидного обмена, признаки дисфункции гипофизарно>тиреоидной системы у детей и подростков с СС и ОС. Установлены однотипность органных и психологических изменений, схожесть морфологических признаков в кожных очагах, что свидетельствует об общности патогенетических механизмов СС и ОС.
Похожие темы научных работ по клинической медицине , автор научной работы — Беляева Л.М., Чижевская И.Д.
Л.М. Беляева, И.Д. Чижевская
СИСТЕМНЫЙ СКЛЕРОЗ И ОГРАНИЧЕННАЯ СКЛЕРОДЕРМИЯ
У ДЕТЕЙ И ПОДРОСТКОВ
Обследовано 24 ребенка с системным склерозом (СС) и 41 пациент с ограниченной склеродермией (ОС). Выявлены нарушения липидного обмена, признаки дисфункции гипофизарно-тиреоидной системы у детей и подростков с СС и ОС. Установлены однотипность органных и психологических изменений, схожесть морфологических признаков в кожных очагах, что свидетельствует об общности патогенетических механизмов СС и ОС.
Ключевые слова: системный склероз, ограниченная склеродермия, нарушения липидного обмена, гипофизарно-тиреоидная система.
Authors examined 24 children with systemic sclerosis (SS) and 41 patients with focal scleroderma (FS). Examination determined disorders of lipid metabolism and dysfunction of hypophyseal-thyroid system both in children with SS and in patients with FS. The study demonstrated similarity of visceral and psychological changes, similarity of morphological changes in skin foci, and this similarity testifies to evidence of common pathogenetical mechanisms in cases of SS and FS.
Key words: systemic sclerosis, focal scleroderma, disorders of lipid metabolism, hypohyseal- thyroid system.
К числу актуальных и сложных проблем медицины относят системные болезни соединительной ткани, среди которых второе место по частоте и распространенности занимает системная склеродермия, в настоящее время по МКБ 10 относящаяся к системному склерозу (СС) [1]. В отличие от СС, при котором в патологический процесс вовлекаются различные органы, ограниченная склеродермия (ОС) характеризуется поражением только кожи, в связи с чем ОС по МКБ 10 относится к болезням кожи и подкожной клетчатки (XII класс) [1]. Считается, что ОС не сопровождается развитием висцеральной патологии, хотя ее распространенные и генерализованные формы имеют много общего с СС. Отличительной чертой склеродермии в детском возрасте является преимущественное формирование очаговых форм поражения кожи - изолированно или с признаками системности. Типичная системная склеродермия (лимитированная или диффузная) у детей встречается значительно реже [2].
Вариабельность клинических проявлений склеродермии, многочисленность этиологических и патогенетических компонентов с развитием аутоиммунных и иммунокомплексных процессов выдвигает на первый план изучение органной патологии у детей и подростков на ранних этапах развития СС и ОС.
Материалы и методы исследования
На базе ревматологического отделения детской клинической больницы № 4 г. Минска обследованы 65 пациентов в возрасте 6-17 лет, страдающих различными формами склеродермии (средний возраст 12,98±0,36 лет). Все пациенты были разделены на 2 клинические группы: 1-я - 24 ребенка с СС, 2-я - 41 ребенок с ОС. В качестве статистического контроля дополнительно обследованы 30 практически здоровых детей в возрасте 6-17 лет (средний возраст 12,93±0,4 лет).
Диагностику СС, оценку стадии, активности, характера течения заболевания проводили с учетом классификации, разработанной Н.Г. Гусевой, а также использовали диагностический алгоритм, разработанный Американской ревматологической ассоциацией и модифицированным НИИ ревматологии РАМН [3, 4]. Диагностику ОС осуществляли согласно классификации С.И. Довжан-ского [2]. Большинству пациентов проведена инцизион-ная биопсия склеродермических очагов с последующей морфологической верификацией диагноза. Комплекс клинического обследования детей включал подробный сбор данных анамнеза жизни и заболевания, объективный осмотр, общепринятые лабораторные и инструментальные исследования, а также консультации узких специалистов. Для оценки функционального состояния органов пищеварительного тракта всем пациентам про-
Беляева Людмила Михайловна - д. м. н., проф., зав. каф. педиатрии ГУО «Белорусская медицинская
Адрес: 220013, г. Минск, ул. П. Бровки, 3, к. 3
Тел.: (375-017) 341-17-22, E-mail: chizhevskaja@mail.ru
Статья поступила 25.11.08, принята к печати 10.06.09
водили эзофагогастродуоденоскопию (ЭГДС) с прицельной биопсией слизистой оболочки желудка (СОЖ) и последующим морфологическим анализом биопсийного материала, ультразвуковое исследование органов брюшной полости, копрологическое исследование и анализ кала на дисбактериоз кишечника.
Иммунологическое обследование включало определение относительного и абсолютного содержания популяций и субпопуляций лимфоцитов, определение концентрации IgG, ^А, ^М с помощью классического метода радиальной иммунодиффузии в агаровом геле МапеШ е! а1.).
Функциональное состояние гипофизарно-тиреоид-ной системы оценивали по содержанию тиреотропного гормона (ТТГ), общего тироксина (Т4), свободного тироксина (Т4 св), общего трийодтиронина (Т3), свободного трийодтиронина (Т3св.) и по значениям соотношения Т3/Т4.
Для исследования показателей липидного спектра крови определяли содержание общих липидов (ОЛ), общего холестерина (ОХС), а-холестерина (а-ХС), тригли-церидов (ТГ), фосфолипидов (ФЛ), липопротеинов низкой плотности (ЛПНП), очень низкой плотности (ЛПОНП), высокой плотности (ЛПВП), а также рассчитывали коэффициент атерогенности (КА) по формуле: КА= (ОХС - а-ХС)/а-ХС [5].
С целью изучения психологического состояния пациентов использовали шкалу Спилбергера, адаптированную Ю.Л. Ханиным (1972), детско-подростковый вариант [6].
Статистическую обработку данных, полученных в результате исследований, проводили с использованием программы 81а18о: 81аЙ8иеа 6.0.
Результаты и их обсуждение
Анализ анамнестических данных показал, что у большинства обследованных детей (62,5% больных с СС и 73,2% пациентов с ОС) заболевание развивалось в дошкольном (4-7 лет) и младшем школьном возрасте (8-11 лет). Средний возраст начала заболевания у пациентов с СС составил 8,27±0,81 лет, у пациентов с ОС - 8,23±0,57 лет. Средняя длительность заболевания у детей с СС составила 4,95±0,81 лет, с ОС - 5,06±0,42 лет.
ОС у детей начиналась без нарушения общего состояния и субъективных жалоб. Первые изменения кожи в области очага были различными: в виде преходящих изменений сосудистого рисунка, нарушений пигментации, легкой отечности кожи с изменениями ее цвета в виде эритемы с сиренево-розовым кольцом от периферии. У большинства пациентов, страдающих ОС (85,4%), имелась бля-шечная склеродермия, которая включала различные формы: овальные и полосовидные, очаговые и распространенные. При локализации очага на конечности склеродермический процесс нередко носил бляшечно-полосовидный и распространенный характер с нарушением функции конечности. У 4,9% пациентов наблюдалась линейная склеродермия, а у 9,7% - саблевидная. Среди обследованных пациентов с СС, несмотря на системный характер заболевания в целом, у 45,8% детей отме-
чалось очаговое поражение кожи. Лимитированную форму заболевания (вовлечение в патологический процесс кожи только кистей и/или лица) имели 41,7% больных с СС, диффузная форма СС наблюдалась у 12,5% пациентов. При гистологическом исследовании кожных биоптатов выявлены однотипные морфологические изменения у пациентов с СС и с ОС в виде атрофии эпидермиса и придатков кожи, периваскулярной лимфоплазмоцитар-ной инфильтрации, склероза и фиброза дермы.
Среди пациентов с СС у 16,7% больных в дебюте заболевания наблюдались субфебрильная лихорадка, слабость, повышенная утомляемость, потеря веса. Лимфоаденопатия выявлена у 16,7% пациентов с СС. Синдром Рейно отмечался у 58,3% детей с СС, при этом наблюдалось преимущественно стертое его течение: характерные приступы вазо-спазма отсутствовали, но имелись повышенная зябкость кистей, чувствительность их к холоду, ак-роцианоз. Телеангиэктазии были отмечены у 25% детей с СС. Наиболее частым проявлением суставного синдрома были полиартралгии у 54,1% больных СС. Артриты с умеренно выраженной воспалительной реакцией выявлены у 33,3% детей с СС. Поражение периартикулярных тканей с формированием контрактур отмечено у 16,7% пациентов с СС. Кальциноз мягких тканей выявлен у 8,3% детей с СС. Миозит был морфологически верифицирован у 33,3% больных. Антитела к ДНК были выявлены у всех детей с СС. Гипергаммаглобулинемия диагностирована в 29,2% случаев СС, повышенные уровни СРБ отмечены у 25% детей с СС.
При рентгенологическом исследовании легких выявлены сгущение и деформация легочного рисунка в базальных отделах, утолщение междолевой плевры у 70,8% пациентов с СС и у 78,1% больных с ОС. При проведении спирометрии у 33,3% детей с СС и у 31,7% пациентов с ОС диагностированы нарушения функции внешнего дыхания по рестрик-тивному типу. По данным электрокардиографического обследования у 75% больных СС и у 75,6% детей с ОС установлены нарушения ритма сердца и проводимости. Клинически висцеральная патология была мало выражена и диагностировалась только при инструментальном исследовании.
По данным ЭГДС у 91,7% пациентов с СС и у 63,4% детей и подростков с ОС наблюдались изменения слизистой оболочки верхних отделов пищеварительного тракта (ВОПТ) с признаками воспаления, при этом у большинства из них воспалительный процесс имел место на уровне нескольких отделов пищеварительного тракта - пищевод, желудок и/или двенадцатиперстная кишка (72,7% случаев с СС и 76,9% с ОС).
Гистоморфологическое исследование пораженных участков слизистой оболочки ВОПТ свидетельствовало о легкой степени выраженности и низкой степени активности воспалительного процесса, а также о невысокой степени обсеменения
Helicobacter pylori, что свидетельствует о возможной связи воспалительного процесса в слизистой оболочке с основным заболеванием.
Нарушения моторной функции ВОПТ в виде недостаточности кардии выявлены у 19,5% детей и подростков с ОС и у 29,2% с СС, а дуоденогастраль-ный рефлюкс - у 7,3% и 20,8% соответственно.
Для детей и подростков, страдающих склеродермией, по данным копрологического исследования было характерно наличие значительного количества растительной клетчатки в кале (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
ких групп при сравнении с контрольной группой (см. рисунок). Полученные результаты указывают на наличие у детей и подростков с СС и с ОС пограничных состояний с признаками угрозы самооценке, снижающих порог устойчивости к стрессовым ситуациям.
1. СС и ОС у большинства детей и подростков (91,7% и 63,4% соответственно) сопровождаются поражением различных отделов желудочно-кишечного тракта, как правило, в виде гастродуоденита или эзофагита с гастродуоденитом; при этом воспаление слизистой оболочки ВОПТ чаще имеет легкую степень выраженности, низкую степень активности и контаминации Helicobacter pylori.
2. Для детей и подростков, страдающих СС и ОС, характерны признаки дисфункции гипофизар-но-тиреоидной системы, проявляющиеся повышением уровня ТТГ, снижением концентраций общих и свободных фракций Т4 и Т3 в сыворотке крови.
3. Для детей и подростков с СС и ОС характерны нарушения липидного обмена, проявляющиеся высокой атерогенной направленностью и снижением уровня ОЛ.
Рисунок. Структура реактивной (а) и личностной (б) тревожности у обследованных детей и подростков. 1 - СС, 2 - ОС, 3 - контроль; Ш - низкий уровень, Ш - умеренный уровень, Ш - высокий уровень.
4. Для большинства детей и подростков с СС (91,3%) и ОС (80,6%) характерны эмоционально-личностные особенности, проявляющиеся повышенными уровнями реактивной и личностной тревожности, что требует включения в комплексную терапию этих пациентов методов психотерапевтической коррекции.
2. Короткий Н.Г., Шарова Н.М., Прокушева Т.В., Гудков ТА. Применение тимодециссина при ограниченной склеродермии. Клин. дерматология и венерология. 2006; 4: 81-83.
3. Гусева Н.Г. Системная склеродермия и псевдосклеро-дермические синдромы. М.: Медицина, 1993.
4. Кардиология и ревматология детского возраста. Под
По данным Института медицинских публикаций, существует много недостатков в качестве охраны здоровья в США. Проводящиеся исследования продолжают выявлять недостатки в качестве медицинской помощи взрослым и детям, в том числе в области узкоспециализированной помощи. Воспалительные заболевания кишечника (ВЗК) - болезнь Крона и язвенный колит - требуют тщательного и длительного ведения и внимания к своим возможным кишечным и внекишечным проявлениям. Хотя качество помощи при ВЗК не было оценено проспективно и всесторонне, но ряд небольших исследований показал, что уровень помощи сильно разнится. Так как име-
ред. Г.А. Самсыгиной и М.Ю. Щербаковой. М.: ИД Медпракти-ка. М., 2004: 721-735.
5. Камышников В.С. Справочник по клинико-биохимичес-кой лабораторной диагностике: в 2 т. 2-е изд. Мн.: Беларусь, 2002.
6. Радюк О.М., Родцевич О.Г. Диагностика уровней тревожности в психотерапевтической практике: учебно-методическое пособие. Мн.: БелМАПО, 2003.
ет место и недостаточное, и чрезмерное, и неправильное лечение и обследование, такой разброс говорит о том, что необходимо знакомить практических врачей с протоколами лечения, основанными на доказательной медицине, и добиваться, чтобы больные получали это лечение. В статье приведены обзор истории проблемы, логические доказательства, описаны методы качественного ведения и рассмотрены проблемы применения этой общей стратегии для лечения ВЗК.
Kappelman MD, Palmer L, Boyle BM, Rubin DT. Inflamm. Bowel. Dis. 2009 Jul 1. [Epub ahead of print].
КАЧЕСТВО ПОМОЩИ БОЛЬНЫМ С ВОСПАЛИТЕЛЬНЫМИ ЗАБОЛЕВАНИЯМИ КИШЕЧНИКА:
Читайте также:


