Проблема госпитальной стафилококковой инфекции микробиология

Несмотря на поиск и внедрение новых методов борьбы с госпитальными микробами, проблема внутрибольничных инфекций остается одной из самых острых в современных условиях, приобретая все большую медицинскую и социальную значимость [1]. Актуальность проблемы внутрибольничных инфекций обусловлена появлением так называемых госпитальных (как правило, полирезистентных к антибиотикам и химиопрепаратам) штаммов стафилококков, сальмонелл, синегнойной палочки и других возбудителей. Они легко распространяются среди детей и ослабленных, особенно пожилых, больных со сниженной иммунологической реактивностью, которые представляют собой так называемую группу риска [7, 8, 9].
Заболеваемость госпитальными инфекциями колеблется от 5 до 20 % от общего числа пациентов, госпитализированных в лечебные учреждения [5]. По результатам ряда исследований, уровень смертности в группе госпитализированных и приобретших внутрибольничные инфекции пациентов в 8–10 раз превышает таковой среди госпитализированных больных без внутрибольничных инфекций [1, 5]. Возбудители госпитальных инфекций отличаются высоким персистентным потенциалом и быстро развивающейся устойчивостью к дезинфектантам и антибиотикам, что позволяет патогенной микрофлоре длительное время находиться в окружающей среде и противостоять защитным силам макроорганизма.
Основными возбудителями бактериальных инфекций являются стафилококки, пневмококки, грамотрицательные энтеробактерии, псевдомонады и представители строгих анаэробов. Главенствующую роль играют стафилококки (до 60 % всех случаев внутрибольничных инфекций), грамотрицательные бактерии, респираторные вирусы и грибы рода Candida. Штаммы бактерий, выделенные от пациентов с нозокомиальными инфекциями, как правило, более вирулентны и обладают множественной химиорезистентностью [9, 11].
В связи с этим целью данного исследования было выявление основных особенностей внутрибольничных штаммов Staphylococcus aureus нозокомиальных инфекций, включая персистентный потенциал, антибиотикорезистентность и чувствительность госпитальных штаммов к дезинфектантам.
Материалы и методы исследования
Бактериологическое исследование микробной обсемененности объектов внешней среды было проведено согласно методическим рекомендациям по санитарно-эпидемиологическому режиму [4]. Отбор проб с поверхностей различных объектов осуществляли методом смывов. Идентификацию штаммов производили с учетом их морфологических и культуральных признаков. В качестве факторов персистенции изучены антилизоцимная, антикомплементарная, каталазная активности [5]. Антибиотикочувствительность исследовали диско-диффузионным методом. Чувствительность выделенных штаммов к 0,01 % раствору анолита исследовали путем добавления в соответствующем разведении к жидкой бактериальной культуре. Статистическую обработку проводили стандартными методами.
Результаты исследования и их обсуждение
При исследовании смывов в лечебном учреждении в 35 % случаев были выделены штаммы Staphylococcus аureus, в 17 % проб были выделены штаммы Klebsiella pneumoniae, в 10 % – Proteus vulgaris и Proteus mirabilis, в 2–5 % – Enterobacter, Acinetobacter. Так как наиболее часто встречаемыми штаммами являлись штаммы Staphylococcus aureus, были исследованы характеристики золотистого стафилококка.
В качестве факторов персистенции исследовали антилизоцимную (АЛА), антиинтерфероновую (АИА), антикомплементарную (АКА) активности как возможные пути противостояния кислороднезависимому механизму фагоцитоза и активность антиоксидантного бактериального фермента – каталазы. Антилизоцимной активностью обладало 67 % (20 культур) из 30 изученных штаммов. АИА обладало 44 % (13 культур), АКА обладали 34 % (10 культур) изученных нами штаммов S.aureus.
Известно, что первичными бактерицидными факторами, выделяемыми фагоцитами, являются перекись водорода и продукты ее свободнорадикального разложения, такие как гипохлорид и гидроксильный радикал [5]. Стафилококки приспосабливаются выживать в среде с повышенной концентрацией перекиси водорода путем индукции генов раннего ответа на окислительное повреждение [5]. Белковыми продуктами этих генов являются, среди прочих, фермент каталаза, разлагающий перекись водорода до нейтральных продуктов – воды и молекулярного кислорода и фермент супероксиддисмутаза, разлагающий супероксид анион радикал до молекулярного кислорода. Каталазная активность была выявлена у 80 % штаммов, при количественной оценке каталазной активности бактерий обнаружено, что большая часть штаммов (55 %) обладала высокой активностью фермента (4,0–5,1 ед./20 млн).
35–42 % штаммов S. aureus обладали множественной резистентностью, проявляя при этом чувствительность к препаратам цефалоспоринов (цефтриаксон, цефотаксим, цефуроксим). Для исследования чувствительности к применяемым в лечебных учреждениях дезинфектантам была проведена серия опытов по определению чувствительности S. aureus к раствору анолита. Обнаружено, что выделенные штаммы проявили устойчивость более чем в 60 % случаев к 0,01 % раствору анолита.
Таким образом, при изучении основных особенностей внутрибольничных инфекций, включая персистентный потенциал, антибиотикорезистентность и чувствительность госпитальных штаммов к дезинфектантам можно сделать следующие выводы:
1. При дальнейшем подборе дезинфектантов в стационарах необходимо учесть, что выделенные штаммы проявили устойчивость к 0,01 % раствору анолита, применяемого в современных медицинских учреждениях для дезинфекции. Возможно, данный дезинфицирующий раствор необходимо применять в более высокой концентрации или заменить его другим раствором.
2. Высокий персистентный потенциал выделенных штаммов стафилококков является фактором риска для пациентов, приводя к развитию затяжных гнойно-воспалительных заболеваний. Поэтому изучение патогенетически значимых свойств микроорганизмов, направленных на инактивацию эффекторов противоинфекционого иммунитета и тем самым нарушающих процесс элиминации патогена из очага воспаления [10], может стать альтернативным подходом к прогнозированию длительности течения гнойно-воспалительных заболеваний и дает возможность своевременного подключения иммунокорригирующих препаратов.
Рецензенты:
Человек тесно связан с повсеместно распространенными стафилококками (убиквитарный микроорганизм), и поэтому стафилококковая инфекция представляет угрозу в любом месте и в любое время. Пример тому – госпитальная инфекция, уже на протяжении многих лет являющаяся серьезной проблемой для больниц во всем мире.
С этой проблемой связан ряд вопросов, требующих обсуждения. Прежде всего, стафилококковая госпитальная инфекция – это осложнение широкого применения антибиотиков. Эти важнейшие антимикробные агенты очень широко и свободно назначаются, но их действие преимущественно бактериостатическое, а не бактерицидное. Стафилококки наделены хорошей приспособляемостью и среди них возникают устойчивые к антибиотикам штаммы. Во-вторых, особенности медицинского страхования и медицинской службы способствуют раннему выявлению болезни и ранней госпитализации большего числа больных. В-третьих, расширение объема и числа хирургических вмешательств. Сложная хирургическая техника позволяет оставлять ткани открытыми дольше. В-четвертых, отдельные виды терапии могут вызывать угнетение иммунной системы (иммунодепрессию). Например, трансплантация тканей и органов на фоне назначения средств, подавляющих отторжение. В этих случаях подавляется резистентность к инфекции.
С наибольшей частотой при госпитальной стафилококковой инфекции наблюдаются следующие поражения:
1. Пиодермия – термин, обозначающий гнойные поражения кожи и подкожных тканей. Чаще у новорожденных. Возможны опасные осложнения в виде пневмонии, септицемии. От новорожденного может заразиться мать, у которой развивается абсцесс грудной железы – мастит.
2. Раневая инфекция, особенно хирургической раны.
3. Вторичная стафилококковая инфекция престарелых и лиц, не способных к соблюдению гигиенических норм.
4. Гастроэнтерит у лиц с угнетенной (например антибиотиками) кишечной микрофлорой.
Патологическая анатомия
Наиболее заметное проявление стафилококковой инфекции – абсцесс, основной тип повреждения. В основе образования абсцесса лежит гноеродная активность стафилококка и его довольно ограниченная способность к распространению. госпитальная стафилококковая инфекция фаговар
Поскольку микроб постоянно обитает на коже, она чаще всего и поражается. Фурункул – это кожный абсцесс. Формирование абсцесса обусловлено локализацией и уровнем распространения. Стафилококковая пневмония – это множественные абсцессы в легких. Пиелонефрит – это множественные абсцессы экскреторной системы почек. Стафилококковая септицемия – образование множественных абсцессов по всему телу. В этом случае более подходит термин пиемия, буквально означающий "гной в крови".
Когда стафилококки инфицируют рану, они вызывают образование в ней гноя. Стафилококки являются важнейшей причиной раневой инфекции. В целом, они вызывают до 80% всех гнойных процессов у человека.
Эпидемиология
Стафилококки в норме обитают на коже человека, а также на слизистой ротовой полости, глотки и носа. Они могут находиться здесь постоянно, пока однажды не преодолеют кожный или слизистый барьер и не вызовут развитие болезни. В другом случае они проникают через неповрежденную кожу в волосяные фолликулы и протоки сальных желез.
В норме способность стафилококка к инвазии и резистентность хозяина хорошо сбалансированы поэтому инфекция не развивается, пока не создастся ситуация, когда встречаются высоковирулентный микроб или макроорганизм со сниженной резистентностью.
Как правило, развивается локальный процесс – абсцесс или фурункул, без распространения инфекции. Но в части случаев микроб выходит за пределы локальной инфекции, попадает в кровоток и поражает разные ткани и органы тела.
Механизм передачи инфекции преимущественно контактный. Например, через руки персонала в больнице. Персонал подвергается риску стать носителями, в этом случае стафилококк может длительно находиться у них на слизистой носа. Носители могут стать источниками инфекции.
Стафилококки Отдел Firmicutes, семейство Micrococcaceae, род Staphylococcus. 3 вида: S. aureus, S. epidermidis и S. saprophyticus.
К факторам патогенности стафилококков относятся фер-менты коагулаза, гиалуронидаза, фибринолизин, ДНК-аза, леци-товителлаза и др. Коагулаза -- бактериальная протеиназа, свер-тывающая плазму крови животных. Наличие коагулазы является одним из наиболее важных и постоянных критериев патогенности стафилококков.
Патогенные стафилококки синтезируют и секретируют высокоактивные экзотоксины и ферменты. Среди экзотоксинов выделяют четыре типа гемотоксинов (стафилолизи-нов), лейкоцидин и энтеротоксины.
К гемотоксинам относятся альфа-, бета-, гамма- и дельта-гемо-лизины.
Альфа-гемолизин вызывает лизис эритроцитов овец, свиней, собак, обладает болезни - группа весьма различных заболеваний, обусловленная стафилококками. Основные проявления стафилококковой инфекции - гнойные заболевания кожи и подкожной клетчатки, стафилококковый сепсис, синдром токсического шока, пневмонии, ангины, энтероколит, отравление стафилококковым энтеротоксином и поражение центральной нервной системы.
Эпидемиология. Эпидермальный и другие коагулазоотрицательные стафилококки являются частью нормальной микрофлоры кожных покровов, слизистых оболочек и нижнего отдела кишечника. Здоровое носительство золотистого стафилококка в нижних носовых ходах наблюдается у 70-90% обследованных, у некоторых из них (20%) носительство может продолжаться длительное время. Носительство чаще наблюдается у медицинского персонала. В отдельных случаях стафилококковое заболевание может возникнуть за счет эндогенной инфекции, при ослаблении защитных сил макроорганизма или при дисбактериозе. Так, при лечении антибиотиками широкого спектра действия возможны тяжелые стафилококковые энтероколиты. Возможна передача инфекции с инструментами, перевязочным материалом, предметами ухода, а также пищевыми продуктами.
Лечение стафилококковых инфекций обычно проводят антибиотиками и сульфаниламидными препаратами. В последние годы от больных часто выделяют стафилококки, резистентные к большинству химиотерапевтических препаратов. В таких случаях для лечения используют антитоксическую противостафилококковую плазму или иммуноглобулин, полученные из крови доноров, иммунизированных стафилококковым анатоксином. Для активной иммунизации (плановых хирургических больных, беременных женщин) может быть использован адсорбированный стафилококковый анатоксин.
бактериологическая диагностика, то есть выделение чистой культуры и идентификацияю. Материал от больных и бактерионосителей засевают немедленно или не позднее 3-4 ч после взятия при условии хранения его на холоде. делают посевы на кровяной агар и элективные для стафилококков среды или молочно-желтково-солевой агар. Чашки с посевами инкубируют при 37 ° С в течение 48 часов. На второй день производят высев из сахарного бульона на указанные элективные среды, исследуют массивность роста и характер колоний после посевов других материалов. На кровяном агаре стафилококки образуют непрозрачные, слегка выпуклые колонии средних размеров с гладкой, блестящей, словно полированной поверхностью, четко очерченным краем, маслянистой консистенции.
Бактериоскопический. Из патологического материала готовят мазки, окрашивают по Граму, микроскопируют. Прямая микроскопия позволяет дать только предварительный ответ. Одновременно сеют материал в чашки с кровяным, молочно-солевым и желточно-солевым агаром.
Выявляют летальные свойства культуры на кроликах и проводят дерматонекротическую пробу.
1) получен препарат из экзотоксина - анатоксин, его используют для вакцинации беременных женщин, у них возникает антитоксический иммунитет, который передается через плаценту ребенку.
2) стафилококковый ?-глобулин - получают из крови доноров, иммунизированных анатоксином, создают пассивный иммунитет (используют так и для лечения).
3) стафилококковая аутовакцина - получают из штаммов staph, выделенных от больных. Используют при хронических инфекциях для активации иммунитета.
4) лечить носителей и больных.
5) разделение гнойного и чистого отделений в больнице
6) прививают рожениц анатоксином, который трансплацентарно передаётся плоду.
9.Проблема госпитальной стафилококковой инфекции в педиатрии. Значение носительства стафилококков у работников в детских учреждениях. Принципы санации носителей. Методы эпидемиологического анализа госпитальных стафилококковых инфекций.
Особое-проблема – профилактика стафилококковых заболеваний у новорожденных. В профилактику включается иммунизация рожениц анатоксином, а также проведение количественного и качественного анализа обсемененности молока рожениц. Наиболее опасноны насители инфекции, слизистых верхних дыхательных путей, с кожными поражениями.
10.Стрептококки, их классификация (Ленсфильд). Общая характеристика стрептококков, факторы патогенности. Роль стрептококков группы А и В в патологии человека. Микробиологическая диагностика стрептококковых заболеваний.
Стрептококки Отдел Firmicutes, семейство Streptococcaceae, род Streptococcus. В род Streptococcus входят более 20 видов, среди которых есть представители нормальной микрофлоры человеческого тела и возбудители тяжелых инфекционных эпидемических заболеваний человека.
Более совершенной оказалась классификация, предложенная Ленсфильд (1933) и Гриффитсом (1935), основанная на антигенной структуре стрептококков. Согласно этой классификации, все стрептококки были разбиты по групповому С-антигену на 17 групп — от А до S. Данные о распространении отдельных групп приведены в табл. 2.

мелкие (меньше 1 мкм) шаровидные клетки, располагающиеся цепочками или попарно, грамположитель-ны, спор не образуют, неподвижны. Большинство штаммов стрептококков образуют капсулу, состоящую из гиалуроновой кислоты. Клеточная стенка содержит белки (М-, Т- и R-антиге-ны), углеводы (группоспецифические) и пептидогликаны. Легко переходят в L-формы.
Растут на средах, обогащенных углеводами, кровью, сывороткой, асцитической жидкостью. На плотных средах обычно формируют мелкие серые колонии. На жидких средах для стрептококков характерен придонный рост. Стрептококки — факультативные анаэробы. На кровяном агаре вызывают а-гемолиз (зеленящий) и р-гемолиз (полный). Погибают при пастеризации при 56 °С в течение 30 мин.
Патогенные стрептококки продуцируют экзотоксины различного действия.
Гемолизин обусловливает разрушение эритроцитов, лейкоцитов, тромбоцитов, макрофагов; при внутривенном введении кроликам вызывает гемоглобинемию и гематурию.
Лейкоцидин разрушает лейкоциты или угнетает их фагоцитарные свойства.
Летальный токсин (некротоксин) при внутрикожном введении кролику вызывает некроз. Некротическому действию могут подвергаться паренхиматозные органы и другие ткани.
Кроме экзотоксинов патогенные стрептококки продуцируют ферменты гиалуронидазу, фибринолизин, дезоксирибонуклеазу, рибонуклеазу, нейраминидазу, протеиназу, стрептокиназу, амилазу, липазу, а также эндотоксины, которые характеризуются термостабильностью. Экзотоксины, например, термолабильны: гемолизин инактивируется при температуре 55 °С в течение 30 мин, лейкоцидин -- при 70 °С. Наиболее термоустойчив фибринолизин, не разрушающийся при кипячении до 50 мин.
Группыстрептококков. Современная классификация основывается на определении антигенной структуры стрептококков, позволяющей под-разделить все стрептококки на 17 серологических групп, обозначаемых латинскими буквами в порядке алфавита. Практический интерес представляют серогруппы А, В, С, D, E, F. Группа А -- возбудители большого числа инфекций у человека; группа В -- возбудители мастита у коров; группы В, С, D, Е -- возбудители инфекций у животных разных видов. Антигеном, который позволяет разделить стрептококки на серогруппы, является полисахарид (С-вещество), входящий в состав клеточной стенки стрептококков.
Химическая природа стрептококковых антигенов неодинакова. В группе А ими являются белковые антигены М, R и Т.
Лечение Лечение стрептококковой инфекции проводится с использованием антибиотиков пенициллинового ряда : бензилпенициллин, ампициллин, бициллин-3. Устойчивость против пенициллиновых антибиотиков стрептококки приобрести не способны
Для выведения токсинов из организма необходимо обильное питье до 3-х литров жидкости в сутки.
Иммунитет после перенесенной стрептококковой инфекции нестоек, поэтому человек может неоднократно болеть стрептококковыми заболеваниями (исключение составляет один из компонентов – против токсинов вырабатываемых стрептококком, он остается на всю жизнь, обеспечивая защиту от повторного заболевания скарлатиной).
Бактериологический При подозрении на сепсис сеют у постели больного 10-15 мл крови во флакон, содержащий 100-150 мл сахарного бульона (соотношение крови и среды 1:10). Лучшие и надежные результаты дают посевы крови в среду Китт-Тароцци с полужидким агаром. В нем будут расти и анаэробные стрептококки. Посевы крови инкубируют в термостате при 37 ° С. При росте стрептококков на дне среды появляется осадок. В среде Китт-Тароцци может образовываться и газ. В мазках из осадка обнаруживают грамположительные стрептококки в виде длинных цепочек.
Бактериоскопический Патологический материал (слизистые истечения из носовых отверстий, гнойный экссудат или пунктат подчелюстных лимфоузлов), направленный в лабораторию, исследуют по общей схеме: микроскопия мазков; посев поступившего материала на питательные среды для выделения чистой культуры стрептококков и их идентификации; биологическая проба -- на белых мышах, кошках, особенно на котятах. Последние гибнут от одной десятимиллионной дозы бульонной культуры при подкожном заражении в течение 3--10 дней.
Значение других стафилококков за редким исключением ограничено проблемой госпитальных (внутрибольничных) инфекций. Реализация их весьма условной патогенности связана с инвазивностью современных диагностических и лечебных процедур, которые способствуют внедрению бактерий, широко представленных в микрофлоре человека и окружающей среде.
Золотистый стафилококк (S. aureus)
Отличить S. aureus от других стафилококков нетрудно, тем более что его культуральные особенноcти легко усилить при помощи дифференциально-диагностических сред, выявляющих активность ферментов (липаза, дезоксирибонуклеаза, стафилокиназа) или токсинов (гемолизины) (рис. 2). Изучение культуральных признаков, мазок из колонии, окрашенный по Граму, и тест на свертывание плазмы (из стафилококков человека только S. aureus обладает коагулазной активностью) фактически исчерпывают рутинный микробиологический анализ. Впрочем, иногда приходится решать еще две задачи: определение чувствительности к антибиотикам и внутривидовое типирование для выяснения закономерностей распространения инфекции (источник заражения, пути передачи).
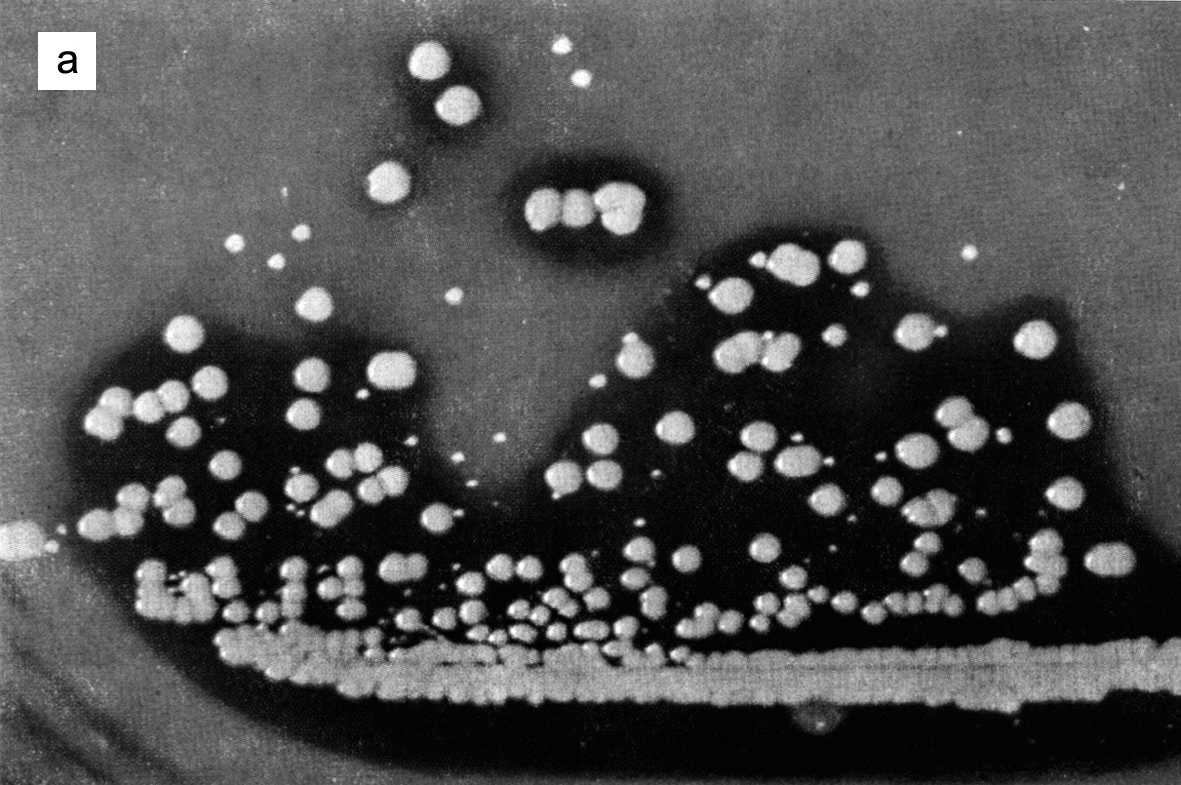
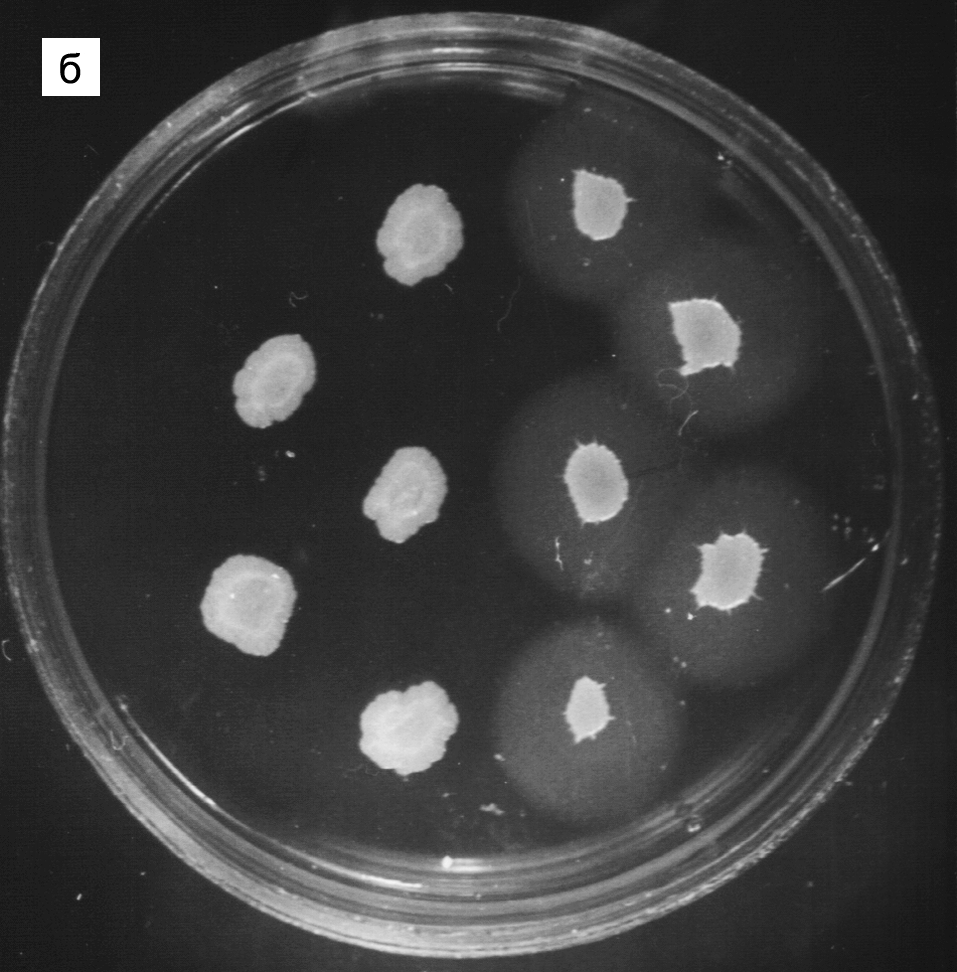
Рис. 2. Колонии стафилококков на дифференциально-диагностических средах. На кровяном агаре (а) колонии S.aureus окружены зоной гемолиза; колонии S.epidermidis — мелкие, негемолитические. На желточно-солевом агаре (б) колонии S. aureus окружены мутным орелом расщепленных липидов (результат высокой липазной активности)
Серологическая дифференцировка штаммов не является общепризнанной. Стафилококки обладают сложным и непостоянным набором поверхностных антигенов и использовать их для типирования бактерий не удалось. По капсульному полисахариду золотистый стафилококк может быть разделен на 11 серотипов, однако этого явно недостаточно для эпидемиологической практики. Штаммы S. aureus можно различить по генотипу или по спектру секретируемых белков, но чаще применяется фаготипирование c помощью международного набора бактериофагов (табл. 1).
Т а б л и ц а 1
Фаготипирование золотистого стафилококка
| Фагогруппа | Фаги (фаготип, или фаговар) |
| I | 29, 52, 52A, 79, 80 |
| II | 3A, 3C, 55, 71 |
| III | 6, 42E, 47, 53, 54, 75, 77 |
| IV | 42D |
| Вне групп | 81, 94, 95, 96 |
Одна и та же культура может лизироваться разными фагами, из чего складывается профиль фагочувствительности (фагомозаика) штаммов. Так как число подобных спектров велико и на практике их трудно учитывать, фаги объединены в группы. Каждый штамм относится к одной из фагогрупп и соответствующему фаготипу; предпочтение отдают фагам с наибольшей литической активностью. Совпадение фагомозаики у штаммов, изолированных от разных больных, говорит об общем источнике инфекции.
Экология
Золотистый стафилококк принадлежит к числу широкораспространенных бактерий. Он часто выделяется от здоровых людей и с этой точки зрения может рассматриваться как факультативный компонент нормальной микрофлоры. Контакт с ним неизбежен, и уже в первые дни жизни (в родильном доме) практически все новорожденные подвергаются контаминации. Повышенный уровень инфицирования наблюдается и в обычных медицинских стационарах, причем как среди больных, так и у обслуживающего персонала. Чаще всего золотистый стафилококк локализуется на слизистой оболочке носа и носоглотки. Примерно 20% людей не поддерживают носительства. Для большинства людей (около 60%) носительство транзиторно: они освобождаются от стафилококка через несколько дней или недель и, если заражаются вновь, то уже другим штаммом. Но встречаются и упорные носители (их около 20%), у которых тот же штамм выделяется месяцы и даже годы. Это наиболее вероятный источник инфицирования окружающих, особенно при высокой обсемененности носителя (эпидемически опасным считается присутствие более 10 млн. бактерий в 1 мл назального секрета).
Борьбе с носительством золотистого стафилококка отдано немало сил. Этот вопрос особенно важен для медицинских учреждений, где угрозе заражения подвергаются ослабленные больные и дети. Однако реальных успехов и общепризнанных рекомендаций добиться не удалось. Борьба со здоровым носительством — это по сути борьба с нормальной микрофлорой, что не всегда проходит бесследно для природных микробиоценозов, провоцируя развитие дисбиотических состояний. Об этом следует помнить и санировать лишь злостных носителей, т.е. лиц, упорно выделяющих большие дозы бактерий. Появились надежды, связанные с местными аппликациями антибиотика мупироцина (природного продукта Pseudomonas fluorescens), который неплохо справляется с интраназальным носительством золотистого стафилококка. Он быстро метаболизируется сывороточными ферментами, а потому должен применяться местно. Это первый препарат, действующий на тРНК-синтетазы (в том числе на метациллинрезистентные клоны золотистого стафилококка), и есть надежда, что будут получены аналоги мупироцина для внутреннего использования.
Вторая по значимости экологическая ниша для S. aureus — кожа, особенно участки с повышенной влажностью (у 10—20% людей золотистый стафилококк выделяется из промежности). Колонизация кожи создает основу для ее пиогенных инвазий — самой распространенной стафилококковой инфекции. В небольших количествах золотистый стафилококк присутствует в толстом кишечнике и влагалище. Изредка это служит причиной местных поражений или системных интоксикаций.
В основе клинического разнообразия стафилококковой патологии лежит способность S. aureus 1) вызывать пиогенную инвазию кожи и ее придатков, 2) проникать в кровь и индуцировать пиогенные (гнойно-деструктивные) поражения внутренних органов, 3) вызывать неспецифическую (септическую) и 4) специфические интоксикации.
Чаще всего S. aureus поражает кожу с развитием пиодермий — не только самой распространенной формы стафилококковой инфекции, но и пиогенных инвазий вообще. Слизистые оболочки поражаются редко, и в этом отношении стафилококк отличается от стрептококка (Str. pyogenes), который чаще инфицирует слизистые оболочки. Отсюда сравнительно небольшое значение золотистого стафилококка при ангинах, отитах, гайморитах и первичных поражениях бронхолегочного аппарата. Стафилококковая инфекция выступает здесь как фактор, осложняющий течение основного патологического процесса.
1.1 . В настоящих методических указаниях представлена информация о роли метициллинрезистентных штаммов золотистого стафилококка в возникновении внутрибольничных инфекций, их микробиологических и эпидемиологических особенностях, изложены традиционные и молекулярно-генетические методы идентификации и типирования.
1.2 . Методические рекомендации разработаны в помощь специалистам органов и учреждений, осуществляющих государственный санитарно-эпидемиологический надзор, и лечебно-профилактических учреждений, осуществляющих организацию и проведение профилактических и противоэпидемических мероприятий по борьбе с внутрибольничными инфекциями.
2.2 . Положение о государственной санитарно-эпидемиологической службе Российской Федерации, утвержденное постановлением Правительства Российской Федерации № 554 от 24 июля 2000 г.
2.6 . Методические указания по эпидемиологическому надзору за внутрибольничными инфекциями от 02.09.87. № 28-6/34.
В последнее десятилетие проблема внутрибольничных инфекций (ВБИ) приобрела исключительно большое значение для всех стран мира. Это обусловлено, прежде всего, значительным ростом числа госпитальных штаммов микроорганизмов, обладающих устойчивостью к широкому кругу антимикробных препаратов. Несмотря на значительный недоучет, в Российской Федерации ежегодно регистрируется около 30 тыс. случаев внутрибольничных инфекций, при этом минимальный экономический ущерб составляет более 5 млрд. рублей ежегодно. Среди возбудителей ВБИ одно из первых мест, по-прежнему, принадлежит микроорганизмам рода Staphylococcus , наиболее патогенным представителем которого является S . aureus . Эпидемиологическая ситуация осложняется в связи с широким распространением в стационарах, а также появлением и во внебольничной среде, клинических изолятов S . aureus, устойчивых к оксациллину (ORSA или MRSA ). MRSA способны вызывать разнообразные клинические формы внутрибольничных инфекций, включая наиболее тяжелые, такие как: бактериемия, пневмония, синдром септического шока, септический артрит, остеомиелит и другие, которые требуют длительного и дорогостоящего лечения. Появление осложнений, вызванных MRSA , приводит к увеличению сроков госпитализации, показателей летальности, значительным экономическим потерям. Показано, что рост частоты ВБИ, наблюдаемый в стационарах различных стран мира, обусловлен распространением эпидемических штаммов MRSA , многие из которых способны вырабатывать пирогенные токсины - суперантигены, подавляющие иммунный ответ на S . aureus .
С конца 90-х годов прошлого века в стационарах России отмечается рост частоты выделения MRSA , которая в ряде больниц достигла 30 - 70 %. Это делает неэффективным использование многих антимикробных препаратов и существенно ухудшает качество оказания медицинской помощи населению. В этих условиях совершенствование методов эпидемиологического и микробиологического мониторингов, направленных на выявление эпидемически значимых штаммов, приобретает все более актуальное значение.
4.1. Таксономия и биологические особенности
4.2. Клиническое значение
В настоящее время MRSA являются ведущими возбудителями внутрибольничных инфекций в стационарах многих странах мира. Частота их выделения в стационарах США, Японии, многих стран Западной Европы достигает 40 - 70 %. Исключение составляют, по-видимому, только ряд скандинавских стран, где исторически были приняты жесткие противоэпидемические меры по контролю за распространением таких штаммов. В стационарах Российской Федерации частота выделения MRSA колеблется от 0 до 89 %. Наибольшая частота выделения отмечается в реанимационных, ожоговых, травматологических и хирургических отделениях стационаров, расположенных в крупных городах. Одной из основных причин этой закономерности является концентрация в таких стационарах пациентов с нарушениями целостности кожных покровов и поврежденными иммунологическими барьерами. Наиболее частым местом локализации инфекции являются послеоперационные и ожоговые раны и дыхательные пути. Первичные и вторичные бактериемии наблюдаются примерно у 20 % инфицированных больных. В случае инфицирования ожоговых больных частота бактериемии нередко возрастает до 50 %. Факторами, способствующими развитию бактериемии, является присутствие центрального венозного катетера, анемия, гипотермия и назальное носительство. Развитие бактериемии значительно увеличивает вероятность летального исхода. Особенно высокая смертность, обусловленная бактериемией, наблюдается среди пациентов, находящихся в ожоговых и отделениях интенсивной терапии, где она может достигать 50 % по сравнению с 15 % в контрольной группе. Риск развития летального исхода возрастает почти в три раза среди пациентов, у которых бактериемия обусловлена MRSA по сравнению с пациентами, инфицированными метициллинчувствительными штаммами S. aureus . Развитие госпитальной бактериемии приводит к значительному увеличению стоимости госпитализации. В современных условиях лечение таких пациентов требует, как правило, внутривенного введения ванкомицина, тейкопланина или линезолида, однако клиническая эффективность этих препаратов нередко оказывается значительно ниже, чем у антибиотиков, используемых для лечения пациентов с осложнениями, вызванными метициллинчувствительными S . aureus . По данным Центра по контролю за заболеваниями (США) средняя продолжительность пребывания пациента в больнице в случае хирургического вмешательства составляет 6,1 дня, тогда как при возникновении осложнений, вызванных MRSA она увеличивается до 29,1 дней, при этом средние расходы возрастают с 29455$ до 92363$ в пересчете на каждый случай. Заболевания, вызванные MRSA, могут начинаться на фоне терапии антибиотиками, в том числе аминогликозидами и цефалоспоринами. В этой связи необходимо отметить, что неадекватное назначение антибиотиков в случае тяжелых ВБИ драматически ухудшает прогноз заболевания. Летальность при осложнениях, вызванных MRSA , значительно колеблется и зависит как от возраста пациента, сопутствующего заболевания (артериальная гипертензия, диабет и др.), так и от присоединения дополнительной микрофлоры. Наиболее распространенными вторичными проявлениями инфекции, обусловленной M RSA , являются эндокардиты, гематогенный остеомиелит, септический артрит. Одним из наиболее грозных осложнений, вызываемых MRSA , является синдром токсического шока (СТШ). Клинические проявления СТШ включают следующий симптомокомплекс: гипертермия, сыпь, рвота, диарея, гипотензия, генерализованный отек, острый респираторный дистресс синдром, полиорганная недостаточность, диссеминированная интраваскулярная коагуляция. СТШ может развиться как осложнение после родов, хирургических вмешательств, при суперинфицировании S . aureus трахеальных повреждений, вызванных вирусом гриппа. Недавно описанные стафилококковая скарлатина и синдром упорной десквамации эпителия рассматривают как варианты СТШ.
4.3. Факторы патогенности и вирулентность
Вопрос о вирулентности MRSA остается дискутабельным. Они практически не вызывают заболевания у здоровых лиц из числа медицинского персонала. Вместе с тем, в многочисленных исследованиях показано, что прогноз при тяжелых формах внутрибольничных инфекций, таких как пневмония и бактериемия, значительно хуже среди пациентов, инфицированных MRSA , по сравнению с пациентами, инфицированными метициллинчувствительными S . aureus.
4.4. Генетический контроль устойчивости к метициллину и особенности фенотипической экспрессии
Мишенью действия b -лактамных антибиотиков (как пенициллинов, так и цефалоспоринов) являются транс- и карбоксипептидазы - ферменты, участвующие в биосинтезе основного компонента клеточной стенки микроорганизмов - пептидогликана. Благодаря своей способности связываться с пенициллином и другими b -лактамами данные ферменты получили название пенициллинсвязывающих белков (ПСБ). У Staphylococcus aureus имеются 4 ПСБ, отличающиеся как по молекулярной массе, так и по функциональной активности. Устойчивость метициллинрезистентных штаммов золотистого стафилококка ( MRSA ) к b -лактамным антибиотикам обусловлена продукцией дополнительного пенициллинсвязывающего протеина - ПСБ-2 ¢ , отсутствующего у чувствительных микроорганизмов. При подавлении В -лактамным антибиотиком активности основных пенициллинсвязывающих белков ПСБ-2 ¢ , в силу своего более низкого сродства к препаратам данной группы, продолжает функционировать и сохраняет микробной клетке жизнеспособность. Синтез ПСБ-2 ¢ кодируется геном mec A , расположенным на хромосоме S . aureus , в специфической области, обнаруживаемой только у метициллинрезистетных штаммов стафилококка - тес ДНК. Ме c ДНК представляет новый класс мобильных генетических элементов, который получил название стафилококковая хромосомная кассета тес ( Staphylococcal chromosomal cassette тес = SCCmec ). Выявлено существование 4 типов SCCmec , различающихся как размерами (от 21 до 66 т.п.н.), так и набором генов, составляющих данные кассеты. Разделение на типы основано на различиях в генах, образующих собственно комлекс тес, и в наборе генов, кодирующих рекомбиназы сс r А и сс r В, входящих в различных сочетаниях в стафилококковую хромосомную кассету (рис. 1 ). Комлекс тес может включать: тесА - структурный ген, детерминирующий синтез ПСБ-2 ¢ ; mec I - регуляторный ген, влияющий на транскрипцию тесА; mecR 1 - ген, передающий внутрь клетки сигнал о наличии в среде b -лактамного антибиотика; а также инсерционные последовательности IS 431 и IS 1272. В настоящее время известны 4 варианта комплекса тес (рис. 2 ).
Кроме того, различия между типами кассет тес обусловлены присутствием ряда дополнительных генов, расположенных в генетических областях J 1а, J 1 b .

Генетическая структура комплексов тес различных классов
• Класс A, IS431 - mecA- mecR1- mec1
• Класс В , IS431 - mecA- D mec R1-IS1272
• Класс С , IS431 - mecA- D mec R1-IS431
• Класс D , IS 431 - mec A - D mec R 1
Рис. 2. тесА - структурный ген, детерминирующий синтез ПСБ-2 ¢ ;
mecI - регуляторный ген, влияющий на транскрипцию тесА;
mecR 1 - ген, передающий внутрь клетки сигнал о наличии в среде b -лактамного антибиотика; IS431 и IS 1272 - инсерционные последовательности
Уникальность метициллинрезистентности заключается также и в существовании феномена гетерорезистентности, суть которого состоит в том, что в условиях инкубации при 37 °С не все клетки популяции проявляют устойчивость к оксациллину. Генетический контроль феномена гетерорезистентности до настоящего времени полностью не выяснен. Известно только, что на экспрессию устойчивости могут влиять регуляторные гены b -лактамазы, а также ряд дополнительных генов, так называемые fem ( factors essential for methicillin resistance ) или aux , локализованные в различных частях хромосомы S . aureus , вне SCCmec . Сложность регуляции проявляется в фенотипических различиях. Выделяют 4 стабильных фенотипа (класса) резистентности. Первые три класса являются гетерогенными. Это означает, что в популяциях стафилококков, относящихся к этим классам, присутствуют субпопуляции микробных клеток с разным уровнем резистентности. При этом клоны стафилококков, получаемые из изолированных колоний (образовавшихся при рассеве первичной культуры) по популяционному составу полностью совпадают с исходной культурой.
Класс 1. Рост 99,99 % клеток подавляется оксациллином в концентрации 1,5 - 2 мкг/мл, рост 0,01 % микробов подавляется только при 25,0 мкг/мл.
Класс 2. Рост 99,9 % клеток подавляется при концентрации оксациллина 6,0 - 12,0 мкг/мл, тогда как рост 0,1 % микробов подавляется при концентрации > 25,0 мкг/мл.
Класс 3. Рост 99,0 - 99,9 % клеток подавляется при концентрации 50,0 - 200,0 мкг/мл и только рост 0,1 - 1 % микробной популяции подавляется при концентрации оксациллина 400,0 мкг/мл.
Класс 4. Представители этого класса характеризуются гомогенным уровнем устойчивости, который превышает 400,0 мкг/мл для всей популяции.
В связи с наличием гетерогенности по устойчивости к оксациллину могут возникать трудности при идентификации MRSA традиционными микробиологическими методами.
4.5. Особенности эпидемиологии MRSA
Будучи однажды занесенными в стационар, MRS А могут выживать там в течение длительного времени. Это определяет стратегию противоэпидемических мероприятий: очень важно не допустить занос и распространение в стационаре эпидемических штаммов.
Следует отметить, что периодически происходит смена эпидемического штамма, доминирующего на отдельных территориях. Так, по данным стафилококковой референс-лаборатории в Colindale ( London ), в 1996 г. штаммы EMRSA -15 и EMRSA -16 были ответственны за более чем 1500 инцидентов, охвативших трех и более пациентов, в 309 больницах Англии, тогда как остальные эпидемические штаммы были ответственны только за 361 инцидент в 93 больницах. Распространение этих эпидемических штаммов привело к росту смертности от MRSA в 15, а частоты бактериемии в 24 раза за период с 1993 по 2002 г.г. согласно данным национального департамента статистики Великобритании.
Продолжает нарастать спектр антибиоткорезистентности эпидемических штаммов MRSA . Они гораздо быстрее, чем метициллинчувствительные, приобретают устойчивость к препаратам из группы фторхинолонов. Характерной чертой многих эпидемических штаммов MRSA является устойчивость практически ко всем известным классам антимикробных препаратов, за исключением гликопептидов и оксазолидинонов. В последние годы участились случаи выделения изолятов MRSA , обладающих умеренной чувствительностью к ванкомицину и даже ванкомицинрезистентных. Распространение таких штаммов в стационарах России может иметь драматические последствия.
С проблемой госпитальных штаммов MRSA тесно переплетается и проблема MRSA вне госпитального происхождения. Эти штаммы пока не обладают множественной резистентностью к антибиотикам, генетически отличаются от госпитальных штаммов, их происхождение остается неизвестным. Предполагается, что они сформировались из спорадических госпитальных штаммов. Внегоспитальные штаммы MRSA способны вызывать некротизирующую форму пневмонии, характеризующуюся крайне тяжелым течением и требующей госпитализации пациента, в связи с чем возникает угроза заноса и распространения таких штаммов в стационарах.
Основные эпидемические штаммы и клоны MRSA
Международные клоны, идентифицированные в LMMRU ** (г. Нью-Йорк)
Читайте также:


