Обнаруженный стафилококк является коагулазоотрицательным что значит
Золотистый стафилококк (Staphylococcus aureus) – грамположительная условно-патогенная бактерия, распространенная повсеместно. В норме золотистый стафилококк могжет находиться у человека на слизистой оболочке носа, в брюшной полости и на коже.
Попав в организм человека, золотистый стафилококк вырабатывает токсины и может стать источником сепсиса при снижении иммунитета, вызывая генерализованные инфекции с очагами воспаления во внутренних органах, коже и костно-мышечной системе.
Основные источники инфекции: здоровые (носители) и больные люди, домашние и сельскохозяйственные животные, а также пища, содержащая золотистый стафилококк и его мощные токсины (чаще всего это сахаросодержащие молочные продукты, мороженное, кондитерские изделия без термообработки, салаты и т.п.).
Дети могут инфицироваться от взрослых стафолококконосителей. У детей грудного возраста возможно выделение стафилококка в посевах фекалий.
В эпидемиологических целях анализ на выявление патогенного стафилококка обязательно проводят во время ежегодных профилактических осмотров и при предварительных осмотрах для приема на работу в сферы обслуживания населения: медицины, образования, питания и торговли. В данном случае посев выполняется из носа и зева.
При наличии патогенного стафилококка в пробе обследуемого, через 18-24 часа наблюдается рост колоний золотистого цвета. В этом случае обязательно определяется количество стафилококка. Это необходимо врачу для решения вопроса о том, нужно ли проводить лечение.
Наличие золотистого стафилококка не обязательно означает инфекцию, это может быть бессимптомное носительство, например, при посеве мазков из носа и зева носительством считается количество бактерий до 10 3 КОЕ. Однако более высокие показатели говорят о том, что это уже не бессимптомное носительство, а то, что выявленный золотистый стафилококк может являться причиной заболевания.
- Для выяснения бактерионосительства или опасного инфицирования.
- Для подтверждения, что стафилококк является причиной возникшего заболевания (об этом свидетельствуют высокие показатели посева).
- Для определения целесообразности лечения.
- Для контроля за состоянием пациента после проведенного лечения.
Исследование можно пройти по направлению от лечащего врача вашей поликлиники, если есть клинические показания или на платной основе.
Лаборатория клинической микробиологии (бактериологии) Мурманской областной больницы предлагает следующие услуги по обнаружению патогенного стафилококка:
Микробиологическое (культуральное) исследование отделяемого зева на патогенный стафилококк
Микробиологическое (культуральное) исследование отделяемого носа на патогенный стафилококк
Микробиологическое (культуральное) исследование испражнений на стафилококк
Срок выполнения анализа: от 2 до 5 рабочих дней.
Подготовка к исследованию:
- Сбор материала проводится до начала лечения антибактериальными, иммунобиологическими препаратами (общего и местного значения).
- При контроле эффективности лечения (после окончания курса лечения) исследование проводится через 14 дней.
- Мазок из зева собирают натощак или через 3–4 часа после приема пищи.
- Перед взятием мазка из носа нельзя промывать носовые ходы.
- Желательно за 2–3 дня до взятия пробы находиться на диете, исключающей приём продуктов, усиливающих процессы брожения в кишечнике и молочнокислые продукты, а также алкоголь.
- За 3–4 дня до исследования необходимо отменить приём слабительных препаратов, касторового и вазелинового масла и прекратить введение ректальных свечей.
- Фекалии собираются ложечкой в стерильный одноразовый контейнер с завинчивающейся крышкой в количестве не более 1/3 объёма.
- Для получения достоверного результата - пробы фекалий храните в темном месте при температуре не выше 20—25 °С, во избежание чрезмерного размножения кишечной микрофлоры.
- Пробы фекалий не замораживайте.
Представлены результаты изучения видового состава стафилококков, циркулирующих среди персонала и на объектах внешней среды акушерского и хирургического стационаров г. Экибастуза за период 2007-2009гг.
Борьба с распространением внутрибольничных инфекций является комплексной и многофакторной задачей здравоохранения. Одним из ведущих возбудителей данных инфекций на протяжении длительного периода остаются микроорганизмы рода Staphylococcus, которые представляют большую угрозу для акушерских и хирургических стационаров, где находится наиболее незащищенный контингент. Одним из факторов в передаче инфекционного агента в стационаре являются персонал и объекты внутрибольничной среды.
Стафилококки - наиболее частые и опасные возбудители внутрибольничных инфекций. Распространение стафилококков в лечебных учреждениях приводит к гнойно-септическим осложнениям в хирургических стационарах, а в родильных домах стафилококковые эпидемии вызывают тяжелые послеродовые осложнения у матерей и новорожденных.
Бактерии распространены повсеместно; колонизируют кожные покровы и поверхности слизистых оболочек человека и животных.
Цель исследования: определение видового состава стафилококков, циркулирующих в акушерских и хирургических стационарах.
Материалы и методы: В работе использованы статистические данные по стафилококку, выделенному с 2007-2009 гг. в акушерских и хирургических стационарах города Экибастуза. Объектами исследования явились предметы внешней среды и персонал акушерского и хирургического стационаров. Выделение и идентификацию культур проводили согласно действующим приказам.
Результаты: Всего за три года (2007-2009 гг.) было обследовано 295 сотрудников акушерского стационара, из них было изолировано 76 штаммов каталазопозитивных, грамположительных кокков, по своим культуральным и биохимическим свойствам отнесѐнных к роду Staphilococcus, что составило 25,8%. Часть этих культур обладала плазмакоагулирующей активностью. Анализ биологических свойств, используемых в классификации стафилококков, согласно действующим приказам, позволил идентифицировать 52 штамма S.aureus (69%), 7 штаммов S.intermedius (9%) и 17 штаммов S.epidermidis (22%).
Таким образом, наиболее распространенным видом для акушерского стационара является S.aureus, но также наблюдается увеличение процента выделения коагулазаотрицательных стафилококков, в частности S.epidermidis. Возможность S. epidermidis провоцировать заболевания невелика - организм здорового человека любого возраста (даже новорожденного) легко с ним борется. Мы сделали разбивку выделенных стафилококков в акушерском стационаре с учетом их видовой принадлежности (рисунок 1). Среди сотрудников акушерского стационара, выделивших стафилококк, независимо от его вида, большую часть составляет средний медперсонал -75%, приблизительно в равном проценте случаев встречается стафилококк у врачей и у младшего персонала(12% и 13%) (см. рисунок 2).
Изучение контаминации поверхностей объектов помещений акушерского стационара показало, что из 650 смывов в 5 был обнаружен рост представителя коагулазоположительных стафилококков, что составило 0,8%. Видовой состав был представлен 5 штаммами S. aureus, что составило 100%.Обращает на себя внимание неодинаковая частота выделения данного микроорганизма на различных объектах. Так, на оборудовании (шлангах) S. aureus выделялся 40% от общего количества положительных смывов, чем на других объектах акушерского стационара.
При изучении стафилококков, изолированных в стационарах хирургического профиля от персонала, выявлено значительное количество штаммов S.aureus-83%, S.intermedius встречался в 17% случаев, а штаммов S.epidermidis вообще за данный период времени не было (см. рисунок 3). В процентном отношении среди сотрудников хирургического стационара, выделивших стафилококк, независимо от его видовой принадлежности, большая часть - это средний медперсонал — 87%, далее идут врачи - 8% и младший персонал — 5% (рисунок 4).
Изучение контаминации поверхностей объектов помещений хирургического стационара показало, что из 1036 смывов в 13 был обнаружен рост представителей коагулазоположительных и коагулазоотрицательных стафилококков, что составило 1,3%. Видовой состав был представлен 12 штаммами S. aureus, что составило 92,3%, 1 штамм S.intermedius, что составило 7,7%. Данные возбудители были обнаружены на объектах внешней среды процедурных кабинетов, причем штаммы золотистого стафилококка были изолированы преимущественно со столов и оборудования кабинетов для процедур. S.intermedius был изолирован со штатива кабинета для процедур.

Рисунок 1 - Разбивка выделенных стафилококков в акушерском стационаре с учетом их видовой принадлежности

Рисунок 2 — Сотрудники, выделившие стафилококк в акушерском стационаре

Рисунок 3 - Разбивка выделенных стафилококков, изолированных в стационарах хирургического профиля

Рисунок 4 - Сотрудники, выделившие стафилококк в стационарах хирургического профиля
Таким образом, на основании проведенных исследований можно сделать следующие выводы:
- В акушерском стационаре коагулазоположительные и коагулазоотрицательные стафилококки выделены в 25,8% от персонала, а в смывах выделены только коагулазоположительные стафилококки, что составило 0,8%. В смывах из внешней среды единственным видом является S. aureus - 100%, у сотрудников, выделивших стафилококк, преобладающим видом также является S. aureus- 69%. В хирургическом стационаре преобладающим видом среди персонала и в смывах является S. Аureus, который составил 83% и 92,3% , соответственно.
Неодинаковая частота выделения госпитальных штаммов стафилококков, их видовое разнообразие свидетельствуют о приверженности к обитанию на определенных объектах и в различных условиях. Так, в смывах хирургического стационара S. aureus в основном циркулирует в процедурных кабинетах, а именно на столах и оборудовании. Отсутствие достаточного внимания к данному возбудителю может привести к его дальнейшему распространению и снижению эффективности контроля за эпидемиологической обстановкой стационара.
- Особое беспокойство вызывает преобладание S. aureus в обоих стационарах как среди персонала, так и на объектах внешней среды, что, возможно, может способствовать развитию гнойно-воспалительных заболеваний.
- Полученные данные о микробном пейзаже акушерского и хирургического стационаров позволяют своевременно проводить санитарно-профилактические мероприятия по предупреждению распространения госпитальных инфекций.

Стафилококки (лат. Staphylococcus) — род повсеместно распространённых грамположительных бактерий-кокков.
Стафилококки встречаются в норме на всем протяжении желудочно-кишечного тракта человека, включая желудок (О.В. Добровольский, С.Ю. Сереброва), а также на коже, слизистой оболочке респираторных органов и в урогенитальном тракте.
Стафилококки представляют собой неподвижные шарообразные клетки диаметром от 0,5 до 1,5 мкм, располагающиеся одиночно, парами или гроздьями. Не образуют спор.
Стафилококки лучше других бактерий переносят воздействие высокой температуры, света, высушивания и химических агентов. Они выдерживают нагревание до 60°С в течение часа, а отдельные штаммы — до 80°С в течение получаса и 10 минут при нагревании до 150°С, солнечный свет в течение 10-12 часов, сухой жар — до 2-х часов. Стафилококки устойчивы к повышенному содержанию хлористого натрия (поэтому они хорошо сохраняются в консервированных продуктах), чистому этанолу и фенолу. Оптимальная температура для развития стафилококков 30–37 °С.
Частота выделения некоторых видов стафилококков от человека и ряда сельскохозяйственных и домашних животных (Широкова И.Ю.).
| Вид стафилококков | Вид хозяев (%) | ||||
| человек | ослы | овцы | козы | кошки | |
| S. aureus | 4,6 | 2,9 | 37,5 | 19,7 | 13,0 |
| S. epidermidis | 23,6 | 2,3 | 6,7 | 9,2 | 6,0 |
| S. hominis | 26,9 | 6,9 | — | — | — |
| S. capitis | 4,7 | 2,3 | — | — | 1,0 |
| S. haemolyticus | 11,8 | — | — | 18,5 | 2,0 |
| S. warneri | 4,6 | — | 2,5 | 13,0 | — |
| S. saprophyticus | 8,4 | 4,6 | 5,0 | 3,8 | — |
| S. cochnii | 4,2 | 2,3 | — | 1,7 | — |
| S. xylosus | 9,9 | 10,3 | 11,7 | 6,6 | 2,0 |
| S. simulans | 1,3 | — | 7,5 | — | 4,0 |
| S. intermedius | — | — | — | — | 10,0 |
| S. felis | — | — | — | — | 45,0 |
| S. sciuri | — | 25,1 | 17,5 | 5,8 | 6,0 |
Род стафилококки входит в семейство Staphylococcaceae, порядок Bacillales, класс Bacilli, тип Firmicutes, Terrabacteria group, царство Бактерии.
В род стафолококки входят следующие виды: S. agnetis, S. argensis, S. argenteus, S. arlettae, S. aureus (стафилококк золотистый), S. auricularis, S. capitis, S. caprae, S. carnosus, S. chromogenes, S. cohnii, S. condimenti, S. delphini, S. devriesei, S. epidermidis (стафилококк эпидермальный), S. equorum, S. faecalis, S. felis, S. fleurettii, S. gallinarum, S. haemolyticus, S. hominis, S. hyicus, S. intermedius, S. kloosii, S.leei, S. lentis, S. lugdunensis, S. lutrae, S. lyticans, S. massiliensis, S. microti, S. muscae, S. pasteuri, S. petrasii, S. pettenkoferi, S. piscifermentans, S. pseudintermedius, S. pseudolugdunensis, S. rostri, S. saccharolyticus, S. saprophyticus (стафилококк сапрофитный), S. schleiferi, S. schweitzeri, S. sciuri, S. simiae, S. simulans, S. stepanovicii, S. succinus, S. vitulus, S. warneri, S. xylosus.
У некоторых видов стафилококков выделены подвиды:
Ряд видов рода стафилококков, исходя из общности физиологических признаков и генетического родства, объединены в 4 группы:
- группа Staphylococcus epidermidis: S. epidermidis, S. capitis, S. warneri, S. haemolyticus, S. hominis и S. saccharolyticus
- группа Staphylococcus saprophiticus: S. saprophyticus, S. cohnii и S. xylosis
- группа Staphylococcus simulans: S. simulans и S. carnosus
- группа Staphylococcus sciuri: S. sciuri и S. lentus
В зависимости от способности продуцировать коагулазу, экстрацеллюлярный фермент, вызывающий свертывание плазмы крови, стафилококки подразделяются на коагулаза-положительные (коагулазопозитивные) и коагулаза-отрицательные (коагулазонегативные).
Коагулаза-положительными являются 5 видов стафилококков: Staphylococcus aureus (золотистый стафилококк), Staphylococcus delphini, Staphylococcus hyicus, Staphylococcus intermedius, staphylococcus lutrae, staphylococcus schleiferi subsp. coagulans, среди которых патогенный для человека только золотистый стафилококк. Кроме стафилококков коагулаза-положительной является бактерия Yersinia pestis — возбудитель чумы.
К коагулаза-отрицательным относятся эпидермальный и сапрофитный стафилококки, а также Staphylococcus caprae, Staphylococcus haemolyticus, Staphylococcus hominis, Staphylococcus lugdunensis, Staphylococcus pettenkoferi, Staphylococcus schleiferi, Staphylococcus warneri, Staphylococcus xylosus и другие виды. Коагулаза-отрицательные стафилококки менее патогенны, чем коагулазо-положительные.
Коагулаза-отрицательные стафилококки входят в состав нормальной микрофлоры кожи человека и обычно не вызывают серьёзных заболеваний. Staphylococcus lugdunensis более вирулентны, чем другие коагулаза-отрицательные стафилококки и, в случае имплантируемых медицинских изделий или катетеров, Staphylococcus lugdunensis могут быть причиной тяжело текущих инфекций костей и суставов, возникающих у пациентов, находящихся на лечении в стационаре.
При исследовании биологического материала человека при положительном тесте на коагулазу делается вывод о наличии золотистого стафилококка.
При микробиологическом анализе кала на дисбактериоз отдельно подсчитывают коагулаза-положительные (фактически золотистый стафилококк) и коагулаза-отрицательные (в основном это эпидермальный и сапрофитный) стафилококки. При этом в норме золотистый стафилококк должен отсутствовать, а количество коагулаза-отрицательных стафилококков не должно превышать 10 4 колониеобразующих единиц (КОЕ) на 1 г кала.
Коагулаза-отрицательные стафилококки обнаруживаются в кале у 15,0±3,0 % здоровых людей, причем среднее содержание в 1 г кала от 800 до 3200 КОЕ (М.Д.Ардатская, О.Н.Минушкин).
При избыточном росте стафилококка, как следствии дисбактериоза кишечника, кроме бактериофагов, при медикаментозной терапии применяются различные пробиотки (Бифидумбактерин, Бифиформ, Лактобактерин, Ацилакт, Линекс и др.) и/или адекватные конкретному штамму стафилококка и причине дисбактериоза антибиотики (у взрослых).

В последние годы не угасает интерес к эпидемиологии стафилококков как этиологических агентов многих инфекционных заболеваний, поcкольку стафилококковое бактерионосительство служит причиной формирования серьезных осложнений в условиях госпитализации.
Особую актуальность этот вопрос приобретает в связи с широким распространением и циркуляцией как в природной популяции, так и госпитальной среде метициллинрезистентных штаммов золотистого стафилококка (MRSA). Принципиально важным для дифференциации таких штаммов является исследование генных комплексов, входящих в состав стафилококковых хромосомных кассет mec (staphylococcal chromosome cassette mec, SCCmec), а также определение генов, детерминирующих синтез энтеротоксинов A, B, C и др., токсина синдрома токсического шока (TSST).
Для большинства стафилококков естественной средой обитания является поверхность кожи человека, слизистые, где они персистируют, не причиняя вред организму хозяина. Однако, как показывают работы последних лет [1, 3], при хронических дерматозах происходят изменения микробиоценозов кожи, в частности, возрастает степень обсемененности кожи представителями рода Staphylococcus, особенно S.aureus. В этой связи встает вопрос об этиопатогенетической роли этих бактерий в развитии кожных патологий. Поскольку основными поражающими факторами воздействия стафилококков на эукариотические клетки и ткани являются секретируемые факторы вирулентности и патогенности (токсины), целью настоящей работы явилось исследование вариабельности геномных комплексов стафилококков, выделенных с кожи людей при хронических дерматозах.
Материал и методы исследования
Бактериальные штаммы. В работе были использованы 185 штаммов стафилококков, из них – 91 штамм S. aureus (49,1 %), полученные от лиц в возрасте от 18 до 80 лет, находящихся в стационаре областного кожно-венерологического диспансера г. Ульяновска с хроническими дерматозами: псориаз (57/144, 39,6 %), экзема (68/144, 47,2 %), атопический дерматит (19/144, 13,2 %).
Забор материала осуществляли с пораженных и интактных участков кожи ватным тампоном, смоченным 0,85 % раствором хлористого натрия. Смывы в количестве 0,1 мл засевали на селективные питательные среды, через 48 часов подсчитывали количество выросших колоний и пересчитывали на 1 см 2 кожи (Иванов, 1984). Результаты пересчитывали на КОЕ/см 2 . Первичную родовую и видовую идентификацию стафилококков осуществляли на основании морфологии колоний, окраски по Граму, данных каталазного и коагулазного тестов. Качественное и количественное исследование микробиоценозов кожи осуществляли на базе бактериологической лаборатории городской клинической больницы № 1 г. Ульяновска (зав. лабораторией – Волгина Т.И.). Полученные данные подвергали статистической обработке с использованием пакета прикладных программ Microsoft Еxcel 2003.
Видовая идентификация стафилококков прямым масс-спектрометрическим профилированием. Свежие бактериальные клетки (1–2 колонии) переносили в 300 мкл деионизированной воды, перемешивали и добавляли 900 мкл этанола. Осадок после центрифугирования (15 мин×14000 об/мин) растворяли в 20 мкл смеси 50 % ацетонитрила (АЦН), 35 % муравьиной кислоты. Полученный в результате последующего центрифугирования супернатант анализировали времяпролетной МАЛДИ масс-спектрометрией. Все использованные реактивы, включая воду, были аналитической чистоты или специальные для масс-спектрометрии.
В качестве матрицы применяли a-циано-4-гидроксикоричную кислоту ( a -cyano-4-hydroxycinnamic acid, a-CHCA, BrukerDaltonics, Германия) в виде насыщенного раствора в смеси 50 % АЦН, 2,5 % трифторуксусной кислоты (ТФУ). Для сокристаллизации матрицы и образца 1 мкл аналита наносили на ячейки стальной мишени для масс-спектрометрии (MSP 96 target ground steel, BrukerDaltonics, Германия), давали подсохнуть 1–2 минуты и сверху наслаивали 2 мкл насыщенного раствора матрицы. Кристаллы оставляли на воздухе в течение 5–10 мин до полного высыхания. Влажность и температуру при этом не контролировали.
Масс-спектрометрический анализ осуществляли с помощью времяпролетного МАЛДИ масс-спектрометра MicroflexTM (BrukerDaltonics, Германия), оснащенного азотным лазером 337 нм. Все измерения проводили в линейном режиме, детектируя положительные ионы. Для накопления масс-спектров мощность лазерного излучения устанавливали на уровне минимального порогового значения, достаточного для десорбции-ионизации образца. Параметры масс-спектрометра оптимизировали для диапазона m/z от 2000 до 20000. Внешнюю калибровку проводили с использованием точных значений масс известных белков E. coli.
Для записи, обработки и анализа масс-спектров использовали программное обеспечение компании Bruker Daltonics (Германия): flexControl 2.4 (Build 38) и flexAnalysis 2.4 (Build 11). Точность измерения масс составляла ± 2 Да. Видовую идентификацию бактерий проводили путем сопоставления получаемых масс-спектров с имеющимися базами данных с помощью программного пакета MALDI Biotyper 2.0 (Bruker Daltonics, Германия).
Генетическое тестирование стафилококков
Для установления наличия генов, детерминирующих синтез стафилококковых энтеротоксинов (гены sea – sed, sei – sej), токсина синдрома токсического шока (ген tsst) и лейкоцидина (гены lukS – lukF) применена традиционная ПЦР с использованием предложенных ранее праймеров [9, 10].
Амплификацию исследуемых фрагментов ДНК выполняли в реакционной смеси, содержащей 10 мМ Tris-HCl, pH 9,0; 50 мM KCl; 2 мM MgCl2, по 250 мкМ каждого дНТФ, 1 едTaq-полимеразы (Promega, USA) и по 10 пмоль каждого праймера в объеме 25 мкл. Реакцию амплификации проводили в программируемом термостате DNA EngineTetrad 2 (MJ Research, USA), используя следующий профиль амплификации: 94 ° С – 5 мин., 30 циклов: 94 ° С – 1 мин, 60 ° С – 1 мин, 72 ° С – 1 мин. Продукты реакции анализировали в 2 % агарозном геле.
Результаты исследования и их обсуждение
Согласно данным бактериологического и масс-спектрометрического тестирования установлен видовой состав стафилококков, выделяемых от пациентов с дерматитами. Среди проанализированных 185 штаммов, 91 штамм (49,1 %) принадлежал к виду S. aureus, 28 штаммов (15,1 %) – к S. epidermidis, 30 штаммов (16,2 %) составили S. hominis, 18 (9,7 %) штаммов – S. haemolyticus, S. capitis– 4 (2 %), на такие виды как S. saprophyticus, S. warneri, S. pattenkoferi приходилось по 0,5 %. Также результаты генетического типирования показали наличие среди выделенных штаммов Micrococcus luteus и Corynebacteriumaurim ucosum в 0,5 % случаев.
Исследуемые штаммы продемонстрировали наличие гена mecA в 15 случаях из 185 (8,1 %), причем данный признак был обнаружен только среди коагулазоотрицательных стафилококков: S. hominis – 7 штаммов из 30 (23,3 %); S. epidermidis – 4 штамма из 28 (14,3 %); S. haemolyticus – 4 штамма из 18 (22,2 %).
Наличие стафилококковой хромосомной кассеты SCCmec у коагулазоотрицательных стафилококков, по мнению некоторых авторов [4], свидетельствует о ее участии в функции горизонтального обмена генами. Считается, что первыми стафилококками, получившими SCCmec, были S. haemolyticus, и только в последующем произошла передача этого элемента другим коагулазоотрицательным стафилококкам и S. aureus [2].
Полученные результаты по отсутствию гена mecA среди изученных штаммов S. aureus согласуются с данными литературы. Cобранные нами штаммы относятся к внебольничной популяции стафилокококков, среди которых процент устойчивых к метициллину штаммов составляет не более 30 %, тогда как ген mecA, кодирующий устойчивость к метициллину, обнаруживается преимущественно среди госпитальных стафилококков – до 40 %.
Следующую группу молекулярных маркеров составили расположенные на МГЭ гены, детерминирующие синтез энтеротоксинов A, B, C и др., токсина синдрома токсического шока, т.е. те гены, продукты которых обладают суперантигенной активностью (PTSAgs) и могут оказать влияние на состояние иммунореактивности макроорганизма. Определение наличия генов PTSAgs позволяет выявить патогенный потенциал и охарактеризовать отдельные штаммы. Проведенные исследования показали наличие генов, детерминирующих токсинообразование стафилококков у 40,5 % изученных штаммов (75 клинических изолятов). Следует отметить, что частота встречаемости указанных генов у штаммов золотистого стафилококка составила 86,7 %, у коагулозоотрицательных штаммов – 13,3 % случаев.
Обнаружена значительная вариабельность в наборе генов, детерминирующих синтез этих токсинов у клинических изолятов стафилококков. Так, изученные штаммы имели от одного до четырех генов в различных сочетаниях. В геноме 35 изолятов обнаружен только один ген из sea – sei. У 20 штаммов преобладали по два гена и у 20 – от трех до четырех генов. При этом установлено, что коагулазоотрицательные штаммы, несущие mec A, не обладали ни одним из перечисленных генов. В целом из общего количества генетических детерминант токсинообразования преобладали гены seg – 26,8 %, seh – 17,1 % случаев.
Исходя из значительной видовой вариабельности грамположительной флоры в микробиоценозе кожи исследуемых больных, была проанализирована частота встречаемости генов, определяющих токсинообразование стафилококков в зависимости от видовой принадлежности штаммов.
Так, наибольшим разнообразием генов обладали штаммы золотистого стафилококка, среди которых преобладал ген seg. В связи с тем, что среди коагулазоотрицательных штаммов стафилококков наибольшую частоту встречаемости показали гемолитический и эпидермальный стафилококки, а доля остальных оказалась незначительна, то анализ генов, детерминирующих токсинообразование, осуществляли только у этих видов стафилококков, что показало у S. haemolyticus наличие только генов seb и sed, у эпидермального стафилококка только seh.
Значительный интерес представлял анализ полученных результатов в зависимости от участка кожи, с которого были выделены микроорганизмы. В соответствии с этим все полученные штаммы разделили на две группы: 1-я – штаммы, выделенные с чистых участков кожи, 2-я – штаммы, выделенные с пораженных участков кожи (рис. 1).
Таким образом, наиболее значимые различия по частоте встречаемости детерминант токсинообразования можно отметить для генов sea (14,7 % в 1-й группе и 7,3 % во 2-й) и sei (11,7 % в первой группе, 19,1 % – во второй). Причем ген sea достоверно чаще обнаруживался в стафилококках, изолированных на чистых участках кожи, тогда как ген sei – на пораженных. Частота встречаемости данного признака в указанных группах в зависимости от вида микроорганизмов показала различия только для S. aureus (рис. 2). Для остальных видов из рода Staphylococcus, наиболее часто обнаруживаемых на коже, результаты следующие: S. epidermidis показал ген энтеротоксина sei в одном случае с чистого участка кожи. А S. haemolyticus – наличие 1 случая из двух, наличие гена sed – в одном из четырех случаев.
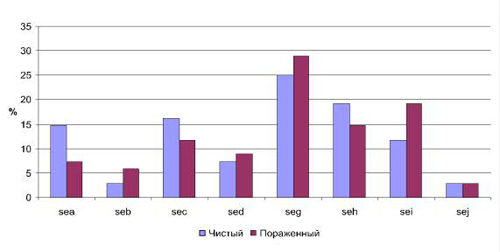
Рис. 1. Частота встречаемости энтеротоксинов a, b, c, d, g, h, I, j в зависимости от участка кожи
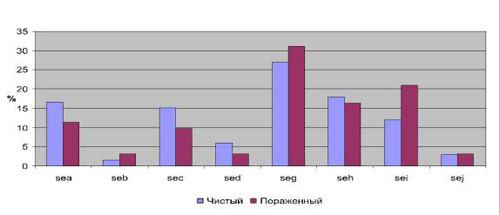
Рис. 2.Частота встречаемости детерминант токсинообразования у S. aureus, выделенных с чистого и пораженного участка кожи
Ген TSST обнаружен только в 10,8 % случаев от всего количества исследуемых штаммов, причем в двух случаях параллельно с наличием хромосомной кассеты mecA у S. epidermidis. При этом в 55 % случаев ген TSST обнаруживали у штаммов, выделенных с чистых участков кожи, в 45 % случаев – с пораженных участков.
Сравнительный анализ хромосомной ДНК стафилококков, выделенных при хронических кожных патологиях, показал, что изученные штаммы Staphylococcus spp. обнаруживают значительную вариабельность в наборе генетических детерминант, характеризующих их патогенный потенциал.
Кассета mecA, рассматриваемая как фактор устойчивости к метициллину, была обнаружена в 8,1 % случаев и только среди коагулазоотрицательных стафилококков.
Гены токсинообразования наиболее часто встречались среди коагулазоположительных стафилококков (S. aureus). Наиболее часто в проанализированной выборке встречались гены seg – 26,8 %, и seh – 17,1 % случаев.
Штаммы, изолированные с разных участков кожи, значимо отличались по частоте обнаружения маркеров генов энтеротоксинов A, С и I.
Таким образом, молекулярно-генетический анализ ДНК и генотипирование стафилококков может иметь теоретическое и практическое значение в целях обеспечения более качественной диагностики стафилококковой инфекции, эффективного мониторинга и лечения.
Нестеров А.С., д.м.н., профессор, зав. Циклом кожных и венерических болезней кафедры инфекционных и кожно-венерических болезней медицинского факультета Ульяновского государственного университета, г. Ульяновск;
Читайте также:


