Не эффективность лечения трихомонад

Начиная с 1959 года, основным эффективным оружием в борьбе с возбудителем трихомониаза Trichomonas vaginalis, был метронидазол и многочисленные дженерики, производные 5-нитроимидазола [11, 13, 14].
Вполне естественно, что это привело к микроэволюционным процессам в популяции Простейшего, отличающегося, сложным мобильным геномом и появлению устойчивых форм Trichomonas vaginalis. [6, 9, 12, 15, 19, 20, 21]. Этот факт стал известен довольно давно, но, тем не менее, до сих пор не признаётся как практикующими врачами (в первую очередь) так и учёными специалистами в области венерических болезней.
Между тем было выяснено, что устойчивость урогенитальной трихомонады к 5-НИ препаратам может быть обусловлена извращением активности пируват-ферродоксин-оксиредуктазы простейшего паразита, что приводит к снижению накопления цитотоксических нитро-радикальных ионных интермедиатов [1, 8, 9, 12].
Исследования Barrientes показали, что в основе механизмов резистентности может быть нарушение транспортных систем клетки, включая феномен выброса [18].
Не исключено, что в состав микрофлоры мочеполовых трактов мужчин и женщин при определённых условиях появляются микроорганизмы, блокирующие нитрогруппы метронидазола и других препаратов этого ряда [11, 12, 18, 20, 21].
Начиная с 2011 года нами проводились оригинальные экспериментальные исследования по изучению формирования резистентности простейшего при проточном культивировании in vitro, в условиях максимально приближенных к естественным, in vivo [3, 4, 5].
Кроме того, был выявлен ещё один вполне вероятный механизм возникновения резистентности микропаразита – изменение проницаемости клеточной мембраны [4, 7].
К сожалению публикации не получили должного резонанса, тем более что эти эксперименты подтверждали выводы профессора С.Г. Инге-Вечтомова о наличие у простейших неканонической изменчивости, играющую громадную роль в их адаптации к воздействиям внешней среды [10].
В связи с отсутствием на сегодня альтернативных метронидазолу препаратов, возможно, полезно обратиться к истории отечественной венерологии и вспомнить как лечили социально значимое заболевание трихомониаз до появления препаратов 5-НИ ряда [6, 7, 16, 19, 20].
В 1836 году французский врач Альфред Донне описал простейшего, жгутиконосца, которого обнаружил в соскобах из женских половых путей при остром воспалении последних, изначально полагая, что оно вызвано гонореей [11].
Приблизительно в 1845 году немецкий натуралист-зоолог Эренберг дал таксономическое название этому простейшему – Trichomonas vaginalis – влагалищная трихомонада. Существенную роль в формировании этиологических представлений о трихомониазе и механизмах его развития и лечения сыграли исследования отечественных учёных медиков – И.П. Лазаревича и К.Ф. Славянского [7, 19].
В 1927 г., чешский венеролог Capek сообщил о двух случаях трихомонадного уретрита у мужчин, возникшего вследствие полового общения с женщинами, страдавшими трихомонадным кольпитом. Ему также принадлежит мысль о необходимости лечения при этой инфекции обоих супругов [7, 11].
Следует отметить, что, несмотря на выявление влагалищных трихоманад в мочеполовой системе, как у мужчин, так и женщин, эти организмы длительное время не считали этиологическим фактором развития воспалительных заболеваний. Лишь в начале XX века признана патогенность урогенитальных трихомонад и возможность их передачи половым путем.
В тоже время среди практикующих врачей стало бытовать убеждение в том, что трихомониаз не является моноэтиологической патологией и что хронически персистирующая трихомонада не нуждается в удалении. Такое мнение есть не что иное, как возврат к далекому прошлому.
До 1927 года на трихомониаз мужчин уже существовал взгляд как на сапрофитное носительство [11].
У мужчин трихомонады поражают уретру, семенные пузырьки, предстательную железу, купферовы железы, мочевой пузырь и почечные лоханки [11].
У женщин наружные половые органы, слизистую влагалища, цервикальный канал, уретру, бартолиновые железы, мочевой пузырь, яичники [11].
Как у женщин, так и у мужчин возможна хронизация инвазии, причём у мужчин чаще отмечается хроническое течение трихомонадной инвазии, приводящей к бесплодию [7, 11].
Так или иначе, с начала 20-го века дерматовенерологии, урологи и гинекологи стали понимать, что влагалищная трихомонада, хоть и относится к Простейшим, далеко не проста, и способна доставлять серьёзные неприятности заболевшим людям [7, 11, 16].
Как же лечили трихомониаз на протяжении более 50 лет до внедрения в практику метронидазола?
Трихомониаз рассматривали как одно из упорных и трудноизлечимых заболеваний мочеполового тракта человека. Это объяснялось как отсутствием специфических противопротозойных препаратов, так и слабой системой борьбы с инфекциями передаваемыми половым путем [15, 16].
Пероральные и парентеральные методы лечения в дометронидазольный период были малоэффективны. Лечение трихомониаза проводили практически только местно.
В этих целях использовали более 300 лекарственных препаратов, главным образом мышьяка (осарсол, аминарсол) и нитрофуранов. Хорошие результаты давал отечественный противотрихомонадный препарат нитазол, который назначался как местно, так и перорально. Женский трихомониаз довольно успешно излечивали растительным алкалоидом лютенурином [7, 11].
Фитотерапия широко использовалась в лечении инфекций передаваемых половым путем. При трихомониазе значительную эффективность проявляли настои хвоща полевого, чистотела большого, чеснока полевого, черёмухи обыкновенной. При остром процессе использовали спринцевания, и ванночки с настоем цветков ромашки, травы шалфея, масло гвоздики [7].
Новый этап в терапии мочеполового трихомониаза начался с открытия антибиотиков и синтетических бактерицидных препаратов. В 1952 г. были выделены трихомицин и аминитразол, применявшиеся в терапии трихомониаза и дававшие неплохой терапевтический эффект, особенно у мужчин [11].
С конца 30-х годов прошлого столетия в практическую медицину пришло увлечение физиотерапевтическими методами лечения практически всех заболеваний. Это электромагнитные излучения (ЭМИ), электрический ток различной мощности, ультра и инфразвук, искусственный сон и проч. Делались попытки излечения этими методами и урогенитального трихомониаза. Доходило до абсурда – больных погружали в искусственный сон на несколько дней. Состояние нервной системы этим пациентам до известной степени оздоравливали, а вот микроскопический паразит спать не хотел и продолжал свою разрушительную деятельность.
Современные исследования показали, что некоторые виды ЭМИ напротив, стимулируют жизнедеятельность трихомонады [7, 15].
Неудачами закончились также попытки лечить трихомониаз гомеопатическими средствами.
И, тем не менее, учитывая способность Trichomonas vaginalis активно адаптироваться к современным противопротозойным препаратам на основе 5-НИ? может быть, полезно заглянуть в историю лечения этой протоинвазии?
Трихомониаз относится к социально значимым заболеваниям и в борьбе с ним новое может оказаться хорошо забытым старым, но верным средством.
Из числа инфекций, передающихся преимущественно половым путем, ведущее место занимает мочеполовой трихомониаз. По данным Ивановой М.А., Виноградовой С.А. с соавторами за период с 1997 по 2008 гг. наибольшую долю в структуре заболеваемости ИППП занимал трихомониаз. Пик заболеваемости трихомониазом был отмечен в1995 г. (344,3 на 100 тыс. населения). С2000 г. вновь началось снижение показателей с 319,7 (в2000 г.) до 167,4 на 100 000 населения в2008 г.
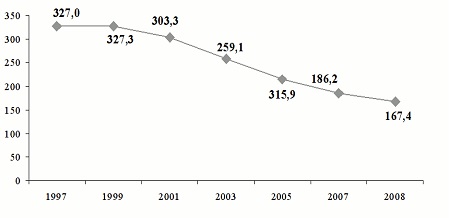
Рис. 3. Динамика заболеваемости урогенитальным трихомониазом в Российской Федерации за 1997-2008 гг. (на 100 000 соотв. населения)
Превышение среднероссийского показателя сегодня отмечается в Сибирском (293,7 на 100 000 населения) и Уральском (181,4 на 100 000 населения) федеральных округах.
Распространенность трихомониаза велика и до конца не учтена. Еще в1962 г. И.И. Ировец сообщал, что трихомониазом поражено до 10% населения Земли.
По суммарным данным ВОЗ, в мире ежегодно заболевают 180-200 млн человек. Среди проституток, а также женщин с белями процент больных МТ достигает 70-80%; при скрининговом обследовании различных контингентов выявлялось до 5—30% женщин, больных трихомониазом, и до 6-15% мужчин — носителей трихомонад.
Значимость трихомонадной инфекции обусловлена не только ее широкой распространенностью, но и способностью вызывать ряд тяжелых осложнений.
- бесплодие;
- воспалительные заболевания органов малого таза у женщин;
- простатиты, эпидидимиты, стриктуры уретры у мужчин;
- преждевременный разрыв околоплодных оболочек;
- рождение детей с пониженной массой тела;
- риск возникновения рака шейки матки и передачи ВИЧ- инфекции.
- сексуальные расстройства.
Необходимо также учитывать тот факт, что трихомонады могут фагоцитировать и резервировать различные патогенные и условно-патогенные микроорганизмы, способствуя распространению других ИППП).
Клиническая картина мочеполового трихомониаза, по мнению ряда авторов, претерпевает патоморфоз, характеризуясь, обилием стертых и малосимптомных форм.
В ходе практической работы и при обзоре литературных данных нами отмечены возможные основные причины неудачного лечения трихомониаза и увеличение количества рецидивов заболевания:
- возникновение резистентных к антипротозойным препаратам штаммов T. vaginalis, несомненно связанно с чрезмерно широким, нередко необоснованным применением препарата в общей медицинской практике;
- снижение активности метронидазола за счет захвата активных нитрорадикалов микроорганизмами, входящими в состав микробиоциноза урогенитального тракта;
- низкая концентрации протистоцидных средств, попадающих в очаги хронического воспаления, в связи с нарушением васкуляризации и развитием рубцовых изменений;
- патология желудочно-кишечного тракта,
- низкая эффекторная функция иммунной системы;
- недостаточно высокая комплаентность пациентов.
- у пациентов с хроническим урогенитальным трихомониазом развивается дисбиоз уретры, проявляющийся изменением видового и количественного состава условно-патогенной микрофлоры. После успешной эрадикации трихомонад воспалительный процесс может сохраняться, поддерживаясь сопутствующей микрофлорой и создавая у врача ложное представление о неэффективности лечения.
- нельзя исключать возможность реинфекции, если оба партнера начали лечение неодновременно или появился новый половой партнер;
- К сожалению, проблема фальсификации лекарственных средств, а также появлением большого количества дженериков.
- вероятность ложноположительных результатов лабораторных тестов, использованных для постановки диагноза заболевания (некорректная трактовка результатов ИФА).
Вот уже 50 лет метронидазол используется в лечении трихомониаза и анаэробных инфекций. По литературным данным, неэффективность лечения трихомониаза метронидазолом составляет до 44%.
Некоторые авторы приводят более впечатляющие результаты; так, по данным дерматовенерологической клиники Новосибирского мединститута, в 1995-1996 гг. рецидивы после полноценного лечения нитроимидазолами достигали 47%.
Уже опубликованы сообщения о более чем 100 резистентных к метронидазолу штаммах из США, порядка 20 устойчивых штаммов описаны европейскими учеными, в том числе российскими.
Описывается также перекрестная устойчивость к тинидазолу и орнидазолу, что свидетельствует о формировании устойчивости ко всей группе 5-нитроимидазолов. В то же время за неимением альтернативных схем лечения предпринимаются попытки лечить трихомониаз, вызванный устойчивыми к метронидазолу штаммами, увеличивая дозировки применяемых схем метронидазола, однако такие попытки редко оказываются успешными.
Известно, что устойчивость – это результат мутации и формирования новых резистентных штаммов. Все чаще появляются публикации, связывающие устойчивость T. vaginalis с ее инфицированием РНК-вирусами. Инфицированные изоляты близки друг к другу при оценке молекулярного строения. Эти изоляты чаще всех остальных оказываются резистентными к группе препаратов 5-нитроимидазолов.
Наиболее сложным вопросом терапии современного трихомониаза является выбор эффективного этиотропного средства. Несмотря на многочисленные публикации результатов изучения эффективности противотрихомонадной терапии, выбор конкретных препаратов на отечественном рынке остается весьма ограниченным.
Таким образом, несмотря на рекомендации, приведенные в отдельных публикациях, отсутствие доказательных данных об эффективности и безопасности препаратов, не принадлежащих к группе 5-НИ, в терапии трихомонадной инфекции, в т. ч. ее рефрактерных форм, не позволяет рекомендовать их использование у пациентов с данной патологией, за исключением случаев, когда другие терапевтические альтернативы исчерпаны.
Обобщение собственного опыта, отечественных и зарубежных дерматовенерологов показывает, что для более успешного лечения трихомониаза необходимо соблюдать следующие положения:
- лечить следует одновременно всех половых партнеров, даже при отсутствии клинических и лабораторных признаков заболевания;
- употребление алкоголя и половая жизнь в период лечения исключаются;
- схема лечения определяются с учетом сопутствующих соматических заболеваний, возраста и веса больного;
- тактика лечения зависит от формы течения заболевания (острый или хронический процесс), локализации воспалительного процесса и наличия смешанной инфекции, а также данных клинико-лабораторного обследования больных..
В Европейском руководстве по заболеваниям, передаваемым половым путем, отмечено, что при персистирующих и рецидивирующих симптомах, связанных с урогенитальным трихомониазом, часто у пациенток, у которых первый курс не дает эффекта, эффективным бывает второй курс стандартного лечения метронидазолом. Перед повторным курсом метронидазола необходимо провести эмпирическое лечение эритромицином или амоксициллином для снижения уровня b-гемолитических стрептококков, поскольку некоторые микроорганизмы, присутствующие во влагалище, могут снижать эффективность метронидазола, захватывая активную нитрогруппу. Это и есть так называемая относительная резистентность к терапии, когда излечение наступает после повторного назначения того же метронидазола после устранения, с помощью антибиотиков, кокковой флоры, являющейся истинной причиной неэффективности первого курса терапии.
Если повторно проведенное лечение вновь оказывается неэффективным, то согласно Европейскому руководству по заболеваниям, передаваемым половым путем, эффективного лечения не существует.
необходимости в местном лечении, так как достаточно общего лечения для ликвидации воспалительных явлений и эрадикации возбудителя
Что касается иммунокоррекции при трихомониазе, то следует отметить, что недостаточно изучен иммунопатогенез, роль клеточных, цитокиновых факторов иммунитета и интерферонового статуса.
А в тоже время назначаемые довольно часто иммунотропные и иммуномодулирующие препараты из разных фармокологических групп имеют как ни странно одинаковые показания в терапии хронических форм трихомониаза. Анализ практических и литературных данных позволил нам выделить следующие основные принципы применения иммуномодуляторов:
Перед назначением ИМ целесообразно выявить у больного клинические и лабораторные признаки нарушений иммунитета;
- Установить причину формирования иммунодефицита и степень его влияния на иммунную систему.
- Препараты не применяются самостоятельно, а лишь дополняют традиционную терапию.
- Перед назначением ИМ обязательна оценка характера иммунологических нарушений у больного.
- Принимать во внимание зависимость изменений иммунологических показателей от возраста, биологических ритмов больного и других причин.
- Учитывать иммунотропные эффекты традиционных лекарственных средств.
- Выраженность эффекта коррекции в остром периоде выше, чем в стадии ремиссии.
- Продолжительность устранения иммунологических нарушений составляет от 30 дней до 6-9 месяцев и зависит от свойств препарата, маркерного показателя и характера заболевания.
- При многократном введении ИМ спектр их действия сохраняется, а выраженность эффекта возрастает.
- Препараты полностью реализуют свои эффекты только при использовании в оптимальных дозах.
Таким образом, в решении задач излеченности и уменьшения количества рецидивов трихомониаза, мы видим в своевременном выявлении и профилактике вышеназванных причин неудачного лечения и в необходимости применения комплексной терапии, включая оптимальное этиотропное, патогенетическое, физиотерапевтическое, адекватное иммунотропное и местное лечение.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
ММА имени И.М. Сеченова
Попадая в мочеполовой тракт, в среднем через 3–7 дней, трихомонады вызывают развитие воспаления в виде острого, подострого или торпидного уретрита (уретропростатита) у мужчин и вульвовагинита и уретрита у женщин. Как правило, процесс изначально протекает в виде острой или подострой формы, затем через 2 месяца воспалительная реакция стихает и трихомониаз переходит в хроническую форму или трихомонадоносительство.
Клиническая картина мочеполового трихомониаза неспецифичная. Трихомонада способна поражать любые органы урогенитального тракта, процесс может также локализоваться на слизистой миндалин, конъюнктивы, прямой кишки. Следует отметить, что в виде моноинфекции трихомониаз встречается лишь у 10–30% пациентов [1], в 70–80% случаев урогенитальный трихомониаз ассоциируется с другими микроорганизмами, в том числе и инфекциями, передаваемыми половым путем [5]. Чаще всего регистрируются трихомонадно–гонорейная, трихомонадно–бактериальная (в ассоциации с энтерококками, гемолитическими стрептококками, эпидермальным стафиллококком), а также трихомонадно–микотическая инфекции. Важен тот факт, что при микст–инфекции трихомонада является резервуаром сопутствующей инфекции, поэтому вследствие внутритрихомонадной персистенции гонококки, хламидии и др. неуязвимы для антибиотиков, что приводит к рецидиву заболевания.
Клиническая картина урогенитального трихомониаза не отличается от любой другой инфекции, передаваемой половым путем.
Терапия урогенитальных инфекций всегда остается актуальной и обсуждаемой проблемой дерматовенерологии, акушерства и гинекологии, урологии. В отношении трихомониаза основным предметом для дискуссий является терапия микст–инфекций, а так же выбор оптимального противопротозойного препарата. Поскольку за счет незавершенного фагоцитоза трихомонада зачастую является основной причиной неудач в терапии ИППП, при ассоциированных инфекциях необходимо в первую очередь проводить пульс–терапию трихомониаза. Для этого существует большой арсенал быстродействующих и эффективных антипротозойных средств. Все рекомендуемые препараты относятся к группе нитроимидазола. Родоначальником (впрочем, не потерявшим свою значимость и по сей день) является метронидазол. По данным Всемирной Организации Здравоохранения (2001 г.), однократный прием 2,0 г этого препарата приводит к излечению у 88% женщин, а при совместном лечении половых партнеров положительный эффект достигается в 95% случаев. Такая же высокая эффективность и у тинидазола. Как правило, для излечения достаточно однократного применения 2,0 г внутрь. Наиболее современными и эффективными антипротозойными препаратами являются орнидазол и секнидазол: однократный прием 1,5 г или 2,0 г соответственно гарантирует элиминацию возбудителя практически у всех больных с неосложненным трихомониазом. Однократные пульс–курсы терапии также удобны для лечения половых партнеров. Однако частое отсутствие клиники или ее минимальные проявления, невысокий лейкоцитоз не позволяют достоверно определить сроки инфицирования, довольно проблемно исключить и поражение трихомонадами парауретральных желез, простаты и т.д. В связи с этим мы рекомендуем использовать вышеназванные препараты пролонгированными курсами по 5–10 дней. Для курсового системного лечения могут быть использованы и другие препараты группы нитроимидазола: ниморазол и нифурател.
В последние годы в России появляется все большее количество методически рекомендаций, указаний, стандартов по терапии ИППП. Все они основаны на большом клиническом материале, а выпускают их ведущие дерматовенерологические учреждения, Ассоциация акушеров–гинекологов. Существуют так же международные европейские рекомендации, рекомендации ВОЗ. Все они построены по единому принципу и предлагают как рекомендуемые схемы терапии, так и альтернативные.
По данным ВОЗ, рекомендуемыми являются схемы терапии трихомониаза метронидазолом или тинидазолом в однократной дозировке 2,0 г. Альтернативным является применение тех же препаратов по 500 мг 2 раза в сутки в течение 5–7 дней. Сходные данные представляют специалисты США, выводя метронидазол на первое место – 2,0 г однократно.
Согласно данным европейских рекомендаций оптимальным способом лечения трихомониаза является прием метронидазола в течение 7 дней по 500 мг каждые 8 часов.
Итак, как же выбрать оптимальный антипротозойный препарат? По международному опыту, а также данным части отечественных исследователей – это метронидазол.
Однако не все так однозначно. Что касается эффективности при соблюдении рекомендаций врача и одновременном лечении половых партнеров, то она примерно одинакова у всех препаратов (все производные нитроимидазола). В удобстве применения так же все препараты схожи, но что касается побочных эффектов, то, по собственным данным и данным литературы, все–таки переносимость орнидазола и секнидазола несколько лучше, чем у метронидазола.
При приеме последнего чаще отмечаются диспептические растройства, головные боли, бессонница, аллергические реакции, чем у других препаратов данной группы.

Трихомониаз(https://www.cdc.gov/std/trichomonas/default.htm) (или трихомоноз) — это широко распространенное заболевание, передающееся половым путем (ЗППП). Оно возникает из-за заражения простейшим микроорганизмом под названием Trichomonas vaginalis. Поскольку симптомы трихомониаза варьируются, большинство зараженных не могут самостоятельно определить у себя наличие этого заболевания.
Трихомониаз — это наиболее распространенное излечимое заболевание, передающееся половым путем. По оценкам специалистов, в США количество зараженных составляет 3,7 млн человек. Однако симптомы этого заболевания проявляются только примерно у 30 % заболевших. Инфекция чаще встречается у женщин, чем у мужчин. Пожилые женщины страдают от нее чаще, чем молодые.
Во время секса микроорганизмы передаются от зараженного человека к здоровому. У женщин чаще всего поражаются нижняя часть половых органов (вульва, влагалище, шейка матки или уретра). У мужчин — внутренняя часть пениса (уретра). Во время секса микроорганизмы попадают из пениса во влагалище или из влагалища в пенис. Они также могут попасть из одного влагалища в другое. Микроорганизмы могут поражать и другие части тела, например, руки, рот или анус. Пока неизвестно, почему у некоторых зараженных людей симптомы трихомониаза возникают, а у других — нет. Вероятно, это зависит от возраста и общего состояния здоровья человека. Даже при отсутствии симптомов носитель заболевания может передать его другим.
Примерно у 70 % зараженных людей не наблюдается признаков или симптомов этого заболевания. При возникновении симптомы могут варьироваться от легкого раздражения до сильного воспаления. У некоторых людей симптомы появляются через 5–28 дней после заражения. У других симптомы появляются намного позже. Симптомы могут появляться и исчезать.
Симптомы заболевания у мужчин:
- зуд или раздражение внутри пениса;
- жжение после мочеиспускания или эякуляции;
- выделения из пениса.
Симптомы заболевания у женщин:
- зуд, жжение, покраснение или болезненность половых органов;
- дискомфорт при мочеиспускании;
- изменение выделений из влагалища (меняется запах или количество), они могут стать прозрачными, белыми, желтоватыми или зеленоватыми с непривычным запахом рыбы.
Наличие трихомониаза может вызвать неприятные ощущения при занятии сексом. Без лечения заболевание может длиться несколько месяцев или даже лет.
Трихомониаз увеличивает риск заражения другими инфекциями, передающимися половым путем. Например, трихомониаз может вызвать воспаление половых органов, это облегчает заражение ВИЧ или передачу ВИЧ(https://www.cdc.gov/std/hiv) сексуальному партнеру.
У беременных женщин с трихомониазом(https://www.cdc.gov/std/pregnancy/stdfact-pregnancy.htm) чаще других рождаются недоношенные дети (происходят преждевременные роды). Кроме того, дети, рожденные такими матерями, чаще имеют низкий вес при рождении (менее 2,5 кг).
Диагностику трихомониаза невозможно провести только на основании внешних симптомов. Поэтому обратитесь в медицинское учреждение, где вас осмотрят и сделают лабораторные анализы.
Для лечения трихомониаза используются специальные препараты (метронидазол или тинидазол). Они выпускаются в виде таблеток. Эти препараты безопасны для беременных. После их приема не рекомендуется употреблять алкоголь в течение 24 часов.
Человек, излечившийся от трихомониаза, может заболеть им снова. Примерно каждый пятый выздоровевший заражается снова в течение 3 месяцев после окончания лечения. Чтобы избежать повторного заражения, вам необходимо убедиться, что лечение прошли все сексуальные партнеры. Кроме того, необходимо подождать 7–10 дней после окончания лечения и только после этого снова заниматься сексом. Если симптомы появились опять, необходимо пройти повторное обследование.
Единственный способ избежать ЗППП — не заниматься вагинальным, анальным или оральным сексом.
Если вы сексуально активны, то для снижения вероятности заражения трихомониазом:
- поддерживайте длительные взаимные моногамные отношения с партнером, который прошел обследование и у которого результаты анализов на ЗППП отрицательные;
- правильно используйте латексные презервативы каждый раз, когда вы занимаетесь сексом. Это может понизить вероятность заражения. Однако микроорганизмы могут попасть на области, не закрытые презервативом, поэтому презервативы не могут полностью защитить вас от трихомониаза.
Вы также можете заранее обсудить с новым сексуальным партнером потенциальный риск появления ЗППП. И по результатам этой беседы принять взвешенное решение с учетом риска, который вы готовы допустить в своей сексуальной жизни.
Если у вас или кого-то из ваших знакомых есть вопросы о трихомониазе или любом другом ЗППП, обратитесь к врачу.
Резюме. Отображены результаты лечения препаратом НАКСОДЖИН 1278 пациентов в возрасте старше 16 лет с бактериоскопически подтвержденным диагнозом трихомониаза. Контроль излеченности проводили трехкратно в течение 7–10 дней после последнего приема препарата. Положительный эффект был достигнут у 92,6% пациентов. Отмечалась хорошая переносимость препарата. Таким образом, НАКСОДЖИН является эффективным и хорошо переносимым средством для лечения больных с урогенитальным трихомониазом.
ВВЕДЕНИЕ
По данным Всемирной организации здравоохранения (ВОЗ) трихомониазом ежегодно заболевают около 200 млн человек, то есть количество вновь заболевших ежегодно в четыре раза превышает численность населения такой страны, как Украина. Трихомониаз считается самым распространенным протозойным заболеванием жителей умеренного климатического пояса.
По разным оценкам распространенность трихомониаза среди женщин колеблется в пределах 5–30% в зависимости от обследуемого контингента. Причем выявленные при обследовании в поликлинике больные составляют 1622%. Среди проституток распространенность трихомониаза превышает 70%.
Распространенность этого заболевания среди мужчин также достаточно высока, 6–15% мужчин являются носителями, у 2,5–4% практически отсутствуют клинические проявления заболевания. 10% всех инфекционных заболеваний у мужчин приходится на трихомониаз.
Неблагополучная эпидемиологическая ситуация по трихомониазу объясняется двумя факторами: 1) интенсивными миграционными процессами и социальными условиями, способствующими случайным сексуальным контактам; 2) широким распространением контрацепции (женщины, пользующиеся внутриматочными спиралями, болеют гораздо чаще).
Трудность лечения трихомониаза обусловлена специфическими свойствами возбудителя. Одноклеточный организм-паразит — трихомонада — по типу своего метаболизма может быть отнесена к факультативным анаэробам, что отличает трихомонад от клеток хозяина и делает их уязвимыми для препаратов группы 5-нитроимидазолов. Помимо этой особенности для данных паразитов характерен переход от дихотомического деления к интенсивному множественному делению при воздействии неблагоприятных факторов внешней среды, что часто проявляется резким увеличением насыщенности трихомонадами секретов в начале лечения. От факторов клеточного иммунитета хозяина трихомонада защищается маскировкой белками плазмы хозяина путем фиксации на своей поверхности антитрипсина.
Препараты группы 5-нитроимидазолов проникают в трихомонаду путем как пассивного, так и активного транспорта, избирательно накапливаясь в клетке. Промежуточные продукты биологической редукции нитрогруппы также обладают трихомонацидным действием, что частично объясняется необратимым торможением синтеза ДНК.
Лекарственные препараты этой группы хорошо известны уже много десятков лет. Их эпоха началась с метронидазола, создание которого совершило в свое время настоящую революцию. Однако сегодня излечиваемость больных трихомониазом с помощью метронидазола снизилась до 9%. Столь низкая эффективность объясняется реинфицированием пациентов, недоступностью для метронидазола всех микроочагов инфекции в организме больных, фоновыми заболеваниями и в первую очередь широким распространением метронидазолустойчивых штаммов трихомонад.
Устойчивость возникает в результате изменения ультраструктуры трихомонад, а именно: одномембранные органеллы облекаются еще одной мембраной или включаются в состав ретикулярной системы.
В этих условиях эффективным окажется то лекарственное средство, которое обладает повышенной способностью проникать через биологические мембраны или разрушать их.
Для получения таких свойств, а также для уменьшения выраженности побочных эффектов метронидазола один за другим создавались препараты II поколения 5-нитроимидазолов, характеризующиеся более высокой эффективностью, липофильностью, лучшей всасываемостью из пищеварительного тракта и меньшей токсичностью, — ниморазол, орнидазол, карнидазол, тинидазол, секнидазол, Go10213 и т. д.
Ниморазол (нитримидизин) — относится ко II поколению 5-нитроимидазолов. Структура ниморазола отличается от метронидазола наличием в первой позиции группы CH2 CH2 NO — морфолина (рис. 1), также обладающего значительной трихомонацидной активностью. Промежуточные метаболиты ниморазола имеют выраженную антипротозойную активность.
При терапии НАКСОДЖИНОМ, как и при использовании других 5-нитроимидазолов, рекомендуется:
- одновременно лечить сексуального партнера;
- сочетать НАКСОДЖИН с препаратами других групп в ходе комплексного лечения;
- исключить алкоголь.
Ниморазол избирательно накапливается в ваги нальном секрете, причем в концентрациях, превышающих в несколько раз концентрации в плазме крови (рис. 2).

Рис. 1. Химическая структура метронидазола и ниморазола (НАКСОДЖИНА)

Рис. 2. Концентрации ниморазола в биологических жидкостях
Сопутствующая бактериальная инфекция притрихомониазе отсутствует или не может быть обнаружена лишь в 1,3% случаев. По этому признаку данное заболевание считается классическим примером микстинфекции. В порядке снижения частоты распространенности трихомониаз сочетается с инфицированием гонококками, хламидиями, микоплазмами, кандидами, вирусами, L-формами микроорганизмов и другими анаэробами и аэробами. Врач обязан провести лечение гонореи, хламидиоза или других заболеваний у больных трихомониазом, поскольку последний часто является их сопутствующим заболеванием.
Бактериальный вагиноз при относительной легкости лечения требует от врача постоянной настороженности, так как в большинстве случаев не проявляется клинически.
Все вышесказанное требует применения ниморазола в сочетании с комплексным лечением микстинфекций в целях предупреждения рецидивирования или развития сопутствующих заболеваний.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
В гинекологических и дерматовенерологических клиниках г. Днепропетровска накоплен значительный опыт применения НАКСОДЖИНА. Мы располагаем материалами о результатах лечения 1278 пациентов в возрасте старше 16 лет с бактериоскопически подтвержденным диагнозом трихомониаза, обязавшихся на время лечения и в последующие 12 дней воздерживаться от половых контактов. Ниморазол назначали в курсовой дозе 9 г. Применяли дозовый режим: 2 г одномоментно на ночь, по 1 г утром и вечером на второй день и по 0,5 г утром и вечером в последующие 5 дней. Таблетки больные принимали внутрь после еды.
У некоторых пациентов системное лечение до полнялось местным применением антисептиков и метронидазолсодержащих препаратов. Все больные были разделены на группы по определенным критериям (таблица). Контроль излеченности проводили трехкратно в течение 7–10 дней после последнего приема препарата.
Таблица
Эффективность применения ниморазола в группах больных (обследовано 1278 пациентов)

РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Положительный эффект был достигнут у 92,6% пациентов.
Среди мужчин отмечена тенденция к более высокой излечиваемости, чем в группе женщин, однако выявленные отличия были недостоверны.
Эффективность препарата в целом не зависела от возраста пациента, однако среди женщин было отмечено существенное снижение показателя излечиваемости у женщин старше 35 лет (до 86,2%).
Не вызвала удивления прямая зависимость эффекта препарата от длительности заболевания. Если эффективность препарата была выше 95% среди больных с длительностью заболевания менее чем 2 месяца, то среди пациентов с более длительным течением болезни она не превышала 88%.
Зависимость эффективности препарата от час тоты возникновения рецидивов также была ярко выражена. Если обострение было четвертым и более, то эффективность ниморазола снижалась с 94% до уровня ниже 60%, что, по-видимому, является проявлением перекрестной устойчивости трихомонад к препаратам нитроимидазолового ряда.
Частота возникновения рецидивов составляла около 8%. Рецидивы отмечали на 3–6-й неделе после окончания лечения. Активное обследование пациентов для выявления рецидивов заболевания позднее 2 месяцев после окончания лечения не проводили. Для больных с длительностью заболевания более одного года проводили дополнительный курс лечения ниморазолом в тех же дозах с интервалом 1 месяц.
Отмечается хорошая переносимость препарата.
Только около 6% пациентов предъявляли жалобы на сонливость, тошноту. У 0,8% отмечали боли в правом подреберье. У 1% больных были зарегистрированы некоторые изменения в составе периферической крови, что не обязательно обусловлено приемом препарата.
Высокая эффективность ниморазола, выявленная нами в исследуемых группах больных, вновь делает актуальным вопрос о распространенности и скорости формирования резистентности к препаратам урогенитальных трихомонад. В западноевропейской литературе в 70-х годах появились восторженные отзывы о ниморазоле, а в 80-х — уже более сдержанные. Появление и распространение устойчивых к ниморазолу штаммов трихомонад в Западной Европе произошло за короткий период (жизнь одного поколения). Врачи бывшего СССР могли судить об этом препарате лишь по зарубежным публикациям — в странах соцлагеря препарат применяли крайне редко. Медицинская литература в Америке не содержала сведений о ниморазоле (из всех 5-нитроимидазолов в США применяется только метронидазол). Все это делало проблематичным широкое применение ниморазола.
ВЫВОДЫ
- НАКСОДЖИН является эффективным и хорошо переносимым средством для лечения больных с урогенитальным трихомониазом.
- Доказана эффективность применения препарата в дозах: 2 г однократно на ночь, по 1 г утром и вечером на 2-й день, затем — по 0,5 г утром и вечером в течение последующих 5 дней.
- Больным с длительно не леченным трихомониазом целесообразно проведение 12 повторных курсов терапии НАКСОДЖИНОМ с интервалом 3–4 нед. Лечение женщин целесообразно начинать в 1-й день менструального цикла.
Ковальський Анатолій Максимович, Федотов В П, Шаленная Н С
Резюме. Відображені результати лікування препаратом НАКСОДЖИН 1278 пацієнтів віком понад 16 років з бактеріоскопічно підтвердженим діагнозом трихомоніазу. Контроль одужання проводили трикратно протягом 7–10 днів після останнього прийому препарату. Позитивний ефект досягнуто у 92,6% пацієнтів. Відзначалася гарна переносимість препарату. Таким чином, НАКСОДЖИН є ефективним і добре переносимим засобом для лікування урогенітального трихомоніазу.
Ключові слова: трихомоніаз, лікування, німоразол, НАКСОДЖИН
Kovalsky Anatoly M, Fedotov V P, Shalennaya N S
Summary. Results of conducted treatment with NAXOGIN of 1278 patients above 16 years old with bacterioscopy confirmed diagnosis of trichomoniasis are presented. Recovery was controlled 3 times during 7–10 days after the last reception of NAXOGIN. Positive effect was reached in 92,6%. The medicine was revealed to be well tolerated. Thus, NAXOGIN is effective in the treatment of urogenital trichomonias and well tolerated.
Key words: trichomonias, treatment, nimorazole, NAXOGIN
Ковальский Анатолий Максимович
320087, Днепропетровск, ул. Байкальская, 9А
Городской кожно-венерологический диспансер
Читайте также:


