Методы диагностики при листериозе
Основные факты
- Листериоз—это тяжелая болезнь, но ее можно предотвращать и лечить.
- Беременным женщинам, пожилым людям и лицам с ослабленной иммунной системой, таким как люди с иммунодефицитным состоянием в связи с ВИЧ/СПИДом, лейкемией, раком, пересадкой почки и стероидной терапией, подвергающимся наиболее высокому риску развития тяжелого листериоза, не следует употреблять пищевые продукты высокого риска.
- В число пищевых продуктов высокого риска входят мясные полуфабрикаты и готовые к употреблению мясные продукты (такие как прошедшие тепловую обработку, консервированные и/или ферментированные мясные продукты и сосиски), мягкие сыры и рыбная продукция холодного копчения.
- Listeria monocytogenes широко распространены в природе. Они могут быть обнаружены в почве, воде, растительности и фекалиях некоторых животных и могут загрязнять пищевые продукты.
- Листериоз—это инфекционная болезнь, вызываемая бактерией Listeria monocytogenes.
Листериоз пищевого происхождения — это одна из самых тяжелых болезней пищевого происхождения. Его возбудителем является бактерия Listeria monocytogenes. Это относительно редкая болезнь — ежегодно происходит от 0,1 до 10 случаев заболевания на 1 миллион человек в зависимости от стран и регионов. И хотя случаев заболевания немного, эта инфекция представляет значительную проблему в области общественного здравоохранения в связи с высокой смертностью.
В отличие от многих других бактерий, вызывающих широко распространенные болезни пищевого происхождения, L. monocytogenes может выживать и размножаться при низких температурах, обычно поддерживаемых в холодильниках. Употребление загрязненных пищевых продуктов, содержащих L. monocytogenes в больших количествах, является основным путем передачи инфекции. Инфекция может также передаваться от человека к человеку, в частности от беременных женщин к плоду.
- продукты с длительным сроком хранения в холодильнике (при достаточно длительном хранении при температурах, поддерживаемых в холодильнике, количество (L. monocytogenes ); в продуктах может значительно увеличиться); и
- продукты, потребляемые без последующей обработки, например без тепловой обработки, которая позволила бы убить L. monocytogenes.
Болезнь
Листериоз — это целый ряд болезней, вызываемых бактерией L. monocytogenes. Вспышки этих болезней происходят во всех странах. Существует два основных типа листериоза: неинвазивная форма и инвазивная форма.
Неинвазивный листериоз (фебрильный листериозный гастроэнтерит) является легкой формой болезни, развивающейся, в основном, у здоровых людей. Симптомы включают диарею, повышенную температуру, головную боль и миалгию (мышечные боли). Инкубационный период короткий и длится несколько дней. Вспышки этой болезни, как правило, связаны с потреблением пищевых продуктов, содержащих L. monocytogenesв больших количествах.
Лечение
Методы борьбы
В соответствующих случаях, для подтверждения и проверки правильного осуществления производственных процессов и соблюдения других гигиенических мер в соответствии с ХАССП производители пищевых продуктов должны проводить тестирование с использованием микробиологических критериев. Кроме того, производители продуктов, ассоциирующихся с рисками листериоза, должны осуществлять мониторинг окружающей среды для выявления и ликвидации экологических ниш, включая области, благоприятные для закрепления и размножения L. monocytogenes.
Профилактика
L. monocytogenes в пищевых продуктах погибают при пастеризации и тепловой обработке.
- Избегать потребления молочных продуктов, приготовленных из непастеризованного молока; мясных полуфабрикатов и готовых к употреблению мясных продуктов (таких как сосиски, ветчина, паштеты и мясные пасты), а также морских продуктов холодного копчения (таких как копченый лосось);
- Читать информацию о сроке годности и температурах хранения, указанную на упаковке, и внимательно следовать этим указаниям.
Важно соблюдать срок годности и температуры хранения, указанные на упаковке готовых к употреблению пищевых продуктов, с тем чтобы количество бактерий, потенциально присутствующих в этих продуктах, не увеличилось до опасных уровней. Тепловая обработка продуктов перед их употреблением является еще одним эффективным способом уничтожения бактерий.

С 2009 по 2015 гг. в хозяйствах Алматинской области РК проводили исследования по обнаружению возбудителя листериоза у 1 % животных. Ежегодно в стационарно неблагополучных хозяйствах области проводили бактериологические исследования биоматериала от больных и патматериала от павших животных по обнаружению возбудителя листериоза. Диагностические исследования проводились с использованием бактериологических, биохимических, серологических и генетических методов, постановкой биопробы.
Листериоз – инфекционная болезнь человека и многих видов животных, которая чаще всего встречается у овец и свиней, реже у крупного рогатого скота и коз, промысловых животных, пушных зверей, кроликов, домашних и диких птиц, лошадей, лисиц, хорьков, кур. Листериоз протекает либо в септической форме (кролики, морские свинки, мыши, поросята), либо с явлениями нервного синдрома и значительным расстройством центральной нервной системы (свиньи, крупный рогатый скот, овцы, лисы). Листериоз может сопровождаться абортами у крупного рогатого скота, овец и коз. Листериозу свойственны природная очаговость и стационарность.
В естественных условиях листериозом поражаются все виды домашних и диких животных. Основным резервуаром возбудителя в природе являются некоторые виды диких животных, но особенно грызуны. Листерии длительное время могут не только сохраняться во внешней среде – почве, навозе, воде, на растениях, но и размножаться, даже при низких (+ 4 °С) температурах. Некачественный силос является благоприятной средой для размножения листерий, особенно в его поверхностных слоях. Загрязненные листериями водоемы опасны в эпизоотологическом и эпидемиологическом отношении. Человек листериозом заражается в результате контакта с инфицированными грызунами, либо с сельскохозяйственными животными, особенно со свиньями, через поврежденную кожу; через пищеварительный тракт – при употреблении в пищу не подвергавшихся термической обработке ранних овощей, собранных с участков, где использованы для полива необеззараженные сточные воды и навоз. В результате инфицирования поражается нервная система и головной мозг человека. Внедрение листерий в организм человека может привести к развитию сепсиса, поражению отдельных органов и систем, а также к бессимптомному заболеванию. У женщин при поражении листериозом отмечаются аборты листериозной этиологии. Заболевание человека возможно также после употребления инфицированной пищи, в частности молока и мяса больных животных. Распространение листерий в организме происходит нейрогенным, лимфогенным, гематогенными путями. Листерии, распространяясь различными путями, преодолевая защитный барьер, проникают в головной мозг. У человека листериоз протекает в форме моноцитарной ангины и листериозного менингита, который во многих случаях заканчивается смертельно. Поражается центральная нервная система, отмечаются приступы судорог, возбуждение. Температура тела в начальный период заболевания повышена, а затем снижается. При листериозе у различных видов животных, а также у человека отмечается значительное повышение числа моноцитов в крови (отсюда и название Listeria monocytogenes). Гистологическое исследование мозга указывает на моноцитарную инфильтрацию.
В хозяйствах Алматинской области листериоз сельскохозяйственных животных встречается. По нашим данным, в стационарно неблагополучных хозяйствах, имеющих крупный и мелкий рогатый скот, листериоз обнаруживается у 10–30 % исследованных животных. В Казахском научно-исследовательском ветеринарном институте из 10 проб, предоставленных из хозяйств Алматинской области РК в 2009 год выделен возбудитель листериоза в двух случаях (от 7 месячного теленка, 2-летней коровы), в 2011 году – в двух случаях (от 3-летней коровы, годовалой овцы); в 2014 году – в трех случаях (от 6 месячного теленка, овцы, 8 месячного ягненка); а в 2015 году – в двух случаях (от коровы и быка-производителя).
Диагноз на листериоз ставят на основании комплекса эпизоотологических данных и результатов лабораторного исследования. Решающее значение принадлежит бактериологическому исследованию – выделению культуры листерий. Бактериологическая диагностика включает микроскопическое исследование исходного материала, посевы на питательные среды, идентификацию выделенных культур по культурально-морфологическим, биохимическим, молекулярно-биологическим и серологическим свойствам, а также постановку биологической пробы на лабораторных животных.
Материалы и методы исследования
Для бактериологического исследования на листериоз отбирается: головной мозг, доля печени, почка.
В патологическом материале с подозрением на листериоз – в паренхиматозных органах павших животных характерные патологоанатоми- ческие изменения: изменен цвет паренхимы печени, мягкой консистенции, бывает разложившаяся; селезенка кровенаполнена, темного цвета; паренхима почки мягкой консистенции, цвет изменен. Предоставленные патматериалы были отобраны от трупов животных. Заболевание протекало в острой форме и закончилось гибелью животных.
Бактериологические исследования проводили путем посева суспензии из головного мозга и паренхиматозных органов на физиологическом растворе в соотношении 1:5 на питательные среды МПБ (мясо-пептонный бульон), МПА (мясо-пептонный агар). При приготовлении сред для лучшего роста листерий добавляли 3 % сыворотки крови КРС, 3 % глюкозы и 2 % глицерина. Посевы культур выращивали в термостате при 25 °С. Из головного мозга и печени готовили мазки-отпечатки. Мазки из суточных колоний листерий и мазки-отпечатки окрашивали по Граму.
Биохимические свойства выделенной культуры листерий, каталазную и лецининазную активность определяли общепринятыми методами, биопробу ставили на белых мышах и морских свинках. Для окончательной идентификации выделенных культур, выполняли генетические исследования по секвенированию 16S rRNA гена бактерии.
Предназначенные для идентификации 24 – часовые бульонные культуры, выращенные при 25 °С, бактериологической петлей засевали частым штрихом на 2 пробирки МПА, так, чтобы получить рост по всей поверхности агара, выращивали при комнатной температуре 24 – 30 часов. Затем агаровую культуру смывали небольшим количеством физраствора, чтобы получить густую взвесь (1–1,5 млрд м.к. (микробных клеток) в 1 мл) для постановки РА – реакция агглютинации, пластинчатая реакция для серологической диагностики листериоза.
Для серологической идентификации выделенной культуры листерий использовали поливалентную листериозную агглютинирующую сыворотку, которая представляет собой смесь кроличьих листериозных агглю- тинирующих сывороток и содержит антитела Н-АВ и О-II, V, VI, VII, IX. Для проведения РА на чистое обезжиренное предметное стекло наносили две капли: каплю поливалентной сыворотки и каплю физиологического раствора (физраствора). К обеим каплям на стекле добавляли по одной капле смыва суточной культуры, смесь тщательно перемешивали бактериологической петлей, после чего стекла плавно покачивали круговыми движениями. Одновременно для контроля исследовали на стекле каплю сыворотки с добавлением капли физраствора.
Результаты исследования и их обсуждение
Через 24 ч культивирования посевов в термостате при 25 °С в МПБ наблюдалось легкое равномерное помутнение бульона, на МПА выросли колонии мелкие, росинчатые, блестящие, вязкой консистенции, в проходящем свете наблюдали нежный рост колоний – мелкие выпуклые беловатые колоний как беловатый налет на агаре.
Для выделения листерий из патматериала использовали МПБ, МПА с добавками. Через 24 ч при появлении сплошного роста колоний бактериоло- гической петлей производили пересев на селективную диагностическую среду Palkam. Через 24 часа инкубирования на селективной среде Pаlcam отмечался обильный рост мелких, серовато-зелёных или оливково-зелёных колоний с чёрным ореолом, диаметром 0,5–1,0 мм. Через 48 часов колонии диаметром 1,0–2,0 мм приобретали зеленую окраску с углубленными центрами, окруженными чёрным ореолом. При появлении сплошного роста колоний листерий производили пересев бактериологической петлей из зон наибольшего почернения среды штрихами на 2–3 чашки Петри с селективной дифференциально-диагностической средой для получения изолированных колоний. Бактериальную массу из выросших изолированных колоний использовали для окрашивания по Граму, проведения молекулярно-генетических исследований.
В окрашенных по Граму препаратах бактерии рода листерия установлены в виде коротких палочек, располагающихся одиночно и попарно. Возбудитель листериоза представляет собой грамположительные с закругленными концами палочки, которые могут быть полиморфными. Характерной особенностью листерий является то, что некоторые 2 бактерий располагаются по отношению друг к другу в виде римской цифры V или летящей чайки (важный дифференцирующий признак). Суточная культура листерий, выделенная от теленка, представлена на рис. 1.

Рис. 1. Культура листерий в мазке, окрашенном по Граму
На рис. 1 видны мелкие грамположительные палочки с закругленными концами, которые являются полиморфными, располагаются по одиночке, попарно или группой клеток. Видны бактерий листерий, располагающихся в виде римской цифры V и летящей чайки.
Дальнейшую идентификацию возбудителя листериоза проводили путем определения подвижности методом висячей капли 12-часовой бульонной культуры, выращенной при комнатной температуре. Для установления подвижности листерий культуры выращивали на ПЖА при комнатной температуре, так как при культивировании при 37 °С термолабильные жгутики у листерий разрушаются и подвижность их прекращается. На ПЖА отмечался характерный рост по линии укола в виде зонтика, в культуре листерий были подвижны.
При хранении патологического материала в холодильнике при + 4 °С происходит размножение и накопление листерий. Поэтому в качестве дополнительного диагностического метода использовали исследуемый материал в течение 30 дней для проведения повторных исследований через каждые 10 дней путем посева на МПБ и МПА. В трех повторностях посевов изолята выросли культуры листерий с характерными культурально-морфологическими признаками.
Изучением биохимических свойств установлено, что при посеве суточных культур на среды Гисса листерии ферментировали с образованием кислоты без газа глюкозу, рамнозу, салицин, левулезу, несколько медленнее -сахарозу, растворимый крахмал и глицерин; не ферментировали арабинозу, дульцит, инулин, сорбит; не образовывали индола и сероводорода, не разжижали желатин, не восстанавливали нитраты в нитриты. Определение каталазной активности листерий: к 1 мл суточной бульонной культуры и агаровой культуре добавляли 1 мл свежеприготовленной 5 %-ной перекиси водорода. Вследствие присутствия фермента каталазы у выращиваемой культуры перекись водорода разлагается с образованием кислорода (пузырьков газа). В наших опытах в пробирочной и пластинчатой реакциях агглютинации наблюдалось газообразование (бурлило), поэтому выделенная культура предварительно идентифицирована как Listeria.
Видовую идентификацию проводили методом определения лецитиназной активности листерий. К среде ГРМ № 1, содержащей 5 % вытяжки желтка куриного яйца в 50 % содержании питательного агара, добавляли порошкообразный активированный уголь до концентрации 0,5 %. Для определения лецитиназной активности исследуемую культуру и контрольный штамм листерий пересевали штрихами в 2 чашки среды ГРМ № 1 (без активированного угля) и 2 чашки с добавлением активированного угля. Инкубировали 48 ч при температуре 25 °С, после чего чашки просматривали в проходящем свете и определяли наличие активности в присутствии активированного угля. Эталонный штамм Listeria ivanovii давала плотную зону помутнения независимо от присутствия активированного угля, Listeria monocytogenes образовывала аналогичную зону помутнения в присутствии активированного угля и не образовывала в отсутствие угля. Это биохимическое свойство отличает Listeria monocytogenes от других видов рода Listeria.
Способом усовершенствования идентификации и таксономической классификации бактериальных разновидностей является получение нуклеотидной последовательности 16S rRNA гена путем секвенирования ДНК бактерий. Данный метод позволит провести генетическую идентификацию рода Listeria путем генотипирования.
Методом ПЦР был амплифицирован фрагмент ДНК протяженностью около 1100 п.н.. ПЦР была выполнена универсальными праймерами 16SrRNA-190F 5’– ATTAGCTAGTAGGTGGGGTAA-3 и 16SrRNA-1100R- 5’ TTACTAGCGATTCCGACTTCA в общем объеме 25 мкл. ПЦР смесь содержала 15 нг ДНК, 2.5х смеси, 5 пмоль каждого праймера и деионизированную воду 10 мкл. Программа амплификации ПЦР включала начальную денатурацию 94 °С в течение 3 минут; 27 циклов: 94 °С – 30 секунд, 60 °С – 30 секунд, 72 °С – 30 секунд; заключительную элонгацию 7 минут при 72 °С. ПЦР программа была выполнена с применением амплификатора Mastercycler Gradient, (Eppendorf).
Перед проведением реакции секвенирования для полученных фрагментов ДНК применяли ферментативный метод очистки. При ферментативном методе ПЦР продукты очищали от остатков олигонуклеотидов методом дефосфорилирования с помощью щелочной фосфатазы (SAP – Shrimp Alkaline Phosphatase, SibEnzyme) и эндонуклеазы Exonuclease I (Fermentas).
После ферментативной очистки ПЦР продукты были использованы для выполнения реакции секвенирования, очистки и разделения на автоматическом генетическом анализаторе ABI 3500.
Нуклеотидные последовательности 16S rRNA гена идентифицируемого штамма Listeria monocytogenes от 6 месячного теленка были проанализированы в программном обеспечении SeqScape 2.6.0 (Applide Biosystems).
С учетом полученных результатов, были проведены дальнейшие исследования по проверке чистоты представленного штамма, которые были осуществлены на основе анализа ферограммы нуклеотидной последовательности 16S rRNA гена. Было установлено, что у анализируемого штамма отсутствует смешение сигналов, что свидетельствует об отсутствии в предоставленной культуре посторонних видов бактерий. На рис. 2 в представлена ферограмма фрагмента нуклеотидной последовательности анализируемого гена Listeria monocytogenes.
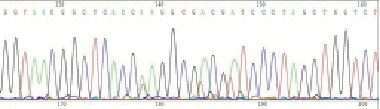
Рис. 2. Ферограмма фрагмента нуклеотидной последовательности гена 16S r RNA
Из рис. 2 видно, что проведенный анализ позволяет сделать выводы об отсутствии перекрестной контаминации культуры Listeria monocytogenes посторонними бактериями.
Последовательности нуклеотидов, полученные с применением прямого и обратного праймеров были объединены в общую последовательность, используя программное обеспечение SeqMan. Последовательности праймеров и плохо разделенные концевые участки были удалены из анализа. В результате проведенного анализа была получена нуклеотидная последовательность протяженностью около 700 п.н. Полученная нуклеотидная последовательность была проанализирована с применением базы данных NCBI утилиты BLAST. Нуклеотидная последовательность и результаты идентификации представлены в таблице и на рис. 3.
Результат идентификации гена 16S rRNA Listeria monocytogenes
Последовательность фрагмента 16S r RNA гена
Идентификация нуклеотидных последовательностей в международной базе данных (http://www.ncbi.nlm.nih.gov/) алгоритм BLAST
Инвентар-ный номер GeneBank (Accesion number) или коллекционный номер штамма
TAAAGAGAGTTTGATCCTGGCTCAGGACGAACGCTGGCGGCGTGCCTAATACATGCAAGTCGAACGAACGGAGGAAGAGCTTGCTCTTCCAAAGTTAGTGGCGGACGGGTGAGTAACACGTGGGCAACCTGCCTGTAAGTTGGGGATAACTCCGGGAAACCGGGGCTAATACCGAATGATAAAGTGTGGCGCATGCCACGCTTTTGAAAGATGGTTTCGCTATCGCTTACAGATGGGCCCGCGGTGCATTAGCTAGTTGGTAGGGTAATGGCCTACCAAGGCAACGATGCATAGCCGACCTGAGAGGGTGATCGGCCACACTGGGACTGAGACACGGCCCAGACTCCTACGGGAGGCAGCAGTAGGGAATCTTCCGCAATGGACGAAAGTCTGACGGAGCAACGCCGCGTGTATGAAGAAGGTTTTCGGATCGTAAAGTACTGTTGTTAGAGAAGAACAAGGATAAGAGTAACTGCTNGTCCCTTGACGGTATCTAACCAGAAAGCCACGGCTAACTACGTGCCAGCAGCCGCGGTAATACGTAGGTGGCNAGCGTNGTCCGGATGGATTGGGCGTNAAGCGCGCGCAGGCGGTCTTTTAAGTCTNATGTGAAAGCCCCCGGCTGAACCGGGNNGGGTCATTGGAAACTGGAAGACTNGAGTGCNGAAGAGGAGAGTGGAATTCCACGTGTAGCGGTGAAATGCGTAGATATGTGGAGGAACACCAGTGGCGAAGGCGACTCTCTGGTCTGTNACTGACG CTGAGGCGCG AAAGCGTGGG
Listeria monocytogenes 07PF0776 strain 07PF0776
Listeria monocytogenes strain NCTC 10357
Listeria innocua strain ATCC 33090
Из таблицы следует, что данные Международного банка GeneBank [6] показывают высокую степень однородности нуклеотидной последовательности 16S rRNA изучаемого штамма с разновидностями рода Listeria (99 %).
Как видно из рис. 3, анализируемый штамм находится на одной филогенетической ветви с разновидностями рода Listeria.
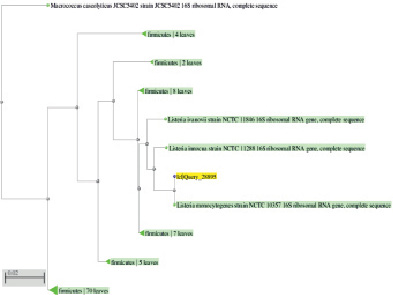
Рис. 3. Филогенетическое древо, построенное на основании фрагмента гена 16S rRNA
Определение патогенности листерий. Биопробу ставили на 3 белых мышах массой 16-18 г, которым подкожно вводили по 0,2 мл суточной бульонной культуры Listeria monocytogenes. На 3 сутки опытные животные пали. При бактериологическом исследовании патматериала от павших белых мышей чистая культура листерий высевалась из печени, сердца.
На 2 морских свинках ставили конъюнктивальную пробу введением в конъюнктивальный мешок по 0,05 мл суточной бульонной культуры Listeria monocytogenes. У морских свинок на 3 сутки развился кератоконъюнктивит и светобоязнь.
В результате проведенных исследований установлено, что эпизоотическая культура Listeria monocytogenes, полученая из патматериала от теленка, коровы, быка-производителя, обладала типичными культурально-морфологическими, биохимическими и антигенными свойствами и по результатам серологических исследований отнесена к 1-му серотипу. По биологическим свойствам эпизоотический изолят был идентичен эталонному музейному штамму. Методом генотипирования была установлена однородность нуклеотидной последовательности 16S rRNA изучаемого штамма с разновидностями рода Listeria (совпадение 99 %).
Таким образом, диагноз на листериоз был поставлен на основании клинико-эпизоотологических данных, характерных культуральных и морфологических свойств, тинкториальных свойств, биохимических свойств (отношение к белкам, углеводам, каталазной, лецитиназной активности и т.д.), молекулярно – генетических свойств (проведения генотипирования методом ПЦР), положительной реакции агглютинации с поливалентной и типовой листериозными сыворотками и отсутствием агглютинации в контроле с физраствором, а также в результате изучения биологических свойств с постановкой биопробы на лабораторных животных.
Во время изолированного содержания, при формировании новых групп в хозяйствующих субъектах или населенных пунктах необходимо проводить клиническое обследование животных и при необходимости (при выявлении признаков поражения нервной системы, абортов, повышенной температуры тела) бактериологические и серологические исследования на листериоз. Систематически проводить уничтожение грызунов, кровососущих насекомых и клещей. Вести строгий учет случаев абортов, мертворождения и падежа животных и направлять патологический материал на исследование в ветеринарную лабораторию.
, MD, FACP, Charles E. Schmidt College of Medicine, Florida Atlantic University;
, MD, Wellington Regional Medical Center, West Palm Beach
Last full review/revision September 2017 by Larry M. Bush, MD, FACP; Maria T. Perez, MD
Listeria представляют собой небольшие, некислотоустойчивые, бескапсульные, неспорообразующие, бета-гемолитические, аэробные и факультативно анаэробные грамположительные бациллы, у которых есть характерная небольшая подвижность. Они распространены по всему миру в окружающей среде и в кишечнике человека, у млекопитающих, птиц, паукообразных насекомых и ракообразных. Есть несколько видов Listeria, но только L. monocytogenes является основным патогеном для человека.
В США средний годовой уровень лабораторно подтвержденного листериоза составляет около 2,6 случаев на 1000000 человек и достигает максимума в летнее время. Показатели заболеваемости являются самыми высокими у новорожденных, у взрослых ≥ 60 лет и лиц с ослабленным иммунитетом, включая пациентов с ВИЧ/СПИД. Листериоз в 300 раз чаще встречается среди пациентов с ВИЧ/СПИДом, чем среди населения в целом.
Пути передачи
Поскольку L. monocytogenes встречается в окружающей среде повсеместно, существует большая вероятность контаминации во время процесса производства пищевых продуктов. Почти все виды пищи могут содержать и передавать L. monocytogenes, но инфекция обычно передается при употреблении в пищу инфицированных молочных продуктов, сырых овощей, мяса или, особенно, замороженных продуктов, которые не требуют приготовления перед употреблением. Контаминация благоприятствует способности L. monocytogenes выживать и расти при температуре холодильной камеры.
Инфекция может также передаваться при прямом контакте и во время истребления зараженных животных.
Listeria monocytogenes может размножаться в холодильнике, поэтому незначительно загрязненная палочками пища может высоко контаминированной.
Факторы риска
В связи с тем, что L. monocytogenes размножается внутри клетки, контроль листериоза обусловлен клеточным иммунитетом; поэтому в группу высокого риска заражения попадают люди следующих групп:
Беременные женщины также находятся в группе риска, поскольку инфекция может начаться во время беременности, передаться плоду в антенатальном периоде и во время родов и привести к аборту или гибели плода.
Клинические проявления
Первичная листериозная бактериемия возникает редко и проявляется высокой температурой тела без локальных симптомов и признаков. Может развиться эндокардит, перитонит, остеомиелит, септический артрит, холецистит и плевропневмония. После приема зараженной пищи может развиться гастрорэнтерит с лихорадкой. Листериозная бактериемия во время беременности может вызывать внутриматочную инфекцию, хориамнионит, преждевременные роды, внутри-утробную смерть или неонатальную инфекцию плода.
Менингит, вызванный Listeria, встречается приблизительно в 20% случаев у новорож-денных и у пациентов > 60 лет. В двадцати процентах случаев могут возникнуть признаки энцефалит, диффузный энцефалит или, редко, ромбэнцефалит и абсцессы; ромбэнцефалит проявляется как измененное сознание, паралич черепных нервов, мозжечковые признаки и моторная или сенсорная недостаточность.
Окулогландуллярный листериоз может вызывать офтальмит и увеличение регионарных лимфатических узлов (синдром Паринауда). За этой симптоматикой могут развиться инокуляции конъюнктивы, которые в случае отсутствия этиотропного лечения могут перейти в бактериемию и менингит.
Диагностика
Диагноз листериоза подтверждается выделением культуры L. monocytogenes из крови и ЦСЖ. Необходимо проинформировать сотрудников лаборатории относительно подозрения на L. monocytogenes, поскольку листерии легко можно принять за дифтероиды.
При всех листериозных инфекциях титры IgG достигают максимума через 2–4 нед. после начала заболевания.
Лечение
Ампициллин или пенициллин G, обычно с аминогликозидом
Листериозный менингит эффективно лечится ампициллином, 2 г внутривенно каждые 4 часа. Большинство специалистов рекомендуют добавлять гентамицин (1мг/кг внутривенно каждые 8 часов), основываясь на синергизме in vitro. Цефалоспорины неэффективны. Для информации о лечении неонатального менингита, Бактериальный менингит новорожденных : Патогенспецифическая терапия антибиотиками.
При эндокардите и первичной листериозной бактериемии применяют ампициллин внутривенно 2 г каждые 4 ч в сочетании с гентамицином (для синергии) до 6 нед. (при эндокардите) или 2 нед. (при бактериемии) после снижения температуры. При окулогляндуллярном листериозе и листериозном дерматите назначаются эритромицин 10 мг/кг каждые 6 ч, лечение продолжается до 1 нед. после снижения температуры. Цефалоспорины не обладают активностью in vitro, поэтому не должны применяться; также сообщалось о неэффекттивности ванкомицина. Триметоприм/сульфаметоксазол 5/25 мг/кг каждые 8 ч является препаратом выбора. Линезолид активен in vitro, но опыта применения в клинической практике недостаточно.
Профилактика
Поскольку инфицирование пищевых продуктов L. monocytogenes распространено, и бацилла может размножаться при низкой температуре в холодильнике, контаминация возбудителем может значительно увеличиться в период хранения пищи. Эта проблема вызывает особую озабоченность, когда продукты питания (например, хранящиеся в холодильнике полуфабрикаты) используют в пищу без дальнейшего приготовления. Таким образом, очень важной является гигиена питания, особенно для лиц из группы риска (например, людей с ослабленным иммунитетом, беременных женщин, пожилых людей). Лицам из группы риска следует избегать употребления следующих продуктов:
Мягких сыров (например, феты, бри, камамбера)
Хранящихся в холодильнике, готовых к употреблению продуктов (например, хот-догов, мясных деликатесов, мясных паштетов), если они не нагреваются до температуры 73,9 °C или не обрабатываются горячим паром перед подачей на стол
Охлажденных копченых, соленых, вяленых, морепродуктов без предварительной горячей обработки
Сырого (непастеризованнго) молока
Основные положения
L. monocytogenes распространена в окружающей среде, но ежегодно в США она вызывает инфекцию лишь у около 2,6 человек/млн, как правило, через инфицированные продукты питания.
Показатели заболеваемости являются самыми высокими у новорожденных, взрослых ≥ 60 лет и лиц с ослабленным иммунитетом.
При этом заболевании могут поражаться различные системы и органы; инфекция во время беременности может привести к смерти плода.
Назначается ампициллин, обычно вместе с гентамицином.
Пациентам с факторами высокого риска для предотвращения болезни рекомендуется избегать употребление продуктов питания, которые с большой степенью вероятностью будут заражены.
Читайте также:


