К какой группе патогенности относится золотистый стафилококк

В связи с техногенным загрязнением окружающей среды в настоящее время отмечается рост числа различных форм дисбиоза у человека [8]. Одной из форм нарушения качественного и количественного состава нормальной микрофлоры является стафилококковое бактерионосительство [3].
Стафилококки являются частью нормальной микрофлоры кожных покровов, слизистых оболочек и нижнего отдела кишечника человека. По данным С.В. Сидоренко (2003), приблизительно 40% людей являются постоянными носителями S. aureus на слизистой оболочке крыльев носа, коже подмышечных впадин и промежности, оставшуюся часть популяции относят к транзиторным и случайным (временным) носителям [4; 6]. Важное клиническое значение бактерионосительства определяется достаточной типичностью процесса транслокации стафилококков с наружных кожных покровов и слизистых оболочек во внутреннюю среду организма хозяина с развитием широкого спектра заболеваний [4; 10]. С другой стороны, носительство стафилококков в носовых ходах может представлять опасность для окружающих за счет аэрогенного распространения, что особенно актуально в организованных детских коллективах.
Исследования последних лет свидетельствуют, что загрязнение окружающей среды приводит не только к широкому распространению экологически обусловленных заболеваний, угнетению иммунобиологической реактивности организма, нарушению репродуктивной функции и другим многочисленным негативным сдвигам в состоянии здоровья макроорганизма [1], но и к качественному и количественному изменению микрофлоры организма человека [5]. По мнению Б.А. Шендорова (1998), различные поллютанты в порядке индукции защитных реакций у микробов могут вызывать существенные изменения в их патогенности [9]. Поэтому изучение биологических свойств золотистых стафилококков, колонизирующих слизистые оболочки такого слабо адаптированного контингента, как младшие школьники, имеет важное научно-практическое значение [2].
Цель работы - изучение факторов патогенности Staphylococcus aureus, выделенных со слизистой оболочки переднего отдела носа у школьников младших классов, проживающих в экологически неравнозначных районах города Красноярска.
Материал и методы исследования. Изучены факторы патогенности 266 культур Staphylococcus aureus, выделенных со слизистой оболочки переднего отдела носа у детей, проживающих в экологически неравнозначных районах города Красноярска. Все дети (возраст 7-11 лет) относились к 1 и 2 группе здоровья и проживали в исследуемых районах города с момента рождения. Обследованные дети условно были разделены на 3 группы. Главным критерием данной дифференциации явились коэффициенты суммарного загрязнения воздуха, по которым различались зоны наблюдения.
При обследовании школьников на стафилококковое бактерионосительство исследуемый материал (клетки эпителия слизистой носа) засевали на чашки с желточно-солевым агаром, инкубировали при 37 °С в течение 24-48 часов, затем проводили количественную и качественную оценку выросших колоний, расчет показателя микробной обсемененности (ПМО).
Число микробных клеток 10 3 и более на тампон является показателем высокой обсемененности и свидетельствует о бактерионосительстве, представляющем эпидемическую опасность.
При определении видовой принадлежности штаммов использовали тесты фирмы PLIVA-Lachema Diagnostika (Чехия). Изучение факторов патогенности (продукция плазмокоагулазы, лецитиназы, ДНК-азы, РНК-азы, лизоцима и гемолизина) культур золотистого стафилококка проводили общепринятыми методами.
Статистическую обработку результатов проводили с помощью пакета прикладных программ Statistica v 6.0. Поскольку по критерию Шапиро-Уилкса распределение носило нормальный характер, для описания качественных учетных признаков применяли среднее арифметическое и стандартную ошибку среднего (М±m). Основываясь на равенстве дисперсий, значимость различий определяли по критерию t-Стьюдента. Критический уровень значимости (р) при проверке статистических гипотез в данном исследовании принимался равным 0,05.
Результаты исследования и их обсуждение. Анализ результатов изучения факторов патогенности S. aureus, выделенных со слизистых оболочек переднего отдела носа у детей, проживающих в городе Красноярске, показал, что плазмокоагулазу, лецитиназу и гемолизин продуцировали все исследуемые культуры золотистого стафилококка, вне зависимости от района выделения (табл. 1). Продукция гиалуронидазы и лизоцима у штаммов стафилококка, выделенных со слизистой оболочки носа у детей, проживающих в первом (экологически благополучном) исследуемом районе, наблюдалась у 21,0 и 63,2% соответственно. Гиалуронидазной и лизоцимной активностью обладали соответственно 59,3 и 84,5% культур стафилококка, выделенных от детей, проживающих во втором исследуемом районе; 75,0% и 95,2% культур соответственно - в третьем исследуемом районе. У стафилококков, выделенных от школьников в первом исследуемом районе, продукцию ферментов гиалуронидазы и лизоцима регистрировали в 2-3 раза достоверно реже, чем у культур стафилококков, выделенных от детей во втором и третьем районах.
Таким образом, все изученные культуры золотистого стафилококка, выделенные со слизистых оболочек переднего отдела носа у детей, проживающих в различных районах города Красноярска, обладали большим набором факторов патогенности. Культуры, выделенные от обследуемых во втором и третьем районах, обладали большим уровнем патогенности по сравнению с культурами золотистого стафилококка, вегетирующими на слизистых оболочках носа у детей, проживающих в первом исследуемом районе.
Таблица 1 - Распространенность факторов патогенности стафилококков, выделенных от детей, проживающих в районах с различной антропогенной нагрузкой
Исследуемый район
Факторы патогенности (%, М ± m)
Плазма-коагулаза
Гиалуронидаза
Лецити-наза
Значение других стафилококков за редким исключением ограничено проблемой госпитальных (внутрибольничных) инфекций. Реализация их весьма условной патогенности связана с инвазивностью современных диагностических и лечебных процедур, которые способствуют внедрению бактерий, широко представленных в микрофлоре человека и окружающей среде.
Золотистый стафилококк (S. aureus)
Отличить S. aureus от других стафилококков нетрудно, тем более что его культуральные особенноcти легко усилить при помощи дифференциально-диагностических сред, выявляющих активность ферментов (липаза, дезоксирибонуклеаза, стафилокиназа) или токсинов (гемолизины) (рис. 2). Изучение культуральных признаков, мазок из колонии, окрашенный по Граму, и тест на свертывание плазмы (из стафилококков человека только S. aureus обладает коагулазной активностью) фактически исчерпывают рутинный микробиологический анализ. Впрочем, иногда приходится решать еще две задачи: определение чувствительности к антибиотикам и внутривидовое типирование для выяснения закономерностей распространения инфекции (источник заражения, пути передачи).
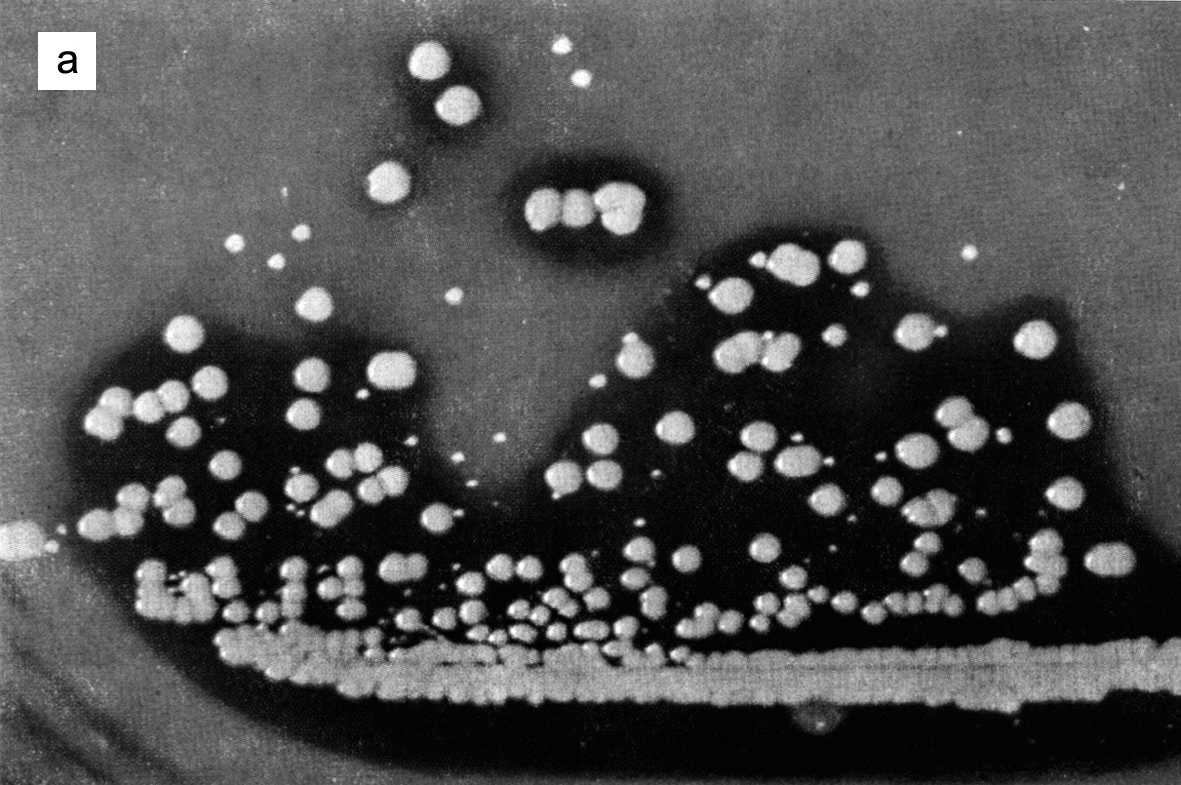
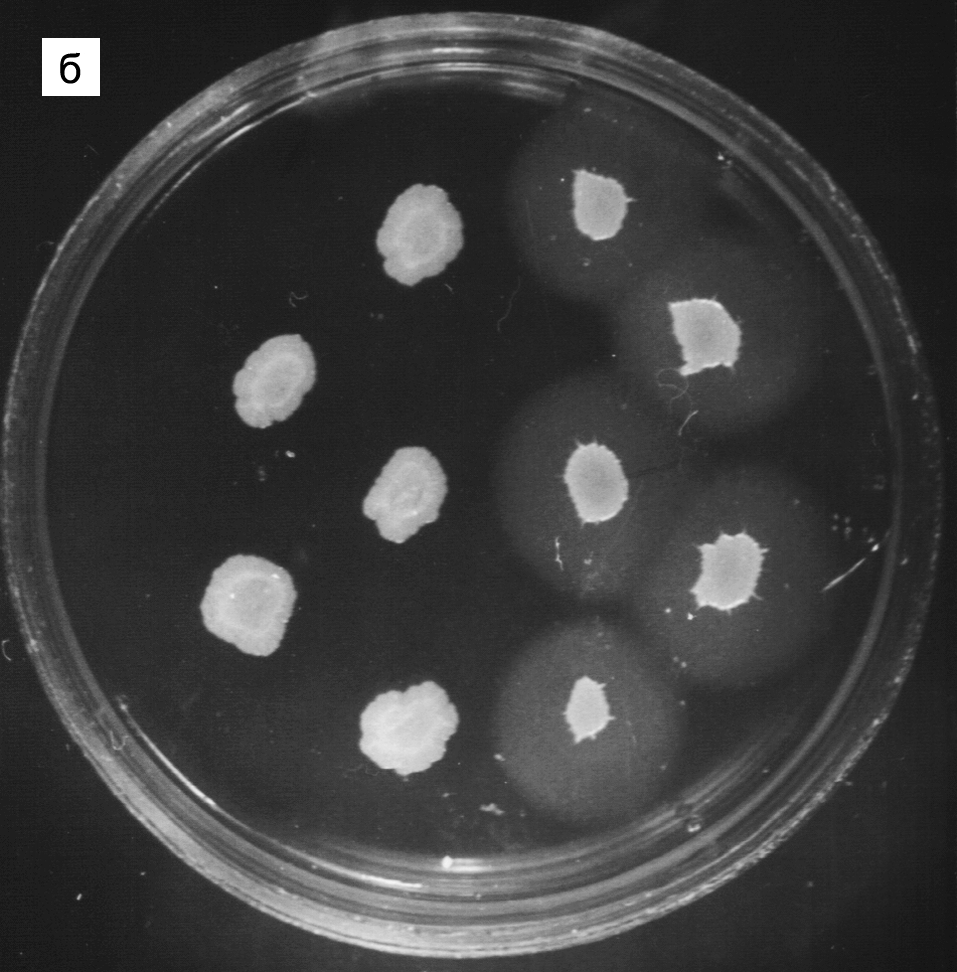
Рис. 2. Колонии стафилококков на дифференциально-диагностических средах. На кровяном агаре (а) колонии S.aureus окружены зоной гемолиза; колонии S.epidermidis — мелкие, негемолитические. На желточно-солевом агаре (б) колонии S. aureus окружены мутным орелом расщепленных липидов (результат высокой липазной активности)
Серологическая дифференцировка штаммов не является общепризнанной. Стафилококки обладают сложным и непостоянным набором поверхностных антигенов и использовать их для типирования бактерий не удалось. По капсульному полисахариду золотистый стафилококк может быть разделен на 11 серотипов, однако этого явно недостаточно для эпидемиологической практики. Штаммы S. aureus можно различить по генотипу или по спектру секретируемых белков, но чаще применяется фаготипирование c помощью международного набора бактериофагов (табл. 1).
Т а б л и ц а 1
Фаготипирование золотистого стафилококка
| Фагогруппа | Фаги (фаготип, или фаговар) |
| I | 29, 52, 52A, 79, 80 |
| II | 3A, 3C, 55, 71 |
| III | 6, 42E, 47, 53, 54, 75, 77 |
| IV | 42D |
| Вне групп | 81, 94, 95, 96 |
Одна и та же культура может лизироваться разными фагами, из чего складывается профиль фагочувствительности (фагомозаика) штаммов. Так как число подобных спектров велико и на практике их трудно учитывать, фаги объединены в группы. Каждый штамм относится к одной из фагогрупп и соответствующему фаготипу; предпочтение отдают фагам с наибольшей литической активностью. Совпадение фагомозаики у штаммов, изолированных от разных больных, говорит об общем источнике инфекции.
Экология
Золотистый стафилококк принадлежит к числу широкораспространенных бактерий. Он часто выделяется от здоровых людей и с этой точки зрения может рассматриваться как факультативный компонент нормальной микрофлоры. Контакт с ним неизбежен, и уже в первые дни жизни (в родильном доме) практически все новорожденные подвергаются контаминации. Повышенный уровень инфицирования наблюдается и в обычных медицинских стационарах, причем как среди больных, так и у обслуживающего персонала. Чаще всего золотистый стафилококк локализуется на слизистой оболочке носа и носоглотки. Примерно 20% людей не поддерживают носительства. Для большинства людей (около 60%) носительство транзиторно: они освобождаются от стафилококка через несколько дней или недель и, если заражаются вновь, то уже другим штаммом. Но встречаются и упорные носители (их около 20%), у которых тот же штамм выделяется месяцы и даже годы. Это наиболее вероятный источник инфицирования окружающих, особенно при высокой обсемененности носителя (эпидемически опасным считается присутствие более 10 млн. бактерий в 1 мл назального секрета).
Борьбе с носительством золотистого стафилококка отдано немало сил. Этот вопрос особенно важен для медицинских учреждений, где угрозе заражения подвергаются ослабленные больные и дети. Однако реальных успехов и общепризнанных рекомендаций добиться не удалось. Борьба со здоровым носительством — это по сути борьба с нормальной микрофлорой, что не всегда проходит бесследно для природных микробиоценозов, провоцируя развитие дисбиотических состояний. Об этом следует помнить и санировать лишь злостных носителей, т.е. лиц, упорно выделяющих большие дозы бактерий. Появились надежды, связанные с местными аппликациями антибиотика мупироцина (природного продукта Pseudomonas fluorescens), который неплохо справляется с интраназальным носительством золотистого стафилококка. Он быстро метаболизируется сывороточными ферментами, а потому должен применяться местно. Это первый препарат, действующий на тРНК-синтетазы (в том числе на метациллинрезистентные клоны золотистого стафилококка), и есть надежда, что будут получены аналоги мупироцина для внутреннего использования.
Вторая по значимости экологическая ниша для S. aureus — кожа, особенно участки с повышенной влажностью (у 10—20% людей золотистый стафилококк выделяется из промежности). Колонизация кожи создает основу для ее пиогенных инвазий — самой распространенной стафилококковой инфекции. В небольших количествах золотистый стафилококк присутствует в толстом кишечнике и влагалище. Изредка это служит причиной местных поражений или системных интоксикаций.
В основе клинического разнообразия стафилококковой патологии лежит способность S. aureus 1) вызывать пиогенную инвазию кожи и ее придатков, 2) проникать в кровь и индуцировать пиогенные (гнойно-деструктивные) поражения внутренних органов, 3) вызывать неспецифическую (септическую) и 4) специфические интоксикации.
Чаще всего S. aureus поражает кожу с развитием пиодермий — не только самой распространенной формы стафилококковой инфекции, но и пиогенных инвазий вообще. Слизистые оболочки поражаются редко, и в этом отношении стафилококк отличается от стрептококка (Str. pyogenes), который чаще инфицирует слизистые оболочки. Отсюда сравнительно небольшое значение золотистого стафилококка при ангинах, отитах, гайморитах и первичных поражениях бронхолегочного аппарата. Стафилококковая инфекция выступает здесь как фактор, осложняющий течение основного патологического процесса.
Стафилококки: золотистый, эпидермальный, сапрофитный
Стафилококки — грамположительные кокки, которым в чистой культуре свойственно скопление в виде гроздьев винограда (характерно деление в разных плоскостях). Неподвижные, не образуют спор, могут образовывать микрокапсулу.
Стафилококки растут на простых питательных средах (мясо-пептонный агар, мясо-пептонный бульон), являются галофильными (хорошо размножаются при высоких концентрация NaCl - изготовление элективной среды - желточно-солевого агара). Чувствительны к анилиновым красителям, йоду (используется в местном лечении пиодермии).
Стафилококки продуцируют каталазу, что защищает их от губительного действия производных кислорода. Синтезируют каротиноидные пигменты, которые также защищают от оксидантов. Антиоксидантная активность — один и механизмов их защиты в условиях пиогенных инфекций. Стафилококки часто характеризуются множественной устойчивость к антибиотикам (β-лактамам, эритромицину, тетрациклинам, хлорамфениколу и др.). Устойчивость к антибиотикам контролируется R-плазмидами (синтез β-лактамаз) или хромосомными мутациями (метициллино-резистентные стафилококки — MRS-штаммы).
Антигены стафилококков:
1) Тейховые и липотейхоевые кислоты (адгезия к эпителиальным клеткам);
2) Пептидогликан;
3) Белок А (связывается с Fc-участком Ig, из-за этого молекулы IgG связываются с поверхностью бактериальных клеток в неправильной ориентации, что приводит к нарушению опсонизации и фагоцитоза);
Стафилококки поражают любые органы и системы организма, вызывают сепсис, септикопиемию, токсинемию. Иммунитет по механизму клеточный и гуморальный, по напряженности — нестойкий. Узкоспецифический (против определенных штаммов). По направленности антитоксический, антиферментный, антибактериальный. Возможен переход острой инфекции в хроническую с развитием аллергии.
В современной медицинской практике большую опасность представляют экзогенные стафилококковые инфекции для больных в стационарах — внутрибольничные инфекции. Основными возбудителями являются S. aureus, S. epidermidis. Источник заражения — здоровые носители госпитальных штаммов, а также больные со стертыми формами стафилококковой инфекции. Наибольшую эпидемическую опасность представляет медицинский персонал — постоянные носители госпитальных штаммов. Механизмы, пути и факторы передачи стафилококка разнообразны: аэрогенный (воздушно-капельный, воздушно-пылевой), фекально-оральный (пищевой), артифициальный (через нестерильные медицинские инструменты) и др. Восприимчивость к стафилококкам высокая.
Кроме экзогенной, не меньшую опасность представляет эндогенная оппортунистическая инфекция, которая вызывается стафилококками - представителями собственно нормально микрофлоры. При снижении
иммунного статуса организма аутоштаммы повышают свою вирулентность и вызывают патологические процессы как в исходном биотопе, так и в других биотопах организма за счет миграции и
транслокации.
Диагностика: ведущим методом является бактериологический. Взятие исследуемого материала зависит от предполагаемой локализации с учетом патогенеза и клинической картины болезни. Главное значение в диагностике имеют идентификация возбудителя, его дифференциация от нормальной, сопутствующей стафилококковой микрофлоры. Экспресс-диагностика направлена на обнаружение серологическими реакциями антигенов ферментов патогенности и токсинов стафилококка.
Бактериологический метод включает также определение у чистой культуры факторов патогенности, фаговара (выявление госпитальных штаммов, источника и путей передачи инфекции), антибиотикограммы.
Важное значение имеет выявление секретируемых факторов персистенции для диагностики резидентного носительства и прогнозирования осложнений, хронизации процесса.
Серологический метод, как правило, применяется в диагностике
затяжных, хронически форм заболевания. Информативным показателем является обнаружение антител к факторам патогенности стафилококков: токсинам, ферментам, тейхоевой кислоте и др.
ЗОЛОТИСТЫЙ СТАФИЛОКОКК. Название бактерия получила благодаря своему внешнему виду под микроскопом (имеет золотистый цвет, обусловленный пигментами из группы каротиноидов).
S. aureus — бактерия-комменсал (разновидность симбиоза, при котором комменсал возлагает на хозяина регуляцию своих отношений с внешней средой, но не вступает с ним в тесные взаимоотношения). Колонизирует кожу и поверхности слизистых (носа, глотки и влагалища). Основным резервуаром является полость носа, но могут обитать и в гортани, в области промежности, в подмышечных областях, на волосистой части кожи головы и в желудочно-кишечном тракте. Бактериальные клетки диаметром 0,5-1,5 мкм, факультативно анаэробные грамположительные кокки, неподвижные. Способен расти в широком диапазоне температур от 7 до 48,5°С (оптимум 30 - 37°С); рН 4,2 - 9,3 (оптимум рН 7,0-7,5) и при высокой концентрации хлорида натрия (до 15% NaCl). Такие свойства позволяют бактериям заселять самые разнообразные продукты.
Существует внутривидовая дифференциация S.aureus на фагогруппы и фаговары, что используется в реакции фаготипирования для выяснения источника заражения и путей передачи инфекции.
У S. aureus обнаружены белки-адгезины, которые взаимодействуют с различным протеинами: лектинами, фибронектином, муцином и др.
S. aureus может вызывать широкий диапазон заболеваний, начиная с лёгких кожных инфекций: угри, фурункул, флегмона, карбункул, стафилококковый ожогоподобный кожный синдром и абсцесс — до смертельно опасных заболеваний: пневмония, менингит, остеомиелит, эндокардит, инфекционно-токсический шок и сепсис. Диапазон заболеваний простирается от кожных, мягких тканей, респираторных, костных, суставных и эндоваскулярных до раневых инфекций. Он до сих пор является одной из четырёх наиболее частых причин внутрибольничных инфекций, часто вызывая послеоперационные раневые инфекции.
С момента открытия пенициллина и активного его использования против стафилококка в популяции закрепилась мутация, в связи с которой в настоящее время большинство штаммов устойчивы к этому антибиотику, благодаря наличию у золотистого стафилококка пенициллиназы (расщепляющет молекулу пенициллина). Для борьбы с бактерией широко применяют метициллин. Но сейчас встречаются штаммы, устойчивые и к метициллину, в связи с чем штаммы золотистого стафилококка делят на метициллин-чувствительные и метициллин-устойчивые штаммы золотистого стафилококка. Выделяются ещё более устойчивые штаммы: ванкомицин-резистентный и гликопептид-резистентный.
ЭПИДЕРМАЛЬНЫЙ СТАФИЛОКОКК. Коагулаза-отрицательный вид стафилококков, представитель нормальной микрофлоры кожи человека. Имеют правильную шарообразную форму и размер от 0,5 до 1,5 мкм, располагаются преимущественно по две и четыре бактерии. Температурный оптимум 30-37 °С. Является факультативным анаэробом, который может расти в аэробных условиях.
Из S. epidermidis выделен специфический полисахарид, обеспечивающий прикрепление стафилококка к протезам, ортопедическим стержням и другим трансплантатам, что создает условие для развития инфекции.
Несмотря на то, что S. epidermidis является непатогенным возбудителем, у части людей со сниженным иммунитетом он может вызывать инфекции. Часто обнаруживается в катетерах и других хирургических имплантатах.
Способен вызывать инфекции кровеносной системы, эндокардиты и инфекции клапанов сердца, воспаление мочеполовой системы, инфекции в искусственных суставах, инфекции у новорожденных. Очень редко может быть причиной сепсиса у госпитализированных пациентов.
Высокая вирулентность S. epidermidis связана с их способностью образовывать биопленку на поверхности пластика. Другие микроорганизмы могут связываться с образовавшейся биопленкой, образуя многослойную биопленку. Такая биопленка уменьшает метаболическую активность микроорганизмов внутри нее и делает их недоступными для антибиотиков. Часто устойчивы к пенициллинам, амоксициллину и метициллину.
САПРОФИТНЫЙ СТАФИЛОКОКК. Коагулаза-отрицательный вид стафилококков, распространенный возбудитель инфекций мочевых путей. Встречается в дистальной части пищевода человека, продуцирует патогенные гемолизины. Является частью нормальной микрофлоры женского мочеполового тракта и промежности.
S. saprophyticus обладает ферментом уреазой и способен под влиянием мочевины образовывать капсулу. Он является одним из основных возбудителей инфекций мочевого тракта(цистита, пиелонефрита), а так же дизурических расстройств. Реже возникают пиелонефриты и эндокардиты.
Устойчив к новобиоцину.
1.1 . В настоящих методических указаниях представлена информация о роли метициллинрезистентных штаммов золотистого стафилококка в возникновении внутрибольничных инфекций, их микробиологических и эпидемиологических особенностях, изложены традиционные и молекулярно-генетические методы идентификации и типирования.
1.2 . Методические рекомендации разработаны в помощь специалистам органов и учреждений, осуществляющих государственный санитарно-эпидемиологический надзор, и лечебно-профилактических учреждений, осуществляющих организацию и проведение профилактических и противоэпидемических мероприятий по борьбе с внутрибольничными инфекциями.
2.2 . Положение о государственной санитарно-эпидемиологической службе Российской Федерации, утвержденное постановлением Правительства Российской Федерации № 554 от 24 июля 2000 г.
2.6 . Методические указания по эпидемиологическому надзору за внутрибольничными инфекциями от 02.09.87. № 28-6/34.
В последнее десятилетие проблема внутрибольничных инфекций (ВБИ) приобрела исключительно большое значение для всех стран мира. Это обусловлено, прежде всего, значительным ростом числа госпитальных штаммов микроорганизмов, обладающих устойчивостью к широкому кругу антимикробных препаратов. Несмотря на значительный недоучет, в Российской Федерации ежегодно регистрируется около 30 тыс. случаев внутрибольничных инфекций, при этом минимальный экономический ущерб составляет более 5 млрд. рублей ежегодно. Среди возбудителей ВБИ одно из первых мест, по-прежнему, принадлежит микроорганизмам рода Staphylococcus , наиболее патогенным представителем которого является S . aureus . Эпидемиологическая ситуация осложняется в связи с широким распространением в стационарах, а также появлением и во внебольничной среде, клинических изолятов S . aureus, устойчивых к оксациллину (ORSA или MRSA ). MRSA способны вызывать разнообразные клинические формы внутрибольничных инфекций, включая наиболее тяжелые, такие как: бактериемия, пневмония, синдром септического шока, септический артрит, остеомиелит и другие, которые требуют длительного и дорогостоящего лечения. Появление осложнений, вызванных MRSA , приводит к увеличению сроков госпитализации, показателей летальности, значительным экономическим потерям. Показано, что рост частоты ВБИ, наблюдаемый в стационарах различных стран мира, обусловлен распространением эпидемических штаммов MRSA , многие из которых способны вырабатывать пирогенные токсины - суперантигены, подавляющие иммунный ответ на S . aureus .
С конца 90-х годов прошлого века в стационарах России отмечается рост частоты выделения MRSA , которая в ряде больниц достигла 30 - 70 %. Это делает неэффективным использование многих антимикробных препаратов и существенно ухудшает качество оказания медицинской помощи населению. В этих условиях совершенствование методов эпидемиологического и микробиологического мониторингов, направленных на выявление эпидемически значимых штаммов, приобретает все более актуальное значение.
4.1. Таксономия и биологические особенности
4.2. Клиническое значение
В настоящее время MRSA являются ведущими возбудителями внутрибольничных инфекций в стационарах многих странах мира. Частота их выделения в стационарах США, Японии, многих стран Западной Европы достигает 40 - 70 %. Исключение составляют, по-видимому, только ряд скандинавских стран, где исторически были приняты жесткие противоэпидемические меры по контролю за распространением таких штаммов. В стационарах Российской Федерации частота выделения MRSA колеблется от 0 до 89 %. Наибольшая частота выделения отмечается в реанимационных, ожоговых, травматологических и хирургических отделениях стационаров, расположенных в крупных городах. Одной из основных причин этой закономерности является концентрация в таких стационарах пациентов с нарушениями целостности кожных покровов и поврежденными иммунологическими барьерами. Наиболее частым местом локализации инфекции являются послеоперационные и ожоговые раны и дыхательные пути. Первичные и вторичные бактериемии наблюдаются примерно у 20 % инфицированных больных. В случае инфицирования ожоговых больных частота бактериемии нередко возрастает до 50 %. Факторами, способствующими развитию бактериемии, является присутствие центрального венозного катетера, анемия, гипотермия и назальное носительство. Развитие бактериемии значительно увеличивает вероятность летального исхода. Особенно высокая смертность, обусловленная бактериемией, наблюдается среди пациентов, находящихся в ожоговых и отделениях интенсивной терапии, где она может достигать 50 % по сравнению с 15 % в контрольной группе. Риск развития летального исхода возрастает почти в три раза среди пациентов, у которых бактериемия обусловлена MRSA по сравнению с пациентами, инфицированными метициллинчувствительными штаммами S. aureus . Развитие госпитальной бактериемии приводит к значительному увеличению стоимости госпитализации. В современных условиях лечение таких пациентов требует, как правило, внутривенного введения ванкомицина, тейкопланина или линезолида, однако клиническая эффективность этих препаратов нередко оказывается значительно ниже, чем у антибиотиков, используемых для лечения пациентов с осложнениями, вызванными метициллинчувствительными S . aureus . По данным Центра по контролю за заболеваниями (США) средняя продолжительность пребывания пациента в больнице в случае хирургического вмешательства составляет 6,1 дня, тогда как при возникновении осложнений, вызванных MRSA она увеличивается до 29,1 дней, при этом средние расходы возрастают с 29455$ до 92363$ в пересчете на каждый случай. Заболевания, вызванные MRSA, могут начинаться на фоне терапии антибиотиками, в том числе аминогликозидами и цефалоспоринами. В этой связи необходимо отметить, что неадекватное назначение антибиотиков в случае тяжелых ВБИ драматически ухудшает прогноз заболевания. Летальность при осложнениях, вызванных MRSA , значительно колеблется и зависит как от возраста пациента, сопутствующего заболевания (артериальная гипертензия, диабет и др.), так и от присоединения дополнительной микрофлоры. Наиболее распространенными вторичными проявлениями инфекции, обусловленной M RSA , являются эндокардиты, гематогенный остеомиелит, септический артрит. Одним из наиболее грозных осложнений, вызываемых MRSA , является синдром токсического шока (СТШ). Клинические проявления СТШ включают следующий симптомокомплекс: гипертермия, сыпь, рвота, диарея, гипотензия, генерализованный отек, острый респираторный дистресс синдром, полиорганная недостаточность, диссеминированная интраваскулярная коагуляция. СТШ может развиться как осложнение после родов, хирургических вмешательств, при суперинфицировании S . aureus трахеальных повреждений, вызванных вирусом гриппа. Недавно описанные стафилококковая скарлатина и синдром упорной десквамации эпителия рассматривают как варианты СТШ.
4.3. Факторы патогенности и вирулентность
Вопрос о вирулентности MRSA остается дискутабельным. Они практически не вызывают заболевания у здоровых лиц из числа медицинского персонала. Вместе с тем, в многочисленных исследованиях показано, что прогноз при тяжелых формах внутрибольничных инфекций, таких как пневмония и бактериемия, значительно хуже среди пациентов, инфицированных MRSA , по сравнению с пациентами, инфицированными метициллинчувствительными S . aureus.
4.4. Генетический контроль устойчивости к метициллину и особенности фенотипической экспрессии
Мишенью действия b -лактамных антибиотиков (как пенициллинов, так и цефалоспоринов) являются транс- и карбоксипептидазы - ферменты, участвующие в биосинтезе основного компонента клеточной стенки микроорганизмов - пептидогликана. Благодаря своей способности связываться с пенициллином и другими b -лактамами данные ферменты получили название пенициллинсвязывающих белков (ПСБ). У Staphylococcus aureus имеются 4 ПСБ, отличающиеся как по молекулярной массе, так и по функциональной активности. Устойчивость метициллинрезистентных штаммов золотистого стафилококка ( MRSA ) к b -лактамным антибиотикам обусловлена продукцией дополнительного пенициллинсвязывающего протеина - ПСБ-2 ¢ , отсутствующего у чувствительных микроорганизмов. При подавлении В -лактамным антибиотиком активности основных пенициллинсвязывающих белков ПСБ-2 ¢ , в силу своего более низкого сродства к препаратам данной группы, продолжает функционировать и сохраняет микробной клетке жизнеспособность. Синтез ПСБ-2 ¢ кодируется геном mec A , расположенным на хромосоме S . aureus , в специфической области, обнаруживаемой только у метициллинрезистетных штаммов стафилококка - тес ДНК. Ме c ДНК представляет новый класс мобильных генетических элементов, который получил название стафилококковая хромосомная кассета тес ( Staphylococcal chromosomal cassette тес = SCCmec ). Выявлено существование 4 типов SCCmec , различающихся как размерами (от 21 до 66 т.п.н.), так и набором генов, составляющих данные кассеты. Разделение на типы основано на различиях в генах, образующих собственно комлекс тес, и в наборе генов, кодирующих рекомбиназы сс r А и сс r В, входящих в различных сочетаниях в стафилококковую хромосомную кассету (рис. 1 ). Комлекс тес может включать: тесА - структурный ген, детерминирующий синтез ПСБ-2 ¢ ; mec I - регуляторный ген, влияющий на транскрипцию тесА; mecR 1 - ген, передающий внутрь клетки сигнал о наличии в среде b -лактамного антибиотика; а также инсерционные последовательности IS 431 и IS 1272. В настоящее время известны 4 варианта комплекса тес (рис. 2 ).
Кроме того, различия между типами кассет тес обусловлены присутствием ряда дополнительных генов, расположенных в генетических областях J 1а, J 1 b .

Генетическая структура комплексов тес различных классов
• Класс A, IS431 - mecA- mecR1- mec1
• Класс В , IS431 - mecA- D mec R1-IS1272
• Класс С , IS431 - mecA- D mec R1-IS431
• Класс D , IS 431 - mec A - D mec R 1
Рис. 2. тесА - структурный ген, детерминирующий синтез ПСБ-2 ¢ ;
mecI - регуляторный ген, влияющий на транскрипцию тесА;
mecR 1 - ген, передающий внутрь клетки сигнал о наличии в среде b -лактамного антибиотика; IS431 и IS 1272 - инсерционные последовательности
Уникальность метициллинрезистентности заключается также и в существовании феномена гетерорезистентности, суть которого состоит в том, что в условиях инкубации при 37 °С не все клетки популяции проявляют устойчивость к оксациллину. Генетический контроль феномена гетерорезистентности до настоящего времени полностью не выяснен. Известно только, что на экспрессию устойчивости могут влиять регуляторные гены b -лактамазы, а также ряд дополнительных генов, так называемые fem ( factors essential for methicillin resistance ) или aux , локализованные в различных частях хромосомы S . aureus , вне SCCmec . Сложность регуляции проявляется в фенотипических различиях. Выделяют 4 стабильных фенотипа (класса) резистентности. Первые три класса являются гетерогенными. Это означает, что в популяциях стафилококков, относящихся к этим классам, присутствуют субпопуляции микробных клеток с разным уровнем резистентности. При этом клоны стафилококков, получаемые из изолированных колоний (образовавшихся при рассеве первичной культуры) по популяционному составу полностью совпадают с исходной культурой.
Класс 1. Рост 99,99 % клеток подавляется оксациллином в концентрации 1,5 - 2 мкг/мл, рост 0,01 % микробов подавляется только при 25,0 мкг/мл.
Класс 2. Рост 99,9 % клеток подавляется при концентрации оксациллина 6,0 - 12,0 мкг/мл, тогда как рост 0,1 % микробов подавляется при концентрации > 25,0 мкг/мл.
Класс 3. Рост 99,0 - 99,9 % клеток подавляется при концентрации 50,0 - 200,0 мкг/мл и только рост 0,1 - 1 % микробной популяции подавляется при концентрации оксациллина 400,0 мкг/мл.
Класс 4. Представители этого класса характеризуются гомогенным уровнем устойчивости, который превышает 400,0 мкг/мл для всей популяции.
В связи с наличием гетерогенности по устойчивости к оксациллину могут возникать трудности при идентификации MRSA традиционными микробиологическими методами.
4.5. Особенности эпидемиологии MRSA
Будучи однажды занесенными в стационар, MRS А могут выживать там в течение длительного времени. Это определяет стратегию противоэпидемических мероприятий: очень важно не допустить занос и распространение в стационаре эпидемических штаммов.
Следует отметить, что периодически происходит смена эпидемического штамма, доминирующего на отдельных территориях. Так, по данным стафилококковой референс-лаборатории в Colindale ( London ), в 1996 г. штаммы EMRSA -15 и EMRSA -16 были ответственны за более чем 1500 инцидентов, охвативших трех и более пациентов, в 309 больницах Англии, тогда как остальные эпидемические штаммы были ответственны только за 361 инцидент в 93 больницах. Распространение этих эпидемических штаммов привело к росту смертности от MRSA в 15, а частоты бактериемии в 24 раза за период с 1993 по 2002 г.г. согласно данным национального департамента статистики Великобритании.
Продолжает нарастать спектр антибиоткорезистентности эпидемических штаммов MRSA . Они гораздо быстрее, чем метициллинчувствительные, приобретают устойчивость к препаратам из группы фторхинолонов. Характерной чертой многих эпидемических штаммов MRSA является устойчивость практически ко всем известным классам антимикробных препаратов, за исключением гликопептидов и оксазолидинонов. В последние годы участились случаи выделения изолятов MRSA , обладающих умеренной чувствительностью к ванкомицину и даже ванкомицинрезистентных. Распространение таких штаммов в стационарах России может иметь драматические последствия.
С проблемой госпитальных штаммов MRSA тесно переплетается и проблема MRSA вне госпитального происхождения. Эти штаммы пока не обладают множественной резистентностью к антибиотикам, генетически отличаются от госпитальных штаммов, их происхождение остается неизвестным. Предполагается, что они сформировались из спорадических госпитальных штаммов. Внегоспитальные штаммы MRSA способны вызывать некротизирующую форму пневмонии, характеризующуюся крайне тяжелым течением и требующей госпитализации пациента, в связи с чем возникает угроза заноса и распространения таких штаммов в стационарах.
Основные эпидемические штаммы и клоны MRSA
Международные клоны, идентифицированные в LMMRU ** (г. Нью-Йорк)
Читайте также:


