Исследование свиней на листериоз
Листериоз — зоонозная болезнь животных и человека, характеризующаяся поражением центральной нервной системы, септическими явлениями, абортами, маститами или протекающая в форме бессимптомного носительства. Экономический ущерб определяется высокой летальностью, снижением продуктивности животных, затратами на лечебно-профилактические и карантинно-ограничительные мероприятия. Возбудитель - Listeria monocytogenes.
Этиология. Возбудитель листериоза — Listeria monocytogenes. Он вызывает аборты у коров, овец, коз и может поражать человека. Морфологически листерии — небольшие грамоположительные палочковидные бактерии с закругленными концами, спор и капсул не образуют.
Листерии длительно сохраняются во внешней среде, способны размножаться при низкой температуре, особенно в силосе. До 4 мес сохраняются в животноводческих помещениях, в сене, концентратах. При хранении в холодильнике при температуре 4 °С может происходить накопление листерии в продуктах питания (молоке, мясе, сыре). В прудовой воде при температуре 37 "С листерии сохраняются до 1 года. Возбудитель данной инфекции погибает под действием 5%-ного раствора лизола или креолина в течение 10 минут, а нагревание до 100 0 С убивает бактерии через 5 мин.
Эпизоотология. Листериоз представляет опасность для многих видов домашних и диких животных. Восприимчивы к листериозу овцы, козы, крупный рогатый скот, свиньи, лошади, кролики, куры, гуси, утки, индейки. Носителями листерии могут быть иксодовых клещи, личинки оводов, блох, вшей, а также рыб, раков и лягушек.
К этой инфекции восприимчив человек. Заболевание возникают чаще всего у лиц пожилого возраста, новорожденных, лиц с иммунодефицитами.
Источник возбудителя инфекции при листериозе — животные, выделяющие листерии во внешнюю среду с истечением из носовой полости, из половых органов (при абортах), абортированным плодом, с калом, мочой, молоком. В естественных условиях заражение происходит через слизистую оболочку носовой и ротовой полостей, конъюнктиву, пищеварительный тракт, а также через поврежденную кожу.
Основной резервуар возбудителя в природе — грызуны, служащие причиной заражения листериозом сельскохозяйственных животных, чаще через воду, корма, загрязненные выделениями больных. В циркуляции возбудителя листериоза между дикими животными определенную роль играют иксодовые клещи, в организме которых листерии сохраняются до 42
Патогенез. Попавшие в организм листерии размножаются и распространяются по организму нейрогенными, лифмогенными и гематогенными путями. Листерии размножаются в месте первоначального внедрения, захватываются фагоцитирующими клетками, проникают в кровоток и распространяются по организму. Неблагоприятное воздействие на микроорганизм оказывают вырабатываемые листериями токсины. Возбудитель попадает в различные органы, в том числе в головной мозг.
Клиника. Инкубационный период при листериозе у животных от 7 до 30 дней. Клиническое проявление болезни зависит от способа заражения, состояния резистентности организма и степени вирулентности возбудителя. Течение болезни острое, подострое, хроническое. Листериоз проявляется в нескольких клинических формах: нервной, септической, смешанной, стертой — бессимптомной (носительство); поражением половой системы (аборты, задержание последа, эндометриты и метриты) и вымени (маститы).
У крупного рогатого скота и овец чаще поражается центральная нервная система. Заболевание начинается угнетением, вялостью, снижением аппетита. Из носовой полости наблюдается серозно-слизистое истечение, изо рта обильно выделяется слюна. Через 3-7 дней отмечают некоординированные движения, судороги, приступы буйства, парезы отдельных групп мышц, потерю зрения, конъюнктивит, стоматит.
Другая форма болезни, характеризующаяся поражением половой системы, проявляется абортами, задержанием последа и воспалительными явлениями в матке.
Диагностика. Диагноз данной болезни устанавливают на основании комплекса эпизоотологических, паталогоанатомических данных, а также результатов лабораторного исследования в соответствии с методическими указаниями по лабораторной диагностике листериоза.
Бактериологическая диагностика включает микроскопию исходного материала, посевы на питательные среды, идентификацию выделенных культур по культурально-биохимическим, тинкториальным и серологическим свойствам, а также постановку биологической пробы на лабораторных животных. Решающее значение принадлежит выделению культуры.
Лечение. Листерии - внутриклеточные паразиты, поэтому болезнь трудно поддается лечению. Лечение проводят с учетом стадии болезни и ее течения. Наиболее эффективны при листериозе антибиотики тетрациклинового ряда. Одновременно проводят симптоматическое лечение — назначают дезинфицирующие, вяжущие средства.
Профилактика. Многообразие источников инфекции и наличие широких возможностей инфицирования населения определяют необходимость осуществления общего комплекса ветеринарно-санитарных и санитарно-гигиенических мероприятий в населённых пунктах, на различных объектах, связанных с животноводством, хранением и переработкой сырья и мясных продуктов. Также необходимы дератизационные мероприятия, защита водоисточников и предприятий общественного питания от грызунов. В хозяйствах (животноводческих комплексах, фермах, отделениях, стадах), неблагополучных по листериозу, проводят поголовный осмотр животных и отбраковку животных, изоляцию и лечение. Полученное от больных животных молоко кипятят, кожевенно-меховое сырье обеззараживают.

С 2009 по 2015 гг. в хозяйствах Алматинской области РК проводили исследования по обнаружению возбудителя листериоза у 1 % животных. Ежегодно в стационарно неблагополучных хозяйствах области проводили бактериологические исследования биоматериала от больных и патматериала от павших животных по обнаружению возбудителя листериоза. Диагностические исследования проводились с использованием бактериологических, биохимических, серологических и генетических методов, постановкой биопробы.
Листериоз – инфекционная болезнь человека и многих видов животных, которая чаще всего встречается у овец и свиней, реже у крупного рогатого скота и коз, промысловых животных, пушных зверей, кроликов, домашних и диких птиц, лошадей, лисиц, хорьков, кур. Листериоз протекает либо в септической форме (кролики, морские свинки, мыши, поросята), либо с явлениями нервного синдрома и значительным расстройством центральной нервной системы (свиньи, крупный рогатый скот, овцы, лисы). Листериоз может сопровождаться абортами у крупного рогатого скота, овец и коз. Листериозу свойственны природная очаговость и стационарность.
В естественных условиях листериозом поражаются все виды домашних и диких животных. Основным резервуаром возбудителя в природе являются некоторые виды диких животных, но особенно грызуны. Листерии длительное время могут не только сохраняться во внешней среде – почве, навозе, воде, на растениях, но и размножаться, даже при низких (+ 4 °С) температурах. Некачественный силос является благоприятной средой для размножения листерий, особенно в его поверхностных слоях. Загрязненные листериями водоемы опасны в эпизоотологическом и эпидемиологическом отношении. Человек листериозом заражается в результате контакта с инфицированными грызунами, либо с сельскохозяйственными животными, особенно со свиньями, через поврежденную кожу; через пищеварительный тракт – при употреблении в пищу не подвергавшихся термической обработке ранних овощей, собранных с участков, где использованы для полива необеззараженные сточные воды и навоз. В результате инфицирования поражается нервная система и головной мозг человека. Внедрение листерий в организм человека может привести к развитию сепсиса, поражению отдельных органов и систем, а также к бессимптомному заболеванию. У женщин при поражении листериозом отмечаются аборты листериозной этиологии. Заболевание человека возможно также после употребления инфицированной пищи, в частности молока и мяса больных животных. Распространение листерий в организме происходит нейрогенным, лимфогенным, гематогенными путями. Листерии, распространяясь различными путями, преодолевая защитный барьер, проникают в головной мозг. У человека листериоз протекает в форме моноцитарной ангины и листериозного менингита, который во многих случаях заканчивается смертельно. Поражается центральная нервная система, отмечаются приступы судорог, возбуждение. Температура тела в начальный период заболевания повышена, а затем снижается. При листериозе у различных видов животных, а также у человека отмечается значительное повышение числа моноцитов в крови (отсюда и название Listeria monocytogenes). Гистологическое исследование мозга указывает на моноцитарную инфильтрацию.
В хозяйствах Алматинской области листериоз сельскохозяйственных животных встречается. По нашим данным, в стационарно неблагополучных хозяйствах, имеющих крупный и мелкий рогатый скот, листериоз обнаруживается у 10–30 % исследованных животных. В Казахском научно-исследовательском ветеринарном институте из 10 проб, предоставленных из хозяйств Алматинской области РК в 2009 год выделен возбудитель листериоза в двух случаях (от 7 месячного теленка, 2-летней коровы), в 2011 году – в двух случаях (от 3-летней коровы, годовалой овцы); в 2014 году – в трех случаях (от 6 месячного теленка, овцы, 8 месячного ягненка); а в 2015 году – в двух случаях (от коровы и быка-производителя).
Диагноз на листериоз ставят на основании комплекса эпизоотологических данных и результатов лабораторного исследования. Решающее значение принадлежит бактериологическому исследованию – выделению культуры листерий. Бактериологическая диагностика включает микроскопическое исследование исходного материала, посевы на питательные среды, идентификацию выделенных культур по культурально-морфологическим, биохимическим, молекулярно-биологическим и серологическим свойствам, а также постановку биологической пробы на лабораторных животных.
Материалы и методы исследования
Для бактериологического исследования на листериоз отбирается: головной мозг, доля печени, почка.
В патологическом материале с подозрением на листериоз – в паренхиматозных органах павших животных характерные патологоанатоми- ческие изменения: изменен цвет паренхимы печени, мягкой консистенции, бывает разложившаяся; селезенка кровенаполнена, темного цвета; паренхима почки мягкой консистенции, цвет изменен. Предоставленные патматериалы были отобраны от трупов животных. Заболевание протекало в острой форме и закончилось гибелью животных.
Бактериологические исследования проводили путем посева суспензии из головного мозга и паренхиматозных органов на физиологическом растворе в соотношении 1:5 на питательные среды МПБ (мясо-пептонный бульон), МПА (мясо-пептонный агар). При приготовлении сред для лучшего роста листерий добавляли 3 % сыворотки крови КРС, 3 % глюкозы и 2 % глицерина. Посевы культур выращивали в термостате при 25 °С. Из головного мозга и печени готовили мазки-отпечатки. Мазки из суточных колоний листерий и мазки-отпечатки окрашивали по Граму.
Биохимические свойства выделенной культуры листерий, каталазную и лецининазную активность определяли общепринятыми методами, биопробу ставили на белых мышах и морских свинках. Для окончательной идентификации выделенных культур, выполняли генетические исследования по секвенированию 16S rRNA гена бактерии.
Предназначенные для идентификации 24 – часовые бульонные культуры, выращенные при 25 °С, бактериологической петлей засевали частым штрихом на 2 пробирки МПА, так, чтобы получить рост по всей поверхности агара, выращивали при комнатной температуре 24 – 30 часов. Затем агаровую культуру смывали небольшим количеством физраствора, чтобы получить густую взвесь (1–1,5 млрд м.к. (микробных клеток) в 1 мл) для постановки РА – реакция агглютинации, пластинчатая реакция для серологической диагностики листериоза.
Для серологической идентификации выделенной культуры листерий использовали поливалентную листериозную агглютинирующую сыворотку, которая представляет собой смесь кроличьих листериозных агглю- тинирующих сывороток и содержит антитела Н-АВ и О-II, V, VI, VII, IX. Для проведения РА на чистое обезжиренное предметное стекло наносили две капли: каплю поливалентной сыворотки и каплю физиологического раствора (физраствора). К обеим каплям на стекле добавляли по одной капле смыва суточной культуры, смесь тщательно перемешивали бактериологической петлей, после чего стекла плавно покачивали круговыми движениями. Одновременно для контроля исследовали на стекле каплю сыворотки с добавлением капли физраствора.
Результаты исследования и их обсуждение
Через 24 ч культивирования посевов в термостате при 25 °С в МПБ наблюдалось легкое равномерное помутнение бульона, на МПА выросли колонии мелкие, росинчатые, блестящие, вязкой консистенции, в проходящем свете наблюдали нежный рост колоний – мелкие выпуклые беловатые колоний как беловатый налет на агаре.
Для выделения листерий из патматериала использовали МПБ, МПА с добавками. Через 24 ч при появлении сплошного роста колоний бактериоло- гической петлей производили пересев на селективную диагностическую среду Palkam. Через 24 часа инкубирования на селективной среде Pаlcam отмечался обильный рост мелких, серовато-зелёных или оливково-зелёных колоний с чёрным ореолом, диаметром 0,5–1,0 мм. Через 48 часов колонии диаметром 1,0–2,0 мм приобретали зеленую окраску с углубленными центрами, окруженными чёрным ореолом. При появлении сплошного роста колоний листерий производили пересев бактериологической петлей из зон наибольшего почернения среды штрихами на 2–3 чашки Петри с селективной дифференциально-диагностической средой для получения изолированных колоний. Бактериальную массу из выросших изолированных колоний использовали для окрашивания по Граму, проведения молекулярно-генетических исследований.
В окрашенных по Граму препаратах бактерии рода листерия установлены в виде коротких палочек, располагающихся одиночно и попарно. Возбудитель листериоза представляет собой грамположительные с закругленными концами палочки, которые могут быть полиморфными. Характерной особенностью листерий является то, что некоторые 2 бактерий располагаются по отношению друг к другу в виде римской цифры V или летящей чайки (важный дифференцирующий признак). Суточная культура листерий, выделенная от теленка, представлена на рис. 1.

Рис. 1. Культура листерий в мазке, окрашенном по Граму
На рис. 1 видны мелкие грамположительные палочки с закругленными концами, которые являются полиморфными, располагаются по одиночке, попарно или группой клеток. Видны бактерий листерий, располагающихся в виде римской цифры V и летящей чайки.
Дальнейшую идентификацию возбудителя листериоза проводили путем определения подвижности методом висячей капли 12-часовой бульонной культуры, выращенной при комнатной температуре. Для установления подвижности листерий культуры выращивали на ПЖА при комнатной температуре, так как при культивировании при 37 °С термолабильные жгутики у листерий разрушаются и подвижность их прекращается. На ПЖА отмечался характерный рост по линии укола в виде зонтика, в культуре листерий были подвижны.
При хранении патологического материала в холодильнике при + 4 °С происходит размножение и накопление листерий. Поэтому в качестве дополнительного диагностического метода использовали исследуемый материал в течение 30 дней для проведения повторных исследований через каждые 10 дней путем посева на МПБ и МПА. В трех повторностях посевов изолята выросли культуры листерий с характерными культурально-морфологическими признаками.
Изучением биохимических свойств установлено, что при посеве суточных культур на среды Гисса листерии ферментировали с образованием кислоты без газа глюкозу, рамнозу, салицин, левулезу, несколько медленнее -сахарозу, растворимый крахмал и глицерин; не ферментировали арабинозу, дульцит, инулин, сорбит; не образовывали индола и сероводорода, не разжижали желатин, не восстанавливали нитраты в нитриты. Определение каталазной активности листерий: к 1 мл суточной бульонной культуры и агаровой культуре добавляли 1 мл свежеприготовленной 5 %-ной перекиси водорода. Вследствие присутствия фермента каталазы у выращиваемой культуры перекись водорода разлагается с образованием кислорода (пузырьков газа). В наших опытах в пробирочной и пластинчатой реакциях агглютинации наблюдалось газообразование (бурлило), поэтому выделенная культура предварительно идентифицирована как Listeria.
Видовую идентификацию проводили методом определения лецитиназной активности листерий. К среде ГРМ № 1, содержащей 5 % вытяжки желтка куриного яйца в 50 % содержании питательного агара, добавляли порошкообразный активированный уголь до концентрации 0,5 %. Для определения лецитиназной активности исследуемую культуру и контрольный штамм листерий пересевали штрихами в 2 чашки среды ГРМ № 1 (без активированного угля) и 2 чашки с добавлением активированного угля. Инкубировали 48 ч при температуре 25 °С, после чего чашки просматривали в проходящем свете и определяли наличие активности в присутствии активированного угля. Эталонный штамм Listeria ivanovii давала плотную зону помутнения независимо от присутствия активированного угля, Listeria monocytogenes образовывала аналогичную зону помутнения в присутствии активированного угля и не образовывала в отсутствие угля. Это биохимическое свойство отличает Listeria monocytogenes от других видов рода Listeria.
Способом усовершенствования идентификации и таксономической классификации бактериальных разновидностей является получение нуклеотидной последовательности 16S rRNA гена путем секвенирования ДНК бактерий. Данный метод позволит провести генетическую идентификацию рода Listeria путем генотипирования.
Методом ПЦР был амплифицирован фрагмент ДНК протяженностью около 1100 п.н.. ПЦР была выполнена универсальными праймерами 16SrRNA-190F 5’– ATTAGCTAGTAGGTGGGGTAA-3 и 16SrRNA-1100R- 5’ TTACTAGCGATTCCGACTTCA в общем объеме 25 мкл. ПЦР смесь содержала 15 нг ДНК, 2.5х смеси, 5 пмоль каждого праймера и деионизированную воду 10 мкл. Программа амплификации ПЦР включала начальную денатурацию 94 °С в течение 3 минут; 27 циклов: 94 °С – 30 секунд, 60 °С – 30 секунд, 72 °С – 30 секунд; заключительную элонгацию 7 минут при 72 °С. ПЦР программа была выполнена с применением амплификатора Mastercycler Gradient, (Eppendorf).
Перед проведением реакции секвенирования для полученных фрагментов ДНК применяли ферментативный метод очистки. При ферментативном методе ПЦР продукты очищали от остатков олигонуклеотидов методом дефосфорилирования с помощью щелочной фосфатазы (SAP – Shrimp Alkaline Phosphatase, SibEnzyme) и эндонуклеазы Exonuclease I (Fermentas).
После ферментативной очистки ПЦР продукты были использованы для выполнения реакции секвенирования, очистки и разделения на автоматическом генетическом анализаторе ABI 3500.
Нуклеотидные последовательности 16S rRNA гена идентифицируемого штамма Listeria monocytogenes от 6 месячного теленка были проанализированы в программном обеспечении SeqScape 2.6.0 (Applide Biosystems).
С учетом полученных результатов, были проведены дальнейшие исследования по проверке чистоты представленного штамма, которые были осуществлены на основе анализа ферограммы нуклеотидной последовательности 16S rRNA гена. Было установлено, что у анализируемого штамма отсутствует смешение сигналов, что свидетельствует об отсутствии в предоставленной культуре посторонних видов бактерий. На рис. 2 в представлена ферограмма фрагмента нуклеотидной последовательности анализируемого гена Listeria monocytogenes.
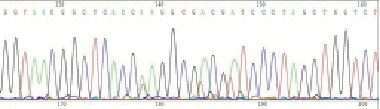
Рис. 2. Ферограмма фрагмента нуклеотидной последовательности гена 16S r RNA
Из рис. 2 видно, что проведенный анализ позволяет сделать выводы об отсутствии перекрестной контаминации культуры Listeria monocytogenes посторонними бактериями.
Последовательности нуклеотидов, полученные с применением прямого и обратного праймеров были объединены в общую последовательность, используя программное обеспечение SeqMan. Последовательности праймеров и плохо разделенные концевые участки были удалены из анализа. В результате проведенного анализа была получена нуклеотидная последовательность протяженностью около 700 п.н. Полученная нуклеотидная последовательность была проанализирована с применением базы данных NCBI утилиты BLAST. Нуклеотидная последовательность и результаты идентификации представлены в таблице и на рис. 3.
Результат идентификации гена 16S rRNA Listeria monocytogenes
Последовательность фрагмента 16S r RNA гена
Идентификация нуклеотидных последовательностей в международной базе данных (http://www.ncbi.nlm.nih.gov/) алгоритм BLAST
Инвентар-ный номер GeneBank (Accesion number) или коллекционный номер штамма
TAAAGAGAGTTTGATCCTGGCTCAGGACGAACGCTGGCGGCGTGCCTAATACATGCAAGTCGAACGAACGGAGGAAGAGCTTGCTCTTCCAAAGTTAGTGGCGGACGGGTGAGTAACACGTGGGCAACCTGCCTGTAAGTTGGGGATAACTCCGGGAAACCGGGGCTAATACCGAATGATAAAGTGTGGCGCATGCCACGCTTTTGAAAGATGGTTTCGCTATCGCTTACAGATGGGCCCGCGGTGCATTAGCTAGTTGGTAGGGTAATGGCCTACCAAGGCAACGATGCATAGCCGACCTGAGAGGGTGATCGGCCACACTGGGACTGAGACACGGCCCAGACTCCTACGGGAGGCAGCAGTAGGGAATCTTCCGCAATGGACGAAAGTCTGACGGAGCAACGCCGCGTGTATGAAGAAGGTTTTCGGATCGTAAAGTACTGTTGTTAGAGAAGAACAAGGATAAGAGTAACTGCTNGTCCCTTGACGGTATCTAACCAGAAAGCCACGGCTAACTACGTGCCAGCAGCCGCGGTAATACGTAGGTGGCNAGCGTNGTCCGGATGGATTGGGCGTNAAGCGCGCGCAGGCGGTCTTTTAAGTCTNATGTGAAAGCCCCCGGCTGAACCGGGNNGGGTCATTGGAAACTGGAAGACTNGAGTGCNGAAGAGGAGAGTGGAATTCCACGTGTAGCGGTGAAATGCGTAGATATGTGGAGGAACACCAGTGGCGAAGGCGACTCTCTGGTCTGTNACTGACG CTGAGGCGCG AAAGCGTGGG
Listeria monocytogenes 07PF0776 strain 07PF0776
Listeria monocytogenes strain NCTC 10357
Listeria innocua strain ATCC 33090
Из таблицы следует, что данные Международного банка GeneBank [6] показывают высокую степень однородности нуклеотидной последовательности 16S rRNA изучаемого штамма с разновидностями рода Listeria (99 %).
Как видно из рис. 3, анализируемый штамм находится на одной филогенетической ветви с разновидностями рода Listeria.
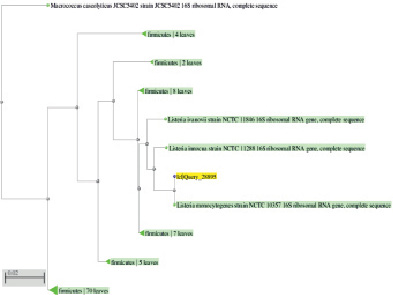
Рис. 3. Филогенетическое древо, построенное на основании фрагмента гена 16S rRNA
Определение патогенности листерий. Биопробу ставили на 3 белых мышах массой 16-18 г, которым подкожно вводили по 0,2 мл суточной бульонной культуры Listeria monocytogenes. На 3 сутки опытные животные пали. При бактериологическом исследовании патматериала от павших белых мышей чистая культура листерий высевалась из печени, сердца.
На 2 морских свинках ставили конъюнктивальную пробу введением в конъюнктивальный мешок по 0,05 мл суточной бульонной культуры Listeria monocytogenes. У морских свинок на 3 сутки развился кератоконъюнктивит и светобоязнь.
В результате проведенных исследований установлено, что эпизоотическая культура Listeria monocytogenes, полученая из патматериала от теленка, коровы, быка-производителя, обладала типичными культурально-морфологическими, биохимическими и антигенными свойствами и по результатам серологических исследований отнесена к 1-му серотипу. По биологическим свойствам эпизоотический изолят был идентичен эталонному музейному штамму. Методом генотипирования была установлена однородность нуклеотидной последовательности 16S rRNA изучаемого штамма с разновидностями рода Listeria (совпадение 99 %).
Таким образом, диагноз на листериоз был поставлен на основании клинико-эпизоотологических данных, характерных культуральных и морфологических свойств, тинкториальных свойств, биохимических свойств (отношение к белкам, углеводам, каталазной, лецитиназной активности и т.д.), молекулярно – генетических свойств (проведения генотипирования методом ПЦР), положительной реакции агглютинации с поливалентной и типовой листериозными сыворотками и отсутствием агглютинации в контроле с физраствором, а также в результате изучения биологических свойств с постановкой биопробы на лабораторных животных.
Во время изолированного содержания, при формировании новых групп в хозяйствующих субъектах или населенных пунктах необходимо проводить клиническое обследование животных и при необходимости (при выявлении признаков поражения нервной системы, абортов, повышенной температуры тела) бактериологические и серологические исследования на листериоз. Систематически проводить уничтожение грызунов, кровососущих насекомых и клещей. Вести строгий учет случаев абортов, мертворождения и падежа животных и направлять патологический материал на исследование в ветеринарную лабораторию.
1.1. Листериоз - инфекционная болезнь сельскохозяйственных и диких животных, которая чаще всего встречается у овец, реже у свиней, крупного рогатого скота и коз, промысловых животных, пушных зверей, кроликов, домашних и диких птиц. Листериозом болеют и люди.
1.2. Возбудитель болезни - Listeria monocytogenes - подвижная неспорообразующая полиморфная грамположительная палочка.
Источник возбудителя листериоза - больные и переболевшие животные, которые выделяют возбудитель во внешнюю среду с мочой, калом, молоком, истечениями из носовой полости, глаз, половых органов, а также животные - листерионосители, играющие определенную роль в поддержании стационарных очагов болезни (дикие мелкие млекопитающие и птицы, а также переносчики - кровососущие членистоногие, особенно пастбищные клещи). Установлено (по данным зарубежных авторов) листерионосительство у человека.
1.3. Листерионосительство длится у переболевших овец и свиней не менее 30 дней, у некоторых видов грызунов - до 260 дней, а в иксодовых клещах листерии могут сохраняться свыше 500 дней; при листериозных маститах возбудитель выделяется с молоком у овец до 90 дней, коров - до 300 дней.
1.4. Основным резервуаром возбудителя в природе являются некоторые виды диких животных и особенно грызуны. Листерии длительное время могут не только сохраняться во внешней среде - почве, навозе, воде, на растениях, но и размножаться, даже при низких (+4 °C) температурах. Некачественный силос (pH свыше 5,5) является благоприятной средой для размножения листерии, особенно в его поверхностных слоях. Загрязненные листериями водоемы опасны в эпизоотологическом и эпидемиологическом отношении.
Листерии инактивируются при действии солнечных лучей в течение 2 - 15 суток; 2,5-процентного раствора формалина или едкого натра - через 20 минут; раствора хлорной извести (100 мг активного хлора в 1 л) - через 1 час; температуры 100 °C - в течение 5 - 10 минут.
Листериозу свойственны природная очаговость и стационарность. У овец болезнь наблюдается в зимне-весенний период. У других видов животных четко выраженной сезонности не отмечают.
1.5. В естественных условиях заражение листериозом происходит через пищеварительный тракт, дыхательные пути, а также поврежденную кожу и слизистые оболочки половых органов.
Животные заражаются через воду и корма, загрязненные листериями, от грызунов, а также больных и переболевших животных.
Заражение человека происходит в результате употребления продуктов (молоко, мясо) от больных животных и листерионосителей, а также при употреблении в пищу не подвергавшихся термической обработке ранних овощей, собранных с участков, где использованы для полива не обеззараженные сточные воды и навоз. Особенно опасен листериоз для беременных женщин.
Возможно профессиональное заражение людей: ветеринарных специалистов, работников боен, мясокомбинатов и животноводческих ферм.
1.6. Диагноз на листериоз ставят на основании комплекса эпизоотологических данных и результатов лабораторного исследования. Решающее значение принадлежит бактериологическому исследованию - выделению культуры листерий. Серологические методы (РА, РНГА, РСК) применяются для выяснения эпизоотической ситуации в хозяйствах, где диагноз на листериоз поставлен комплексным методом с выделением культуры возбудителя.
1.7. Для исследования на листериоз в лабораторию направляют целый труп мелких животных или голову (головной мозг), печень, селезенку, почку, лимфоузлы, пораженные участки легких, абортированный плод или его оболочки. Для прижизненной диагностики - истечения из половых органов абортировавших маток, кровь или сыворотку от больных и подозрительных по заболеванию животных, молоко.
2.1. В целях профилактики листериоза необходимо:
2.1.1. Комплектовать фермы животными из благополучных по листериозу хозяйств.
2.1.2. Не допускать ввода вновь поступивших животных в общее стадо без предварительного карантинирования их в течение 30 дней, соблюдать принцип - "все свободно - все занято". Во время карантина и при формировании новых групп в животноводческих комплексах проводить клиническое обследование животных и при необходимости (выявление признаков поражения нервной системы, абортов, повышенной температуры тела) - бактериологические и серологические исследования на листериоз.
2.1.3. Систематически проводить уничтожение грызунов, кровососущих насекомых и клещей.
2.1.4. Периодически организовывать отлов грызунов в животноводческих помещениях, на прилегающей к ним территории и в хранилищах кормов. Учитывать сезонные колебания численности грызунов и систематически проводить лабораторные исследования пойманных зверьков на листериоз.
2.1.5. Постоянно контролировать качество кормов, особенно силоса и комбикорма, а при наличии показаний подвергать их бактериологическому исследованию.
2.1.6. Вести строгий учет случаев абортов, мертворождения и падежа животных и направлять патологический материал на исследование в ветлабораторию.
2.1.7. Серологически исследовать на листериоз племенных животных перед продажей их в другие хозяйства.
2.1.8. Медицинским и ветеринарным специалистам проводить санитарно-просветительную работу среди населения, работников животноводческих хозяйств, а также общесанитарную профилактическую работу среди лиц, занятых заготовкой, сбором, хранением, транспортировкой, переработкой и реализацией сырья животного происхождения.
3.1. При выявлении в хозяйстве (в животноводческом комплексе, на ферме, в отделении, стаде, свинарнике, индивидуальном дворе и т.д.) больных листериозом животных ветеринарный специалист, обслуживающий хозяйство, немедленно сообщает об этом руководителю хозяйства, главному ветеринарному врачу района и районной санитарно-эпидемиологической станции; одновременно проводит тщательное эпизоотологическое обследование (выясняет пути заноса, источник возбудителя инфекции) и организует мероприятия по ликвидации болезни.
3.2. Хозяйства (отдельные корпуса животноводческих комплексов, фермы, отделения, свинарники, птичники, индивидуальные дворы и т.д.), в которых выявлено заболевание животных листериозом, в установленном порядке объявляют неблагополучными по листериозу.
3.3. Главный ветеринарный врач района берет такие хозяйства на учет, совместно с их руководителями и специалистами разрабатывает план оздоровительных мероприятий и осуществляет контроль за их выполнением по ликвидации заболевания животных листериозом в хозяйстве.
3.4. План оздоровления неблагополучного по листериозу хозяйства, разработанный ветслужбой района, согласовывают с санитарно-эпидемиологической станцией и вносят на утверждение в исполком районного (городского) Совета народных депутатов. В плане предусматривают регулярные диагностические исследования животных, соответствующие ветеринарно-санитарные и организационно-хозяйственные мероприятия, предусмотренные настоящей Инструкцией, с указанием сроков их осуществления и лиц, ответственных за их выполнение.
Ветеринарные и медицинские специалисты организуют мероприятия, предотвращающие заражение листериозом работников животноводческих хозяйств, обратив особое внимание на персонал родильных отделений, боен и мясокомбинатов, а также лабораторных работников.
3.5. В хозяйствах, неблагополучных по листериозу, вводят ограничения, на основании которых запрещается:
3.5.1. Вывод из хозяйства (фермы) животных, за исключением вывоза животных для убоя.
3.5.2. Вывоз мяса от вынужденно убитых больных листериозом животных в сыром виде, за исключением его вывоза для переработки на мясокомбинаты. Мясо от таких животных в хозяйствах и на мясокомбинатах подвергают ветеринарно-санитарной оценке согласно п. 3.1.11 "Правил ветеринарного осмотра убойных животных и ветеринарно-санитарной экспертизы мяса и мясных продуктов".
3.5.3. Вывоз кормов, имевших контакт с больными животными или подозрительных в инфицировании листериями.
3.5.4. Патологически измененные внутренние органы, кишки, кровь, а также головы от больных листериозом животных во всех случаях направляют на техническую утилизацию с обработкой при температуре не менее 100° или их проваривают при той же температуре в течение часа.
3.6. В хозяйствах (животноводческих комплексах, фермах, отделениях, стадах), неблагополучных по листериозу, проводят:
3.6.1. Поголовный клинический осмотр животных с выборочным измерением температуры тела; больных животных, имеющих признаки поражения центральной нервной системы, направляют на убой. Подозрительных по заболеванию животных изолируют и подвергают лечению хлортетрациклином, окситетрациклином, тетрациклином или ампициллином согласно "Методическим указаниям по применению антибиотиков в ветеринарии". За остальными животными устанавливают постоянное ветеринарное наблюдение. Их иммунизируют или с профилактической целью им вводят вышеупомянутые антибиотики. Проводят замену кормов, а при возможности подвергают корма соответствующей термической (проварка, запаривание) или биотермической обработке согласно п. 3.10.
3.6.2. Для выявления животных-листерионосителей и бессимптомно больных серологически исследуют сыворотку крови. Животных с положительной реакцией изолируют и подвергают лечению антибиотиками или направляют на убой.
3.7. В неблагополучных хозяйствах в период ограничений молоко, полученное от животных, больных листериозом, кипятят в течение 15 минут или перерабатывают на топленое масло.
3.8. В стадах, неблагополучных по листериозу, животных осеменяют искусственно спермой от здоровых производителей, которых исследуют серологически на листериоз.
3.9. Дезинфекцию, дезинсекцию и дератизацию на животноводческих фермах, неблагополучных по листериозу, а также обеззараживание навоза проводят согласно действующей "Инструкции по проведению ветеринарной дезинфекции, дезинвазии, дезинсекции и дератизации".
3.10. Скирды, стога сена, соломы, силос, комбикорма, находящиеся на неблагополучных по листериозу участках, тщательно проверяют на заселение грызунами, при обнаружении последних проводят дератизацию. Комбикорма, сено и солому из скирд и стогов, заселенных большим количеством грызунов, подвергают термической обработке при 100 °C в течение 30 минут. Пробы силоса для выявления обсеменения его листериями направляют на бакисследование.
В случаях инфицирования силосной массы, хранящейся в траншеях или в буртах, возбудителем листериоза вся испорченная силосная масса подлежит обеззараживанию биотермическим способом в порядке, предусмотренным пунктами 110 - 113 "Инструкции по проведению ветеринарной дезинфекции, дезинвазии, дезинсекции и дератизации" от 08.12.68 в отношении инфицированного навоза. Для этого поверхностный испорченный слой силоса следует снять вплоть до слоя силоса хорошего качества (pH 4,1 - 4,2), находящегося в траншее (бурте), и перевезти на специально подготовленную площадку, на которой силосную массу укладывают в штабель шириной до 1,2 м, высотой до 1 м, увлажнив его водой из расчета 20 - 30 литров на 1 куб. м. Штабель силосной массы, уложенный для биотермического обеззараживания, выдерживают не менее 1 месяца.
3.11. Полученное от больных листериозом животных кожевенно-меховое сырье обеззараживают согласно п. п. 2.18.9 и 2.22 "Инструкции по дезинфекции сырья животного происхождения и предприятий по его заготовке, хранению и обработке", утвержденной 27.12.1979.
3.12. Хозяйство (животноводческий комплекс, ферму, отделение, двор) объявляют благополучным по листериозу через два месяца после последнего случая выделения клинически больных животных и получения отрицательных результатов по РСК (РА, РНГА) при двукратном исследовании сывороток крови с интервалом 14 - 20 дней, а также проведения заключительной дезинфекции помещений и территории фермы.
3.13. Вывод овец в течение двух лет после оздоровления хозяйства (животноводческого комплекса, фермы, отделения) от листериоза допускается при условии получения отрицательных серологических результатов исследования сыворотки крови выводимых животных на листериоз. Вывод других видов животных допускается при тех же условиях в течение 1 года.
3.14. В хозяйствах, ранее неблагополучных по листериозу, необходимо проводить серологические обследования животных 1 раз в год перед постановкой на стойловое содержание. Положительно реагирующих животных изолируют, подвергают лечению или направляют на убой. При вывозе животных в ветсвидетельстве указывают результаты исследования их на листериоз.
3.15. Люди, работающие по уходу за больными животными или разделке туш таких животных, при исследовании патологического материала от больных или подозрительных по заболеванию животных листериозом, а также в лабораториях с культурами листерий, должны строго соблюдать общие меры личной профилактики.
С утверждением настоящей Инструкции утрачивает силу Инструкция о мероприятиях по борьбе с листериозом животных от 6 августа 1974 г.
Читайте также:


