Хронический синусит и стафилококк
Проблема воспалительных заболеваний околоносовых пазух на сегодняшний день крайне актуальна. Заболеваемость риносинуситом за последние 10 лет увеличилась в 2 раза, а удельный вес госпитализированных по этому поводу возрастает ежегодно

Проблема воспалительных заболеваний околоносовых пазух на сегодняшний день крайне актуальна. Заболеваемость риносинуситом за последние 10 лет увеличилась в 2 раза, а удельный вес госпитализированных по этому поводу возрастает ежегодно на 1,5–2%. Наибольшее число больных приходится на возраст от 18 до 55 лет.
В структуре синусита 56–73% приходится на долю поражения верхнечелюстной пазухи в связи с ее наибольшими размерами, высоким расположением естественного соустья и близким контактом с корнями зубов. В последнее время отмечается ежегодный прирост заболеваемости на 1,5–2%.
Известно, что верхние и нижние отделы дыхательных путей имеют тесные анатомо-физиологические связи. Следует отметить участие рецепторного аппарата слизистой оболочки полости носа в регуляции работы легких посредством ринобронхиального рефлекса.
Таким образом, проблема воспалительных заболеваний околоносовых пазух выходит далеко за рамки оториноларингологии и тесно связана с бронхолегочной патологией, аллергизацией организма и изменениями в местном и гуморальном иммунитете.
Риносинусит — воспаление слизистой оболочки носа и околоносовых пазух, практически всегда вызывающийся застоем секрета, нарушением аэрации пазух и, как следствие, инфицированием. Острые риносинуситы обычно имеют вирусную (более чем в 80% случаев возбудителем являются риновирусы) или бактериальную этиологию, хронические — бактериальную, реже грибковую.
Важным моментом в развитии синусита и особенно его хронизации являются аномалии строения внутриносовых структур и решетчатого лабиринта. Полипы, отечная слизистая оболочка, искривленная перегородка носа и другие патологические изменения нарушают проходимость естественных отверстий околоносовых пазух, приводят к стагнации секрета и снижению парциального давления кислорода в околоносовых пазухах. Дополнительное соустье верхнечелюстной пазухи также предрасполагает к развитию синусита, наличие двух и более отверстий создает условия для заброса инфицированной слизи из полости носа обратно в верхнечелюстную пазуху.
Следует подчеркнуть, что вирусное инфицирование является лишь первой фазой заболевания; в этот период продлевается время контакта патогенных бактерий с клетками и становится возможным вторичное бактериальное инфицирование.
Возбудителями инфекционного синусита могут быть как патогенные, так и условно-патогенные микроорганизмы.
Среди возбудителей синусита наиболее значимыми в настоящее время являются Streptococcus (Str.) pneumoniae, Haemophilus (H.) influenzae, реже встречается Moraxella catarrhalis.
Известно, что серьезные внутричерепные и орбитальные осложнения при остром синусите обычно являются результатом инфицирования Str. pneumoniae и H. Influenzae.
В процентном соотношении при остром синусите в 44,9% выделяется Str. pneumoniae, в 17,3% — H. influenzae, в 10,2% — анаэробы, в 7,1% — ассоциации аэробов (Str. pneumoniae и H. influenzae). Считается, что Staphylococcus (S.) aureus обусловливает наиболее тяжелые случаи госпитального (нозокомиального) синусита.
При хронических синуситах микробная флора отличается большим разнообразием: различные стрептококки — 21%, гемофильная палочка — 16%, синегнойная палочка — 15%, золотистый стафилококк и моракселла — по 10%; Prevotella — 31%, анаэробные стрептококки — 22%, Fusobacterium — 15% и др.
Антибиотики для местного воздействия. В настоящее время существует только один антибиотик для местного воздействия на слизистую оболочку — фузафунгин (Биопарокс), выпускаемый в форме дозированного аэрозоля. Благодаря очень малому размеру аэрозольных частиц фузафунгин способен проникать в околоносовые пазухи. Спектр его антимикробной активности распространяется на микроорганизмы, которые чаще всего являются возбудителями инфекций верхних дыхательных путей. Кроме того, за время его применения не отмечено появления новых резистентных к нему штаммов бактерий. Помимо антибактериальных свойств, фузафунгин обладает собственным противовоспалительным действием. Он усиливает фагоцитоз макрофагов и ингибирует образование медиаторов воспаления.
Препараты для местного воздействия особенно эффективны в лечении синусита в случаях хорошей проходимости естественных соустьев пазух. Кроме того, целесообразно использование местных препаратов после операций в полости носа и на околоносовых пазухах.
Системная антибиотикотерапия. Эмпирическая антибактериальная терапия — наиболее рациональная стратегия этиотропной терапии в период возникновения острых гнойных или обострения хронических гайморитов на начальном этапе их лечения.
Отмечаются рост устойчивости к макролидам, а также крайне высокая резистентность к ко-тримоксазолу и тетрациклинам (более 50%), очень низкая активность в отношении ранних фторхинолонов. Приведенные данные позволяют избежать ошибок при выборе конкретного препарата, например назначения сульфаниламидов, линкомицина, доксициклина, ципрофлоксацина и других антибактериальных средств, которые часто рекомендуются врачами поликлиник.
В отношении H. influenzae практически не отмечено резистентности к ингибиторозащищенным пенициллинам, цефалоспоринам II–IV поколений, фторхинолонам.
Спектр значимых возбудителей и характер резистентности в отношении антибактериальных препаратов в настоящее время таковы, что для терапии гнойных синуситов на современном этапе используют β-лактамы, фторхинолоны и макролиды.
Достаточно высокой эффективностью при лечении синуситов обладают цефалоспорины. Пероральный цефалоспорин 3-й генерации Супракс (цефиксим) хорошо зарекомендовал себя как препарат с удобным режимом дозирования (1 раз в сутки), высоким уровнем антибактериальной активности, оптимальной фармакокинетикой в ЛОР-органах, позволяющей сохранять высокие концентрации действующего вещества в слизистой околоносовых пазух. Карбоцистеин — единственный препарат среди отхаркивающих средств, обладающий одновременно мукорегулирующим и муколитическим эффектами. Препарат нормализует количественное соотношение кислых и нейтральных сиаломуцинов бронхиального секрета, что восстанавливает вязкость и эластичность слизи (эффект достигается за счет сиаловой трансферразы, вырабатываемой бокаловидными железами слизистой оболочки).
На фоне применения препарата восстанавливается секреция иммуноглобулина A, улучшается мукоцилиарный транспорт, происходит регенерация структур слизистой оболочки. Действие препарата распространяется на слизистую оболочку всех отделов дыхательного тракта.
Одновременное назначение карбоцистеина и антибиотиков потенцирует лечебную эффективность последних при воспалительных процессах в области как верхнего, так и нижнего отделов дыхательного тракта. Кроме того, карбоцистеин повышает эффективность глюкокортикостероидной терапии, усиливает бронхолитический эффект теофиллина. Активность карбоцистеина ослабляют противокашлевые и атропиноподобные средства.
Для подтверждения тезиса о возможности консервативной терапии синуситов нами проведено обследование и лечение 65 больных гайморитом (диагноз устанавливался на основании жалоб, анамнестических данных, результатов оториноларингологического осмотра, лабораторного и инструментального обследования).
Следует отметить, что данная группа была сформирована из больных, отказавшихся от пункционного метода лечения.
Распределение больных по полу было приблизительно одинаковым: 39 женщин (60%) и 26 мужчин (40%) в возрасте от 18 до 63 лет (39 ± 10,82 года), 67% больных находились в трудоспособном возрасте (20–50 лет).
У 45 (69,2%) больных данной группы диагностирован острый гайморит: у 22 — двусторонний, у 23 — односторонний процесс. У 20 (30,8%) больных отмечалось обострение хронического гайморита: у 16 — двусторонний, у 4 — односторонний процесс.
На неэффективность предшествующей амбулаторной антибиотикотерапии указывали 26 (40%) больных: 6 больных принимали азитромицин по схеме 500, 250, 250 мг в течение 3 сут, 7 больных — ко-тримоксазол (Бисептол 480) по 2 таблетки 2 раза в сутки в течение 7–9 дней, 2 пациента — ампиокс по 500 мг 4 раза в сутки в течение 5–7 дней, 3 пациента — амоксициллин/клавуланат по 375 мг 3 раза в сутки в течение 7–10 дней, 3 пациента — ципрофлоксацин по 250 мг 2 раза в сутки в течение 5 дней, 2 пациента — пефлоксацин по 400 мг 2 раза в сутки в течение 5 дней, 3 пациента — цефазолин внутримышечно по 500 мг 2 раза в сутки в течение 7–9 дней.
На неэффективность предшествующего пункционного лечения указывали 18 (28,1%) больных. У 60 (92,3%) больных после проведенного микробиологического исследования была выявлена патогенная микрофлора.
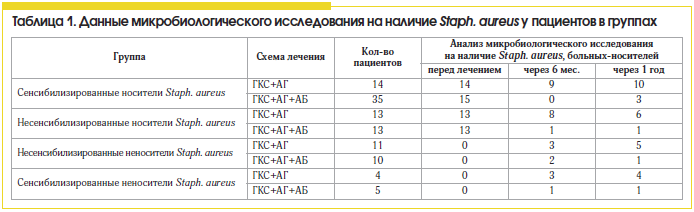
Микробные ассоциации отмечены у 20 (30,7%) больных. Максимальное число возбудителей, выделенных у одного больного, равнялось трем (табл. 1).
Рентгенологическое исследование околоносовых пазух в носолобной и носоподбородочной проекциях было проведено 24 больным, компьютерная томография — 21 больному.
При проведении сахаринового теста для оценки транспортной функции мерцательного эпителия, у подавляющего числа больных (56–86%) выявлено увеличение времени появления сладкого привкуса во рту (> 13 мин), что косвенно свидетельствует о снижении мукоциллиарного клиренса.
Пульмонологическое (до лечения) и аллергологическое (после лечения) обследования проведены 22 больным с сопутствующим аллергическим риносинуситом (в 8 случаях сочетанным с бронхиальной астмой, в 4 — с аллергией к пыльцевым аллергенам, а в 2 — с непереносимостью Аспирина и Новокаина), 9 больным с сопутствующим полипозным риносинуситом (в 4 случаях сочетанным с бронхиальной астмой и аллергией к бытовым аллергенам), а также 3 больным только с бронхиальной астмой и 5 больным с подозрением на бронхиальную астму.
Все больные получили консультацию пульмонолога. Скрытая бронхоконстрикция выявлена у 10 больных, у 5 человек были обнаружены хронический катаральный бронхит и эмфизема легких, у 4 — диффузный пневмосклероз. У 9 пациентов была диагностирована инфекционно-зависимая бронхиальная астма с атопическими реакциями, немного реже встречалась инфекционно-зависимая бронхиальная астма без атопических реакций (7 человек). Диагноз атопической бронхиальной астмы был поставлен только 4 больным. По степени тяжести бронхиальной астмы все больные были распределены следующим образом: средняя степень тяжести диагностирована у 8, легкая степень — у 9, тяжелая степень — у 3 больных. Минимальная продолжительность бронхиальной астмы составила 4 года, максимальная — 25 лет. Длительность аллергического и полипозного риносинусита колебалась от 4 до 25 лет. Десяти больным ранее по поводу бронхиальной астмы проводилось системное лечение глюкокортикостероидами. У 5 больных бронхиальная астма была выявлена впервые.
Схема эмпирической антибактериальной терапии представлена на рис. 1.
Повторное бактериологическое исследование проводилось на 10-е сутки от начала лечения, а повторная диагностика методом полимеразной цепной реакции — на 30-е сутки после лечения.
Получены следующие результаты микробиологического исследования после лечения:
- эрадикация - у 28 больных;
- предположительная эрадикация (отсутствие патологического отделяемого) - у 37;
- персистирование - не отмечено ни в одном из случаев.
При сравнении показателей риноманометрии, проведенной всем больным до начала лечения и после его окончания, у большинства — 45 (69,2%) человек — отмечено их улучшение (р Рис. 4. Динамика изменений в околоносовых пазухах по данным рентгенографии и компьютерной томографии через 30 дней от начала лечения
Повторное пульмонологическое обследование проведено всем 20 больным, страдающим бронхиальной астмой, и 10 больным с выявленной бронхоконстрикцией. Отмечены улучшение показателей функции внешнего дыхания по сравнению с исходными данными у 21 больного и отсутствие изменений у 9 (табл. 2).
Клинический пример. Больная К., 44 года (история болезни № 28385/04) поступила в клинику с жалобами на выделения гнойного характера из обеих половин носа, умеренную заложенность носа с обеих сторон, периодическую головную боль, нарастающую к вечеру, гипосмию.
Длительность заболевания составляла 7 дней, в течение которых больная закапывала сосудосуживающие капли в нос. Обратилась в клинику в связи с отсутствием улучшения состояния.
Слизистая оболочка полости носа гиперемирована, средние и нижние носовые раковины сильно увеличены в объеме за счет отека, средний носовой ход значительно сужен, в общем носовом ходе — большое количество слизисто-гнойного отделяемого.
При обследовании в общем анализе крови отклонений от нормы не выявлено. При эндоскопии полости носа видимых патологических изменений в области остиомеатального комплекса не установлено. При бактериологическом исследовании выявлен рост Str. pneumoniae 107.
Больная консультирована пульмонологом. Показатели функции внешнего дыхания до начала лечения: ОФС1 — 76,2; МОС50 — 46,8. Заключение оториноларинголога: острый двусторонний гнойный гайморит. Аллергический риносинусит. Заключение пульмонолога: скрытая бронхоконстрикция.
Больная принимала цефиксим (Супракс) по 400 мг 1 раз в день в течение 10 дней, Кларготил по 10 мг в день и мометазон в дозе 200 мкг в каждую половину носа 2 раза в день течение 30 дней.
Через 2 дня после начала лечения головная боль прекратилась, периоды затрудненного носового дыхания сократились, появились обильные выделения из носа слизисто-гнойного характера. Через 5 дней выделения приобрели слизистый характер, значительно уменьшились отек и гиперемия слизистой оболочки, восстановилось обоняние.
Слизистая оболочка полости носа розовая, влажная, носовые раковины не увеличены, носовые ходы свободны.
При повторном бактериологическом исследовании роста микрофлоры выявлено не было. Сахариновое время для правой и левой половин носа уменьшилось соответственно до 17 и 15 мин. Показатели функции внешнего дыхания после проведенного лечения улучшились: ОФВ1 — до 86,5; МОС50 — до 58,4.
Спустя 30 дней больная жалоб не предъявляла, а риноскопическая картина полностью нормализовалась.
Многие практикующие врачи крайне скептически относятся к попыткам беспункционного лечения гайморита, называя в качестве главного аргумента неизбежную хронизацию процесса при использовании только системной антибактериальной терапии. Ошибочная постановка знака равенства между пункцией и антибактериальной терапией нередко приводит к нежелательным последствиям. В случае консервативного, неинвазивного лечения пункции — как дренирующему мероприятию — должен быть найден альтернативный метод эвакуации патологического секрета из пазухи, начиная с медикаментозных средств и заканчивая щадящими инструментальными пособиями. А индивидуальный подход к каждому конкретному больному с учетом частой сопутствующей патологии со стороны нижних дыхательных путей позволит в значительной мере оптимизировать результаты лечения и избежать частых обострений и рецидивов как со стороны верхнего, так и нижнего отделов дыхательной системы.
А. Ю. Овчинников, доктор медицинских наук
С. И. Овчаренко, доктор медицинских наук, профессор
И. Г. Колбанова, кандидат медицинских наук
ММА им. И. М. Сеченова, Москва
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
Работа посвящена вопросам эффективности лечения хронического синусита. Раскрыты основные принципы и приоритеты в выборе антибактериальной терапии на основе собственного исследования авторов.
Цель исследования: повысить эффективность лечения полипозного синусита с учетом влияния персистирующей стафилококковой инфекции на возникновение и течение этого заболевания.
Материал и методы: на основе клинико-лабораторных, иммунологических и аллергологических показателей у 105 пациентов с хроническим полипозным риносинуситом выполнен сравнительный анализ различных схем лечения полипозного синусита (топический стероид и антигистаминный препарат; топический стероид, антигистаминный препарат и антибактериальный препарат, курсом раз в полгода).
Результаты и обсуждение: распространенность среди пациентов с полипозным синуситом персистирующей стафилококковой инфекции составляет 71%, частота встречаемости пациентов, сенсибилизированных к антигенам Staphylococcus aureus, – 55,2%. Установлено, что полипозный синусит, ассоциированный с носительством золотистого стафилококка, сопровождается в 1,5 раза более тяжелым клиническим течением. Эта закономерность объясняется более выраженным эозинофильным воспалением при полипозном синусите, ассоциированном с колонизацией Staph. аureus. Сенсибилизация к Staph. аureus также приводит к увеличению выраженности эозинофильного воспаления при полипозном синусите по сравнению с несенсибилизированными пациентами. Присоединение антибиотика к схеме лечения больных с полипозным синуситом значительно улучшает течение заболевания и в 1,5 раза снижает выраженность эозинофильного воспаления у всех пациентов с полипозным синуситом, и в 2 раза − у носителей и больных, сенсибилизированных к антигенам Staph. аureus.
Заключение: больные полипозным синуситом, сенсибилизированные к антигенам Staph. aureus, более резистентны к стандартной противорецидивной терапии топическими стероидами и антигистаминными препаратами, чем несенсибилизированные пациенты, и требуют проведения бактериологического мониторинга и периодической антибактериальной терапии.
Ключевые слова: полипозный синусит, антибактериальная терапия, золотистый стафилококк, сенсибилизация к золотистому стафилококку, рецидив полипозного синусита, левофлоксацин, хронический синусит, эозинофильное воспаление, антигены стафилококка, лечение полипозного синусита.
Для цитирования: Кунельская Н.Л., Туровский А.Б., Колбанова И.Г., Попова И.А. Антибактериальная терапия хронического синусита. РМЖ. 2016;21:1411-1416.
Antibacterial treatment for chronic sinusitis
Kunel'skaya N.L., Turovskiy A.B., Kolbanova I.G., Popova I.A.
L.I. Sverzhevskiy Scientific Research Institute for Ear, Nose, and Throat Diseases, Moscow
The paper discusses treatment efficacy of chronic sinusitis and uncovers major principles and priorities in antibacterial therapy choice based on authors’ study.
Aim: to improve treatment efficacy of sinusitis with nasal polyps with respect to the effect of persistent Staphylococcus infection on the development and course of the disease.
Patients and methods: the study included 105 patients with chronic sinusitis and nasal polyps who underwent clinical examination and laboratory, immunological, and allergy tests. Comparative analysis of different treatment regimens (topical steroid plus antihistamine or topical steroid plus antihistamine plus antibacterial agent every 6 months) was performed.
Results: the prevalence of persistent Staphylococcus infection among the patients with nasal polyps was 71%. The occurrence of sensitization to Staph. aureus antigens wass 55.2%. It was demonstrated that clinical course of nasal polyps associated with Staph. aureus carriage is more severe due to the eosinophilic inflammation as a result of Staph. аureus colonization. Moreover, sensitization to Staph. aureus antigens enhances eosinophilic inflammation in nasal polyps as compared with non-sensitized persons. Additional antibacterial agent significantly improves disease course and reduces eosinophilic inflammation severity by 1.5-times in all patients with nasal polyps and twice in carriers and persons sensitized to Staph. аureus antigens.
Conclusions: patients with nasal polyps sensitized to Staph. aureus antigens are more resistant to standard treatment with topical steroids and antihistamines than non-sensitized patients thus requiring bacteriological monitoring and periodic antibacterial therapy.
Key words: nasal polyps, antibacterial therapy, Staphylococcus aureus, sensitization to Staphylococcus aureus, recurrence of nasal polyps, levofloxacin, chronic sinusitis, eosinophilic inflammation, Staphylococcus antigens, treatment of nasal polyps.
For citation: Kunel'skaya N.L., Turovskiy A.B., Kolbanova I.G., Popova I.A. Antibacterial treatment for chronic sinusitis // RMJ. 2016. № 21. P. 1411–1416.
В статье изложено антибактериальная терапия хронического синусита

Современное понимание патогенетических основ развития хронического риносинусита (ХРС) позволяет на сегодняшний день отнести эту патологию к гетерогенной группе заболеваний носа и околоносовых пазух, которые характеризуются воспалением и ремоделированием тканей.
В соответствии с европейской классификацией ХРС подразделяется на хронический риносинусит с полипами и хронический риносинусит без полипов [1]. Диагноз ХРС устанавливается при наличии по крайней мере 2-х симптомов из следующих: заложенность носа, носовая секреция и/или постназальный синдром, головные и/или лицевые боли, снижение обоняния в течение более чем 12 нед. за последний год. Согласно последним данным, различные формы ХРС отличаются также процессом ремоделирования верхних дыхательных путей. Гистологически ХРС без полипов характеризуется фиброзом слизистой оболочки и базальной мембраны, в то время как полипозный риносинусит (ПРС) сопровождается выраженным отеком с отложением альбумина и развитием псевдокист.
Процесс ремоделирования слизистой оболочки полости носа и околоносовых пазух при хроническом воспалении создает условия для ослабления защитных механизмов и в большинстве случаев делает ее более восприимчивой к воздействию различных видов микроорганизмов [2].
При хронических синуситах микробная флора отличается большим разнообразием и спектр возбудителей несколько смещается в пользу анаэробной флоры. Так, по данным ряда авторов, в 52% случаев выделяются аэробы (различные стрептококки – 21%, гемофильная палочка – 16%, синегнойная палочка – 15%, золотистый стафилококк и моракселла − по 10%). Анаэробным возбудителям принадлежит 48% случаев (Prevotella – 31%, анаэробные стрептококки – 22%, Fusobacterium − 15% и др.). Выделение энтеробактерий при синуситах может быть объяснено кишечным дисбактериозом, который рассматривается в настоящее время как побочное действие антибиотикотерапии. По причине дефицита бифидобактерий и молочнокислых бактерий происходит беспрепятственное заселение условно-патогенной микрофлорой не только кишечника, но и других сообщающихся с внешней средой полостей организма. Этим же обстоятельством объясняется выявление грибов рода Candida [3].
Т.Н. Леонтьева и соавт. (1988) при обследовании 200 больных ПРС выявили стафилококковую обсемененность слизистой оболочки полости носа у 70,7% больных ПРС и у 81,5% больных полипозно-гнойным риносинуситом (ПГРС). При ПРС выявлялись в основном условно-патогенные штаммы. В 13,7% определялась стрептококковая флора, представленная в большей степени зеленящим стрептококком и встречающаяся одинаково часто как при ПРС, так и при ПГРС. E. сoli высевалась из отделяемого полости носа в 10,5% случаев. По результатам исследования авторы приходят к выводу, что S. aureus способствует более тяжелому течению заболевания с частыми рецидивами. Флора околоносовых пазух (ОНП) как сапрофитирующая, так и патогенная крайне разнообразна, причем микробный пейзаж варьирует в зависимости от тяжести и продолжительности заболевания.
Для возникновения инфекционного процесса ведущее значение, наряду с вирулентностью возбудителя, имеет состояние макроорганизма. Оно определяется сложным комплексом факторов и механизмов, тесно связанных между собой, а также чувствительностью и резистентностью к инфекции. Наиболее значимыми факторами являются неблагоприятный аллергический фон, частые полипотомии полости носа, нерациональное назначение антибактериальных препаратов, как в виде местной терапии, так и в виде общей антибиотикотерапии.
Особое внимание в последнее время уделяется способности микроорганизмов собираться в сообщества, т. е. формировать биопленки. Доказано, что биопленки оказывают серьезное влияние на свойства и потенциальные возможности образующих их патогенов. В первую очередь речь идет о защитном матриксе, своеобразной среде внутри микроколоний, способности микроорганизмов к элементарным видам взаимодействия между собой. В биопленке бактерия способна продуцировать такие факторы устойчивости, которые не продуцируют планктонные микроорганизмы, не говоря о лабораторных штаммах, а матрикс, окружающий микроколонии, служит защитным барьером, благодаря которому бактерии в биопленке более устойчивы к внешнесредовым влияниям и действию защитных факторов организма. Биопленкообразование широко изучено на золотистом стафилококке. Продемонстрировано, что S. aureus может не только обсеменять слизистую полости носа, но и формировать биопленку на слизистой оболочке, в особенности у пациентов с полипами.
Недавние исследования были посвящены изучению роли биопленок в персистенции S. aureus: биопленки выступают в качестве резервуара для микроорганизмов и позволяют им быстро внедряться в слизистую оболочку [4]. Используя флуоресцентную гибридизацию in situ пептидно-нуклеиновых кислот, было продемонстрировано наличие внутриклеточно расположенного S. aureus в ткани полипов от пациентов с аспирин-индуцированными заболеваниями дыхательной системы [5]. Также было выявлено, что данный микроорганизм располагается интраэпителиально в слизистой полипов, но не присутствует в назальном эпителии пациентов с хроническим риносинуситом без полипоза и у здоровых добровольцев. S. aureus не только выживает, но и размножается внутри эпителиальных клеток назальных полипов [6]. Данные исследований подчеркивают способность S. aureus к персистенции в условиях нарушенного механизма защиты слизистой оболочки. Как известно, Th2 сдвиг воспалительной реакции поддерживает программирование так называемых М2 макрофагов в ткани полипов, у которых, как было показано, снижена способность к фагоцитированию и внутриклеточному лизису S. aureus [7].
Кроме того, предполагается, что S. aureus высвобождает энтеротоксин в ткань полипа лишь в небольшом количестве, что приводит к постоянной стимуляции местной иммунной системы и изменению как врожденного [6], так и адаптивного иммунитета [8]. Все это позволяет бактерии в течение длительного времени выживать в пораженных дыхательных путях. Нами было проведено собственное исследованиею
Цель исследования: повысить эффективность лечения ПРС с учетом изученного влияния персистирующей стафилококковой инфекции на возникновение и течение этого заболевания.
В результате проведенного исследования выявлена высокая распространенность среди пациентов ПРС персистирующей стафилококковой инфекции, которая составляет 71%, и высокая частота встречаемости пациентов, сенсибилизированных к антигенам Staph. aureus, – 55,2%. Установлено, что ПРС, ассоциированный с носительством золотистого стафилококка, сопровождается в 1,5 раза более тяжелым клиническим течением, нежели ПРС без носительства (6±0,64 балла и 4±0,84 соответственно) и большей частотой обострений гнойного воспаления ОНП за год (2,7±0,79 и 1,8±0,67 соответственно).
Описанная закономерность объективно объясняется более выраженным эозинофильным воспалением при ПРС, ассоциированным с колонизацией Staph. аureus, чем при ПРС, ассоциированным с инфицированием прочими микроорганизмами (Str. pneumoniae, Str. viridans, Staph. epidermidis, E. coli, K. pneumoniae, H. influenzae, P. аeruginosa), что выражается повышенным количеством эозинофилов в крови (7,98±2,86 и 5,98±3,20 соответственно), в мазках со слизистой оболочки полости носа (13,3±6,20 и 7,87±5,22 соответственно) и средним уровнем эозинофильного катионного протеина (17,5±5,10 и 11,3±6,07 мкг/мл соответственно). Сенсибилизация к Staph. аureus также приводит к увеличению выраженности эозинофильного воспаления при полипозном синусите по сравнению с несенсибилизированными пациентами: повышение количества эозинофилов в крови (8,26±2,97 и 4,32±1,59 соответственно), в мазках со слизистой оболочки полости носа (13,3±5,54 и 4,8±3,89 соответственно) и повышение среднего уровня эозинофильного катионного протеина (17,6±4,66 и 8,0±6,64 мкг/мл соответственно).
В группах, получавших лечение без антибиотика, положительная эрадикация микрофлоры была достигнута только в 28,5% у сенсибилизированных носителей и в 54% случаев – у несенсибилизированных носителей, что можно расценивать как спонтанную эрадикацию возбудителя на фоне нормализации носового дыхания и аэрации в ОНП, при условии отсутствия сенсибилизации (табл. 1). Обращает на себя внимание тот факт, что у всех пациентов, сенсибилизированных к стафилококку, не получавших антибактериальную терапию и не являвшихся носителями, через год был выявлен рост микрооганизма в значимой концентрации (>104). Это свидетельствует о необходимости проведения бактериологического мониторинга у всех сенсибилизированных к стафилококку пациентов.
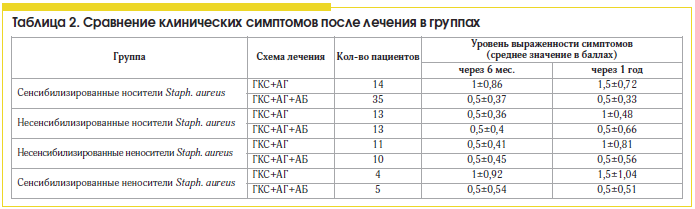
Сравнивая различные схемы лечения ПРС, мы установили, что больные полипозным синуситом, сенсибилизированные к антигенам Staph. aureus, более резистентны к стандартной противорецидивной терапии (табл. 2 и 3) топическими стероидами и антигистаминными препаратами, чем несенсибилизированные пациенты, и требуют проведения антибактериальной терапии.
Как известно, выбор антибиотика зависит от определенных факторов: срока последнего обострения (менее 6 мес.); результатов микробиологического исследования; тяжести течения заболевания; наличия осложнений. Все пациенты с хроническим синуситом в несколько раз чаще применяют антибактериальные препараты, что значительно повышает риск встречи с резистентной флорой. Уже этот фактор служит показанием к назначению антибиотиков, резистентность к которым минимальна.
В этом аспекте понятен повышенный интерес оториноларингологов к респираторным фторхинолонам, в частности к левофлоксацину – высокоэффективному в отношении респираторной флоры, с практическим отсутствием резистентных штаммов в России, который, к тому же в терапевтических концентрациях способствует ингибированию синтеза биопленки.
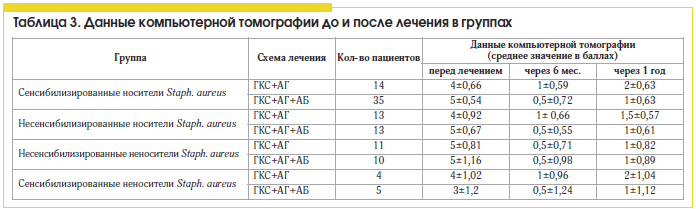
В нашем исследовании применение антибиотиков в составе комплексной терапии ПРС, ассоциированного с персистирующей стафилококковой инфекцией, приводит к статистически достоверному (в 2 раза) уменьшению выраженности эозинофильного воспаления и улучшению клинических показателей заболевания (клинических симптомов, картины компьютерной томографии околоносовых пазух) и снижению частоты гнойных осложнений по сравнению со стандартной противорецидивной терапией.
Фторхинолоны − это полностью синтетические препараты, которые не имеют природного аналога. Одной из последних разработок препаратов данной группы является левофлоксацин. Левофлоксацин обладает быстрым бактерицидным действием, поскольку проникает внутрь микробной клетки и подавляет, так же как и фторхинолоны первого поколения, ДНК-гиразу (топоизомеразу II) бактерий, что нарушает процесс образования бактериальной ДНК. Ферменты клеток человека не чувствительны к фторхинолонам, и последние не оказывают токсического действия на клетки макроорганизма. В отличие от препаратов прежнего поколения новые фторхинолоны ингибируют не только ДНК-гиразу, но и второй фермент, ответственный за синтез ДНК, − топоизомеразу IV, выделенную у некоторых микроорганизмов, прежде всего грамположительных. Считается, что именно воздействием на этот фермент объясняется высокая антипневмококковая и антистафилококковая активность новых фторхинолонов.
Левофлоксацин обладает клинически значимым дозозависимым постантибиотическим эффектом, достоверно более длительным по сравнению с ципрофлоксацином, а также длительным (2−3 ч) субингибирующим действием [9].
Под действием левофлоксацина отмечено повышение функции полиморфноядерных лимфоцитов у здоровых добровольцев и ВИЧ-инфицированных пациентов. Показано его иммуномодулирующее воздействие на тонзиллярные лимфоциты у больных хроническим тонзиллитом. Полученные данные позволяют говорить не только об антибактериальной активности, но и о синергическом противовоспалительном и антиаллергическом действии левофлоксацина. Левофлоксацин характеризуется широким антимикробным спектром, включающим грамположительные и грамотрицательные микроорганизмы, в т. ч. внутриклеточные возбудители [10]. При сравнении эффективности различных антибактериальных препаратов в отношении возбудителей респираторных инфекций было выявлено, что по противомикробной активности левофлоксацин превосходит остальные препараты. К нему оказались чувствительны все штаммы пневмококка, в т. ч. пенициллин-резистентные, при сравнительно более низкой чувствительности пневмококков к препаратам сравнения: офлоксацин − 92%, ципрофлоксацин − 82%, кларитромицин − 96%, азитромицин − 94%, амоксициллин/клавуланат − 96%, цефуроксим − 80%. К левофлоксацину оказались также чувствительны все штаммы моракселлы катаралис, гемофильной палочки и метициллин-чувствительного золотистого стафилококка, 95% штаммов клебсиеллы пневмонии [11]. Важным преимуществом левофлоксацина, наряду с хорошей переносимостью, является возможность однократного приема в течение суток.
Перечисленные характеристики препарата обусловливают чрезвычайно важное в практическом отношении свойство левофлоксацина – высокую комплаентность. Сокращение кратности приема и длительности лечения играют ключевую роль в формировании лучшей приверженности протоколам антибиотикотерапии.
Таким образом, левофлоксацин высокоактивен относительно основных возбудителей бактериального синусита. Как показали исследования, чувствительность пневмококка, гемофильной палочки, моракселлы к левофлоксацину превышает 99%. Отмечается также низкий уровень устойчивости золотистого стафилококка (его метициллин-резистентных штаммов) и других возбудителей синусита.
Читайте также:


