Факторами патогенности стафилококков не являются

В связи с техногенным загрязнением окружающей среды в настоящее время отмечается рост числа различных форм дисбиоза у человека [8]. Одной из форм нарушения качественного и количественного состава нормальной микрофлоры является стафилококковое бактерионосительство [3].
Стафилококки являются частью нормальной микрофлоры кожных покровов, слизистых оболочек и нижнего отдела кишечника человека. По данным С.В. Сидоренко (2003), приблизительно 40% людей являются постоянными носителями S. aureus на слизистой оболочке крыльев носа, коже подмышечных впадин и промежности, оставшуюся часть популяции относят к транзиторным и случайным (временным) носителям [4; 6]. Важное клиническое значение бактерионосительства определяется достаточной типичностью процесса транслокации стафилококков с наружных кожных покровов и слизистых оболочек во внутреннюю среду организма хозяина с развитием широкого спектра заболеваний [4; 10]. С другой стороны, носительство стафилококков в носовых ходах может представлять опасность для окружающих за счет аэрогенного распространения, что особенно актуально в организованных детских коллективах.
Исследования последних лет свидетельствуют, что загрязнение окружающей среды приводит не только к широкому распространению экологически обусловленных заболеваний, угнетению иммунобиологической реактивности организма, нарушению репродуктивной функции и другим многочисленным негативным сдвигам в состоянии здоровья макроорганизма [1], но и к качественному и количественному изменению микрофлоры организма человека [5]. По мнению Б.А. Шендорова (1998), различные поллютанты в порядке индукции защитных реакций у микробов могут вызывать существенные изменения в их патогенности [9]. Поэтому изучение биологических свойств золотистых стафилококков, колонизирующих слизистые оболочки такого слабо адаптированного контингента, как младшие школьники, имеет важное научно-практическое значение [2].
Цель работы - изучение факторов патогенности Staphylococcus aureus, выделенных со слизистой оболочки переднего отдела носа у школьников младших классов, проживающих в экологически неравнозначных районах города Красноярска.
Материал и методы исследования. Изучены факторы патогенности 266 культур Staphylococcus aureus, выделенных со слизистой оболочки переднего отдела носа у детей, проживающих в экологически неравнозначных районах города Красноярска. Все дети (возраст 7-11 лет) относились к 1 и 2 группе здоровья и проживали в исследуемых районах города с момента рождения. Обследованные дети условно были разделены на 3 группы. Главным критерием данной дифференциации явились коэффициенты суммарного загрязнения воздуха, по которым различались зоны наблюдения.
При обследовании школьников на стафилококковое бактерионосительство исследуемый материал (клетки эпителия слизистой носа) засевали на чашки с желточно-солевым агаром, инкубировали при 37 °С в течение 24-48 часов, затем проводили количественную и качественную оценку выросших колоний, расчет показателя микробной обсемененности (ПМО).
Число микробных клеток 10 3 и более на тампон является показателем высокой обсемененности и свидетельствует о бактерионосительстве, представляющем эпидемическую опасность.
При определении видовой принадлежности штаммов использовали тесты фирмы PLIVA-Lachema Diagnostika (Чехия). Изучение факторов патогенности (продукция плазмокоагулазы, лецитиназы, ДНК-азы, РНК-азы, лизоцима и гемолизина) культур золотистого стафилококка проводили общепринятыми методами.
Статистическую обработку результатов проводили с помощью пакета прикладных программ Statistica v 6.0. Поскольку по критерию Шапиро-Уилкса распределение носило нормальный характер, для описания качественных учетных признаков применяли среднее арифметическое и стандартную ошибку среднего (М±m). Основываясь на равенстве дисперсий, значимость различий определяли по критерию t-Стьюдента. Критический уровень значимости (р) при проверке статистических гипотез в данном исследовании принимался равным 0,05.
Результаты исследования и их обсуждение. Анализ результатов изучения факторов патогенности S. aureus, выделенных со слизистых оболочек переднего отдела носа у детей, проживающих в городе Красноярске, показал, что плазмокоагулазу, лецитиназу и гемолизин продуцировали все исследуемые культуры золотистого стафилококка, вне зависимости от района выделения (табл. 1). Продукция гиалуронидазы и лизоцима у штаммов стафилококка, выделенных со слизистой оболочки носа у детей, проживающих в первом (экологически благополучном) исследуемом районе, наблюдалась у 21,0 и 63,2% соответственно. Гиалуронидазной и лизоцимной активностью обладали соответственно 59,3 и 84,5% культур стафилококка, выделенных от детей, проживающих во втором исследуемом районе; 75,0% и 95,2% культур соответственно - в третьем исследуемом районе. У стафилококков, выделенных от школьников в первом исследуемом районе, продукцию ферментов гиалуронидазы и лизоцима регистрировали в 2-3 раза достоверно реже, чем у культур стафилококков, выделенных от детей во втором и третьем районах.
Таким образом, все изученные культуры золотистого стафилококка, выделенные со слизистых оболочек переднего отдела носа у детей, проживающих в различных районах города Красноярска, обладали большим набором факторов патогенности. Культуры, выделенные от обследуемых во втором и третьем районах, обладали большим уровнем патогенности по сравнению с культурами золотистого стафилококка, вегетирующими на слизистых оболочках носа у детей, проживающих в первом исследуемом районе.
Таблица 1 - Распространенность факторов патогенности стафилококков, выделенных от детей, проживающих в районах с различной антропогенной нагрузкой
Исследуемый район
Факторы патогенности (%, М ± m)
Плазма-коагулаза
Гиалуронидаза
Лецити-наза
Глава 14. Стафилококки
Впервые стафилококки были обнаружены Л. Пастером в 1897 г. Подробно они были изучены А. Огстоном (1882) и Ф. Розенбахом (1884).
Морфология. Стафилококки (от греч. staphyle - виноградная гроздь) имеют вид круглых шаров диаметром 0,5-1,5 мкм. Размножаясь, образуют скопления в виде грозди винограда. Такая форма является результатом деления микробов в различных плоскостях. Однако в гное встречаются единичные и парные кокки. Стафилококки неподвижны, не имеют спор, при специальных условиях культивирования образуют микрокапсулу, грамположительны.
Культивирование. Стафилококки - факультативные анаэробы, однако лучше растут в присутствии кислорода. Растут и размножаются на обычных питательных средах, хорошо растут на средах с кровью, оптимальные условия - температура 37° С, рН 7,2-7,4.
Элективными средами являются желточно-солевой агар и солевой агар. На МПА колонии стафилококка выпуклые, круглые, непрозрачные, блестящие, размером 2-4 мм с ровными краями. При росте стафилококки образуют пигмент: золотистый, лимонно-желтый или белый. Лучше всего пигмент образуется на молочной среде при комнатной температуре и рассеянном свете. Стафилококковый пигмент не растворяется в воде, растворяется в ацетоне, эфире, спирте и т. д. При росте некоторых штаммов стафилококка на агаре с кровью вокруг колонии образуется зона гемолиза. Рост на бульоне характеризуется равномерным помутнением и осадком на дне.
Ферментативные свойства. Стафилококки вырабатывают сахаролитические и протеолитические ферменты. Сахаролитические ферменты расщепляют ряд сахаров: лактозу, глюкозу, сахарозу, мальтозу, глицерин и другие с образованием кислоты.
Протеолитические свойства стафилококка выражаются в способности растворять казеин, разжижать желатин (медленно), расщеплять другие белковые субстраты.
Стафилококки продуцируют ферменты патогенности: 1) коагулазу (сворачивает плазму крови); 2) гиалуронидазу (фактор распространения); 3) лецитиназу (растворяет лецитин оболочки клеток); 4) фибринолизин (лизирует фибрин); 5) ДНКазу (деполимеризует ДНК); 6) фосфатазу и др.
Наличие плазмокоагулазы позволяет дифференцировать золотистый стафилококк от стафилококков других видов. Многие стафилококки вырабатывают пенициллиназу, разрушающую пенициллин.
Токсинообразование. Стафилококки вырабатывают экзотоксины. К их числу относятся гемолизины четырех типов, из которых наибольшее значение имеет α-токсин. Он обладает следующими свойствами: гемолитическим - вызывает гемолиз эритроцитов, дермонекротическим - при внутрикожном введении вызывает некроз, летальным - при внутривенном введении приводит к гибели чувствительных к нему животных.
Кроме гемолизинов стафилококки образуют лейкоцидин, убивающий лейкоциты, энтеротоксины шести типов, вызывающие пищевые отравления, эксфолиатины двух типов, приводящие к отслаиванию эпидермиса у новорожденных детей.
Антигенная структура. Стафилококки имеют протеиновый антиген А, общий для всех золотистых стафилококков, и полисахаридные антигены: А, Б, С.
Стафилококки выделяют бактериоцины (стафилоцины), которые обладают антагонистическим действием по отношению к микроорганизмам данного рода.
Среди золотистых (реже эпидермальных) стафилокков различают около 40 фаговаров. Определение чувствительности выделенных из различных объектов стафилококковых культур к типовым фагам имеет важное эпидемиологическое значение (при установлении источника и путей передачи возбудителя).
Классификация. В настоящее время стафилококки, выделенные от человека, делят на 3 вида (табл. 23): S. aureus, S. epidermidis, S. saprophyticus.

Таблица 23. Дифференциация видов стафилококков, выделенных от человека
Примечание. + наличие ферментации, устойчивости, - отсутствие ферментации, устойчивости.
Устойчивость к факторам окружающей среды. Стафилококки довольно устойчивы, поэтому они обнаруживаются в воздухе, почве, воде, на предметах обихода. При температуре 100° С они погибают моментально, при температуре 70° С - через 10-15 мин. Они хорошо переносят низкие температуры. При замораживании сохраняют жизнеспособность в течение нескольких лет. Хорошо переносят высушивание. Прямой солнечный свет убивает их только через несколько часов. Обычные растворы дезинфицирующих веществ (например, сулема в разведении 1:1000) убивают их через 15-20 мин. При обезвреживании выделений, содержащих гной, белок, мокроту, не следует применять фенол. Это дезинфицирующее вещество вызывает коагуляцию белков, что предохраняет микроорганизмы от гибели. Стафилококки чувствительны к бриллиантовому зеленому.
Восприимчивость животных. К стафилококку чувствительны крупный и мелкий рогатый скот, лошади, свиньи, куры. Из экспериментальных животных - кролики, белые мыши и котята.
Источники инфекции. Больной человек и бактерионоситель.
Пути передачи. Контактно-бытовой, воздушно-капельный, воздушно-пылевой, пищевой.
Заболевания у человека. Пиодермия, фурункулы, карбункулы, панариции, абсцессы; воспалительные процессы различных органов и тканей; ангины, циститы, остеомиелиты, холециститы, маститы; сепсис и септикопиемия; пищевые токсикоинфекции и многие другие. Описано около 120 нозологических форм стафилококковой этиологии.
Патогенез. Стафилококки проникают через кожу и слизистые оболочки.
Преимущественное значение при стафилококковых заболеваниях имеет золотистый стафилококк (S. aureus). Менее выражена роль в патологии человека S. epidermidis и S. saprophyticus. Патогенез обусловливается свойствами возбудителя - ферментами, экзотоксинами, веществами бактериальной клетки и состоянием иммунной системы макроорганизма.
Чаще поражается кожа и подкожная клетчатка - возникают пиодермиты, фурункулы, панариции. Нередко стафилококки обусловливают вторичные заболевания, например пневмонию при гриппе. Они также вызывают раневые инфекции. Особенно велика роль стафилококков в акушерской практике, так как новорожденные очень чувствительны к ним. В течении стафилококковых заболеваний имеет значение развитие аллергии, поэтому заболевание характеризуется рецидивами.
Особое место среди стафилококковых заболеваний занимают пищевые интоксикации. Клинически они протекают как токсикозы, сопровождаются рвотой, поносом, головной болью и другими явлениями.
Иммунитет. У человека имеется естественная резистентность, связанная с механическими факторами, фагоцитозом и наличием антител. Воспалительный процесс, возникающий в месте внедрения возбудителя, обусловливает задержку стафилококков и затрудняет их распространение по организму. В образовавшемся очаге стафилококки подвергаются фагоцитозу.
Образующийся в процессе заболевания антитоксин является важным фактором в общем комплексе иммунитета. Однако приобретенный иммунитет нестойкий, поэтому наблюдаются рецидивы.
Профилактика. Сводится к улучшению санитарно-гигиенических условий, активному выявлению больных и бактерионосителей, правильному режиму работы больничных учреждений.
Специфическая профилактика. Стафилококковый анатоксин и антистафилококковый иммуноглобулин.
Лечение. Антибактериальные препараты, поливалентный стафилококковый бактериофаг, антистафилококковая плазма и иммуноглобулин. В некоторых случаях при хроническом течении стафилококковых инфекций применяют аутовакцину.
1. По какому признаку кокки объединены в одну группу?
2. Какие ферменты и факторы патогенности продуцируют стафилококки?
3. Какие заболевания вызывают стафилококки?
4. Какие виды стафилококков Вы знаете?
Цель исследования: выделение и идентификация стафилококков.
1. Гной (фурункулы, карбункулы, абсцессы).
2. Слизь из зева (ангина).
3. Мокрота (пневмония).
4. Моча (пиелиты и циститы).
5. Дуоденальное содержимое (холецистит).
6. Кровь (подозрение на сепсис).
7. Рвотные массы, промывные воды желудка, пищевые продукты (пищевые отравления).
8. Слизь из носа (обследование на бактерионосительство).

Способы сбора материала

Первый день исследования
Все посевы ставят в термостат на сутки.
Обнаружение стафилококков при микроскопии гноя из закрытого абсцесса и осадка мочи, взятой катетером, позволяет дать предварительный положительный ответ: обнаружен стафилококк.
Посевы на плотных и жидких питательных средах вынимают из термостата и изучают. Подозрительные в отношении стафилококка колонии, выросшие на желточно-солевом агаре, отсевают на скошенный агар для получения и дальнейшего изучения чистой культуры. При этом учитывают наличие лецитиназы, которое проявляется в образовании радужного венчика вокруг колонии. Чашки с оставшимися колониями оставляют на 2-3 дня при комнатной температуре для выявления пигмента. Просматривают посевы на чашках с агаром, содержащим кровь. Колонии с четкой зоной гемолиза (просветление) вокруг них выделяют на скошенный агар. Посев крови в сахарном бульоне инкубируют 10 сут, производя через 2-3 дня высевы на агар с кровью и желточно-солевую среду.
При отсутствии роста на плотных питательных средах делают высев из бульона с глюкозой на агар с кровью. Посевы ставят в термостат на сутки.
Вынимают посевы из термостата. Из выделенных на скошенный агар культур делают мазки, окрашивают по Граму и микроскопируют. При наличии грамположительных стафилококков проводят дальнейшее изучение выделенной культуры:
а) ставят реакцию плазмокоагуляции;
б) изучают гемолитические свойства;
в) определяют продукцию ДНКазы;
г) определяют ферментацию маннита в анаэробных условиях;
д) определяют устойчивость к новобиоцину.
Реакция плазмокоагуляции. Цитратную плазму, полученную из крови кролика, разводят изотоническим раствором натрия хлорида в соотношении 1:4 и наливают в две преципитационные пробирки по 0,3-0,5 мл. В одну пробирку вносят петлю исследуемой культуры, другая пробирка служит контролем. Обе пробирки ставят в термостат при температуре 37° С. Учет реакции производят через 2-3 ч. При отсутствии свертывания плазмы посевы оставляют при комнатной температуре на 24 ч, после чего учитывают реакцию. При наличии фермента коагулазы плазма свертывается (не выливается из перевернутой пробирки). В контрольной пробирке консистенция плазмы не изменяется.
Ускоренный метод определения коагулазы. В стерильной капле воды на предметном стекле суспендируют выделенную культуру, к ней прибавляют одну каплю неразведенной плазмы. При положительной реакции из микробных клеток в течение 20-60 с образуются крупные хлопья. Этот метод используют при массовых обследованиях.
Определение гемолитических свойств. Производят посев на агар с 5% крови (штаммы, продуцирующие α-гемолизин, дают зоны просветления среды и на кроличьей и на бараньей крови, продуцирующие β-гемолизин лизируют только эритроциты барана).
Определение ДНКазы. Исследуемую культуру засевают на среду, содержащую ДНК. Посевы инкубируют. Через 18-20 ч на чашку с выросшими колониями стафилококка добавляют 5-7 мл раствора хлороводородной кислоты. ДНК реагирует с кислотой и среда становится мутной. Если выделенная культура продуцирует фермент ДНКазу, он деполимеризует ДНК и помутнение не образуется.
Расщепление маннита в анаэробных условиях. Исследуемую культуру засевают уколом на полужидкий агар с маннитом. Поверхность среды заливают вазелиновым маслом. Инкубируют 18-24 ч при 37° С. Положительная реакция характеризуется изменением цвета среды (в среде имеется индикатор).
Производят учет результатов (табл. 24).
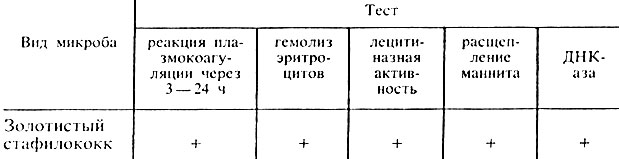
Таблица 24. Свойства золотистого стафилококка
Примечание. + положительная реакция.
Наличие перечисленных признаков позволяет отдифференцировать золотистые стафилококки от стафилококков других видов и дать окончательный ответ: выделен S. aureus (рис. 37).
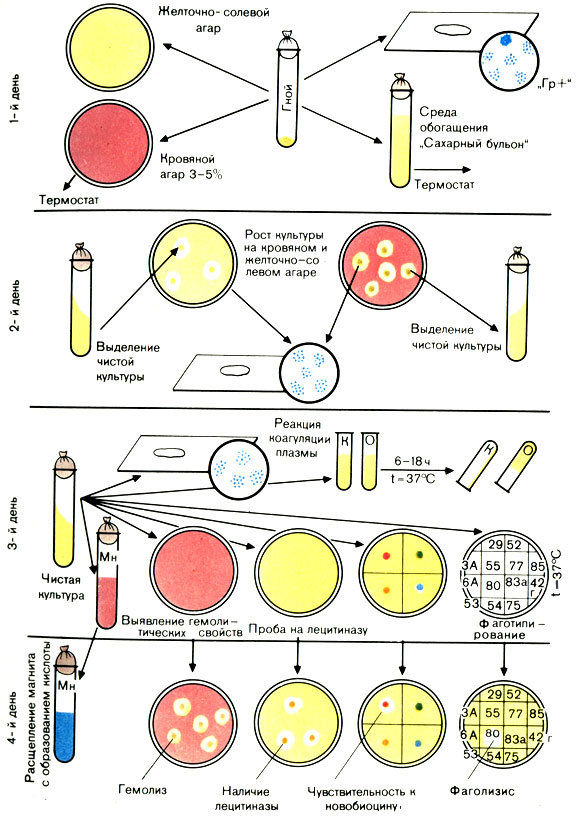
Рис. 37. Схема выделения и идентификации стафилококка
Для установления эпидемиологической цепочки выделенную культуру фаготипируют. Фаготипирование может подтвердить идентичность стафилококков, выделенных от разных больных и из объектов внешней среды.
Для фаготипирования используют критические тест-разведения фагов. Критическим тест-разведением называют то максимальное разведение фагов, при котором происходит полусливной лизис соответствующего штамма стафилококка.
Методика фаготипирования. В чашку Петри наливают 20 мл 1,5% МПА, дают ему застыть и подсушивают в термостате в течение 30-40 мин. На поверхность агара наносят 1 мл 4-6-часовой культуры выделенного стафилококка, распределяют по поверхности всей чашки, избыток жидкости отсасывают или дают ей испариться в термостате в открытой чашке. Предварительно дно чашки делят на секторы или квадраты. Число квадратов или секторов должно соответствовать количеству используемых фагов. Затем на каждый квадрат или сектор наносят один фаг.
Чашки ставят в термостат при температуре 37° С. Результаты определяют через 6-7 ч. Если чашки оставляют при комнатной температуре, то учет фаголизиса производят через 18-24 ч.
Биологические пробы. Проба на определение летальных свойств культуры. Для выявления летального действия токсина кролику вводят внутривенно (или внутрибрюшинно) фильтрат бульонной культуры стафилококка из расчета 0,1-0,2 мл фильтрата на 1 кг массы кролика. Гибель кролика через 3-4 дня свидетельствует о наличии летального действия токсина.
Дермонекротическая проба. Пробу ставят на кролике (наиболее чувствительному к этому токсину животному). Предварительно на боку или на спине животного выщипывают шерсть и вводят внутрикожно 0,2 мл двухмиллиардной взвеси стафилококковой культуры в изотоническом растворе натрия хлорида. При наличии в выделенной культуре некротических свойств в месте введения образуется инфильтрат, сопровождающийся некрозом.
Реакцию учитывают через 24-18 ч.
Полученную культуру стафилококка проверяют на чувствительность к антибиотикам методом бумажных дисков (см. главу 9).
1. Какой материал исследуют при заболеваниях, вызываемых стафилококками?
2. Каковы основные методы лабораторного исследования для выявления стафилококков?
3. Какова методика постановки реакции плазмокоагуляции?
4. На какой среде выявляют гемолитические свойства стафилококков?
5. С какой целью проводят фаготипирование?
Проверьте, к какому антибиотику чувствительна выделенная культура стафилококка.
Желточно-солевой агар Чистовича. Готовят желточную смесь (1 желток куриного яйца на 150 мл стерильного изотонического раствора натрия хлорида). К мясопептонному солевому агару (8-10% натрия хлорида), растопленному и остуженному до 45° С, добавляют 20% желточной взвеси (соблюдают стерильность) и разливают в чашки.
Агар с кровью. См. главу 7.
Солевой бульон, солевой агар. Готовят как обычные среды - МПБ и МПА, только натрия хлорид вносят в большем количестве (8-10%). Бульон разливают в колбы, пробирки, агар - в чашки.
Стафилококки: золотистый, эпидермальный, сапрофитный
Стафилококки — грамположительные кокки, которым в чистой культуре свойственно скопление в виде гроздьев винограда (характерно деление в разных плоскостях). Неподвижные, не образуют спор, могут образовывать микрокапсулу.
Стафилококки растут на простых питательных средах (мясо-пептонный агар, мясо-пептонный бульон), являются галофильными (хорошо размножаются при высоких концентрация NaCl - изготовление элективной среды - желточно-солевого агара). Чувствительны к анилиновым красителям, йоду (используется в местном лечении пиодермии).
Стафилококки продуцируют каталазу, что защищает их от губительного действия производных кислорода. Синтезируют каротиноидные пигменты, которые также защищают от оксидантов. Антиоксидантная активность — один и механизмов их защиты в условиях пиогенных инфекций. Стафилококки часто характеризуются множественной устойчивость к антибиотикам (β-лактамам, эритромицину, тетрациклинам, хлорамфениколу и др.). Устойчивость к антибиотикам контролируется R-плазмидами (синтез β-лактамаз) или хромосомными мутациями (метициллино-резистентные стафилококки — MRS-штаммы).
Антигены стафилококков:
1) Тейховые и липотейхоевые кислоты (адгезия к эпителиальным клеткам);
2) Пептидогликан;
3) Белок А (связывается с Fc-участком Ig, из-за этого молекулы IgG связываются с поверхностью бактериальных клеток в неправильной ориентации, что приводит к нарушению опсонизации и фагоцитоза);
Стафилококки поражают любые органы и системы организма, вызывают сепсис, септикопиемию, токсинемию. Иммунитет по механизму клеточный и гуморальный, по напряженности — нестойкий. Узкоспецифический (против определенных штаммов). По направленности антитоксический, антиферментный, антибактериальный. Возможен переход острой инфекции в хроническую с развитием аллергии.
В современной медицинской практике большую опасность представляют экзогенные стафилококковые инфекции для больных в стационарах — внутрибольничные инфекции. Основными возбудителями являются S. aureus, S. epidermidis. Источник заражения — здоровые носители госпитальных штаммов, а также больные со стертыми формами стафилококковой инфекции. Наибольшую эпидемическую опасность представляет медицинский персонал — постоянные носители госпитальных штаммов. Механизмы, пути и факторы передачи стафилококка разнообразны: аэрогенный (воздушно-капельный, воздушно-пылевой), фекально-оральный (пищевой), артифициальный (через нестерильные медицинские инструменты) и др. Восприимчивость к стафилококкам высокая.
Кроме экзогенной, не меньшую опасность представляет эндогенная оппортунистическая инфекция, которая вызывается стафилококками - представителями собственно нормально микрофлоры. При снижении
иммунного статуса организма аутоштаммы повышают свою вирулентность и вызывают патологические процессы как в исходном биотопе, так и в других биотопах организма за счет миграции и
транслокации.
Диагностика: ведущим методом является бактериологический. Взятие исследуемого материала зависит от предполагаемой локализации с учетом патогенеза и клинической картины болезни. Главное значение в диагностике имеют идентификация возбудителя, его дифференциация от нормальной, сопутствующей стафилококковой микрофлоры. Экспресс-диагностика направлена на обнаружение серологическими реакциями антигенов ферментов патогенности и токсинов стафилококка.
Бактериологический метод включает также определение у чистой культуры факторов патогенности, фаговара (выявление госпитальных штаммов, источника и путей передачи инфекции), антибиотикограммы.
Важное значение имеет выявление секретируемых факторов персистенции для диагностики резидентного носительства и прогнозирования осложнений, хронизации процесса.
Серологический метод, как правило, применяется в диагностике
затяжных, хронически форм заболевания. Информативным показателем является обнаружение антител к факторам патогенности стафилококков: токсинам, ферментам, тейхоевой кислоте и др.
ЗОЛОТИСТЫЙ СТАФИЛОКОКК. Название бактерия получила благодаря своему внешнему виду под микроскопом (имеет золотистый цвет, обусловленный пигментами из группы каротиноидов).
S. aureus — бактерия-комменсал (разновидность симбиоза, при котором комменсал возлагает на хозяина регуляцию своих отношений с внешней средой, но не вступает с ним в тесные взаимоотношения). Колонизирует кожу и поверхности слизистых (носа, глотки и влагалища). Основным резервуаром является полость носа, но могут обитать и в гортани, в области промежности, в подмышечных областях, на волосистой части кожи головы и в желудочно-кишечном тракте. Бактериальные клетки диаметром 0,5-1,5 мкм, факультативно анаэробные грамположительные кокки, неподвижные. Способен расти в широком диапазоне температур от 7 до 48,5°С (оптимум 30 - 37°С); рН 4,2 - 9,3 (оптимум рН 7,0-7,5) и при высокой концентрации хлорида натрия (до 15% NaCl). Такие свойства позволяют бактериям заселять самые разнообразные продукты.
Существует внутривидовая дифференциация S.aureus на фагогруппы и фаговары, что используется в реакции фаготипирования для выяснения источника заражения и путей передачи инфекции.
У S. aureus обнаружены белки-адгезины, которые взаимодействуют с различным протеинами: лектинами, фибронектином, муцином и др.
S. aureus может вызывать широкий диапазон заболеваний, начиная с лёгких кожных инфекций: угри, фурункул, флегмона, карбункул, стафилококковый ожогоподобный кожный синдром и абсцесс — до смертельно опасных заболеваний: пневмония, менингит, остеомиелит, эндокардит, инфекционно-токсический шок и сепсис. Диапазон заболеваний простирается от кожных, мягких тканей, респираторных, костных, суставных и эндоваскулярных до раневых инфекций. Он до сих пор является одной из четырёх наиболее частых причин внутрибольничных инфекций, часто вызывая послеоперационные раневые инфекции.
С момента открытия пенициллина и активного его использования против стафилококка в популяции закрепилась мутация, в связи с которой в настоящее время большинство штаммов устойчивы к этому антибиотику, благодаря наличию у золотистого стафилококка пенициллиназы (расщепляющет молекулу пенициллина). Для борьбы с бактерией широко применяют метициллин. Но сейчас встречаются штаммы, устойчивые и к метициллину, в связи с чем штаммы золотистого стафилококка делят на метициллин-чувствительные и метициллин-устойчивые штаммы золотистого стафилококка. Выделяются ещё более устойчивые штаммы: ванкомицин-резистентный и гликопептид-резистентный.
ЭПИДЕРМАЛЬНЫЙ СТАФИЛОКОКК. Коагулаза-отрицательный вид стафилококков, представитель нормальной микрофлоры кожи человека. Имеют правильную шарообразную форму и размер от 0,5 до 1,5 мкм, располагаются преимущественно по две и четыре бактерии. Температурный оптимум 30-37 °С. Является факультативным анаэробом, который может расти в аэробных условиях.
Из S. epidermidis выделен специфический полисахарид, обеспечивающий прикрепление стафилококка к протезам, ортопедическим стержням и другим трансплантатам, что создает условие для развития инфекции.
Несмотря на то, что S. epidermidis является непатогенным возбудителем, у части людей со сниженным иммунитетом он может вызывать инфекции. Часто обнаруживается в катетерах и других хирургических имплантатах.
Способен вызывать инфекции кровеносной системы, эндокардиты и инфекции клапанов сердца, воспаление мочеполовой системы, инфекции в искусственных суставах, инфекции у новорожденных. Очень редко может быть причиной сепсиса у госпитализированных пациентов.
Высокая вирулентность S. epidermidis связана с их способностью образовывать биопленку на поверхности пластика. Другие микроорганизмы могут связываться с образовавшейся биопленкой, образуя многослойную биопленку. Такая биопленка уменьшает метаболическую активность микроорганизмов внутри нее и делает их недоступными для антибиотиков. Часто устойчивы к пенициллинам, амоксициллину и метициллину.
САПРОФИТНЫЙ СТАФИЛОКОКК. Коагулаза-отрицательный вид стафилококков, распространенный возбудитель инфекций мочевых путей. Встречается в дистальной части пищевода человека, продуцирует патогенные гемолизины. Является частью нормальной микрофлоры женского мочеполового тракта и промежности.
S. saprophyticus обладает ферментом уреазой и способен под влиянием мочевины образовывать капсулу. Он является одним из основных возбудителей инфекций мочевого тракта(цистита, пиелонефрита), а так же дизурических расстройств. Реже возникают пиелонефриты и эндокардиты.
Устойчив к новобиоцину.
Редкое присутствие фактора объясняется следующим образом. Лейкоцидин относится к двухкомпонентным токсинам. Он состоит из двух неассоциированных белков, S и F (от англ. slow и fast — медленно и быстро элюируемые компоненты при ионообменной хроматографии), каждый из которых обладает собственной мишенью. Цитолитический эффект наблюдается только при их совместном действии. В штаммах, обладающих двумя токсинами (гамма-гемолизин и лейкоцидин), имеются три разных S-компонента (HlyA, HlyC и LukS-PV) и два F-компонента (HlуB и LukF-PV). От их сочетания зависит цитотоксическая активность цельного токсина. В частности, LukS-PV—LukF-PV — комбинация, которая не действует на эритроциты. Остальные сочетания дают три гамма-токсина — HlyA (HlуA—LukF-PV), HlyB (HlуA—HlуB) и HlyC (HlуC—HlyB). Они продуцируются практически всеми штаммами S. aureus, имеют высокую гемолитическую активность и слабее действуют на нейтрофилы.
Белок А. Пожалуй, это самый знаменитый фактор золотистого стафилококка, по крайней мере для специалистов, непосредственно не связанных с микробиологией. Он входит в состав клеточной стенки и обладает способностью вступать во взаимодействие с Fc-фрагментом IgG человека. Этот феномен, нашедший широкое применение в иммунологии, неспецифичен, так как реакция не затрагивает участков IgG, ответственных за распознавание антигенов. Если учесть, что Fc-фрагмент обеспечивает связывание IgG-опсонинов с фагоцитами и комплементом, то его блокада белком А может иметь негативные последствия для опсонофагоцитарной защиты.
Стафилокиназа. Растворение сгустков крови обеспечивает проникновение бактерий во внутреннюю среду. Так действует стафилокиназа. Переводя плазминоген в плазмин, она способствует разрушению фибрина, в том числе образуемого стафилококковой коагулазой. Это высвобождает инфицированные микротромбы, которые с током крови распространяются по организму. Этому содействует и повреждение экстрацеллюлярного матрикса соединительной ткани. В нем участвуют протеазы и гиалуронидаза стафилококка. Определенное значение имеет стафилококковая ДНК-аза. Ее подключение к инвазивности связано с расщеплением ДНК, накапливающейся в гнойном содержимом.
Лекарственная резистентность. Золотистый стафилококк печально знаменит своей быстрой адаптацией к антибиотикам и другим антибактериальным средствам. И хотя блестящий опыт первых испытаний пенициллина связан с излечением от стафилококкового сепсиса, сегодня это удается далеко не всегда. Количество резистентных стафилококков и спектр их устойчивости быстро росли на протяжении последних лет, и в настоящее время многие штаммы не чувствительны не только к классическому пенициллину, но и к антибиотикам последних поколений. Это эволюционно неизбежный процесс, отражающий экологическую пластичность бактерий. У стафилококков он связан с селекцией штаммов, разрушающих антибиотики. Главная роль принадлежит ферментам — плазмидзависимым бета-лактамазам. Они легко подстраиваются к новым пенициллинам и цефалоспоринам, а благодаря подвижности генов резистентности, входящих в состав R-транспозонов, быстро распространяются в микробных популяциях.
Лекарственная устойчивость — важнейший патогенетический фактор стафилококковых инвазий: затрудняя элиминацию возбудителя, он стабилизирует очаговые процессы, повышая вероятность осложнений. Кроме бета-лактамазоустойчивых пенициллинов (их история начинается с метициллина), цефалоспоринов и новых классов бета-лактамных антибиотиков (карбапенемы, монобактамы) для преодоления резистентности в состав препаратов предложено включать ингибиторы бета-лактамаз, например, сульбактам. Это повышает эффективность антибактериальной терапии, расширяя спектр чувствительных штаммов. Впрочем, и такой подход спасает не всегда. Большим злом являются метициллинрезистентные стафилококки, MRSA (от англ. methicillin-resistent S. aureus). Они устойчивы к бета-лактамным антибиотикам благодаря хромосомной добавке, кодирующей дополнительный пенициллинсвязывающий белок (РВР2а) — мутантную пептидогликановую транспептидазу. Несмотря на свое название (и в отличие от четырех главных транспептидаз), РВР2а слабо связывает бета-лактамные антибиотики, которые из-за этого лишаются антибактериальной активности. Такие штаммы резистентны к пенициллинам и цефалоспоринам (по крайней мере в реальных клинических дозировках), создавая серьезные трудности для этиотропной терапии. Приходится использовать другие антибиотики, в частности гликопептидного ряда. Препаратом выбора является ванкомицин, активный против MRSA. Однако недавно появились штаммы S. aureus, устойчивые к ванкомицину. Они создают тревожную перспективу, заставляя искать новые подходы к лечению инфекций, вызываемых множественно устойчивыми к лекарствам штаммами стафилококков.
Условия возникают не только извне (высокая инфицирующая дозировка, повреждение тканей, внедрение инородных тел), их формирует и сам инфицируемый организм. Речь идет о нарушениях гомеостаза, которые снижают резистентность к местным инвазиям и повышают вероятность системных осложнений. Сопротивление пиогенной инфекции во многом зависит от качества опсонофагоцитарных реакций. Их ослабление повышает чувствительность к стафилококку, способствуя стабилизации пиогенного процесса. Эндогенными факторами риска по развитию стафилококковых пиодермий являются диабет, гиперфункция сальных желез и изменение качества их секрета (в периоде полового созревания), возрастная эволюция апокринных потовых желез.
Стабилизация очагов пиогенной инфекции может быть связана с тем, что бактерии вызывают слабый иммунный ответ, который не обеспечивает образования необходимого количества опсонически активных антител. Установлено, например, что в отличие от стафилококковых поражений внутренних органов пиодермии не стимулируют синтеза антипептидогликановых антител — важного компонента опсонофагоцитарной защиты. У больных с хроническими стафилококковыми инвазиями (например, при остеомиелите) находили антитела, блокирующие опсоническую активность противостафилококковых антител здоровых людей. Кроме того, золотистый стафилококк способен скрываться от антител в сгустках фибрина и внутри самих фагоцитов. По той же причине иммунитет не срабатывает и при бактериемии. В любом случае, никто еще не сумел доказать, что содержание антител к каким-либо антигенам надежно коррелирует с устойчивостью против стафилококковых инвазий.
Много сил отдано иммунопрофилактике и иммунотерапии стафилококковых инфекций. На роль протективных антигенов претендовали разные продукты золотистого стафилококка. Наиболее широкие испытания прошел стафилококковый анатоксин. Его применение было нацелено на повышение устойчивости к S. aureus на основе антител против альфа-токсина. Опыты начались в 1930-х гг. под впечатлением блестящих результатов борьбы с дифтерией при помощи обезвреженного формалином токсина дифтерийной палочки. В нашей стране дело зашло так далеко, что препаратом стали широко иммунизировать беременных женщин для профилактики перинатальной гнойной патологии. Но накопилось столько противоречий, что плановая иммунопрофилактика была оставлена. Собственно этого следовало ожидать, исходя из патогенетической поливалентности золотистого стафилококка и скромной роли каждого из его факторов в развитии инфекционного процесса. Анатоксин (так же, как еще более загадочный препарат — антифагин) был рекомендован и для лечения хронических стафилококковых пиодермий. Механизм его действия в этом случае не ясен, но он, безусловно, не исчерпывается стимуляцией специфического иммунитета.
Иллюзорная идея о профилактической и терапевтической ценности анатоксина породила еще один препарат — противостафилококковый иммуноглобулин, широко разрекламированный как эффективное средство против септических стафилококковых инвазий. Его готовят из крови доноров, вакцинированных стафилококковым анатоксином, стандартизуют по антителам против альфа-токсина и именно их считают действующим началом. Но подобная логика не убеждает: вакцинация, не гарантирующая активного иммунитета, вряд ли способна обеспечить образование антител, эффективных в создании пассивного иммунитета. Введение иммуноглобулина (особенно больших дозировок при внутривенных инфузиях) может давать санирующий эффект не за счет нейтрализации бактериальных токсинов, а в результате подавления вторичной токсемии, связанной, в частности, с цитокинами. Синдром интоксикации (сложный сам по себе) — лишь часть патогенеза стафилококковой инвазии, и только с таких позиций следует обсуждать проблемы иммунотерапии стафилококковых инфекций.
Наряду с пиогенными инфекциями, золотистый стафилококк способен вызывать специфические интоксикации, патогенез и клиническая картина которых целиком связаны с определенными бактериальными токсинами. Инвазия необязательна, хотя она может предшествовать или сопутствовать интоксикации. К специфическим токсинам золотистого стафилококка относятся эксфолиативный токсин, токсин синдрома токсического шока, энтеротоксин. В отличие от других патогенетически значимых факторов названные токсины кодируются плазмидами, умеренными бактериофагами или хромосомными генами, называемыми островами патогенности. Поэтому они продуцируются ограниченным числом стафилококковых штаммов, определяя уникальность их вирулентности.
Читайте также:


