Доксициклин лечит золотистый стафилококк
Ну что нам делать?! У нас золотистый стафилококк 10*5 и клебсиелла 10*7. Мы все мучаемся, и никто не может помочь. Все педиатры сказали, что лечить не нужно, у малышей часто патогенная флора, надо ждать заселения. Да сколько ждать-то уже?! Ребенок практически весь день рыдает, у него что-то болит. Что с врачами у нас.
Пролечились три курса, один кололи антибиотики, был 10 в 7 степени, сейчас 10 в 6 Опять прописали курс антибиотиков, поменяли уже трех врачей, не знаю, что делать, думаю просто остановить лечение, сколько уже можно мучить ребенка. Вы сможете убрать золотистый стафилококк.
Поздний вечер. Внезапный звонок на мобильный. На дисплее высвечивается международный код абонента +792xxxxxxxx. Взволнованный голос женщины настолько отчетливо слышен в трубке, как будто она находится на консультативном приеме прямо у нас в кабинете:
– У меня критическая ситуация. клебсиелла пневмония. Она в зеве. в носу. везде! Самые сильные антибиотики не помогают… сейчас заканчиваю принимать последний, но надежды, что подействует нет! Сможете срочно передать мне лекарство в Москву? Слишком мало времени — инфекция развивается!… Лечение только травами? И все.
Наши предшественники, накопившие огромный опыт в лечении болезней, вызываемых многочисленными инфекциями, в том числе и золотистым стафилококком, даже не могли себе представить, что за какие-нибудь несколько десятков лет бактерии мутируют, превратившись в токсических чудовищ — супербактерии.

Почти три года назад, молодой парень 1987 г.р. возвращался с мотосборов в темное время суток и врезался в прицеп лесовоза, который ехал без габаритных огней, поворачивая со второстепенной дороги. В результате удара головой получил ушиб головного мозга тяжелой степени и после 9 месяцев реанимации в больнице был выписан домой со вставленным в голову металлическим шунтом. Его родители не захотели опускать руки и организовали сбор средств через интернет.

«Моему сыну с каждым днем становится все ЛУЧШЕ и ЛУЧШЕ. Сняли в понедельник швы, все заживает, доктор отметила, что послеоперационная ранка "лучше не бывает."
Но через некоторое время состояние его здоровья начало резко ухудшаться. Поднялась высокая температура, пульс увеличился до 158 ударов. Оказалось, что шунт установленный в головном мозге подвергся инфицированию золотистым стафилококком, который попал в лимфатическую и кровеносную системы и начал поражать все органы. Врачи назначали все новые и новые курсы антибиотиков, а его мать, случайно нашедшая наш сайт, обратилась к нам за помощью.
Естественно, такая переписка не имела никакой перспективы и оборвалась, так толком и не начавшись. Вот только недавно, я совершенно случайно узнал, что ее сын умер в декабре 2016 года, спустя три с половиной года после злополучной аварии и установки шунта. Причиной его смерти стали резистентные патогенные супербактерии.
А ведь эти препараты считаются фундаментом, на котором основана практически вся современная медицина. Раковая терапия, трансплантация органов, любые операции и даже рождение ребенка – все держится на них, как на средствах для профилактики инфекций. Но последние становятся неизлечимыми в силу своего колоссального генетического инструментария – ведь они одни из древнейших живых существ на планете и, как оказалось, асы по выживанию.
Миллиарды их живут в каждом из нас, многие из них помогают нам работать и оставаться здоровыми. Мы — люди лишь на 10%, все остальное — бактерии, микробы. Появился даже такой термин — микробиота.
Сегодня эти бактерии способны изменить свой облик и антибиотик их просто не узнает. Они научились вырабатывать вещества, способные разрушать антибактериальное средство еще до того, пока оно сможет достигнуть цели или создают вокруг себя защищенную оболочку, пробиться через которую лекарству невозможно.
И все эти навыки бактерии разных видов передают друг другу в виде цепочек ДНК, в которых зашифрована инструкция, каким именно способом противостоять воздействию разных антибиотиков.
Исследователи обнаружили, что новые штаммы могут появляться в организме одного единственного пациента и передаваться другим, не вызывая симптомов в течение многих месяцев. В итоге, в человеческом организме возникают микробы с комбинациями генов, которые защищают их от множества препаратов.
Недавно команда исследователей из Эксетерского университета (University of Exeter) обнаружила, что антибиотики могут стимулировать рост и размножение бактерий. Они изучили действие антибиотика доксициклина на кишечную палочку (Escherichia coli). В течение четырех дней ученые восемь раз подвергли культуру бактерий воздействию этого антибиотика. E.coli выработали резистентность к лекарству, что было ожидаемо, однако это был не единственный результат опыта. Мутировавшие микроорганизмы размножались быстрее, чем до начала эксперимента, и их колонии стали в три раза больше. Такой эффект наблюдался только среди тех бактерий, которые находились в контакте с антибиотиками. Мало того, когда воздействие прекратили – изменения сохранились.


Один из ученых этой команды Роберт Бердмер отметил, что эволюцию часто называют медленной, однако это утверждение далеко от истины, по крайней мере, если речь идет о микроорганизмах. Эволюция бактерий (изменение их ДНК) под действием антибиотиков идет очень быстро, поэтому лекарственные препараты могут перестать действовать уже через несколько дней.

Шаровидная бактерия из рода стафилококков относится к метициллин-резистентному виду (Methicillin-resistant Staphylococcus aureus). Ее особенность заключается в устойчивости к действию антибиотиков. Она может провоцировать широкий спектр болезней — от легких инфекций до менингита, пневмонии и сепсиса.


Надежда - это чувство ожидания, что определенное событие произойдет (Hope is the feeling of expectation for a certain thing to happen).
В середине 90 -х годов прошлого века, будучи по делам в одном из банков, мне совершенно случайно довелось встретиться с его управляющим, которым оказалась весьма эмоциональная женщина. Когда она узнала, что мы родственники и преемники известного фитотерапевта, то буквально схватила мои руки, долго не отпускала их и благодарила. Я был очень растроган, так как выяснилось, что еще в начале 70 —х годов ее месячного сына, в числе многих других новорожденных, заразили резистентным золотистым стафилококком в роддоме и остались в живых только те дети, которые прошли лечение у нашего Учителя.

Антибиотики не должны быть единственным средством борьбы с инфекционными заболеваниями, так как это постоянно генерирует все новые и новые проблемы. Мы предлагаем людям альтернативу, но общество предпочло идти другим путем и теперь обречено на соревнование с супербактериями собственного изготовления.


Антибиотик Astellas Юнидокс Солютаб при Staphylococcus aureus. Схема лечения, побочные эффекты и результат лечения - все это в отзыве.


Я активно взялась за лечение своего горла (постоянно ощущаю боль). Врач поставил диагноз "Хронический тонзиллит" и отправил сдавать анализ на микрофлору. Получив результаты, было назначено лечение, а именно курс антибиотиков.

Врач выписал "Доксицилин". В аптеке встал выбор, что приобрести: Юнидокс Солютаб (около 300 руб.) или Доксицилин (около 50 руб.).
Лично я не доверяю дешевым антибиотикам, имея выбор я лучше куплю средство подороже. Мой выбор взят не с потолка, а обоснован:
Доксициклин содержит меньше вспомогательных компонентов, в связи с чем на него чаще возникают побочные реакции. Юнидокс Солютаб основан на Доксициклина моногидрат, тогда как Доксициклин содержит в составе Доксициклина гидрохлорид. Эти два вещества несколько отличаются друг от друга. Первый содержит в себе молекулу воды, а второй — нейтральную электрически частицу хлорводорода. В целом формула вещества не меняет воздействие на организм человека и микроорганизмы, но побочные эффекты на фоне приема этих антибиотиков будут существенно различаться.
Пить антибиотики - итак удар по организму (грубо говоря), поэтому лишнюю нагрузку не хочется давать.
В общем, купила я Антибиотик Astellas Юнидокс Солютаб
Внимание! Я принимала таблетки по назначению лечащего врача, и Вам советую не заниматься самолечением!

Место приобретения: Аптека
Отпуск - без рецепта.
Стоимость: 310 рублей - полная стоимость, со скидкой вышло 294 руб.
Плюс зависит от аптеки.Так как мне на курс одной упаковки не хватило, я докупала в другой аптеке по полной стоимости, без скидки за 316 руб.
В упаковке - 10 таблеток. У меня был курс 7 дней по 1 таблетке 2 раза в день. В общей сложности необходимо было выпить 14 таблеток.
Страна-производитель: Нидерланды
Таблетки находятся в картонной упаковке, на которую нанесена краткая информация для потребителя.


Внутри коробки имеется развернутая инструкция, в которой потребитель найдет исчерпывающую информацию.


Таблетки маленькие - проблем с проглатыванием не должно возникнуть.

"Пилюли" серо-желтого цвета, гладкие, с видимыми вкраплениями. С одной стороны на таблетку нанесен код, с другой стороны - риска:

Состав:
доксициклина моногидрат, в пересчете на доксициклин 100 мг Вспомогательные вещества: целлюлоза микрокристаллическая, сахарин, гипролоза (низкозамещенная), гипромеллоза, кремния диоксид коллоидный (безводный), магния стеарат, лактозы моногидрат.
Честно говоря, мне список этих веществ особо ни о чем не говорит, но как вы могли прочитать выше - форма доксициклина, входящая в состав лекарственного средства на организм человека воздействует с меньшим проявлением побочных эффектов.
Показания:
Инфекционно-воспалительные заболевания, вызванные чувствительными к препарату микроорганизмами:
— инфекции дыхательных путей (в т.ч. фарингит, острый бронхит, обострение хронической обструктивной болезни легких, трахеит, бронхопневмония, долевая пневмония, внебольничная пневмония, абсцесс легкого, эмпиема плевры);
— инфекции ЛОР-органов (в т.ч. отит, синусит, тонзиллит);
— инфекции мочеполовой системы (цистит, пиелонефрит, бактериальный простатит, уретрит, уретроцистит, урогенитальный микоплазмоз, острый орхиэпидидимит; эндометрит, эндоцервицит и сальпингоофорит /в составе комбинированной терапии/);
— инфекции, передающиеся половым путем (урогенитальный хламидиоз, сифилис у пациентов с непереносимостью пенициллинов, неосложненная гонорея /как альтернативная терапия/, паховая гранулема, венерическая лимфогранулема);
— инфекции ЖКТ и желчевыводящих путей (холера, иерсиниоз, холецистит, холангит, гастроэнтероколит, бациллярная и амебная дизентерия, диарея путешественников);
— инфекции кожи и мягких тканей (включая раневые инфекции после укуса животных), тяжелая угревая болезнь (в составе комбинированной терапии);
— другие заболевания (фрамбезия, легионеллез, хламидиоз различной локализации /в т.ч. простатит и проктит/, риккетсиоз, лихорадка Ку, пятнистая лихорадка Скалистых гор, тиф /в т.ч. сыпной, клещевой возвратный/, болезнь Лайма /I стадия - erythema migrans/, туляремия, чума, актиномикоз, малярия, лептоспироз, пситтакоз, орнитоз, сибирская язва /в т.ч. легочная форма/, бартонеллез, гранулоцитарный эрлихиоз, коклюш, бруцеллез);
— инфекционные заболевания глаз, в составе комбинированной терапии - трахома;
— подострый септический эндокардит;
Профилактика послеоперационных гнойных осложнений и малярии, вызванной Plasmodium falciparum, при кратковременных путешествиях (менее 4 мес) на территории, где распространены штаммы, устойчивые к хлорохину и/или пириметамин-сульфадоксину.
Мне назначили по результатам анализов, т.к.был обнаружен Staphylococcus aureus.
Staphylococcus aureus (стафилококк ауреус, золотистый стафилококк ) — условно-патогенная бактерия, обитающая на различных объектах окружающей среды и в локусах человеческого организма. Микробы колонизируют кожный покров и слизистую оболочку внутренних органов. Их обнаруживают в воздухе, почве, на бытовых предметах, игрушках, медицинских инструментах. Условно-допустимое количество золотистого стафилококка в любом биоматериале – менее 104 колониеобразующих единиц.Заразиться этой опасной инфекцией можно в местах общего пользования.
Противопоказания:
тяжелые нарушения функции печени и/или почек;
период лактации (грудного вскармливания);
детский возраст до 8 лет;
Гиперчувствительность к антибиотикам группы тетрациклинов.
У меня нет противопоказаний к применению данного лекарственного средства.
Прием таблеток.
Я пила таблетки 2 раза в день после приема пищи. Запивая половиной стакана воды.
Также допустимо растворять таблетку в воде и употреблять в виде суспензии. Мне такой способ показался "невкусным", поэтому я даже не пробовала. Ну, и разжевывать таблетку я тоже не пыталась.

Astellas Юнидокс Солютаб. Побочные эффекты:
Со стороны пищеварительной системы: тошнота, рвота, анорексия, боли в животе, диарея, запор, дисфагия, глоссит, эзофагит, транзиторное повышение содержания в крови печеночных трансаминаз, ЩФ, билирубина.
Со стороны системы кроветворения: нейтропения, тромбоцитопения, гемолитическая анемия.
Аллергические реакции: кожная сыпь, зуд, эозинофилия; редко - отек Квинке, фотосенсибилизация.
Прочие: увеличение остаточного азота, кандидоз, кишечный дисбактериоз, изменение цвета зубов у детей.
Всем известно, что антибиотик неблагоприятно влияет на микрофлору кишечника. Я еще у врача спросила, что он посоветует, пить, чтоб не "убить" ЖКТ, на что он мне ответил "кефирчик перед сном попей".
Честно сказать, кефир кефиром, но я для подстраховки приобрела также и лакто- и бифидобактерии в аптеке. Принимала их пока пила антибиотик.
Именно поэтому, я считаю, что никаких сбоев в работе ЖКТ я не выявила, пока принимала курс антибиотика.

Никакой тошноты и рвоты также не было.
Аллергия, зуд - отсутствовали.
Единственный момент - на третий день приема антибиотика Astellas Юнидокс Солютаб я весь день ощущала головную боль. Просто невыносимую. то ли это совпадение, то ли влияние каких-либо других факторов, но это было только один день, в последующие дни больше голова не болела.
Зачастую при приеме антибиотика развивается молочница. Я избежала этой участи, так как паралельно принимала еще и противогрибковое лекарственное средство (в анализах была обнаружена Candida, ее тоже лечила)
Если почитать отзывы на Astellas Юнидокс Солютаб в данной ветке, можно обнаружить, что зачастую этим антибиотиком "лечат" прыщи. Я ждала такого "побочного" эффекта. Не скажу, что меня прям сильно беспокоят высыпания на лице, но почистить кожу было бы не лишним.
Воспаления у меня единичные можно сказать - парочка на подбородке и парочка на лбу. Так вот с ними антибиотик не справился никак. Они прошли в такой же срок, как и если бы я не пила антибиотик.
Результат приема.
Примерно через 2 недели после окончания приема антибиотика я пошла снова сдавать анализ на микрофлору из зева.
Результат видно из выписки.

Staphylococcus aureus пришел в норму (если можно так выразится). Самое главное - я справилась с заболеванием, причем без проявления побочек.
Вывод. Благодаря лечению данным антибиотиком я избавилась от "бяки". Плюс ко всему я не испытала побочных эффектов - это не может не радовать.
Рекомендую ли я Astellas Юнидокс Солютаб? Конечно, при условии, что вам его назначил врач.
Я описала лишь свой опыт применения.
16 августа 2016
- 9972
- 7,0
- 0
- 6
Структурная формула нового пептидного антибиотика.
Немецкие ученые обнаружили новое оружие для борьбы с больничным монстром — мультирезистентным золотистым стафилококком. Долгие годы оно скрывалось не в вечной мерзлоте или Марианской впадине, а прямо под нашим носом. Вернее — в нём.
В последние годы во всем мире увеличилось количество инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. Организмы с множественной лекарственной резистентностью (multidrug-resistant organisms, MDRO), такие как метициллин-резистентный золотистый стафилококк, нечувствительные к ванкомицину энтерококки или резистентные к цефалоспоринам третьего поколения грамотрицательные бактерии, в ближайшие десятилетия могут стать более частыми причинами смерти, чем рак [1].
Несколько лет назад удалось обнаружить, что представители человеческой микробиоты способны производить бактериоцины, поражающие близкородственных бактерий [2]. Например, в 2014 году из человеческого комменсала Lactobacillus gasseri выделили и описали новый синтезируемый рибосомами тиопептидный антибиотик — лактоциллин [3].
Семейные разборки
Немецкий исследователь Александр Ципперер со своими сотрудниками в июле 2016 года сообщил о том, что обнаружил в человеческом носу бактерию Staphylococcus lugdunensis IVK28, которая подавляет рост метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) [1].
Стафилококки относятся к типичным бактериям-комменсалам, колонизирующим кожу и поверхности слизистых оболочек. Staphylococcus aureus — шаровидные грамположительные бактерии, вырабатывающие каротиноидный пигмент, который придает их клеткам золотистый цвет (рис. 1). Эти микроорганизмы чрезвычайно устойчивы к внешним воздействиям и выживают в воздухе, пыли, почве, продуктах питания, на оборудовании пищевых производств и предметах быта [6], [7].
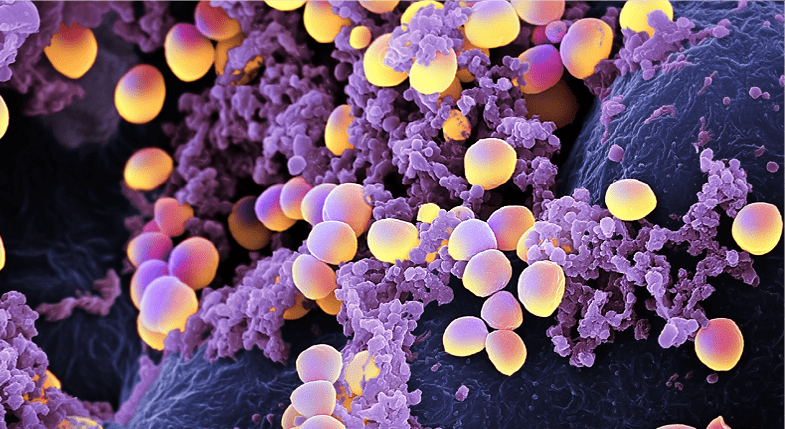
Рисунок 1. Staphylococcus aureus и лейкоциты.
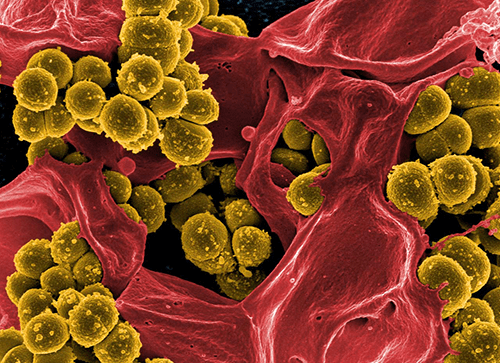
Рисунок 2. Метициллин-резистентные золотистые стафилококки.
Staphylococcus aureus — бактерия условно-патогенная, проявляющая свои патологические свойства только в благоприятных условиях, а создает их, как правило, ослабление иммунитета носителя. Активная жизнедеятельность стафилококка может привести к разнообразным заболеваниям [5], [7], [8]:
- кожи (прыщи, фурункулы, синдром ошпаренной кожи);
- органов дыхания (плеврит, пневмония);
- костной и соединительной тканей (артрит, остеомиелит);
- нервной системы и органов чувств (отит, менингит);
- сердечно-сосудистой системы (эндокардит, флебит, стафилококковая бактериемия).
Факторы патогенности S. aureus — это микрокапсула, компоненты клеточной стенки, ферменты агрессии и токсины. Микрокапсулы защищают клетки бактерий от фагоцитоза, способствуют их адгезии и распространению по организму хозяина. Составляющие клеточной стенки (например пептидогликан, тейхоевые кислоты и белок А) вызывают развитие воспаления, обездвиживают фагоциты и нейтрализуют иммуноглобулины. Коагулаза, главный фермент агрессии, вызывает свертывание плазмы крови [7], [9].
Наиболее опасны метициллин-резистентные стафилококки (methicillin-resistant S. aureus, MRSA) (рис. 2). Метициллин — это модифицированный пенициллин, с помощью которого еще недавно успешно боролись со стафилококковой инфекцией. MRSA устойчивы не только к метициллину, но и к другим антибиотикам пенициллиновой группы (диклоксациллину, оксациллину, нафциллину и др.), а также к цефалоспоринам. В последнее время выявлены штаммы и с более широким спектром устойчивости: ванкомицин-резистентные (VRSA) и гликопептид-резистентные (GISA) [6], [9], [10].
Штамм S. lugdunensis IVK28 эффективно боролся со своим вредоносным родственником лишь в условиях недостатка железа и только на твердых агаризованных средах (рис. 3, слева). Механизм противостояния был неясен, а потому Ципперер провел транспозонный мутагенез клеток выделенного штамма — чтобы выявить ген, ответственный за синтез смертельного для S. aureus вещества.

В итоге удалось получить мутанта IVK28, который не мог подавлять рост MRSA. Анализ места встройки транспозона показал, что тот нарушил структуру гена предполагаемой нерибосомной пептидсинтетазы (НРПС). Оказалось, что этот ген вместе с другими последовательностями, связанными с биосинтезом антибиотиков, входит в состав оперона размером 30 т.п.н. Это указывало на то, что предполагаемая молекула ингибитора может быть комплексом нерибосомных пептидов.
Оперон методом ПЦР обнаружили во всех культурах S. lugdunensis, а значит, он характерен для всего вида, а не только для штамма IVK28. Однако GC-состав оперона (26,9%) отличался от GC-состава остального генома S. lugdunensis (33,8%), что свидетельствовало о возможном заимствовании этого полезного генетического кластера у других видов бактерий — путем горизонтального переноса .
Оперон состоит из генов lugA, B, C и D, кодирующих пептидсинтетазные белки (см. врезку ниже), а также из других генов, чьи продукты необходимы для синтеза и транспорта нерибосомного пептида.
Чтобы окончательно вменить оперону участие в антибактериальной деятельности S. lugdunensis, наименьший ген (lugD) удалили. Мутант ΔlugD, как и ожидалось, не мог подавлять рост золотистого стафилококка, но когда в него ввели плазмиду с работающим геном lugD, агрессивный фенотип восстановился (рис. 3, в центре и справа).
Секретное оружие
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.
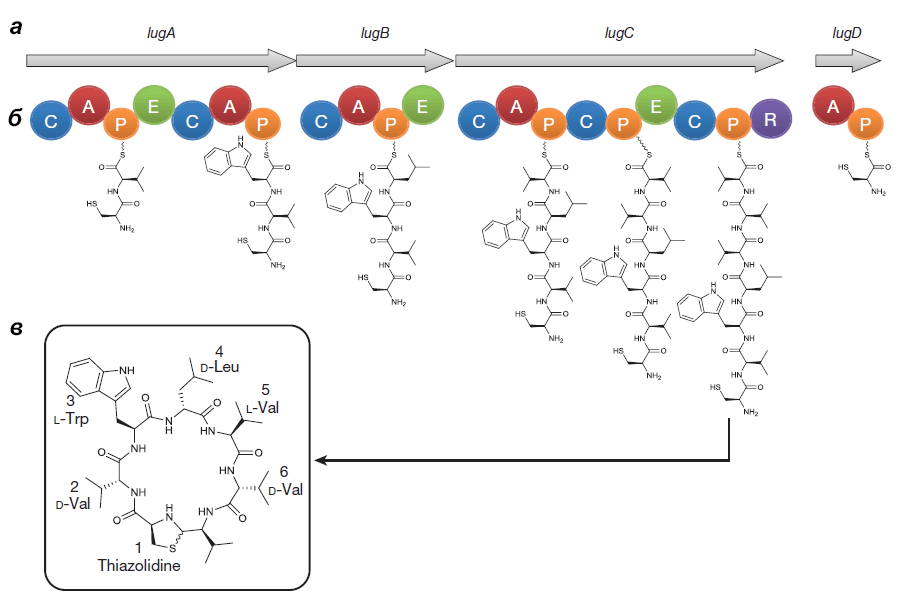
Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров — белков, ДНК и пептидогликанов [5].
Этот класс пептидов синтезируется в клетках низших грибов и бактерий без участия рибосом. Нерибосомные пептиды (НРП) также встречаются и у высших организмов, которые имеют бактерий-комменсалов [12].
НРП подразделяются на несколько функциональных групп [13]:
- антибиотики (ванкомицин);
- предшественники антибиотиков (ACV-трипептид — предшественник пенициллина и цефалоспорина);
- иммуносупрессоры (циклоспорин);
- противоопухолевые пептиды (блеомицин);
- сидерофоры (пиовердин);
- токсины (HC-токсин);
- сурфактанты (сурфактин).
Каждый модуль состоит как минимум из трех доменов:
- конденсирующего (принимающего пептидную цепь из предыдущего модуля);
- аденилирующего (выбирающего нужную аминокислоту);
- пептидильного (образующего пептидную связь).
Нередко модули включают и другие домены, в том числе эпимеризующий, который преобразует L-аминокислоты в D-формы [14].
По аналогии с триплетным рибосомным кодом для синтеза белка существует и нерибосомный, код НРПС, определяемый 10 остатками аминокислот в субстрат-связывающем кармане аденилирующего домена. От комбинации этих остатков зависит то, какая аминокислота будет встроена в пептид конкретным модулем НРПС. Зная этот код, можно предсказывать субстратную специфичность аденилирующих доменов и даже произвольно изменять ее посредством замены аминокислот в домене [14].
В экспериментах немецких ученых лугдунин действовал не только на метициллин-резистентных стафилококков, но и на гликопротеин-резистентных, и даже на других грамположительных бактерий типа листерии и ванкомицин-резистентного энтерококка (табл. 1). Минимальная ингибирующая концентрация (МИК) нового бактериоцина — 1,5–12 мкг × мл −1 , что говорит о высокой активности вещества. При этом такие концентрации никак не влияли на человеческую сыворотку, не вызывали лизис нейтрофилов или эритроцитов и не ингибировали метаболическую активность моноцитов. Бактериальные же клетки под действием лугдунина в концентрации даже ниже МИК прекращали синтезировать ДНК, РНК, белки и компоненты клеточной стенки. В этом отношении лугдунин напоминает даптомицин, дающий такой же эффект, но способ действия которого пока не изучен. Не было отмечено возникновения резистентности клеток S. aureus к лугдунину даже после их месячного выращивания на малых концентрациях.
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл −1 ) |
|---|---|---|
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 |
| + 50% человеческой сыворотки крови | 1,5 | |
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 |
| Staphylococcus aureus Mu50 | GISA | 3 |
| Staphylococcus aureus SA113 | 3 | |
| Staphylococcus aureus RN4220 | 3 | |
| Enterococcus faecium BK463 | VRE | 3 |
| Enterococcus faecalis VRE366 | VRE | 12 |
| Listeria monocytogenes ATCC19118 | 6 | |
| Streptococcus pneumoniae ATCC49619 | 1,5 | |
| Bacillus subtilis 168 (trpC2) | 4 | |
| Pseudomonas aeruginosa PAO1 | >50 | |
| Escherichia coli DH5α | >50 | |
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. | ||
Испытания в боевых условиях
Как и полагается, способность лугдунина лечить стафилококковые инфекции продемонстрировали in vivo на мышиной модели (рис. 5). У шести мышей сбрили шерсть на спине и, повредив кожу многократным приклеиванием/отклеиванием пластыря, нанесли на это место золотистого стафилококка. Затем кожу обработали мазью, содержащей 1,5 мкг лугдунина, и спустя шесть часов оценили результат. Обработка новым антибиотиком сильно сокращала или даже полностью уничтожала популяцию S. aureus. Причем не только на поверхности кожи, но и в более глубоких ее слоях.
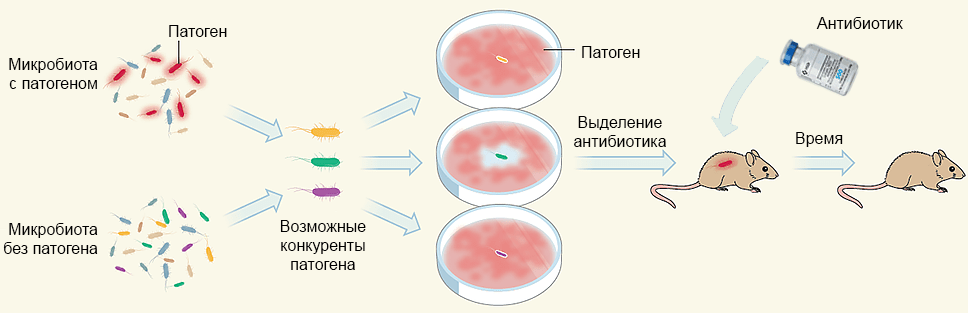
Рисунок 5. Общая схема подхода к идентификации природного антибиотика. Из бактериальных популяций человеческого тела отбирают представителей, которые не могут сосуществовать с интересующими патогенными бактериями. Этих возможных конкурентов тестируют по отдельности на средах с инфекционным агентом. Из культуры, успешно подавляющей рост патогенов, выделяют антибиотик, действие которого проверяют на животных моделях.
[5], рисунок модифицирован и адаптирован
Чтобы понять, может ли S. lugdunensis помешать колонизации носовой полости позвоночных животных золотистым стафилококком в естественных условиях, ученые провели следующий эксперимент. В носы хлопковых хомяков ввели два вида смешанных культур (S. aureus + S. lugdunensis IVK28 и S. aureus + S. lugdunensis IVK28ΔlugD) и каждую по отдельности. В контрольных случаях, когда вводили по одному штамму, все три культуры стабильно колонизировали носовую полость. Однако при введении смеси S. aureus + S. lugdunensis IVK28 количество золотистого стафилококка через 5 дней значительно уменьшилось по сравнению со смесью S. aureus + S. lugdunensis IVK28ΔlugD. Этот эксперимент показал, что продукция лугдунина позволяет штамму IVK28 эффективно конкурировать с золотистым стафилококком in vivo.
Оставалось разобраться, предотвращает ли присутствие S. lugdunensis в носу человека колонизацию бактериями S. aureus. Ципперер и его коллеги исследовали мазки из носовых ходов 187 госпитализированных больных. Из них у 60 человек (32,1%) обнаружили золотистого стафилококка и у 17 человек (9,1%) — S. lugdunensis. И только у одного пациента с S. lugdunensis в носу обитал S. aureus. У всех выделенных штаммов S. lugdunensis ПЦР-анализ продемонстрировал наличие lug-оперона, а все обнаруженные штаммы S. aureus оказались восприимчивы к лугдунину.
Перспективы
Лугдунин оказался первым обнаруженным бактериоцином нового класса — макроциклических тиазолидиновых пептидных антибиотиков. Все проверенные штаммы S. aureus (как природные, так и лабораторные) не смогли выработать резистентности к нему. Это дает надежду на то, что лугдунин в будущем станет коммерческим препаратом для борьбы с золотистым стафилококком.
И наконец, сам факт обнаружения нового антибиотика у представителя человеческой микробиоты должен послужить стимулом для активизации поиска других продуцентов бактериоцинов в составе именно таких сообществ. В дальнейшем это поможет медикам успешнее сдерживать наступление мультирезистентных патогенов.
Читайте также:


