Диски с антибиотиками для стафилококков
Решедько Галина Константиновна,
к.м.н., ассистент кафедры клинической фармакологии
Смоленской государственной медицинской академии
214019, г.Смоленск, ул.Крупской, 28, а/я № 5.
Тел.: +7(0812) 61 13 01, 61 13 27, Факс: (0812) 61 12 94,
E-Mail: galina@antibiotic.ru
В лекции рассмотрены основные методы определения чувствительности in vitro микроорганизмов к антимикробным препаратам (диско-диффузионный, Е-тестов, методы разведения). Отражены подходы к эмпирическому и этиотропному назначению антибиотиков в клинической практике. Обсуждены вопросы интерпретации результатов определения чувствительности с клинической и микробиологической точек зрения.
В настоящее время в клинической практике существуют два принципа назначения антибактериальных препаратов: эмпирическое и этиотропное. Эмпирическое назначение антибиотиков основано на знаниях о природной чувствительности бактерий, эпидемиологических данных о резистентности микроорганизмов в регионе или стационаре, а также результатах контролируемых клинических исследований. Несомненным преимуществом эмпирического назначения химиопрепаратов является возможность быстрого начала терапии. Кроме того, при таком подходе исключаются затраты на проведение дополнительных исследований.
|
Однако при неэффективности проводимой антибактериальной терапии, при нозокомиальных инфекциях, когда затруднительно предположить возбудителя и его чувствительность к антибиотикам стремятся проводить этиотропную терапию. Этиотропное назначение антибиотиков предполагает не только выделение возбудителя инфекции из клинического материала, но и определение его чувствительности к антибиотикам. Получение корректных данных возможно только при грамотном выполнении всех звеньев бактериологического исследования: от взятия клинического материала, транспортировки его в бактериологическую лабораторию, идентификации возбудителя до определения его чувствительности к антибиотикам и интерпретации полученных результатов.
|
Вторая причина, обусловливающая необходимость определения чувствительности микроорганизмов к антибактериальным препаратам - это получение эпидемиологических данных о структуре резистентности возбудителей внебольничных и нозокомиальных инфекций. В практике эти данные используют при эмпирическом назначении антибиотиков, а также для формирования больничных формуляров.
Методы определения чувствительности бактерий к антибиотикам делятся на 2 группы: диффузионные и методы разведения.
|
При определении чувствительности диско-диффузионным методом на поверхность агара в чашке Петри наносят бактериальную суспензию определенной плотности (обычно эквивалентную стандарту мутности 0,5 по McFarland) и затем помещают диски, содержащие определенное количество антибиотика. Диффузия антибиотика в агар приводит к формированию зоны подавления роста микроорганизмов вокруг дисков. После инкубации чашек в термостате при температуре 35 о -37 о С в течение ночи учитывают результат путем измерения диаметра зоны вокруг диска в миллиметрах (рис. 1).
Рисунок 1. Определение чувствительности микроорганизмов диско-диффузионным методом.
Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной (рис. 2). В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК).
Рисунок 2. Определение чувствительности микроорганизмов с помощью Е-тестов.
Несомненным достоинством диффузионных методов является простота тестирования и доступность выполнения в любой бактериологической лаборатории. Однако с учетом высокой стоимости Е-тестов для рутинной работы обычно используют диско-диффузионный метод.
Методы разведения основаны на использовании двойных последовательных разведений концентраций антибиотика от максимальной к минимальной (например от 128 мкг/мл, 64 мкг/мл, и т.д. до 0,5 мкг/мл, 0,25 мкг/мл и 0,125 мкг/мл). При этом антибиотик в различных концентрациях вносят в жидкую питательную среду (бульон) или в агар. Затем бактериальную суспензию определенной плотности, соответствующую стандарту мутности 0,5 по MсFarland, помещают в бульон с антибиотиком или на поверхность агара в чашке. После инкубации в течение ночи при температуре 35 о -37 о С проводят учет полученных результатов. Наличие роста микроорганизма в бульоне (помутнение бульона) или на поверхности агара свидетельствует о том, что данная концентрация антибиотика недостаточна, чтобы подавить его жизнеспособность. По мере увеличения концентрации антибиотика рост микроорганизма ухудшается. Первую наименьшую концентрацию антибиотика (из серии последовательных разведений), где визуально не определяется бактериальный рост принято считать минимальной подавляющей концентрацией (МПК). Измеряется МПК в мг/л или мкг/мл (рис. 3).
|
Рисунок 3. Определение значения МПК методом разведения в жидкой питательной среде.
На основании получаемых количественных данных (диаметра зоны подавления роста антибиотика или значения МПК) микроорганизмы подразделяют на чувствительные, умеренно резистентные и резистентные (рис. 4). Для разграничения этих трех категорий чувствительности (или резистентности) между собой используют так называемые пограничные концентрации (breakpoint) антибиотика (или пограничные значения диаметра зоны подавления роста микроорганизма).
Рисунок 4. Интерпретация результатов определения чувствительности бактерий в соответствии со значениями МПК.
Пограничные концентрации не являются неизменными величинами. Они могут пересматриваться, в зависимости от изменения чувствительности популяции микроорганизмов. Разработкой и пересмотром критериев интерпретации занимаются ведущие специалисты (химиотерапевты и микробиологи), входящие в специальные комитеты. Одним из них является Национальный комитет по клиническим лабораторным стандартам США (National Committee for Clinical Laboratory Standards - NCCLS). В настоящее время стандарты NCCLS признаны в мире и используются как международные для оценки результатов определения чувствительности бактерий при многоцентровых микробиологических и клинических исследованиях.
Существуют два подхода к интерпретации результатов определения чувствительности: микробиологический и клинический. Микробиологическая интерпретация основана на анализе распределения значений концентраций антибиотика, подавляющих жизнеспособность бактерий. Клиническая интерпретация основана на оценке эффективности антибактериальной терапии.
Клинически к чувствительным относят бактерии (с учетом параметров, полученных in vitro), если при лечении стандартными дозами антибиотика инфекций, вызываемых этими микроорганизмами, наблюдают хороший терапевтический эффект.
При отсутствии достоверной клинической информации подразделение на категории чувствительности базируется на совместном учете данных, полученных in vitro, и фармакокинетики, т.е. на концентрациях антибиотика, достижимых в месте инфекции (или в сыворотке крови).
К резистентным (устойчивым) относят бактерии, когда при лечении инфекции, вызванной этими микроорганизмами, нет эффекта от терапии даже при использовании максимальных доз антибиотика. Такие микроорганизмы имеют механизмы резистентности.
Клинически промежуточную резистентность у бактерий подразумевают в случае, если инфекция, вызванные такими штаммами, может иметь различный терапевтический исход. Однако лечение может быть успешным, если антибиотик используется в дозировке, превышающей стандартную, или инфекция локализуется в месте, где антибактериальный препарат накапливается в высоких концентрациях.
С микробиологической точки зрения к бактериям с промежуточной резистентностью относят субпопуляцию, находящуюся в соответствии со значениями МПК или диаметра зон, между чувствительными и резистентными микроорганизмами. Иногда штаммы с промежуточной резистентностью и резистентные бактерии объединяют в одну категорию резистентных микроорганизмов.
Необходимо отметить, что клиническая интерпретация чувствительности бактерий к антибиотикам является условной, поскольку исход терапии не всегда зависит только от активности антибактериального препарата против возбудителя. Клиницистам известны случаи, когда при резистентности микроорганизмов, по данным исследования in vitro, получали хороший клинический эффект. И наоборот, при чувствительности возбудителя может наблюдаться неэффективность терапии.
В определенных клинических ситуациях, когда недостаточно результатов исследования чувствительности обычными методами, определяют минимальную бактерицидную концентрацию.
Минимальная бактерицидная концентрация (МБК) - наименьшая концентрация антибиотика (мг/л или мкг/мл), которая при исследовании in vitro вызывает гибель 99,9% микроорганизмов от исходного уровня в течение определенного периода времени.
|
Значение МБК используют при терапии антибиотиками, обладающими бактериостатическим действием, или при отсутствии эффекта от антибактериальной терапии у особой категории больных. Частными случаями для определения МБК могут быть, например, бактериальный эндокардит, остеомиелит или генерализованные инфекции у пациентов с иммунодефицитными состояниями.
В заключение хотелось бы отметить, что на сегодняшний день не существует методов, которые позволили бы с абсолютной достоверностью прогнозировать клинический эффект антибиотиков при лечении инфекционных болезней. Однако, данные результатов определения чувствительности могут служить хорошим ориентиром клиницистам для выбора и коррекции антибактериальной терапии.
Таблица 1. Критерии интерпретации чувствительности бактерий

Представленный раздел каталога посвящен индикаторным и диагностическим дискам , применяемым при проведении лабораторных исследований для достижения следующих целей:
- выявление чувствительности микробам к препаратам и химическим реактивам, подавляющим их активность;
- разделение бактерий, грибов и иных возбудителей, размещенных в питательной среде.
Индикаторные диски для определения чувствительности микроорганизмов к антибактериальным препаратам
используются для выявления реакции грибов и иных возбудителей на использование подавляющих их активность веществ. Такой метод считается одним из наиболее выгодных. Дисковый способ определения чувствительности довольно прост, доступен и точен.
Диагностические диски и их наборы, предназначенные для разделения бактерий, грибов и иных возбудителей, размещенных в питательной среде необходимы при проведении исследований для осуществления селективной изоляции и разделения микроорганизмов, находящихся в питательной среде.
В нашей компании можно приобрести диски и их наборы от производителей с общемировой известностью. Мы предлагаем качественную продукцию от производителей по привлекательным ценам. Вся продукция соответствует мировым и российским стандартам качества.
Даже если Вы не обнаружили в нашем каталоге интересующие Вас позиции, можете оформить заявку, и наши специалисты сделают все возможное, чтобы удовлетворить все Ваши потребности.
Наименование
Единица измерения
Отдельные диски
Диски с антибиотиками Азитромицин 15 мкг
Флакон 100 дисков.
Азлоциллин 75 мкг
Амикацин 30 мкг
Амоксиклав, амоксицилин, аугментин, клавуланат
Ампициллин 10 мкг
Амфотерицин 100 ЕД
Бацитрацин 10 ЕД
Флакон 100 дисков.
Гентамицин 10 мкг
Гентамицин 120 мкг
Флакон 100 дисков.
Доксициклин 10 мкг
Флакон 100 дисков.
Доксициклин 30 мкг
Флакон 100 дисков
Итраконазол 10 мкг
Флакон 100 дисков
Канамицин 30 мкг
Флакон 100 дисков.
Клиндамицином 2 мкг
Флакон 100 дисков.
Клотримазол 10 мкг Himedia
Флакон 100 дисков.
Ко-тримоксазол (бисептол) 25 мкг
Флакон 100 дисков.
Левомицетин (хлорамфеникол) 30 мкг
Флакон 100 дисков.
диски с антибиотиками Левофлоксацин 5 мкг
Флакон 100 дисков.
Линкомицин 15 мкг
Флакон 100 дисков.
Ломефлоксацин 10 мкг
Флакон 100 дисков.
Нитроксолин (5-НОК) 30 мкг
Флакон 100 дисков.
Норфлоксацин 10 мкг
Флакон 100 дисков.
Оксациллин 1 мкг
Флакон 100 дисков.
Пефлоксацин 5 мкг
Флакон 100 дисков.
Тетрациклин 30 мкг
Флакон 100 дисков.
Триметоприм 5 мкг H
Флакон 100 дисков.
Флюконазол 10 мкг
Флакон 100 дисков.
Цефазолин 30 мкг
Флакон 100 дисков.
Цефалотин 30 мкг
Флакон 100 дисков.
Цефамандол 30 мкг
Флакон 100 дисков.
Флакон 100 дисков.
Цефокситин 30 мкг
Флакон 100 дисков.
Цефоперазон 75 мкг
Флакон 100 дисков.
Цефотаксим 30 мкг
Флакон 100 дисков.
Цефтриаксон 30 мкг
Флакон 100 дисков.
Ципрофлоксацин 5 мкг
Флакон 100 дисков.
Эритромицин 15 мкг
Флакон 100 дисков.
Диски с бацитрацином 0,04 ЕД
Флакон 50 дисков
Диски с бацитрацином 10 ЕД
Флакон 50 дисков
Диски с желчью для идентификации пневмококков
Флакон 100 дисков
Диски с новобиоцином
Флакон 50 дисков
Диски с оптохином для идентификации пневмококков
Флакон 100 дисков
Диски с сапонином для идентификации гемофильной палочки
Флакон 100 дисков
Наборы дисков
Набор дисков для дифференциации стафилококков, микрококков, цепочковых кокков (5 наим.)
Набор дисков для палочек сине-зел. гноя (12 наим.)
Набор дисков для стафилококков (20 наим.)
Набор дисков для стафилококков (15 наим.)
Набор дисков для энтерококков (10 наим.)
Набор дисков для энтеробактерий (20 наим.)
Набор дисков для энтеробактерий (30 наим.)
Набор дисков с противогриб. препаратами (6 наим.)
Набор дисков для определения метициллинрезистентности с питательной средой
Набор № 7 — Набор дисков для определения чувствительности энтеробактерий
Набор № 11 — Набор дисков для определения чувствительности синегнойной палочки и ацинетобактеров (11 наимен.)
Набор № 14 – Набор дисков для определения чувствительности.стафилококков
Набор № 17 — Набор дисков для определения чувствительности энтерококков
Набор № 21 — Набор дисков для оценки чувствительности гемофильной палочки к антибиотикам (10 наим.)
Набор № 24 — Набор дисков с противогрибыми препаратами (6 наим.)
Набор дисков для дифференциации неспорообразующих облигатно анаэробных бактерий
Набор дисков для дифференциации стафилококков, микрококков, цепочковых кокков
Набор дисков для идентификации гемофильной палочки

Различные штаммы стафилококков присутствуют у большинства людей и являются частью нормальной микробиоты кожных покровов, слизистых оболочек и нижнего отдела кишечника. Важное значение со стороны клинической практики и эпидемиологического надзора имеет бактерионосительство S. aureus, являющегося возбудителем многих инфекционных заболеваний человека. Стафилококками продуцируется большое количество факторов патогенности и токсинов. В настоящее время у стафилококков выделено и изучено более 30 различных экзотоксинов, эндотоксинов и суперэнтеротоксинов. Факторы патогенности микробов различными механизмами действуют на иммунную систему человека, что приводит к снижению сопротивляемости организма и развитию как острых, так и хронических форм заболеваний стафилококкового генеза. По данным литературных источников, приблизительно 40 % людей являются постоянными носителями S. аureus на слизистых оболочках крыльев носа, зева, коже подмышечных впадин и промежности, оставшуюся часть популяции относят к транзиторным и случайным носителям [1].
Важное клиническое значение бактерионосительства определяется типичностью процесса транслокации (переноса) стафилококков с наружных кожных покровов и слизистых оболочек во внутреннюю среду организма хозяина с развитием широкого спектра заболеваний [2, 3, 4]. Неблагоприятные факторы окружающей среды влияют не только на макроорганизм, но и на колонизирующие его микроорганизмы. В частности, усиливают действие механизмов агрессии потенциально патогенных бактерий и способность противостоять действию антибактериальных препаратов. Следовательно, стафилококки представляют опасность как для самого бактерионосителя, так и в эпидемиологическом плане, попадая в окружающую среду [5].
Ещё одна причина неэффективности лечения инфекций с помощью антибиотиков – стратегия, которую применяют многие практикующие врачи. Зачастую не проводится бактериологическое исследование и верификация возбудителя инфекции с последующим исследованием его чувствительности к антибиотикам. Получается нонсенс: лечение без диагностики [7]. Теряется время, пациент страдает не только от инфекции, но и от побочных эффектов антибиотика.
Цель работы – изучить наличие в микробиоме зева гемолитических штаммов стафилококков у здоровых молодых людей в открытом коллективе и определить чувствительность выделенных штаммов к антибактериальным препаратам, применяемым в практическом здравоохранении.
Материалы и методы исследования
Результаты исследования и их обсуждение
В результате исследования от 350 практически здоровых студентов без клинических признаков патологии носоглотки и верхних дыхательных путей было выделено 23 гемолитических штамма, идентифицированных как представители рода Staphylococcus spp.
У 7 % студентов без клинических признаков патологии носоглотки и верхних дыхательных путей выявлены гемолитические штаммы Staphylococcus spp. (рис. 1).
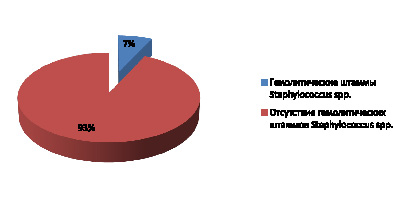
Рис. 1. Частота выявления гемолитических штаммов Staphylococcus spp. в микробиоме зева студентов, %
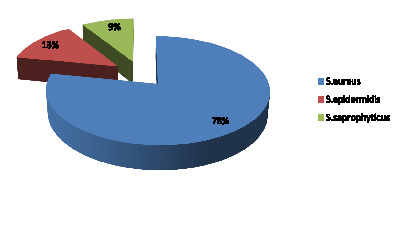
Рис. 2. Частота выявления видов Staphylococcus spp. в микробиоме зева студентов, %
Культуры, выделенные со слизистой оболочки зева, были представлены гемолитическими штаммами S. aureus – 18, S. epidermidis – 3, S. saprophyticus – 2 изолята (рис. 2). MRSA штаммы Staphylococcus spp. не выявлены.
Выделенные штаммы S. aureus в 100 % случаев чувствительны к следующим антибактериальным препаратам: пенициллину, ванкомицину, линезолиду, эритромицину, левофлоксацину, фузидину, клиндамицину, гентамицину, доксоциклину, оксациллину, рифампицину, ципрофлоксацину. В 6 и 50 % были устойчивы к левомицетину и ко-тримаксозолу соответственно (рис. 3).
Штаммы S. epidermidis чувствительны на 100 % к пенициллину, ванкомицину, линизолиду, эритромицину, левофлоксацину, левомицетину и ко-тримаксозолу. К фузидину, левомицетину чувствительны 33 % выделенных штаммов данного микроорганизма, к гентамицину и оксациллину чувствительны 27 %, к рифампицину 77 и 100 % не чувствительны к ципрофлоксацину (рис. 4).
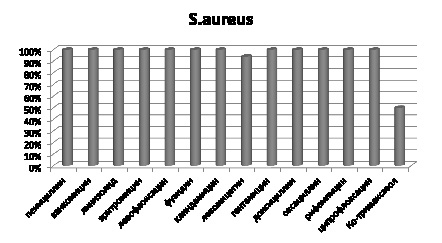
Рис. 3. Чувствительность выделенных штаммов S. aureus к антибиотикам, %
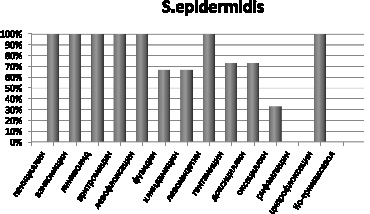
Рис. 4. Чувствительность выделенных штаммов S. epidermidis к антибиотикам, %
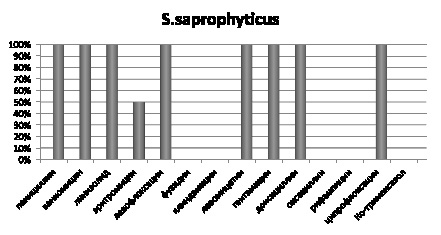
Рис. 5. Чувствительность выделенных штаммов S. saprophyticus к антибиотикам, %
Изоляты S. saprophyticus чувствительны на 100 % к пенициллину, ванкомицину, линизолиду, левофлоксацину, левомицетину, гентамицину, доксоциклину и ципрофлоксацину, на 50 % к эритромицину, и не чувствительны к фузидину, клиндамицину, оксациллину, рифампицину и ко-тримаксозолу (рис. 5).
Выводы
Получены данные о вариантах и частоте носительства условно-патогенных и патогенных стафилококков (7 %) в микробиоте зева молодых людей, при котором не установлено формирование патологических процессов в зеве, что свидетельствует о динамическом равновесии биоценоза и не требует активной эрадикации стафилококков.
Рецензенты:








АНТИБИОТИКОРЕЗИСТЕНТНОСТЬ ВЫДЕЛЕННЫХ СТАФИЛОКОККОВ
Стафилококковые инфекции кожи — многочисленные фурункулезы, карбункулезы, фолликулиты и другие заболевания — могут причинять немало проблем. При генерализованном, обширном процессе без антибиотиков не обойтись. Однако гораздо чаще заболевание протекает локально, и высыпания в основном концентрируются на каком-то одном участке.
Стафилококки в основном устойчивы ко многим антибиотикам или быстро к ним адаптируются.
Чувствительность микроорганизмов к антибиотикам определяют методами:
серийных разведений в жидкой или на плотной питательной среде;
диффузии в агар с применением дисков, содержащих антибиотики.
Исследованию на чувствительность к антибиотикам подвергается не исследуемый клинический материал (гной, мокрота, моча и т.д.), а микроб-возбудитель, выделенный в чистой культуре из этого материала. Поэтому исследуемый материал должен быть взят до начала антимикробной терапии.
По степени чувствительности к антимикробным препаратам микроорганизмы принято разделять на три группы: чувствительные, промежуточные и устойчивые (резистентные). Существует два подхода к интерпретации этих понятий.
Клинический подход, основанный на оценке эффективности антибактериальной терапии.
Микробиологический подход основан на анализе концентраций антибиотика в питательной среде.
Методы, применяемые в бактериологической лаборатории для определения чувствительности (устойчивости) возбудителей к антимикробным препаратам, принято разделять на две группы:
Методы серийных разведений антибиотика в питательной среде:
• разведение химиопрепарата в жидкой питательной среде;
• разведение химиопрепарата в плотной питательной среде.
Наиболее прост и доступен метод определения чувствительности с помощью дисков, пропитанных антибиотиками (дискодиффузионный метод). В стерильные чашки Петри, расположенные на горизонтальной поверхности, разливают по 15-20 мл плотной питательной среды(чаще всего 2 % агар на переваре Хоттингера, содержащий 0,11 - 0,13 % аминного азота). На поверхность застывшего и слегка подсушенного агара наливают 1 мл суспензии суточной культуры микроба-возбудителя, эквивалентную стандарту мутности 0,5 по Мак-Фарланду. Бактериальную взвесь равномерно распределяют по поверхности агара, а ее избыток удаляют пастеровской пипеткой. На поверхности засеянного агара пинцетом раскладывают диски с антибиотиками – по 5 – 6 дисков на каждую чашку на расстоянии 25 мм от центра чашки. См. рис 1.4
Рис. 1 Диско-диффузионный метод
Коммерческие диски диаметром 6 мм изготавливают из специального картона, а концентрация антибиотика в диске соответствует рекомендациям ВОЗ (Всесоюзная организация здравоохранения). В настоящее время за рубежом производят диспенсеры, позволяющие одновременно размещать на чашке с плотной питательной средой 6,8 12 дисков с антимикробными препаратами. Для размещения 6 дисков используют стандартную чашку Петри диаметром 90-100 мм, а для размещения 8 и 12 дисков применяют специальные чашки большого диаметра. Чашки выдерживают при 35-37 0 С 18 – 24 ч, после чего учитывают результаты опыта путем измерения зон задержки роста микробов вокруг дисков, включая диаметр самого диска с помощью прозрачной линейки.На результаты определения чувствительности микроорганизмов к антибактериальным препаратам влияют:
• толщина слоя питательной среды в чашке Петри (4 мм),
• скорость роста исследуемых штаммов,
• величина посевной дозы,
• скорость диффузии антибиотиков из дисков в питательную среду и другие факторы
Дискодиффузный метод позволяет разделить исследуемые возбудители в зависимости от диаметра зоны задержки роста на питательной среде: при зоне диаметром до 10 мм штамм расценивается как устойчивый; 11 – 15 мм – как малочувствительный, 15 – 25 мм – как чувствительный. Зоны, превышающие 25 мм, свидетельствуют о высокой чувствительности микроорганизма к данному антибиотику. Однако нельзя считать этот метод количественным. [4,6]
В своих исследованиях мы использовали девять разных антибиотиков: неомицин, полимиксин, ципрофлоксацин, рифампицин, олеандомицин, оксациллин, ампицилин, амоксицилин, цефазолин. И три разных вида стафилококков (не типированных до вида): st белый и st желтый - взяты смывом с поверхности кожи лица, st 15 - проба из незаживающей раны. Результаты представлены в таблице 1.
Таблица 1. Результаты изучения антибиотикорезистентности исследуемых микроорганизмов
Дискодиффузный метод (ДЦМ) наиболее распространен в лабораторной диагностике, так как он обладает рядом преимуществ — доступность тестирования, низкая себестоимость, возможность определять чувствительность антибиотиков в конкретной клинической ситуации, высокая воспроизводимость результатов.
Принцип метода. Диффузия антибиотика в агар приводит к формированию зоны подавления роста микроорганизмов вокруг дисков, которую измеряют линейкой. На поверхность агара в чашке Петри наносят бактериальную суспензию тестируемого микроорганизма определенной плотности; затем помещают диски, содержащие антибиотик, на расстоянии 20…25 мм друг от друга и далее измеряют зону подавления.
Выбор средств для тестирования. Международным стандартом среды для тестирования микроорганизмов является среда Мюллера-Хинтона. Стандартами NCCLS (Национального комитета клинических лабораторных стандартов США) предполагается использование именно этой среды или ее стандартизированных модификаций.
В большинстве микробиологических ветеринарных и медицинских лабораторий в России для оценки чувствительности выделяемых культур ДЦМ используют среду АГВ. Существенным недостатком этой среды является отсутствие стандартизации по содержанию двухвалентных катионов (кальций, магний, цинк), а также тимина и тимидина. Ввиду этого среда АГВ непригодна для определения антимикробной чувствительности к сульфаниламидам и ко-тримоксазолу в отношении всех микроорганизмов, а также при определении чувствительности Р. aeruginosa к имипенему, амино-гликозидам, фторхинолонам. Для определения чувствительности к макролидам и азитромицину на среде АГВ следует использовать диск с эритромицином.
При исследовании S. aureus на чувствительность к оксациллину (для выявления MRSA-штаммов) используется диск с 1 мг оксациллина. Зона задержки роста для чувствительных штаммов S. aureus составляет 13 мм и более, промежуточного уровня — 11…12 мм, устойчивых — 11 мм и менее. При этом следует учитывать, что все чувствительные к оксациллину штаммы стафилококка считаются чувствительными к цефалоспоринам I, II и IV поколения, ингибиторзащищенным пенициллинам и карбапенемам, а все устойчивые к оксациллину штаммы устойчивы ко всем β-лактамам (цефалоспорины, ингибиторзащищснныс пенициллины, карбопенемы) независимо от получаемых при тестировании на чашках зон задержки роста.
Для коагулазонегативных стафилококков зоны задержки роста, равные 18 мм и более, характеризуют чувствительность, 17 мм и менее — устойчивость к оксациллину.
Тестирование S. pneumoniae на чувствительность к пенициллину на среде АГВ с 5 % дефибринированной бараньей крови возможно при использовании диска с оксациллином (1 мг). При этом штаммы с зоной ингибиции 20 мм и более считаются чувствительными к пенициллину, амоксициллину, цефалоспоринам и карбапенемам. Штаммы с зоной подавления 19 мм и менее могут быть устойчивыми, промежуточно чувствительными или чувствительными. Для их оценки необходимо определять МПК. Непосредственное использование дисков с пенициллином, ампициллином, цефалоспоринами, карбапенемами приводит к ошибкам.
В настоящее время отсутствуют сведения о возможности использования среды АГВ для тестирования Enterococcus spp.
Постановка ДДМ. Включает несколько этапов.
Приготовление чашек с питательной средой. Приготовление чашек Петри с плотной питательной средой связано с рядом особенностей. Среду готовят в соответствии с инструкцией. Перед заполнением расплавленной средой чашки Петри устанавливают на строго горизонтальную поверхность. Глубина агарового слоя должна быть 4 мм, что достигается внесением 25…30 мл расплавленного агара в чашку диаметром 100 мм или 60…70 мл в чашку диаметром 150 мм. Соблюдение указанных условий связано с тем, что при увеличении толщины слоя агара уменьшается диаметр зон подавления роста в различной степени для разных антибиотиков, что может быть ошибочно расценено как резистентность. В то же время при недостаточной толщине слоя агара может происходить отраженная диффузия антибиотиков от дна чашки; это приводит к формированию больших зон подавления роста, и штамм может быть ошибочно оценен как чувствительный.
После заполнения чашки оставляют при комнатной температуре для застывания среды. При использовании свежеприготовленных чашек перед инокуляцией бактериальной взвеси их надо подсушить, что достигается выдерживанием при 37 °С с приоткрытой крышкой в течение 10…20 мин.
Хранить их можно в запаянных полиэтиленовых пакетах при 4…8 °С в течение 7…10 сут. Перед использованием их необходимо подсушить.
Приготовление суспензии и инокуляция. Бактериальную суспензию исследуемой культуры готовят в свежем бульоне или физиологическом растворе из 16…18-часовых колоний, выросших на плотной неселективной среде, соответствующей потребностям вида (МПА, КА и др.), или 5…6-часовой бульонной культуре. Плотность приготовленной суспензии должна соответствовать (1…2) ∙ 10 8 КОЕ/мл Е. coli. Такую плотность можно получить без особой погрешности при разведении в 2 раза бактериальной суспензии оптической плотности 5 ед. стандарта ГИСК им. Л. А. Тарасевича. В течение 15 мин после приготовления 1…2 мл суспензии наносят на поверхность агара, равномерно распределяя покачиванием, и удаляют избыток жидкости пипеткой. Приоткрытые чашки подсушивают при комнатной температуре в течение 10…15 мин.
Более удобно использование стерильных ватных тампонов. Тампон погружают в приготовленную суспензию, избыток влаги удаляют, отжимая его о стенку пробирки. Инокуляцию на поверхность питательной среды проводят штриховыми движениями, периодически поворачивая чашку Петри на 60°.
Наложение дисков и инкубация. На поверхность питательной среды не позднее чем через 15…20 мин после инокуляции накладывают диски с антибиотиками, но только при отсутствии неадсорбированных остатков бактериальной суспензии. Диски размещают с помощью стерильного пинцета. Расстояние от края чашки и между дисками должно быть 15…20 мм. Таким образом, на одну чашку диаметром 100 мм приходится не более 6 дисков. Они должны равномерно соприкасаться с поверхностью агара, для чего их следует аккуратно прижать пинцетом. Диск нельзя перекладывать на другое место. Испорченный заменяют другим диском.
Учет результатов. После инкубации рост на поверхности чашки должен быть сплошной и равномерный. Наличие отдельных колоний свидетельствует о том, что суспензия бактерий была недостаточно густой. В этом случае исследование следует повторить. Измеряют зону задержки роста (а не гемолиза) с обратной стороны чашки линейкой на темном фоне в отраженном свете. На кровяном агаре измерение осуществляют с верхней поверхности агара при закрытой крышке.
За зону ингибиции принимают участок полного отсутствия роста, видимый невооруженным глазом. Двойная зона является чаще всего результатом использования смешанной культуры, что требует ее рассева для очистки и повторного тестирования. Не следует обращать внимание на очень мелкие колонии, выявляемые в пределах зоны ингибиции роста только при особых условиях освещения или увеличения, и едва заметный налет у края зоны. Крупные колонии, выявляемые в пределах четкого участка подавления роста, свидетельствуют о наличии посторонней микрофлоры или различной резистентности клеток популяции, что требует повторного исследования.
При оценке антибиотикочувствительности роящихся штаммов протея зона задержки роста может быть затянута тонкой вуалеобразной пленкой, которая не мешает установлению границы зоны.
При оценке резистентности к сульфаниламидам и их комбинациям с триметопримом на среде Мюллера—Хинтона границу зоны задержки роста следует учитывать при уровне ингибиции роста 80 %.
При оценке результатов антибиотикочувствительности стафилококков в отношении оксациллина следует учитывать и самые мелкие колонии в пределах четкой зоны ингибиции роста.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Читайте также:


