Антибиотики от стафилококка и стрептококка в носу
Золотистый стафилококк – признаки и лечение. Симптомы золотистого стафилококка в кишечнике у взрослых
Золотистый стафилококк – аэробная бактерия, отличающаяся шарообразной формой и неподвижностью. Может провоцировать развитие разных заболеваний у детей. У взрослых встречается крайне редко. Анализ на золотистый стафилококк поможет выявить его присутствие в окружающей среде – на игрушках и посуде, постельном белье и коже человека, как абсолютно здорового, так и больного.
Классификация инфекции
В медицине выделяют две формы стафилококковой инфекции – генерализованную и очаговую. В первом случае речь идет о сепсисе, когда все системы и органы заражены стафилококком. Сепсис – опасное состояние, которое часто заканчивается летальным исходом даже на фоне оказания квалифицированной медицинской помощи.
Чаще диагностируется очаговая форма стафилококковой инфекции, когда выявляются заболевания кожных покровов, костной ткани, суставов. Отдельно врачи выделяют пищевое отравление токсинами – с характерными симптомами золотистого стафилококка в кишечнике у взрослых.
Стафилококковая инфекция может протекать в легкой, средней и тяжелой степени, острой или хронической форме.
Симптомы стафилококковой инфекции
Заболевания, вызванные рассматриваемой аэробной бактерией, не имеют каких-либо отличительных признаков. Если золотистый стафилококк поражает горло, то у человека может развиться ангина, фарингиты и ларингиты, отличающиеся тяжелым течением с высокой температурой тела и сильной слабостью. Заболевания дыхательной группы с частыми рецидивами считаются основным признаком присутствия бактерии в зеве.
Кроме этого, золотистый стафилококк может быть выявлен:
- в костной ткани – инфекция проникает при переломах или тяжелых ранениях;
- в фурункулах, карбункулах и абсцессах – как правило, инфицируется волосяная луковица, и процесс воспаления запускается снова и снова даже на фоне проводимого лечения;
- на коже – у ребенка появляются высыпания, дерматиты.
Нередко выявляется золотистый стафилококк у грудничка в кале. Диагностироваться это может еще в роддоме – инфицирование происходит во время тяжелых родов на фоне сниженного иммунитета у недоношенных детей или младенцев с врожденными патологиями.
Самое тяжелое состояние при инфицировании аэробной бактерией – токсический шок. Он отличается характерными симптомами – резким повышением температуры до критических показателей, тошнотой, острой болью в голове, сыпью на теле, появлением гнойного отделяемого из имеющихся ран. В таком случае никакие исследования не проводятся – только золотистый стафилококк может вызвать данное состояние. Назначается срочная терапия.
Лечение золотистого стафилококка
Антибиотики против золотистого стафилококка не всегда эффективны, поэтому их назначают лишь на начальной стадии развития заболевания. Эффективными будут только антибиотики последнего поколения – цефалоспорины и другие непенициллинового ряда.
Чаще всего врачи применяют комбинированную терапию. Если требуется лечение золотистого стафилококка в горле у ребенка, то будут назначены:
- обработка слизистой антисептическими растворами – хлорфиллиптом;
- иммуностимулирующие препараты;
- антистафилококковый бактериофаг.
Многих интересует, как вылечить золотистый стафилококк в зеве, который вызывает частые ангины, ларингиты, тонзиллиты. Без назначений врача не обойтись – привычные лекарственные препараты не помогают либо дают кратковременный эффект выздоровления. Специалист даст рекомендации по обработке слизистой глотки антисептическими растворами, проведет исследование на восприимчивость бактерии к антибиотикам и сделает медикаментозные назначения.
Чаще всего колонии рассматриваемых бактерий обнаруживаются в носу – они могут годами там находиться и не вызывать никаких заболеваний. Если же ребенок часто простужается, имеет отставание в росте и развитии, то хронических патологий не избежать. Как лечить золотистый стафилококк в носу у детей:
- госпитализировать ребенка в лечебное учреждение;
- проводить ежедневную санацию слизистой носа и глотки, так как имеется большой риск распространения инфекции;
- выполнять назначения врача для снятия тяжелых симптомов.
Независимо от того, какой именно орган поражен стафилококком, обязательно будут назначаться витамины, иммуномодуляторы и пробиотики для восстановления кишечной микрофлоры.
Длительность лечения стафилококковой инфекции – от 7 до 30 дней, что зависит от своевременности диагностирования заболевания и выявления больших колоний бактерии. Если терапия проводится в точном соблюдении назначений лечащего врача, то прогноз по заболеванию благоприятный.
Более подробно о том, как передается золотистый стафилококк и какие симптомы укажут на наличие аэробных бактерий, можно узнать на нашем сайте Добробут.ком.
нужна консультация врача лор, клинициста
Привет!
У меня хронический тонзилит, лорингит. Удалены гланды.
Анализ показал - на слизистой бактериальное инфицирование
стафилококков, энтерококков и цитробактерррром.
На слизистой зева бактериальное инфицирование
B-гемолитическим стрептококком и энтерококком.
нос: staph et citrobacter
зев: B-hacm strept, arcanobacter, luterococcus
Назначили:
антибиотик для носа - Амикацин 7 дн
(тк единственный антибиотик к которому чувствительность),
+20 дн бифиформ.
После курса полоскать 0,04% раствор хлоргексицина биглюконат 3р/день/7дн
Потом полоскать морской солью 3р/день/30дн
После антибиотик для горла - Клиндамицин 7дн
Вопрос: не хочу пить Амикацин, он токсичный и дает на почки осложнения возможно,
чем его можно заменить? И еще чем лечат грамположительные палочки,
это по части генекологии?
Спасибо
Т.к. вы не трастовый пользователь. Как стать трастовым.
Т.к. тема является архивной.
Т.к. вы не трастовый пользователь (не подтвержден телефон). Укажите и подтвердите телефон. Подробнее о трастовости.
Т.к. тема является архивной.
Т.к. вы не трастовый пользователь (не подтвержден телефон). Укажите и подтвердите телефон. Подробнее о трастовости.
Т.к. тема является архивной.
Т.к. вы не трастовый пользователь (не подтвержден телефон). Укажите и подтвердите телефон. Подробнее о трастовости.
Т.к. тема является архивной.
Т.к. вы не трастовый пользователь (не подтвержден телефон). Укажите и подтвердите телефон. Подробнее о трастовости.
Т.к. тема является архивной.
Т.к. вы не трастовый пользователь (не подтвержден телефон). Укажите и подтвердите телефон. Подробнее о трастовости.
Т.к. тема является архивной.
Т.к. вы не трастовый пользователь (не подтвержден телефон). Укажите и подтвердите телефон. Подробнее о трастовости.
Т.к. тема является архивной.
Лечение медицинскими приборами ДЭТА (DETA)
Вопрос. Как прибор DETA влияет на нормальную микрофлору ЖКТ при воздействии прибором на стрептококк и стафилококк?
Стафилококко-стрептококковая инфекция условно патогенна, но при развитии в организме, она может дать заболевания, чаще всего лор-патологию. Под воздействием антипаразитарного прибора состояние микрофлоры нормализуется.
Вопрос. Микробиолог интересуется, если мы воздействуем на стафилококк и стрептококк, не убивает ли при этом прибор DETA-AP полезную микрофлору?
Если вы начинаете лечить стафилококко-стрептококковую инфекцию тогда, когда у вас есть какое-то заболевание. В том же случае, когда вы просто хотите пролечить стафилококко-стрептококковую инфекцию и никаких жалоб или симптомов болезни у вас нет, то этой программой и пользоваться не нужно. Если же мы лечим какое либо заболевание , например ангину, вызванную стрептококком, то , конечно же, прибор не убивает полезную микрофлору, так как воздействует снайперский именно на стафилококки и стрептококки и, снижая их повышенное количество, вылечивает ангину.
Стрептококк и стафилококк паразитирует в каком-либо органе-мишени и этот орган начинает болеть. При воздействии в это время программ аппарата DETA-AP снижается уровень стафилококка и стрептококка. А в остальное время, поскольку стрептококк и стафилококк условно патогенны, то просто так применять эти программы не надо.
Вопрос. Беременность 37 недель, бак. посев мочи показывает стафилококк золотистый, показано ли лечение прибором?
Да, показано, программа по стафилококку золотистому, каждые 2-3 часа до достижения эффекта.
Вопрос: Можно ли ставить программы при стафилококке и папиломовирусе таким образом, сегодня на один, завтра на другой возбудитель?
Нет,так делать нельзя. Вирусные заболевания можно лечить несколько раз в день (кроме вируса гепатита В и С, потому что главная фильтрационная функция печени не работает), если лечите вирус папиломмы человека можно ставить программу и 1 раз и несколько раз, чем чаще , тем быстрее она уходит, обычно 10 дней бывает достаточно.
В настоящее время есть 3 программы по папиломмам, но по стафилококку если нет гнойной инфекции, если вы не видите его проявлений, то профилактически его лечить нельзя, если есть проявления стафилококка ( температура, гнойные выделения) ставить несколько раз в день, пока есть гнойные проявления, обычно 2-3 дня, ангины, отиты быстро разрешаются, если не проходит, значит, вы что-то не так сделали, потому что стафилококков есть много видов, есть мутосомные формы, посмотрите в антисептиках(он 5 сверху-антисептик при операциях- стафилококк, стрептококк), это как раз та внутрибольничная инфекция, мутировшая форма.
Т.к. вы не трастовый пользователь (не подтвержден телефон). Укажите и подтвердите телефон. Подробнее о трастовости.
, MD, FACP, Charles E. Schmidt College of Medicine, Florida Atlantic University;
, MD, Wellington Regional Medical Center, West Palm Beach
Last full review/revision September 2017 by Larry M. Bush, MD, FACP; Maria T. Perez, MD





Способность к тромбообразованию путем продуцирования коагулазы отличает вирулентный патоген, Staphylococcus aureus, от менее вирулентных коагулазонегативных штаммов стафилококка. Коагулазопозитивный S. aureus - один из самых распространенных и опасных для человека болезнетворных микроорганизмов из-за его высокой вирулентности и способности к формированию резистентности к антибиотикам.
Коагулазонегативные виды, такие как S. epidermidis все чаще ассоциируются с внутрибольничной инфекцией; S. saprophyticus является причиной инфекции мочевых путей. Коагулазонегативный S. lugdunensis может вызывать инвазивное заболевание с вирулентностью, аналогичной S. aureus. В отличие от большинства коагулазонегативных стафилококков, S. lugdunensis часто остается чувствительным к пенициллиназа-резистентным бета-лактамным антибиотикам (например, к метициллину).
Патогенные стафилококки распространены повсеместно. Около 30% здоровых взрослых, обычно временно, являются носителями стрептококков в носовых проходах и около 20% – на коже; отсюда стрептококки могут инфицировать самого носителя и других людей. Обсемененность пациентов стационаров и медперсонала значительно выше. Инфекция, вызванная S. aureus, чаще встречается среди бактерионосителей, чем среди лиц, которые таковыми не являются, и обычно вызвана колонизирующим штаммом.
Факторы риска
Людьми, предрасположенными к стафилококковой инфекции, являются:
Новорожденные младенцы и кормящие матери
Пациенты с гриппом, хроническими бронхолегочными заболеваниями (например, муковисцидоз, эмфизема), лейкемией, опухолями, хроническими кожными заболеваниями или сахарным диабетом
Пациенты с трансплантатами, имплантированными протезами, другими инородными телами или имплантированными внутрисосудистыми пластмассовыми катетерами
Пациенты, получающие глюкокортикоиды, иммуносупрессанты, лучевую терапию, или противоопухолевую химиотерапию
Пациенты с хронической болезнью почек и находятся на диализе
Пациенты с хирургическими разрезами, открытыми ранами или ожогами
Предрасположенным пациентам могут передаваться антибиотикорезистентные штаммы стафилококков от других пациентов, медперсонала или контактно-бытовым путем через предметы ухода за пациентами. Передача через руки персонала – наиболее распространенный способ заражения, воздушно-капельная передача также актуальна.
Болезни, вызываемые стафилококками
Стафилококки вызывают заболевание путем
Прямого проникновения в ткань
Иногда продукцией экзотоксина
Прямое проникновение в ткань является наиболее распространенным механизмом возникновения стафилококковых заболеваний, включая следующее:
Иногда стафилококками продуцируются множественные экзотоксины. Некоторые имеют локальные проявления; другие вызывают выработку цитокина из определенных Т-клеток, что ведет к серьезным системным поражениям (например, поражения кожи, шок, недостаточность органа, смерть). Лейкоцидин Пантона-Валентайна (PVL) является токсином, продуцируемым штаммами, инфицированными определенным бактериофагом. Лейкоцидин Пантон-Валентайна, как правило, присутствует в штаммах бытового метициллин резистентного стафилококка S. aureus (БМРЗС) и считается, что он опосредует способность к формированию некрозов; однако этот эффект не был доказан.
Токсин-опосредованные стафилококковые заболевания включают следующие:
Синдром токсического шока
Стафилококковый синдром ошпаренной кожи
Стафилококковое пищевое отравление
Упомянутые болезни обсуждаются далее в Р у к оводстве .
S. aureus вызываетбактериемию, которая часто приводит к появлению метастатических очагов инфекции, может возникнуть от инфекции S. aureus любой локализации, но особенно часто – от инфекции, связанной с присутствием внутрисосудистых катетеров или других инородных тел. Может также проявляться без какой-либо четко выявленной первичной локализации. S. epidermidis и другие коагулазонегативные стафилококки чаще вызывают внутрибольничную бактериемию, связанную с наличием внутрисосудистых катетеров и других инородных тел, так как они могут образовывать биопленки на этих материалах. Стафилококковая бактериемия является основной причиной заболеваемости (особенно удлинения периода госпитализации) и смертности среди ослабленных пациентов.
Инфекция кожи – наиболее распространенная форма стафилококкового заболевания. Поверхностные инфекции могут быть диффузными, с везикулярными пустулами, покрытыми коркой (импетиго), иногда в виде флегмоны или очаговыми с узловыми абсцессами (фурункулы и карбункулы). Более глубокие кожные абсцессы также широко распространены. Могут встречаться тяжелые некротизирующие инфекции кожи.




Стафилококки обычно являются причиной раневых и ожоговых инфекций, послеоперационных раневых инфекций и мастита или абсцесса груди у кормящих матерей.
Неонатальные инфекции обычно появляются у детей в течение 6 нед после рождения и включают:
Повреждения кожи с шелушением или без него
Пневмония, которая возникает в амбулаторных условиях, не является распространенной, однако может развиваться у пациентов
Пациенты, получающие кортикостероиды или иммуносупрессанты
Имеют хронические бронхолегочные или другие заболевания с высоким уровнем риска
Стафилококковая пневмония может быть первичной инфекцией, а также следствием гематогенного распространения инфекции S. aureus из других частей тела (например инфицирование внутривенного катетера, эндокардит, инфекция мягких тканей) или инъекционной наркомании. Однако S. aureus является частой причиной развития внутрибольничной пневмонии, включая вентиляторную пневмонию при ИВЛ
Стафилококковая пневмония иногда характеризуется формированием абсцессов легких, сопровождаемых быстрым развитием пневматоцеле и эмпиемы. Внебольничный MRSA часто является причиной развития тяжелой некротизирующей пневмонии.
Эндокардит может развиться у инъекционных наркоманов и пациентов с протезами клапанов сердца. Поскольку частота использования внутрисосудистых катетеров и имплантаций сердечных устройств увеличилась, S. aureus стал ведущей причиной бактериального эндокардита.
Эндокардит, вызванный S. aureus, является острым фебрильным заболеванием, которое часто сопровождается формированием висцеральных абсцессов, эмболий, перикардита, подногтевых петехий, кровоизлияний в конъюнктиву глаза, пурпуры, шумов в сердце и сердечной недостаточности, как следствие вторичного повреждения клапанов сердца.
Остеомиелит встречается наиболее часто у детей, вызывая озноб, лихорадку и боль поражённой кости. Впоследствии и мягкие ткани над зоной поражения становятся красными и отечными. Может наблюдаться суставная инфекция, что часто приводит к суставному выпоту, предполагая септический артрит, а не остеомиелит. Большинство инфекций позвонков и межпозвоночных дисков у взрослых связаны с S. aureus.
Стафилококковый синдром токсического шока может быть следствием применения вагинальных тампонов или осложнением любого типа инфекции S. aureus (например послеоперационная раневая инфекция, ожоговые инфекции, инфекции кожи). Хотя большинство случаев связано с метициллин-чувствительным S. aureus (MSSA), случаи, связанные с MRSA, становятся все более частыми.

Стафилококковый синдром ошпаренной кожи вызывается несколькими токсинами, так называемыми эксфолиатинами, и проявляется как детский эксфолиативный дерматит, характеризующийся крупными волдырями и шелушением верхнего слоя кожи. В конечном счёте происходит эксфолиация. Синдром "ошпаренной кожи" наиболее часто встречается у младенцев и детей
Стафилококковое пищевое отравление вызывается употреблением в пищу инфицированных стафилококками продуктов питания (устойчивый к высокой температуре стафилококковый энтеротоксин). Пища может быть заражена стафилококковыми носителями или людьми с выраженными заболеваниями кожи. В пище, недостаточно термически обработанной или оставленной при комнатной температуре, стафилококки активно размножаются и вырабатывают энтеротоксин. Многие продукты могут служить питательной средой, не изменяя при этом своих органолептических свойств (вкус и запах). Тяжелая тошнота и рвота начинаются спустя 2–8 ч после приема пищи, как правило, сопровождаемыми спазмами брюшной полости и диареей. Приступ непродолжительный, часто составляет 12 ч.
Диагностика
Цитобактерископия мазков, окрашенных по Граму, и посев на обогащенные питательные среды
Диагноз стафилококковой инфекции устанавливается после бактериоскопии мазков, окрашенных по Граму, и посевов инфицированного материала на питательные среды.
Необходимо провести тесты на восприимчивость, поскольку метициллин-резистентные микроорганизмы теперь повсеместно распространены и требуют альтернативной терапии.
Если подозревается стафилококковый синдром ошпаренной кожи, то следует провести посевы крови, мочи, носоглотки, отделяемого пупочного кольца, пораженной кожи или любого подозреваемого очага инфекции; интактные волдыри являются асептическими. Хотя диагноз обычно ставится клинически, биопсия зараженной кожи может помочь подтвердить диагноз.
Стафилококковое пищевое отравление обычно предполагают из-за регистрации однотипных случаев инфекции (например, в пределах семьи, среди посетителей массовых социальных учреждений или ресторанов). Подтверждение (как правило, отделом здравоохранения) подразумевает выделение стафилококков в подозрительной пище и иногда анализ на наличие энтеротоксинов.
При остеомиелите рентгенологические изменения могут не проявиться до 10–14 дней болезни, и размягчение кости, и периостальная реакция могут не выявляться и дольше. Отклонения по МРТ, КТ или сканирование радионуклида кости часто становятся очевидными раньше. Биопсия кости (открытая или перкутатная) должна быть проведена для идентификации патогена и анализа антибиотикорезистентности.
В некоторых учреждениях с высокой распространённостью метициллин - резистентных штаммов S. аureus обычно проверяют пациентов на стафилококковое носительство (активное наблюдение), используя лабораторные методы быстрой диагностики, чтобы оценить образцы мазков из носа. Некоторые учреждения проводят скрининг только у пациентов группы риска (например тех, кто поступает в отделение интенсивной терапии, у кого ранее была инфекция MRSA, кому планируются сосудистые, ортопедические оперативные вмешательства или операция на сердце).
Быстрая идентификация MRSA:
позволяет произвести изоляцию контактных носителей и, в случае необходимости предоперационной антибиотикопрофилактики против кожных микроорганизмов, назначить ванкомицин как часть их курса лечения
уменьшает распространение MRSA
может снизить частоту внутрибольничных инфекций MRSA
Однако лечение, направленное на деколонизацию (например, местное применение назального мупироцина), хотя иногда и проводится, но еще окончательно не доказало своей эффективности, так как выявлена резистентность к мупироцину. Ежедневное обмывание с хлоргексидином пациентов отделения интенсивной терапии снижает частоту инфекций, вызванных MRSA.
Лечение
Местные меры (например, санация раны, удаление катетеров)
Антибиотики выбираются с учетом тяжести заболевания и результатов антибиотикограммы
Контроль стафилококковых инфекций включает дренирование абсцесса, санацию некротической ткани, удаление инородных тел (включая внутрисосудистые катетеры) и назначение антибиотиков ( Лечение антибиотиками стафилококковых инфекций у взрослых).
Первоначальный выбор и дозировка антибиотиков зависят от
вероятности того, что задействованы резистентные штаммы
Таким образом, необходимо иметь данные о циркуляции антибиотикорезистентных штаммов в определенном регионе для стартовой терапии (и в конечном счете знать фактическую антибиотикочувствительность выделенного микроорганизма).
Лечение токсин-опосредованного стафилококкового заболевания (самым тяжелым из которых является синдром токсического шока) подразумевает деконтаминацию токсин-продуцирующих областей (ревизия хирургических ран, некрэктомия, промывание), интенсивную терапию (включая внутривенное введение жидкостей, вазопрессоры и респираторную поддержку), коррекцию водно-электролитного баланса и антибактериальные препараты. Доказательства in vitro свидетельствуют о предпочтительном назначении ингибиторов синтеза белка (например, клиндамицин по 900 мг внутривенно каждые 8 ч, линезолид 600 мг внутривенно каждые 12 ч) по сравнению с другими классами антибиотиков. В тяжелых случаях оправдано применение внутривенного иммуноглобулина.
Многие стафилококковые штаммы продуцируют пенициллиназу, фермент, который инактивирует некоторые бета-лактамные антибиотики; эти штаммы являются резистентными к пенициллину G, ампициллину и противопсевдомонадному пенициллину.
Внебольничные штаммы часто чувствительны к пенициллиназа-резистентным пенициллинам (например, метициллину, оксациллину, нафциллину, клоксациллину, диклоксациллину), цефалоспоринам, карбапенемам (например, имипенему, меропенему, эртапенему, дорипенему), тетрациклинам, макролидам, фторхинолонам, триметоприму/сульфаметоксазолу (TMP/SMX), гентамицину, ванкомицину и тейкопланину.
Изоляты MRSAстали повсеместно распространены, особенно в стационарах. Кроме того, внебольничный МRSA появился за последние несколько лет в большинстве географических регионов. Как правило, внебольничные MRSA обладают меньшей резистентностью ко многим антибиотикам, в отличие от внутрибольничных. Эти штаммы, хотя и резистентные к большинству бета-лактамов, обычно чувствительны к TMP/SMX, тетрациклинам (миноциклину, доксициклину) и часто чувствительны к клиндамицину, однако есть возможность развития резистентности к клиндамицину у штаммов с индуцируемой устойчивостью к эритромицину (эти штаммы могут быть выявлены с помощью D-теста). Ванкомицин эффективен против большинства MRSA, иногда в сочетании с рифампином и аминогликозидами при тяжелых инфекциях (таких как остеомиелит, инфекции протезированных суставов, эндокардит протезированного клапана). Назначение альтернативного препарата (даптомицин, линезолид, тедизолид, далбаванцин, оритаванцин, тигециклин, хинупристин/дальфопристин, TMP-SMX, возможно цефтаролин) следует рассматривать при лечении метициллин-резистентных штаммов S. аureus с МИК (минимальная ингибирующая концентрация) ванкомицина > 1,5 мкг/мл.
В США появились штаммы ванкомицин-резистентного S. aureus (VRSA; МИК > 16 мкг/мл) и штаммы S. aureus с умеренной чувствительностью к ванкомицину (VISA, МИК 4–8 мкг/мл). Для терапии инфекций, вызванных этими штаммами стафилококка, требуется назначение линезолида, тедизолида, хинупристина/дальфопристина, даптомицина, TMP/SMX или цефтаролина.
Поскольку распространённость метициллин - резистентных штаммов S. аureus увеличилась, стартовое лечение тяжелых стафилококковых инфекций (особенно тех, которые возникают в стенах учреждений здравоохранения) должно включать препарат с высокой активностью против метициллин-резистентного S. аureus. Таким образом, адекватными лекарственными средствами являются:
Для доказанных или подозреваемых инфекций кровотока– ванкомицин или даптомицин
Для пневмонии – ванкомицин, телаванцин или линезолид (т к даптомицин не проявляет должной активности в легких)
16 августа 2016
- 9970
- 7,0
- 0
- 6
Структурная формула нового пептидного антибиотика.
Немецкие ученые обнаружили новое оружие для борьбы с больничным монстром — мультирезистентным золотистым стафилококком. Долгие годы оно скрывалось не в вечной мерзлоте или Марианской впадине, а прямо под нашим носом. Вернее — в нём.
В последние годы во всем мире увеличилось количество инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. Организмы с множественной лекарственной резистентностью (multidrug-resistant organisms, MDRO), такие как метициллин-резистентный золотистый стафилококк, нечувствительные к ванкомицину энтерококки или резистентные к цефалоспоринам третьего поколения грамотрицательные бактерии, в ближайшие десятилетия могут стать более частыми причинами смерти, чем рак [1].
Несколько лет назад удалось обнаружить, что представители человеческой микробиоты способны производить бактериоцины, поражающие близкородственных бактерий [2]. Например, в 2014 году из человеческого комменсала Lactobacillus gasseri выделили и описали новый синтезируемый рибосомами тиопептидный антибиотик — лактоциллин [3].
Семейные разборки
Немецкий исследователь Александр Ципперер со своими сотрудниками в июле 2016 года сообщил о том, что обнаружил в человеческом носу бактерию Staphylococcus lugdunensis IVK28, которая подавляет рост метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) [1].
Стафилококки относятся к типичным бактериям-комменсалам, колонизирующим кожу и поверхности слизистых оболочек. Staphylococcus aureus — шаровидные грамположительные бактерии, вырабатывающие каротиноидный пигмент, который придает их клеткам золотистый цвет (рис. 1). Эти микроорганизмы чрезвычайно устойчивы к внешним воздействиям и выживают в воздухе, пыли, почве, продуктах питания, на оборудовании пищевых производств и предметах быта [6], [7].
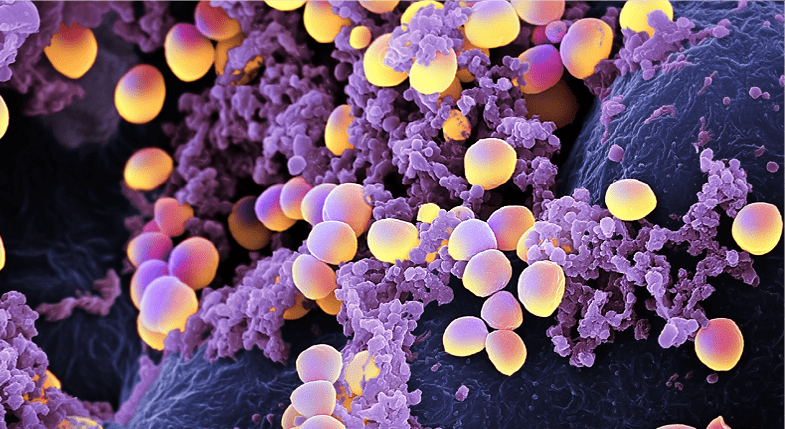
Рисунок 1. Staphylococcus aureus и лейкоциты.
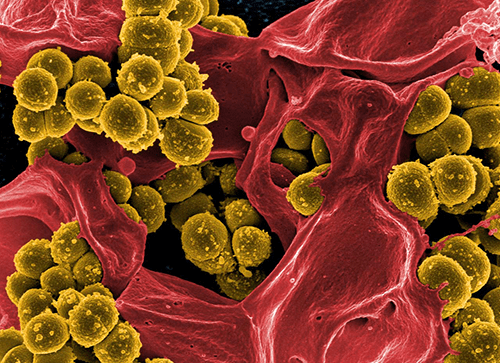
Рисунок 2. Метициллин-резистентные золотистые стафилококки.
Staphylococcus aureus — бактерия условно-патогенная, проявляющая свои патологические свойства только в благоприятных условиях, а создает их, как правило, ослабление иммунитета носителя. Активная жизнедеятельность стафилококка может привести к разнообразным заболеваниям [5], [7], [8]:
- кожи (прыщи, фурункулы, синдром ошпаренной кожи);
- органов дыхания (плеврит, пневмония);
- костной и соединительной тканей (артрит, остеомиелит);
- нервной системы и органов чувств (отит, менингит);
- сердечно-сосудистой системы (эндокардит, флебит, стафилококковая бактериемия).
Факторы патогенности S. aureus — это микрокапсула, компоненты клеточной стенки, ферменты агрессии и токсины. Микрокапсулы защищают клетки бактерий от фагоцитоза, способствуют их адгезии и распространению по организму хозяина. Составляющие клеточной стенки (например пептидогликан, тейхоевые кислоты и белок А) вызывают развитие воспаления, обездвиживают фагоциты и нейтрализуют иммуноглобулины. Коагулаза, главный фермент агрессии, вызывает свертывание плазмы крови [7], [9].
Наиболее опасны метициллин-резистентные стафилококки (methicillin-resistant S. aureus, MRSA) (рис. 2). Метициллин — это модифицированный пенициллин, с помощью которого еще недавно успешно боролись со стафилококковой инфекцией. MRSA устойчивы не только к метициллину, но и к другим антибиотикам пенициллиновой группы (диклоксациллину, оксациллину, нафциллину и др.), а также к цефалоспоринам. В последнее время выявлены штаммы и с более широким спектром устойчивости: ванкомицин-резистентные (VRSA) и гликопептид-резистентные (GISA) [6], [9], [10].
Штамм S. lugdunensis IVK28 эффективно боролся со своим вредоносным родственником лишь в условиях недостатка железа и только на твердых агаризованных средах (рис. 3, слева). Механизм противостояния был неясен, а потому Ципперер провел транспозонный мутагенез клеток выделенного штамма — чтобы выявить ген, ответственный за синтез смертельного для S. aureus вещества.

В итоге удалось получить мутанта IVK28, который не мог подавлять рост MRSA. Анализ места встройки транспозона показал, что тот нарушил структуру гена предполагаемой нерибосомной пептидсинтетазы (НРПС). Оказалось, что этот ген вместе с другими последовательностями, связанными с биосинтезом антибиотиков, входит в состав оперона размером 30 т.п.н. Это указывало на то, что предполагаемая молекула ингибитора может быть комплексом нерибосомных пептидов.
Оперон методом ПЦР обнаружили во всех культурах S. lugdunensis, а значит, он характерен для всего вида, а не только для штамма IVK28. Однако GC-состав оперона (26,9%) отличался от GC-состава остального генома S. lugdunensis (33,8%), что свидетельствовало о возможном заимствовании этого полезного генетического кластера у других видов бактерий — путем горизонтального переноса .
Оперон состоит из генов lugA, B, C и D, кодирующих пептидсинтетазные белки (см. врезку ниже), а также из других генов, чьи продукты необходимы для синтеза и транспорта нерибосомного пептида.
Чтобы окончательно вменить оперону участие в антибактериальной деятельности S. lugdunensis, наименьший ген (lugD) удалили. Мутант ΔlugD, как и ожидалось, не мог подавлять рост золотистого стафилококка, но когда в него ввели плазмиду с работающим геном lugD, агрессивный фенотип восстановился (рис. 3, в центре и справа).
Секретное оружие
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.
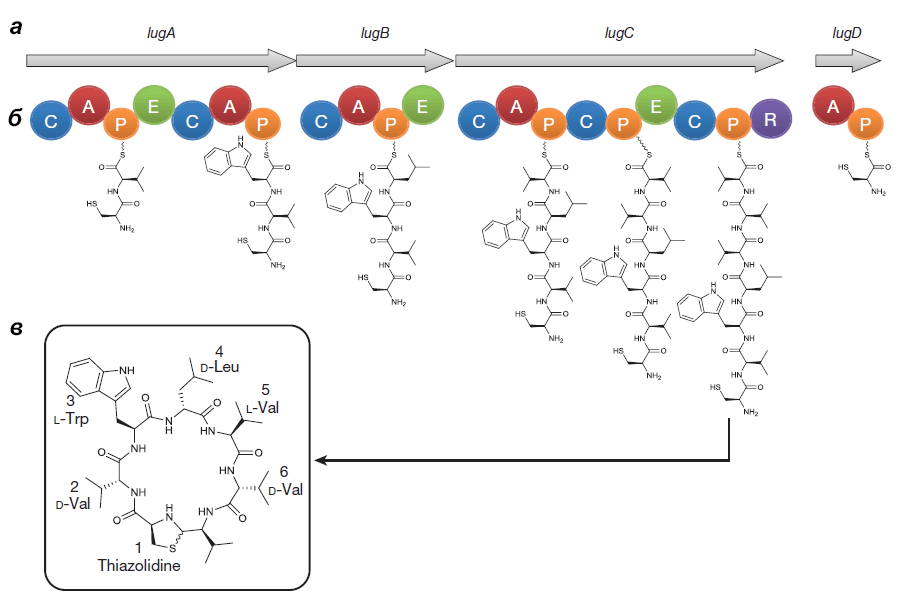
Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров — белков, ДНК и пептидогликанов [5].
Этот класс пептидов синтезируется в клетках низших грибов и бактерий без участия рибосом. Нерибосомные пептиды (НРП) также встречаются и у высших организмов, которые имеют бактерий-комменсалов [12].
НРП подразделяются на несколько функциональных групп [13]:
- антибиотики (ванкомицин);
- предшественники антибиотиков (ACV-трипептид — предшественник пенициллина и цефалоспорина);
- иммуносупрессоры (циклоспорин);
- противоопухолевые пептиды (блеомицин);
- сидерофоры (пиовердин);
- токсины (HC-токсин);
- сурфактанты (сурфактин).
Каждый модуль состоит как минимум из трех доменов:
- конденсирующего (принимающего пептидную цепь из предыдущего модуля);
- аденилирующего (выбирающего нужную аминокислоту);
- пептидильного (образующего пептидную связь).
Нередко модули включают и другие домены, в том числе эпимеризующий, который преобразует L-аминокислоты в D-формы [14].
По аналогии с триплетным рибосомным кодом для синтеза белка существует и нерибосомный, код НРПС, определяемый 10 остатками аминокислот в субстрат-связывающем кармане аденилирующего домена. От комбинации этих остатков зависит то, какая аминокислота будет встроена в пептид конкретным модулем НРПС. Зная этот код, можно предсказывать субстратную специфичность аденилирующих доменов и даже произвольно изменять ее посредством замены аминокислот в домене [14].
В экспериментах немецких ученых лугдунин действовал не только на метициллин-резистентных стафилококков, но и на гликопротеин-резистентных, и даже на других грамположительных бактерий типа листерии и ванкомицин-резистентного энтерококка (табл. 1). Минимальная ингибирующая концентрация (МИК) нового бактериоцина — 1,5–12 мкг × мл −1 , что говорит о высокой активности вещества. При этом такие концентрации никак не влияли на человеческую сыворотку, не вызывали лизис нейтрофилов или эритроцитов и не ингибировали метаболическую активность моноцитов. Бактериальные же клетки под действием лугдунина в концентрации даже ниже МИК прекращали синтезировать ДНК, РНК, белки и компоненты клеточной стенки. В этом отношении лугдунин напоминает даптомицин, дающий такой же эффект, но способ действия которого пока не изучен. Не было отмечено возникновения резистентности клеток S. aureus к лугдунину даже после их месячного выращивания на малых концентрациях.
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл −1 ) |
|---|---|---|
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 |
| + 50% человеческой сыворотки крови | 1,5 | |
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 |
| Staphylococcus aureus Mu50 | GISA | 3 |
| Staphylococcus aureus SA113 | 3 | |
| Staphylococcus aureus RN4220 | 3 | |
| Enterococcus faecium BK463 | VRE | 3 |
| Enterococcus faecalis VRE366 | VRE | 12 |
| Listeria monocytogenes ATCC19118 | 6 | |
| Streptococcus pneumoniae ATCC49619 | 1,5 | |
| Bacillus subtilis 168 (trpC2) | 4 | |
| Pseudomonas aeruginosa PAO1 | >50 | |
| Escherichia coli DH5α | >50 | |
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. | ||
Испытания в боевых условиях
Как и полагается, способность лугдунина лечить стафилококковые инфекции продемонстрировали in vivo на мышиной модели (рис. 5). У шести мышей сбрили шерсть на спине и, повредив кожу многократным приклеиванием/отклеиванием пластыря, нанесли на это место золотистого стафилококка. Затем кожу обработали мазью, содержащей 1,5 мкг лугдунина, и спустя шесть часов оценили результат. Обработка новым антибиотиком сильно сокращала или даже полностью уничтожала популяцию S. aureus. Причем не только на поверхности кожи, но и в более глубоких ее слоях.
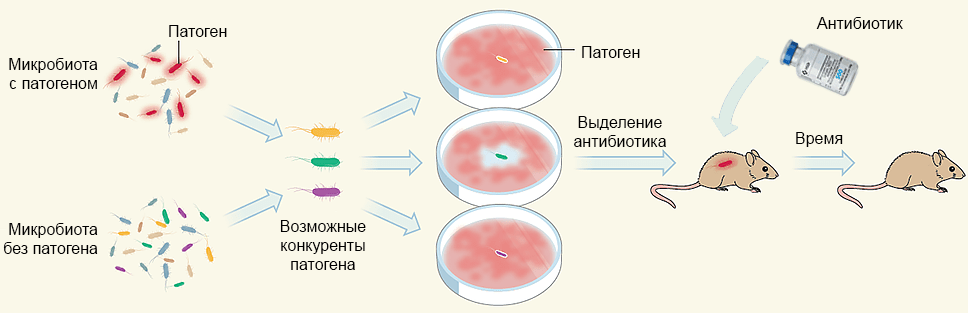
Рисунок 5. Общая схема подхода к идентификации природного антибиотика. Из бактериальных популяций человеческого тела отбирают представителей, которые не могут сосуществовать с интересующими патогенными бактериями. Этих возможных конкурентов тестируют по отдельности на средах с инфекционным агентом. Из культуры, успешно подавляющей рост патогенов, выделяют антибиотик, действие которого проверяют на животных моделях.
[5], рисунок модифицирован и адаптирован
Чтобы понять, может ли S. lugdunensis помешать колонизации носовой полости позвоночных животных золотистым стафилококком в естественных условиях, ученые провели следующий эксперимент. В носы хлопковых хомяков ввели два вида смешанных культур (S. aureus + S. lugdunensis IVK28 и S. aureus + S. lugdunensis IVK28ΔlugD) и каждую по отдельности. В контрольных случаях, когда вводили по одному штамму, все три культуры стабильно колонизировали носовую полость. Однако при введении смеси S. aureus + S. lugdunensis IVK28 количество золотистого стафилококка через 5 дней значительно уменьшилось по сравнению со смесью S. aureus + S. lugdunensis IVK28ΔlugD. Этот эксперимент показал, что продукция лугдунина позволяет штамму IVK28 эффективно конкурировать с золотистым стафилококком in vivo.
Оставалось разобраться, предотвращает ли присутствие S. lugdunensis в носу человека колонизацию бактериями S. aureus. Ципперер и его коллеги исследовали мазки из носовых ходов 187 госпитализированных больных. Из них у 60 человек (32,1%) обнаружили золотистого стафилококка и у 17 человек (9,1%) — S. lugdunensis. И только у одного пациента с S. lugdunensis в носу обитал S. aureus. У всех выделенных штаммов S. lugdunensis ПЦР-анализ продемонстрировал наличие lug-оперона, а все обнаруженные штаммы S. aureus оказались восприимчивы к лугдунину.
Перспективы
Лугдунин оказался первым обнаруженным бактериоцином нового класса — макроциклических тиазолидиновых пептидных антибиотиков. Все проверенные штаммы S. aureus (как природные, так и лабораторные) не смогли выработать резистентности к нему. Это дает надежду на то, что лугдунин в будущем станет коммерческим препаратом для борьбы с золотистым стафилококком.
И наконец, сам факт обнаружения нового антибиотика у представителя человеческой микробиоты должен послужить стимулом для активизации поиска других продуцентов бактериоцинов в составе именно таких сообществ. В дальнейшем это поможет медикам успешнее сдерживать наступление мультирезистентных патогенов.
Читайте также:


