Пцр вич анализ что это такое расшифровка
Высокотехнологичные лабораторные методы диагностики дают возможность выявить множество заболеваний на самых ранних стадиях. Метод полимеразной цепной реакции (ПЦР) — один из самых новых и точных способов диагностики. За его разработку ученый Кэри Муллис получил в 1993 году Нобелевскую премию. Сегодня этот метод хотя и считается экспериментальным, но уже широко и успешно применяется в медицине.
ПЦР-диагностика: суть подхода
Метод ПЦР использует принципы молекулярной биологии. Его суть заключается в применении особых ферментов, которые многократно копируют фрагменты РНК и ДНК возбудителей болезни, которые находятся в пробах биоматериала, например в крови.
После этого работники лаборатории сверяют полученные фрагменты с базой данных, выявляют тип возбудителя болезни и его концентрацию.
ПЦР проводят в амплификаторе — приборе, охлаждающем и нагревающем пробирки с пробами биоматериала. Нагрев и охлаждение необходимы для проведения репликации. Точность температурного режима влияет на точность результата.
Диагностические возможности метода ПЦР огромны, с его помощью можно выявить самые разные инфекции. Чаще всего ПЦР-метод применяют для диагностики:
- ВИЧ;
- герпеса;
- различных половых инфекций, в частности хламидиоза, уреаплазмоза, гарднереллеза, микоплазмоза и трихомониаза;
- кандидоза;
- гепатитов;
- мононуклеоза;
- листериоза;
- цитомегаловируса;
- туберкулеза;
- вируса папилломы человека;
- клещевого энцефалита.
Это далеко не полный список, метод ПЦР-анализа используется в разных областях медицины.
У диагностики методом ПЦР много плюсов:
Высокая чувствительность. Метод позволяет выявить возбудителя болезни даже при наличии нескольких молекул его ДНК, то есть на очень ранних стадиях, при хронической форме заболевания, а так же в случаях, когда болезнь никак себя не проявляет, протекая латентно.
Универсальность. Для проведения ПЦР анализа подходит почти любой биоматериал — от крови и слюны до клеток кожи.
Широкий охват. Исследование одного образца может выявить сразу нескольких возбудителей болезни.
Оперативность. Результат, как правило, готов через 5–7 часов, то есть получить заключение можно уже на следующий день после забора биоматериала.
Точность. Метод ПЦР практически никогда не дает ложноположительных или ложноотрицательных результатов, если была соблюдена технология проведения этого анализа.
Невысокая стоимость. По цене ПЦР-анализ сравним с любыми другими лабораторными анализами крови.
Однако следует понимать, что совершенных методов анализа не бывает. У ПЦР есть и минус — высокие требования к соблюдению технологии и к профессионализму лаборантов. Если образец был загрязнен, анализ может дать ложный результат. Поэтому проводить ПЦР-диагностику лучше только в самых лучших лабораториях, где внедрены системы контроля качества работы.
Для ПЦР-диагностики заболеваний на анализ берут разные виды биоматериала. Выбор зависит от типа инфекции. При анализе на ЗППП методом ПЦР берут соскоб или мазок из шейки матки или уретры, а также мочу. Для выявления герпеса, цитомегаловируса, гепатита, токсоплазмоза и ВИЧ на анализ берут кровь. При анализе на мононуклеоз и цитомегаловирус берут мазок из зева. Спинномозговая жидкость используется для анализа при поражениях нервной системы, для диагностики внутриутробных инфекций исследуются ткани плаценты, для выявления легочных инфекций — мокрота или плевральная жидкость.
Подготовка к ПЦР-диагностике напрямую зависит от типа биоматериала. Кровь сдается натощак утром. Моча также сдается утром, в лабораторных условиях, в стерильный контейнер. Перед сдачей мазка или соскоба из урогенитальной области нельзя вступать в половые контакты за несколько дней до исследования, не следует проводить спринцевания. Мазок или соскоб нельзя сдавать во время менструации и в течение 2-х дней после ее окончания.
Существует немало различных методик ПЦР-диагностики: ПЦР в реальном времени, секвенирование, пиросеквенирование, микрофлюидные технологии. Сейчас наиболее распространенным способом проведения анализа является ПЦР в реальном времени — этот метод практически не допускает ложноположительных результатов, к тому же срок обработки образцов при исследовании таким способом сокращается — результат можно получить уже через час.
Для пациента результат ПЦР-анализа может быть либо положительным, либо отрицательным. Отрицательный означает, что следов враждебной ДНК не обнаружено и человек здоров. Положительный подразумевает наличие фрагментов ДНК возбудителя болезни — это значит, что человек заражен и ему требуется лечение.
Нередко ПЦР-диагностика дает положительный результат, но пациент не чувствует никакого недомогания, а признаки болезни отсутствуют. Однако это означает не ошибку, а очень раннюю стадию заболевания. В этом случае необходимы дополнительные исследования и лечение. Если заболевание было диагностировано на столь ранней стадии, следует начинать терапию как можно скорее, ведь чем дальше зайдет болезнь, тем сложнее будет ее вылечить.
ПЦР-диагностика инфекций невероятно точна — она позволяет обнаружить возбудителя болезни, даже если в пробе находится всего одна-единственная молекула его ДНК. Именно это качество сделало ПЦР-анализ одним из эффективнейших диагностических инструментов как для определения наличия инфекции, так и для контроля за ходом лечения.
За звучной аббревиатурой ПЦР скрывается сложная и не слишком понятная для рядового пациента расшифровка — полимеразная цепная реакция. Что же такое ПЦР-диагностика, на чем она основана и почему в последнее время ее стали считать самой перспективной технологией в постановке диагнозов, касающихся инфекционных и вирусных заболеваний? Мы расскажем о преимуществах ПЦР-метода, его особенностях и этапах проведения.
ПЦР-диагностика: что это такое?
Диагностика методом ПЦР существует чуть более 30 лет. Значительно эволюционировав за это время, она зарекомендовала себя как один из наиболее точных способов выявления инфекций. В основе метода лежит принцип многократного увеличения микроскопических концентраций фрагментов ДНК возбудителя в биологической пробе пациента в искусственных условиях. В результате сложного процесса, называемого амплификацией, под воздействием ферментов и изменения температуры (от 50 до 95°С) из одной молекулы ДНК образуется две. При этом происходит копирование участка ДНК, который присутствует только у того вида патогенного микроорганизма, который интересует врача.
Цикл образования новой молекулы ДНК занимает всего около 3 минут, а тридцати-сорока циклов вполне достаточно, чтобы получить количество молекул, необходимое для достоверного визуального определения методом электрофореза.
Кроме амплификации, то есть простого увеличения числа копий молекулы ДНК, с помощью ПЦР можно производить и другие манипуляции с генетическим материалом, например, сращивать фрагменты ДНК, вводить мутации и т.д. Это позволяет использовать ПЦР не только для диагностики инфекционных и генетических заболеваний, но и для установления отцовства, клонирования и выделения новых генов.
ПЦР-диагностика проводится в специальных лабораториях с помощью амплификационного оборудования. На сегодня существует множество различных модификаций ПЦР, включая технологии с использованием не только ДНК, но и фрагментов рибонуклеиновой кислоты (РНК). В некоторых из них амплификация осуществляется при постоянной температуре, и для их проведения специальное оборудование не требуется.
Еще одна популярная модификация ПЦР — мультиплексная амплификация (МПА), которая позволяет проводить исследование сразу нескольких изучаемых фрагментов в одной пробирке. Это не только ускоряет и удешевляет проведение анализа, но и позволяет рассматривать одни фрагменты, получившиеся в результате реакции, в качестве положительных маркеров для других, что еще больше увеличивает точность исследования методом ПЦР.
В клинической медицине ПЦР-диагностика является одним из наиболее востребованных методов анализа в самых разных сферах:
- Прямое определение возбудителя инфекции. Некоторые традиционные методы, такие как иммуноферментный анализ (ИФА), выделяют только белки-маркеры, которые являются продуктом жизнедеятельности возбудителей инфекции, а потому только косвенно указывают на присутствие микроорганизмов. Наличие специфического участка в ДНК, выявленное с помощью ПЦР, безошибочно или почти безошибочно указывает на присутствие конкретной инфекции.
- Высокая специфичность метода . Она обусловлена тем, что в исследуемом материале выявляется фрагмент ДНК, характерный только для конкретного возбудителя инфекции. Специфичность исключает возможность ложных результатов анализа, тогда как в иммунологических методах исследований ошибки вполне вероятны из-за перекрестной реакции антигенов.
- Высокая чувствительность . При помощи ПЦР-диагностики можно выявить присутствие в организме даже единичных клеток вирусов или бактерий в тех случаях, когда обычными методами сделать это практически невозможно. ПРЦ определяет наличие всего 10–100 клеток в пробе, тогда как иммунологическими и микроскопическими тестами можно определить наличие инфекции при количестве клеток не менее 103–105.
- Универсальность . Сходство состава всех ДНК или РНК дает возможность применять универсальные методы лабораторных исследований, диагностируя сразу несколько возбудителей из одной биологической пробы.
- Скорость получения результатов . Поскольку для проведения ПЦР-диагностики не нужен посев и выделение культуры возбудителя, то и большого количества времени на нее не требуется. Весь цикл — от забора биоматериала до получения результатов — занимает 4–5 часов.
- Диагностика латентных инфекций . ПЦР-методом диагностируются трудно культивируемые и некультивируемые формы микроорганизмов, встречающиеся в тех случаях, когда заболевание протекает в скрытой форме.
Методом ПЦР можно выявлять возбудителей инфекции не только в организме человека, но и в почве, воде, продуктах питания.
Тем не менее не стоит думать, что ПЦР-диагностика не имеет недостатков. У нее есть свои ограничения, но их количество настолько незначительно, что не может отрицательно повлиять на популярность и эффективность метода:
- Вероятность амплификации ДНК не только живого, но и погибшего микроорганизма . При проведении ПЦР-диагностики для контроля эффективности лечения необходимо соблюдать определенные требования. В частности, проводить ПЦР нужно после определенного промежутка времени (1–2 месяца), за который происходит полное исчезновение возбудителя инфекции в организме.
- Возможность возникновения перекрестной реакции . Подбор фрагментов ДНК (праймеров) осуществляется на основе знаний о генетическом строении конкретного микроорганизма. Но теоретически такой же фрагмент может присутствовать и у других микроорганизмов, геном которых на сегодняшний день еще не расшифрован. Их присутствие в пробе может привести к ложноположительному результату анализа.
- Изменчивость микроорганизмов . Эта способность возбудителей к мутации иногда приводит к тому, что некоторые их штаммы становятся неуловимыми в процессе ПЦР-анализа.
Чтобы уменьшить риски, разработаны стандарты объемов испытаний тест-систем ПЦР-диагностики, включающие проверку на перекрестные реакции и тестирование всех известных штаммов конкретного возбудителя.
ПЦР-диагностика проводится в специальной лаборатории в несколько этапов.
- Забор биоматериала . Процедура, предшествующая непосредственному анализу, которая осуществляется в процедурном кабинете соответствующего профиля. Забор делается с помощью стерильного оборудования только в стерильные пробирки. Материалом для исследования могут быть:
- Эпителиальные соскобы со слизистых оболочек: из уретры, из цервикального канала, со слизистой дыхательных путей и зева, из конъюнктивы. Забор проводится с помощью специального ершика, при этом недопустимо попадание в материал следов крови.
- Моча . Собираются первые 50 г утренней мочи в стерильную емкость. Материал используется для диагностики мочеполовых инфекций.
- Мокрота . Используется для ПЦР-диагностики туберкулеза и респираторных форм микоплазмоза и хламидиоза. Мокроту собирают в стерильный флакон в количестве 15–20 мг.
- Кровь, сыворотка, плазма . С их помощью диагностируются гепатиты, герпес, ВИЧ-инфекция. Для анализа используется венозная кровь (1–1,5 мл), собранная у пациента натощак в стерильную пробирку. Хранить биоматериал можно не более суток при температуре 4°С. Замораживать кровь категорически запрещается.
- Биологические жидкости . К ним относятся слюна, сок простаты, околоплодная, плевральная, спинномозговая, суставная жидкости. Собираются при помощи пункции с использованием стерильного инструментария в количестве 0,1–1,5 мл в стерильные пробирки.
- Биоптаты , т.е. материалы, полученные путем биопсии. Обычно на анализ отправляют биоптаты двенадцатиперстной кишки или желудка, чтобы выявить хеликобактерную инфекцию. Объем материала 2–3 мм 3 .
- Хранение и транспортировка биоматериала . Хранить образцы можно при комнатной температуре не более 2 часов. Если необходимо длительное хранение, то пробы помещают в холодильник с температурой 2–8°С на срок не более одних суток. Допустимо хранение некоторых биоматериалов в течение двух недель в замороженном виде при температуре -20°С. Оттаивание и повторное замораживание проб запрещено. Транспортировка, если она необходима, должна проводиться в специальных термоконтейнерах или термосах с соблюдением всех правил хранения и перевозки биоматериалов.
- Выделение ДНК из образца . Способ выделения зависит от вида определяемого микроорганизма и от вида биологического образца. Если, например, анализируется соскоб эпителиальных клеток, используется так называемый метод твердофазной сорбции, заключающийся в добавлении в образец специального вещества, концентрации ДНК на сорбенте и его многократной отмывке буферным раствором.
- Проведение ПЦР . Некоторое количество образца из биологической пробы переносится в специальную микроцентрифужную пробирку. Туда же добавляется амплификационная смесь, имеющая сложный состав, в объеме 25 мл. Пробирки устанавливают в программируемый термостат, и автоматическом режиме проводится амплификация. Время ее проведения зависит от заданной программы и составляет 2–3 часа. Одновременно с опытными пробами проводятся контрольные — положительные , включающие в себя контрольный препарат ДНК исследуемого возбудителя, и отрицательные , не содержащие исследуемую ДНК. Количество циклов амплификации варьирует от 30 до 40, более 40 циклов проводить не рекомендуется, так как это способствует увеличению количества неспецифических продуктов в пробе.
- Регистрация результатов . Фрагмент ДНК, характерный для возбудителя инфекции, выделяют методом электрофореза в присутствии специального вещества — бромистого этидия. Его соединение с фрагментами ДНК дает светящиеся полосы при облучении ультрафиолетовым излучением. Образец помещают в камеру для электрофореза и в течение 35–40 минут проводят разделение продуктов амплификации. После этого образец просматривают в ультрафиолетовом свете — наличие оранжевой светящейся полосы свидетельствует о положительном результате.
- Интерпретация результатов исследования . Результат ПЦР-диагностики может быть либо положительным, либо отрицательным. Положительный результат говорит о том, что в организме человека обнаружены следы инфекции, причем именно в данный момент времени. Количественный результат ПЦР-анализа оценить может только врач, они индивидуальны для разных типов инфекций. На основании количественного результата можно сделать вывод о степени активности заболевания и определить характер лечения.
Цена ПЦР-диагностики зависит от того, на какую конкретно инфекцию пациент планирует проверяться, от вида анализируемого материала, методики тестирования — качественной или количественной. Цена за определение одной инфекции составляет от 200 до 800 рублей в разных клиниках. Кроме того, к стоимости анализа добавится и плата за забор биоматериала — около 400 рублей. Средняя стоимость ПЦР-диагностики разных видов приведена в таблице 1.
Таблица 1 . Примерные цены на анализы ПЦР в Москве
| Название анализа | Цена, руб. |
| Определение ДНК хламидия | 750 |
| Определение ДНК микоплазмы хоминис | 540 |
| Определение микоплазмы гениталиум | 350 |
| Определение ДНК уреаплазмы | 350 |
| Гонококк, определение ДНК | 350 |
| Определение ДНК герпеса (разные типы) | 350–600 |
| Определение ДНК кандиды | 570 |
| Вирус краснухи, определение РНК | 800 |
| Дифференцированное определение ДНК ВПЧ (разные типы) | 350–1900 [1] |
Для диагностики ВИЧ-инфекции проводится определение в крови антител к вирусу, его антигенов или генетического материала. Основных методов исследования два: Комботест, в ходе которого определяются антитела и антигены, а также ПЦР для оценки концентрации РНК в крови. Первое исследование в основном используют для первичной диагностики ВИЧ, второе – для оценки вирусной нагрузки, и лишь в небольшом числе случаев для первичной диагностики.
Особенности назначения исследования на вирус иммунодефицита
Обследование на ВИЧ проводится в рамках скрининга, по клиническим или эпидемиологическим показаниям. В некоторых случаях оно является обязательным, в других – добровольным.
Обязательное обследование

Обязательному периодическому обследованию на эту инфекцию подлежат:
- Доноры любого биоматериала. Чаще всего донорство используется в гематологии и онкологии. Доноры могут сдавать кровь и половые клетки (сперматозоиды, яйцеклетки). Реже используется донорство стволовых клеток, внутренних органов. В ходе переливания крови или использования любого другого биоматериала может произойти передача ВИЧ, поэтому всех доноров проверяют на эту инфекцию. В случае получения даже сомнительных результатов анализов донорство для них запрещают пожизненно.
- Представители некоторых профессий обследуются каждый раз, устраиваясь на работу. Некоторые также проходят периодическое профилактическое обследование на ВИЧ.
- Беременные. Согласно действующему приказу, беременных обследуют однократно, в последнем триместре. Если женщина не прошла диагностику в этот период, анализы берутся сразу после поступления в роддом.
- Дети, рожденные от ВИЧ-инфицированных матерей. Требует проведения обследования минимум три раза. Первый раз диагностика проводится сразу после рождения. Затем требуются повторные анализы в возрасте одного и полутора лет.
- Все учащиеся в военных учебных заведениях – обследуются однократно, при поступлении. Анализы также сдают при поступлении на воинскую службу.
- Иностранцы, которые запрашивают российское гражданство, вид на жительство или разрешение на работу в РФ.
Добровольное обследование
Поводом для добровольного обследования на ВИЧ-инфекцию могут стать три группы показаний. Это пациенты, имеющие симптомы острого заболевания, лица с признаками иммунодефицита, а также люди без каких-либо проявлений ВИЧ, но имеющие высокий риск этого заболевания (обнаружение одного или нескольких факторов риска, свидетельствующих о значительной вероятности заражения).
- длительные, плохо поддающиеся лечению, частые пневмонии;
- любые бактериальные, вирусные, грибковые инфекции, которые протекают тяжелее, чем у большинства людей (включая диссеминированную герпетическую инфекцию, герпетический менингоэнцефалит, инвазивный кандидоз или глубокие микозы);
- хронические воспалительные процессы малого таза у пациентов женского пола, которые не поддаются лечению стандартными методами.
- опоясывающий герпес у лиц, моложе 60 лет;
- криптококкоз (кроме легочной формы);
- пневмоцистная пневмония;
- поражения головного мозга токсоплазмой;
- криптоспоридиоз;
- гистоплазмоз;
- саркома Капоши;
- онкогематологические заболевания.
Обследоваться на ВИЧ рекомендовано лицам из групп риска по этому заболеванию. К факторам риска относятся гомосексуализм, проституция, беспорядочная половая жизнь, наркомания, пребывание в местах лишения свободы. Обследуют контактных лиц: в основном после полового акта с носителем инфекции или медицинских работников, проконтактировавших с кровью ВИЧ-позитивного пациента.
Методы лабораторной диагностики иммунодефицита
Основным методом первичной диагностики у взрослых является одновременное определение антител к ВИЧ 1 и 2 типов и антигена р25/24. Для этого используют ИФА или иммунохемилюминесцентный анализ. В качестве подтверждающего теста используют иммуноблот (может обозначаться аббревиатурой ИБ).
ПЦР используют как уточняющий метод для определения показаний к назначению лечения, оценки его эффективности. В некоторых ситуациях метод используют для первичной диагностики. Он применяется:
- Для обследования контактных лиц. Антитела в крови не образуются моментально. Они появляются только через несколько месяцев. Чтобы получить ответ в короткие сроки, определяется наиболее ранний маркер ВИЧ в крови – РНК вируса.
- Для обследования новорожденных. В их крови циркулируют материнские антитела. Поэтому проведенный анализ ИФА всегда будет положительным, независимо от того, болен ребенок или нет. Но вирусной РНК в его крови быть не должно. Поэтому ПЦР позволяет дать ответ, заразился ли новорожденный во время родов.
Расшифровка результата анализа при СПИДе
Стандартная схема обследования пациента предполагает проведение ИФА. В случае получения положительного результата нужно исключение ложноположительных реакций. Поэтому выполняется иммуноблот. Этот тест считается подтверждающим, он очень редко дает ложные результаты. Если они и бывают, то в основном связаны с человеческим фактором – ошибкой лаборатории, в которой проводилось тестирование.
Расшифровка ИФА и ИБ
Первичная диагностика может дать три варианта результатов:
Результаты обследования с помощью иммуноблота могут быть сомнительными. В этом случае человек должен наблюдаться в течение 6 месяцев. Повторное обследование проводят через 1-3 месяца. Если снова получен сомнительный результат, с высокой вероятностью человек здоров. Последнее обследование проводят спустя полгода. Получение сомнительного результата не является поводом для установления ВИЧ. Но пациент пожизненно отстраняется от донорства.
При выполнении перечисленных тестов расшифровка не представляет затруднений. На бумаге, выданной пациенту, пишется, положительный результат получен в ходе анализа или отрицательный. Количественных результатов нет.
Расшифровка ПЦР
Особого внимания заслуживает расшифровка результатов ПЦР. Ведь этот анализ дает количественные показатели. Он не только оценивает факт наличия или отсутствия вируса, но также сообщает врачу о количестве копий РНК вируса на 1 мл крови. Иногда обозначение результатов выглядит по-другому: может использоваться геномный эквивалент.
- Любое количество копий вирусной ДНК – повод для установления диагноза ВИЧ-инфекции.
- Вирусная нагрузка 100 000 копий/мл и более – оценивается как высокая.
- Вирусная нагрузка 10 000 копий/мл и меньше – классифицируется как низкая.
Вирусная нагрузка – важный показатель, позволяющий оценить эффективность проводимой антиретровирусной терапии. ПЦР помогает понять, работают ли назначенные врачом препараты. Если они работают, то назначение лекарств позволяет снизить вирусную нагрузку на 99% в течение 2 недель. У 85% пациентов после начала антиретровирусной терапии через 4 недели вирусная нагрузка не превышает 1000 копий/мл. Если лечение начинают при исходном уровне РНК ВИЧ меньше 1000 копий/мл, то через 2 недели она становится неопределяемой. При исходном уровне РНК 1 миллион копий/мл вирус перестает определяться в крови в среднем через 113 дней терапии.
В ходе лечения вирусная нагрузка при помощи ПЦР измеряется через каждые 4 недели. Этого срока вполне достаточно, чтобы спрогнозировать дальнейшую динамику. Если препарат не работает, это видно намного раньше – уже через 1-2 недели ПЦР позволяет получить результаты, которые демонстрируют вирусологическую неудачу с точностью 99%.
Порог определения вирусной нагрузки у разных лабораторных тестов отличается. В основном он составляет 20-50 копий/мл. Целью лечения является достижение отрицательных результатов ПЦР. До этого момента тест проводится каждый месяц. После получения отрицательного результата достаточно дальнейшего контроля 1 раз в 3 месяца. С такой периодичностью лабораторных контроль успешности лечения осуществляется до того момента, пока вирусная нагрузка снова не начнет увеличиваться. В этом случае пациента вновь будут обследовать через каждые 4 недели.
Обычно в первый месяц терапии вирусная нагрузка уменьшается в 100 раз и более. Максимум через 6 месяцев (при высокой исходной нагрузке) она становится неопределяемой.
Теоретически, ПЦР может определять вирус иммунодефицита не только в крови. В качестве материала для тестирования подходит эякулят, вагинальное отделяемое или ликвор. Но в медицинской практике такие исследования не проводятся. Их используют только в научных целях.
Значительно реже ПЦР используется как метод, позволяющий определить показания для начала антиретровирусной терапии. Пациентов с нормальным иммунитетом, без уменьшения CD4 клеток, обычно не лечат. В том числе в случаях, когда вирусная нагрузка высокая. Но эти показатели напрямую взаимосвязаны. Обычно чем выше количество копий РНК вируса, тем быстрее прогрессируют иммунные нарушения.
Основным исследованием, позволяющим оценить показания к началу антиретровирусной терапии, остается определение CD4. По европейским рекомендациям, лечение может быть назначено при уровне CD4 более 350 клеток/мкл только при наличии дополнительных факторов риска развития СПИД. Одним из них является вирусная нагрузка свыше 100 000 копий РНК в мл крови.
Как исключают вероятность получения ложного результата исследований
Основной метод диагностики ВИЧ – ИФА. Он обладает чувствительностью 99% и специфичностью 99,5%. Это означает, что ложноотрицательные результаты получает 1 из 100 пациентов, ложноотрицательные – 1 из 200 больных. К тому же, анализ может оказаться отрицательным в первые месяцы после инфицирования. Риск его получения, в зависимости от сроков проведения:
- через 3 месяца – 5-10%;
- через 6 месяцев – 1-2%.
- наличие антител к аутоантигенам HLA класса II;
- реактивные воспалительные процессы;
- заболевания печени;
- недавняя вакцинация.
Если для первичной диагностики использовалась ПЦР, при возникновении сомнений в результатах тест может быть проведен повторно. Методы обнаружения РНК ВИЧ-1 дают 2-5% ложных отрицательных результатов. Концентрация вируса при этом всегда составляет менее 2000 копий/мл. Повторное проведение теста с высокой вероятностью дает правильный отрицательный результат, если пациент не инфицирован.
🔊 Прослушать пост
ПЦР (полимеразная цепная реакция) представляет собой метод молекулярной генетики, который позволяет анализировать любую короткую последовательность ДНК (или РНК) даже в образцах, содержащих только мельчайшие количества ДНК или РНК, тем самым определив наличие/отсутствие патогенного возбудителя (определить, например есть ли в человеке вирус ВИЧ или гепатита Б или микобактерии туберкулёза). ПЦР используется для воспроизведения/умножения/клонирования (амплификации) выбранных участков ДНК или РНК для анализа.
Метод ПЦР настолько прост, что его может поставить даже школьник)
Раньше амплификация ДНК включала клонирование сегментов, представляющих интерес, в векторы для экспрессии в бактериях и занимала недели. Но теперь, когда ПЦР делается в пробирках, требуется всего несколько часов. ПЦР является высокоэффективной, так что из ДНК может быть сделано огромное количество копий.

Последовательность ДНК и соответствие нуклеотидов.
Более того, ПЦР использует те же молекулы, которые природа использует для копирования ДНК:
То есть ПЦР — это такая техника при которой частицы ДНК (иногда РНК) умножаются в определенном растворе или на специальной поверхности, где они могут быть депонированы.
ПЦР — это метод, с помощью которого учёные могут находить иглу в стоге сена и затем строить стог из этих игл.
Ключом к пониманию ПЦР является знание о том, что каждый человек, животное, растение, паразит, бактерия или вирус содержит генетический материал — ДНК (или РНК) последовательности (нуклеотидные последовательности или кусочки ДНК (или РНК)), которые уникальны для каждого индивидуума. То есть, если образец содержит сегменты ДНК или РНК,
задача ПЦР как метода — умножить (амплифицировать), сделать как можно больше их копий, чтобы можно было идентифицировать кому они могут принадлежать (определенному человеку, животному или патогенному организму), даже если есть только следы наличия ДНК/РНК.
Однако ПЦР-амплификация является лишь частью диагностического теста. После проведения амплификации амплифицированные сегменты необходимо сравнить с другими нуклеотидными сегментами, но уже из известного источника (например, конкретного человека, животного или патогенного организма). Это сравнение уникальных сегментов часто выполняется путем размещения нуклеотидных последовательностей, сгенерированных ПЦР, рядом с известными нуклеотидными последовательностями от людей, патогенов или других источников в специальном геле.
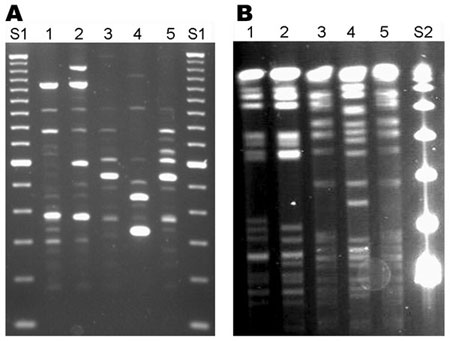
В 1983 году Кари Муллис разработал основные этапы по амплификации ДНК-последовательностей. Он и Майкл Смит были удостоены Нобелевской премии за создание ПЦР в 1993 году.

ПЦР проводится в одной пробирке с соответствующими химическими веществами и при определенной температуре нагревания.
Необходимы следующие реагенты или химикаты:
- Образец, содержащий нуклеотидную последовательность (из крови, волос, гноя, кожи и т. д.).
- ДНК-праймеры: короткая одноцепочечная ДНК, которая присоединена к нуклеотидным последовательностям, которая способствует синтезу комплементарной цепи нуклеотидов.
- ДНК-полимераза: фермент, который, когда ДНК связывается с праймером, спускается по фрагменту ДНК с добавлением структурных блоков ДНК для образования комплементарных пар оснований и, таким образом, синтезирует комплементарную нуклеотидную цепь ДНК (введение термостойкой ДНК-полимеразы, Taq-полимеразы , полученной из термостойких бактерий, заметно улучшает способность к ПЦР).
- Большой избыток структурных блоков ДНК, называемых нуклеотидами (аденин, тимидин, цитозин и гуанин, сокращенные как: A, T, C и G соответственно) в растворе. Когда эти блоки соединены вместе, они образуют нуклеотидную последовательность или одну нить ДНК. Когда эти строительные блоки связывают свой комплементарный строительный блок слабыми водородными связями (например, A будет связываться только с T и G только с C) образуется комплементарная нуклеотидная последовательность ДНК, которая связана с исходной одноцепочечной ДНК. Когда связывание завершается, комплементарная ДНК с двойной цепью образуется в определенной последовательности.
Он верит в астрологию, но не верит, что ВИЧ вызывает СПИД.)
Затем полимеразно-цепная реакция начинается с сегмента ДНК из образца, который помещается в пробирку с указанными выше реагентами. Раствор нагревают до 94°С. Нагревание разрушает водородные связи, которые позволяют образовывать комплементарные цепи ДНК, поэтому в смеси существуют только одиночные нити (это называется денатурацией двухцепочечной ДНК).
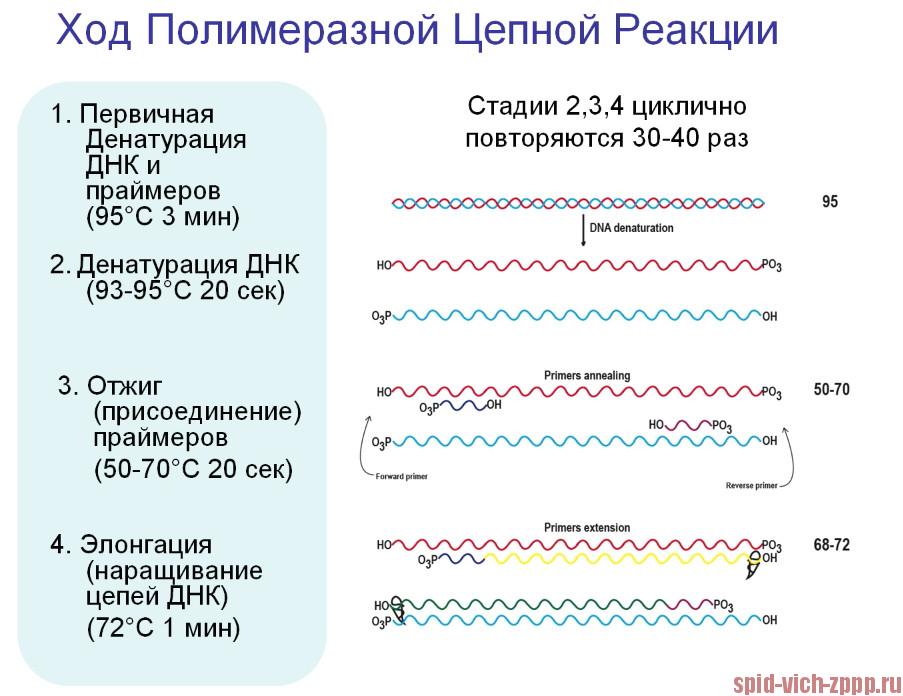
Этапы ПЦР
Смеси дают остыть до 54°C. При этой температуре ДНК-праймеры и ДНК-полимераза связываются с отдельной одноцепочечной ДНК (это называется отжигом ДНК). Поскольку строительных блоки в избытке (высокая концентрация) в смеси, полимераза использует их для создания новых комплементарных нитей ДНК (называемых расширением ДНК), и этот процесс происходит быстрее при 72°C. Этот процесс создает новую двухцепочечную молекулу ДНК из каждой из одиночных нитей исходной молекулы.
Этот цикл повторяется примерно 40 раз в машине, называемой термическим циклером (термосайклером), который автоматически повторяет циклы нагрева-охлаждения, при этом количество каждой последовательности ДНК удваивается каждый раз, когда цикл нагрева-охлаждения завершается. То, что изначально было одним коротким сегментом ДНК, можно было увеличить до примерно 100 миллиардов копий после 40 циклов удвоения.
Тест на ПЦР является основой для ряда тестов, которые могут отвечать на многие различные медицинские вопросы, которые помогают врачам диагностировать и лечить пациентов. Например, тесты ПЦР могут обнаруживать и идентифицировать патогенные организмы у пациентов, особенно тех, которые трудно культивировать (например, ВИЧ и другие вирусы и некоторые грибы).
Одни врачи назначают ПЦР-тесты, чтобы помочь диагностировать генетические заболевания, в то время как другие врачи используют ПЦР для обнаружения биологических родственных отношений, таких как идентификация родителей детей. ПЦР-тесты также используются для идентификации и характеристики генетических мутаций и перегруппировок, обнаруженных при определенных раковых заболеваниях.
Тем не менее, ПЦР-тесты были модифицированы и внедрены во многие аспекты научных исследований, включая эволюционную биологию, генетическую отпечатку пальцев, судебно-медицинские исследования и многие другие.
Обратно-транскриптазный ПЦР (RT-PCR) — это тест на ПЦР, который предназначен для обнаружения и измерения количества РНК. Хотя первоначальные тесты ПЦР амплифицировали ДНК, многие вирусы и другие биологические компоненты (например, митохондрии) используют РНК в качестве своего генетического материала. RT-PCR отличается от обычной ПЦР сначала взятием РНК и превращением нити РНК в нить ДНК. Это делается по существу тем же самым методом для ПЦР, описанным выше, за исключением использования фермента, называемого обратной транскриптазой, вместо ДНК-полимеразы.
Обратная транскриптаза позволяет перевести одну нить РНК в комплементарную цепь ДНК. Как только эта реакция происходит, рутинный метод ПЦР можно затем использовать для амплификации ДНК. RT-PCR используется для обнаружения и изучения многих РНК-вирусов. RT-PCR не следует путать с другим вариантом ПЦР, называемым ПЦР в реальном времени (реал-тайм).
ПЦР в реальном времени представляет собой вариацию ПЦР, которая позволяет анализировать амплифицированную ДНК в течение обычных 40 циклов процедуры. Хотя процедура аналогична обычной ПЦР с циклированием, ПЦР реального времени использует флуоресцентные красители, прикрепленные к некоторым из строительных блоков или небольших нуклеотидных нитей. В зависимости от используемого метода флуоресценция возникает, когда образуются амплифицированные нити ДНК. Количество флуоресценции можно измерить на протяжении 40 циклов и позволяет исследователям измерять определенные продукты и их количества во время циклов амплификации.
Это часто позволяет исследователям или техническим специалистам пропускать гель-электрофорез или другие вторичные процедуры, необходимые для анализа продуктов ПЦР, тем самым обеспечивая более быстрые результаты. ПЦР в реальном времени и RT-PCR являются вариациями или модификациями исходного теста ПЦР. Тем не менее, существует еще много вариантов (не менее 25), которые существуют и используются для решения конкретных проблем. Все они имеют разные названия, такие как сборка ПЦР, ПЦР с горячим началом, мультиплексная ПЦР, твердотельная ПЦР и многие другие.
ПЦР будет развиваться и дальше, чтобы помочь ответить на многие другие вопросы в медицине, биологии и других областях науки.
ПЦР (полимеразная цепная реакция) — метод умножения генетического материала вируса, анализ, который определяет генетический материал вируса — РНК или ДНК ВИЧ.
Если вирус содержится в минимальном значении, то в результате реакции это количество многократно увеличивается. Поэтому ПЦР имеет высокое диагностическое значение.
Обычно этот тест используется для определения ВИЧ в донорской крови или для раннего определения наличия ВИЧ в организме до выработки специфических антител к ВИЧ. Специфические антитела определяют обычные тесты на ВИЧ (ИФА), но только через 1-3, редко 12 месяцев после заражения. А с помощью ПЦР можно дать достаточно точный ответ через 14 дней с достоверностью 98% и даже через 5 дней, но тогда достоверность будет 80%. ПЦР на ВИЧ — это дорогой и более трудоемкий анализ, чем ИФА, поэтому его используют не всем подряд, а только по особым показаниям (доноры, пострадавшие от медицинской аварии с ВИЧ-инфицированным) или платно.
Это метод определения комплиментарного участка ДНК в геноме клетки лимфоцита пораженного ВИЧ. Т.е. определяется не сам вирус, а материал, который вирус встраивает в клетку. В ядре клетки уже будет храниться его ДНК из которой он потом будет считываться и размножаться (копировать самого себя).
Количественный ПЦР анализ на РНК ВИЧ — определяет количество копий РНК вируса в крови (для определения вируса в клетках используют ПЦР ДНК, например у детей). Делается только у ВИЧ-инфицированных, для контроля лечения, определения выраженности процесса развития болезни, эффективности лечения.
ВИЧ с помощью ПЦР можно обнаружить через 4-14 дней после заражения. Отрицательный результат ПЦР на ВИЧ достоверен после 14 дней после рискованного контакта, но по действующим нормативам всё равно требуется обследование с помощью ИФА.
РНК обычно используется в количественных тестах для оценки вирусной нагрузки у диагностированных лиц, например, для оценки эффективности терапии.
ДНК — в мононуклеарных клетках, например, для диагностики у детей, там, где антитела к ВИЧ матерей мешает использовать метод ИФА.
И тот и другой тест могут быть и количественными, и качественными.
И тот, и другой можно в особых случаях применить диагностики, но с учетом конкретных ограничений, которые накладывают технические параметры системы, т.е. по назначению врача.
Но если были допущены ошибки со стороны персонала медицинского учреждения , ТО ПЦР может быть ложноположительным, более чем в 2% случаев.
Для исследования на ВИЧ методом ПЦР сдаётся кровь из вены, желательно (но необязательно) утром натощак.
-
Москва: ЦМД (2450 руб.), ИАКИ (2300 руб.). Санкт-Петербург: СПб СПИД-центр. Екатеринбург: КДЛ (2480 руб.). Самара: СитиЛаб (1400 руб.). Краснодар: КДЛ (3000 руб.). Минск: Республиканский центр гигиены, эпидемиологии и общественного здоровья. Киев: Первая Независимая Лаборатория.
Около 1,5-3 тыс. руб. в зависимости от региона.
Через 14 дней после заражения достоверность ПЦР на ВИЧ составляет 100%, с 4-5 дня — достоверность 80%.
Технически 4-6 часов, но в реальности зависит от организации работы лаборатории и обычно результат выдается через 2-3 дня.
Так как у ребёнка до 1,5 лет рожденного от ВИЧ+ матери сохраняются её антитела против ВИЧ, то определить заражен ВИЧ ребенок или нет с помощью ИФА невозможно. В такой ситуации используется ПЦР:
- Если у ребенка возрастом 1 мес с помощью ПЦР обнаружили вирус, значит он заразился.
- Если у ребенка в 1-2 месяца и 4-6 месяцев ПЦР отрицательная, то при условии, что мать не кормила его своим грудным молоком — ребёнок здоров.
ПЦР определяет сам вирус, а ИФА реакцию (в виде антител) организма на вирус.
ПЦР быстрее определяет наличие вируса, чем ИФА.
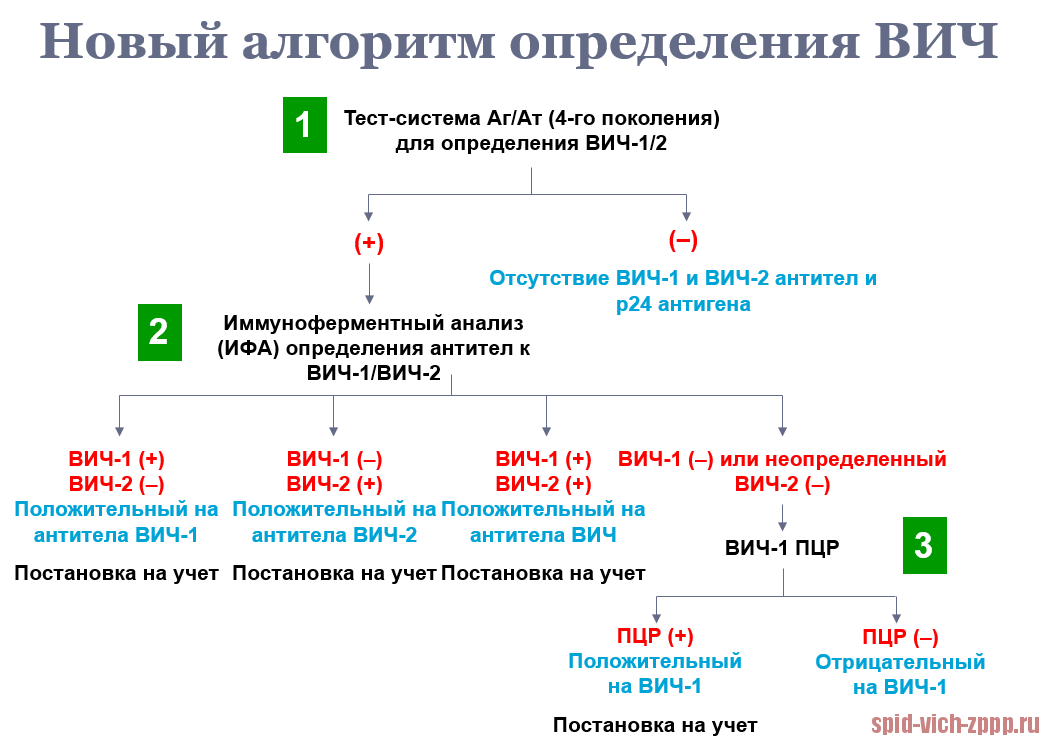
Новый алгоритм определения ВИЧ.
Читайте также:


