Обзор литературы вич инфекция

Дата публикации: 26.07.2019 2019-07-26
Статья просмотрена: 65 раз
Ключевые слова: ВИЧ-инфекция, антиретровирусная терапия, лимфоциты CD4.
ВИЧ-инфекция — медленно прогрессирующее заболевание, вызываемое вирусом иммунодефицита человека (ВИЧ). Вирус поражает клетки иммунной системы, имеющие на своей поверхности рецепторы CD4: Т-хелперы, моноциты, макрофаги, клетки Лангерганса, дендритные клетки, клетки микроглии.
Основные пути передачи ВИЧ:
- незащищенный половой контакт с ВИЧ-инфицированным;
- совместное использование с ВИЧ-инфицированным принадлежностей для инъекций;
- вертикальный путь передачи ВИЧ от ВИЧ-инфицированной матери ребенку (во время беременности, родов или после родов, через грудное молоко). [2]
Эпидемиология. Первые случаи СПИДа были описаны в США в 1981 г. Открытие ВИЧ как причины развития СПИДа произошло в 1983 г. Ежегодно ВИЧ заражаются 2,6 млн жителей планеты. Первыми инфицируются, как правило, лица из так называемых групп риска (потребители инъекционных наркотиков, работники коммерческого секса, гомосексуалисты); впоследствии инфекция распространяется половым путем на другие группы населения (при незащищенных половых контактах). [2]
Патогенез. Репликация ВИЧ происходит постоянно, период полужизни вируса составляет около 30 минут. За сутки образуется около 10 10 новых вирионов. На ранней стадии инфекции в ответ на виремию происходит увеличение скорости пролиферации и созревания новых лимфоцитов.
Наружный оболочечный гликопротеин gp120 присоединяется к CD4-рецептору клетки-мишени, вследствие чего gp41 встраивается в мембрану клетки CD4, далее происходит слияние оболочки вируса и клеточной мембраны, в результате чего сердцевина вируса переносится в цитоплазму клетки. Далее с помощью обратной транскриптазы синтезируется ДНК-копия РНК-генома вируса, которая переносится в ядро клетки, встраивается в ДНК инфицированной клетки при помощи вирусной интегразы. Затем происходит процессинг транслированных вирусных белков вирусными интегразами, сборка новых вирионов, которые высвобождаются из клетки и инфицируют новые клетки-мишени.
Клиническое стадии ВИЧ-инфекции по классификации ВОЗ:
– стадия I: бессимптомное течение;
– стадия II: потеря веса 10 % от исходного, продолжающаяся более месяца диарея неясного генеза и/или лихорадка неясного генеза, кандидозный стоматит, волосатая лейкоплакия слизистой полости рта, туберкулез легких, развившийся в течение года;
– стадия IV: СПИД согласно диагностическим критериям.
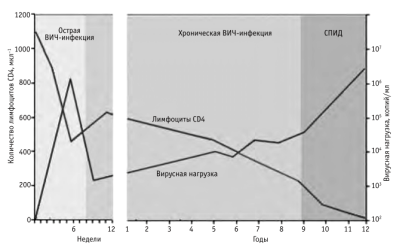
Рис. 1. Естественное течение ВИЧ-инфекции
Лабораторная диагностика. ВИЧ устанавливается при обнаружении антител (АТ) к вирусу, вирусных антигенов (АГ), вирусной РНК или ДНК. Стандарт диагностики — анализ крови на АТ к ВИЧ.
- Положительный результат скринингового теста (ИФА), подтвержденный результатами вестерн блота, непрямого иммунофлюоресцентного анализа или дополнительного анализа на АТ к ВИЧ.
- Выявление маркеров ВИЧ-инфекции в количестве, превышающем установленные уровни определения ДНК или РНК ВИЧ, антигена р24 или выделение культуры ВИЧ.
Важно выявить ВИЧ-инфекцию на ранней стадии, поскольку она характеризуется высоким риском передачи ВИЧ; в это время стандартные серологические анализы на АТ к ВИЧ дают ложноотрицательные результаты и выявление ВИЧ-инфекции может объяснить появление непонятных клинических симптомов. [1]
Согласно рекомендациям: тестирование на ВИЧ должно проводиться всем пациентам в возрасте 13–64 лет и проводиться во всех медицинских учреждениях; пациентов следует предупреждать о том, что обследование будет включать тестирование на ВИЧ; пациентов с положительным результатом следует направлять в медицинское учреждение, специализирующееся на лечении ВИЧ.
Лечение. Цели антиретровирусной терапии:
– клинические: снизить заболеваемость и смертность, связанные с ВИЧ-инфекцией и ее лечением. Увеличить продолжительность и качество жизни ВИЧ-инфицированных;
– вирусологические: снизить вирусную нагрузку до минимального уровня ( -1 ;
– количество лимфоцитов CD4 >500 мкл -1 , при готовности пациента начать терапию;
– независимо от количества лимфоцитов CD4: ВИЧ-ассоциированная нефропатия; беременность, чтобы предупредить перинатальную передачу ВИЧ; сопутствующий гепатит В, при наличии показаний к его лечению, высокая вирусная нагрузка >100 000 копий/мл; возраст инфицированного.
Для лечения ВИЧ-инфекции разрешены к применению 30 отдельных и комбинированных препаратов. Эти препараты принадлежат к пяти фармакологическим группам:
- Нуклеозидные и нуклеотидные ингибиторы обратной транскриптазы (НИОТ) (Видекс, Вирид, Зерит, Ретровир, Эмпивир).
- Ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ) (Вирамун, Интеленс, Рескриптор, Эдурант).
- Ингибиторы протеазы (ИП) (Аптивус, Вирасепт, Инвираза, Калетра, Норвир, Телзир).
- Ингибиторы проникновения (блокаторы корецепторов и ингибиторы слияния) (Селзентри, Фузеон).
- Ингибиторы интегразы (Исентресс). [2]
После начала АРТ наблюдается быстрое снижение уровня РНК ВИЧ в течение 2–4 недель. Максимальный противовирусный эффект ожидается через 4–6 месяцев. Вирусная нагрузка — самый важный критерий эффективности терапии, хотя лучшим прогностическим показателем клинического прогрессирования ВИЧ служит количество лимфоцитов CD4. При низком уровне вирусной нагрузки ( ВИЧ-инфекция, антиретровирусная терапия, лимфоциты CD4
Похожие статьи
[7]. Нуклеозидные и нуклеотидные ингибиторы обратной транскриптазы (НИОТ) активны в инфицированных ВИЧ Т-клетках и
Можно выделить три основных направления в генной терапии ВИЧ. Первое — введение генетических последовательностей, которые кодируют.
На модели вирусной ко-инфекции клеток изучено действие антигерпетического препарата ганцикловир и аномального нуклеозида G8.
Моделирование смешанной адено-герпетической инфекции клеток MDBK, ее характеристика и особенности антивирусного действия веществ.
В данной статье представлены методы диагностики, лечения и профилактики вирусного поражения шейки матки. В связи с тем, что происходит омоложение патологии шейки матки, необходимы наиболее ранняя диагностика, своевременное лечение с использованием.
Нуклеозидные (НИОТ) и Нуклеотидные (НтИОТ) ингибиторы обратной транскриптазы блокируют один из ферментов ВИЧ, называемый обратная транскриптаза. Эти препараты часто объединяются в одну группу, называемую НИОТ. Препараты НИОТ подменяют нуклеотиды и.
Вирусное поражение шейки матки (ВПШМ) занимает второе место среди гинекологических заболеваний в мире, в
Если ранее опухолевый процесс на поздних стадиях выявлялся у женщин в возрасте 60 лет и старше, то все чаще вирусное поражение встречается у женщин.
Вопрос информативности анти-Hsp60 антител у больных различными инфекциями в последнее время является актуальным в связи с тем, что выработка этих антител является неспецифической защитной реакцией против патогенов.
На сегодняшний день издано целый ряд научных работ, которые посвящены взаимосвязи герпесвирусной инфекции и бактериальной инфекции при заболеваниях полости рта [7,16,17]. Открыто 80 представителей семейства Herpesviriolae.
В данной статье рассмотрены проблемы герпес-вирусной инфекции. Основное содержание исследования составляет выявление особенностей клинического течения у пациентов разного пола с герпес-вирусной инфекцией.
Данная статья посвящена проблемам диагностики и лечения вирусного иммунодефицита кошек в условиях ветеринарных клиник г. Краснодара. Представлены пошаговый план развития ветеринарных клиник по улучшению диагностики, а также мероприятия, способствующие.
Полный текст:
1. Вирус иммунодефицита человека - медицина. Руководство для врачей / Под ред. Н.А. Белякова и А.Г.Рахмановой.- СПб.: Балтийский образовательный центр, 2010.- С. 183.
2. Balogou A.A., Saka B., Kombaté D., Kombaté K., Mouhari-Toure A., Akakpo S. Causes of mortality associated with HIV/AIDS in health-care facilities in Togo: a six-month prospective study // Trop. Doct.- 2011.- Vol. 41.- P. 215-217.
3. Sibéril S., Elluru S., Graff-Dubois S., Negi V.S., Delignat S., Mouthon L., Lacroix-Desmazes S., Kazatchkine M.D., Bayry J., Kaveri S.V. Intravenous immunoglobulins in autoimmune and inflammatory diseases: a mechanistic perspective // Ann. N Y Acad. Sci.- 2007.- Vol. 1110.- P. 497-506.
4. Asselman V., Thienemann F., Pepper D.J., Boulle A., Wilkinson R.J., Meintjes G. Central nervous system disorders after starting antiretroviral therapy in South Africa // AIDS.- 2010.- Vol. 24.- P. 2871-2876.
5. Howlett W.P. Neurological illness in HIV disease // Neurology in Africa.- 2012.- P. 191-206.
6. Bicanic T., Meintjes G., Rebe K., Williams A., Loyse A., Wood R. Immune reconstitution inflammatory syndrome in HIV-associated cryptococcal meningitis: a prospective study // J. Acquir. Immune Defic. Syndr.- 2009.- Vol. 51.- P. 130-134.
7. Магонов Е.П., Прахова Л.Н., Ильвес А. Г., Катаева Г.В., Трофимова Т.Н. Автоматическая сегментация МРТ-изображений головного мозга: методы и программное обеспечение // ВИЧ-инфекция и иммуносупрессии.- 2014.- Т. 6, № 3.- С. 73-77.
8. Letendre S.L., McCutchan J.A., Childers M.E., Woods S.P., Lazzaretto D., Heaton R.K., Grant I., Ellis R.J. Enhancing antiretroviral therapy for human immunodeficiency virus cognitive disorders // Annals of Neurology.- 2004.- Vol. 56.- P. 416-423.
9. Palmer S., Josefsson L., Coffin J.M. HIV reservoirs and the possibility of a cure for HIV-infection // Journal of internal medicine.- 2011.- Vol. 270.- P. 550-560.
10. Havlir D.V., Koelsch K.K., Strain M.C., Margot N., Lu B., Ignacio C.C., Miller M.D., Wong J.K.Predictors of residual viremia in HIV-infected patients successfully treated with efavirenz and lamivudine pluseither tenofovir or stavudine // J. Infect. Dis. - 2005.- Vol. 191.- P. 1164-1168.
11. Maldarelli F., Palmer S., King M.S., Wiegand A., Polis M.A., Mican J., Kovacs J.A., Davey R.T., Rock-Kress D., Dewar R., Liu S., Metcalf J.A., Rehm C., Brun S.C., Hanna G.J., Kempf D.J., Coffin J.M., Mellors J.W.ART suppresses plasma HIV-1 RNA to a stable set point predicted by pretherapy viremia // PLoS Pathog.- 2007.- Vol. 3.- P. 46-48.
12. Yukl S.A., Shergill A.K., McQuaid K., Gianella S., Lampiris H., Hare C.B., Pandori M., Sinclair E., Günthard H.F., Fischer M., Wong J.K., Havlir D.V. Effect of raltegravir-containing intensification on HIV burden and T-cell activation inmultiple gut sites of HIV-positive adults on suppressive antiretroviraltherapy // AIDS.- 2010.- Vol. 24.- Р. 2451-2460.
13. Palmer S., Josefsson L., Coffin J.M. HIV reservoirs and the possibility of acure for HIV infection // The Association for the Publication of the Journal of Internal Medicine.- 2011.- Vol. 270.- P. 550-560.
14. Berger M., McCallus D.E., Clindy S.L. Rapid and reversible responses to IVIG in autoimmune neuromuscular diseases suggest mechanisms of action involving competition with functionally important autoantibodies // J. Peripher. Nerv. Syst.- 2013.- Vol. 18.- P. 275-296.
15. Mantegazza R., Bonanno S., Camera G., Antozzi C. Current and emerging therapies for the treatment of myasthenia gravis // Neuropsychiatr. Dis. Treat.- 2011.- Vol. 7.- P. 151-160.
16. Hughes R.A.C., Dalakas M.C., Cornblath D.R., Latov N., Weksler M.E., Relkin N. Clinical applications of intravenous immunoglobulins in neurology // Clin. Exp. Immunol.- 2009.- Vol. 158.- P. 34-42.
17. Melzer N., Meuth S.G. Disease-modifying therapy in multiple sclerosis and chronic inflammatory demyelinating polyradiculoneuropathy: common and divergent current and future strategies // Clin. Exp. Immunol.- 2014.- Vol. 175.- P. 359-372.
18. Elovaam I., Apostolskib S., van Doornc P., Gilhusd N.E., Hietaharjue A., Honkaniemif J., van Schaikg I.N., Scoldingh N., Soelberg P., Uddj B. EFNS guidelines for the use of intravenous immunoglobulin in treatment of neurological diseases EFNS task force on the use of intravenous immunoglobulin in treatment of neurological diseases // European Journal of Neurology.- 2008.- Vol. 15.- P. 893-908.
19. Hartung H.P. Advances in the understanding of the mechanism of action of IVIg // J. Neurol.- 2008.- Vol. 255.- P. 3-6.
20. Ballow M. Mechanisms of immune regulation by IVIG // Curr. Opin. in Allergy and Clin. Immunol.- 2014.- Vol. 14.- P. 509-515.
21. Аверченков В.М., Палагин И.С. Внутривенные иммуноглобулины: механизмы действия и особенности клинического применения // Клиническая микробиология и антимикробная химиотерапия.- 2004.- № 6.- С. 273-281.
22. Ballow M. The IgG molecule as a biological immune response modifier: mechanisms of action of intravenous immune serum globulin in auto-immuen and inflammatory disorders // J. Allergy Clin. Immunol.- 2011.- Vol. 127.- P. 315-323.
23. Samuelsson A., Towers T.L., Ravetch J.V. Anti-inflammatory activity of IVIG mediated through the inhibitory Fc receptor // Science. - 2001.- Vol. 291.- P. 484-486.
24. Anthony R.M., Kobayashi T., Wermeling F., Ravetch J.V. Intravenous gammaglobulin suppresses inflammation through a novel T(H)2 pathway // Nature.- 2011.- Vol. 475.- P. 110-113.
25. Lindkvist A., Edén A., Norström M.M., Gonzalez V.D., Nilsson S., Svennerholm B., Karlsson A.C., Sandberg J.K., Sönnerborg A., Gisslén M. Reduction of the HIV-1 reservoir inresting CD4+ T-lymphocytes by high dosage intravenous immunoglobulin treatment: a proof-of-conceptstudy // AIDS Res. Ther.- 2009.- Vol. 6.- P. 15-17.
26. Cikurel K., Schiff L., Simpson D.M. Pilot Study of Intravenous Immunoglobulin in HIV-Associated Myelopathy // AIDS Patient Care and STDs.- 2009.- Vol. 23.- P. 75-78.
27. Di Rocco A., Simpson D.M. AIDS-associated vacuolar myelopathy // AIDS Patient Care and STDs.- 1998.- Vol. 12.- P. 457-461.
28. Petito C.K., Navia B.A., Cho E.S., Jordan B.D., George D.C., Price R.W. Vacuolar myelopathy pathologically resembling subacute combined degeneration in patients with the acquired immunodeficiency syndrome // New Engl. J. Med.- 1985.- Vol. 312.- P. 874-879.
29. Henin D., Smith T.W., De Girolami U., Sughayer M., Hauw J.J. Neuropathology of the spinal cord in the acquired immunodeficiency syndrome // Hum. Pathol.- 1992.- Vol. 23.- P. 1106-1114
30. Artigas J., Grosse G., Niedobitek F. Vacuolar myelopathy in AIDS: a morphologic analysis // Pathol. Res. Pract.- 1990.- Vol. 186.- P. 228-237.
31. Tan S.V., Guiloff R.J., Scaravilli F. AIDS-associated vacuolar myelopathy: a morphometric study // Brain.- 1991.- Vol. 118.- P. 1247-1261.
32. Fernàndez-Fernàndez F.J., de la Fuente-Aguado J., Ocampo-Hermida A., IglesiasCastanön A. Remission of HIV-associated myelopathy after highly active antiretroviral therapy // J. Postgrad. Med.- 2004.- Vol. 50.- P. 195-196.
33. Chong J., Di Rocco A., Tagliati M., Danisi F., Simpson D.M., Atlas S.W. MR Findings in AIDS-Associated Myelopathy // AJNR Am. J. Neuroradiol.- 1999.- Vol. 20.- P. 1412-1416.
34. Aboulafia D.M., Taylor L. Vacuolar myelopathy and vacuolar cerebellar leukoencephalopathy: A late complication of AIDS after highly active antiretroviral therapy-induced immune reconstitution // AIDS Patient Care and STDs.- 2002.- Vol. 12.- P. 579-584.
35. Staudinger R., Henry K.Remission of HIV myelopathy after highly active antiretroviral therapy // Neurology. - 2000.- Vol. 54.- P. 267-268.
36. Di Rocco A., Geraci A., Tagliati M. Remission of HIV myelopathy after highly active antiretroviral therapy // Neurology.- 2000.- Vol. 55.- P. 456.
37. Ramratnam B., Ribeiro R., He T., Chung C., Simon V., Vanderhoeven J., Hurley A., Zhang L., Perelson A.S., Ho D.D., Markowitz M. Intensification of antiretroviral therapy accelerates the decay of the HIV-1 latent reservoir and decreases, but does not eliminate, ongoing virus replication // J. Acquir. Immune. Defic. Syndr.- 2004.- Vol. 35.- P. 33-37.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Попова М.Ю., Танцурова К.С., Яковлева Ю.А.
Профилактика передачи ВИЧ-инфекции от матери к ребенку во время беременности и родов
Попова М.Ю., Танцурова К.С., Яковлева Ю.А.
ФГБОУ ВО Южно-Уральский ГМУ Минздрава России
Кафедра акушерства и гинекологии
Профилактика передачи ВИЧ-инфекции от матери к ребенку во время беременности и родов
Попова М.Ю., Танцурова К.С., Яковлева Ю.А.
Профилактика передачи ВИЧ-инфекции от матери к ребенку во время беременности и родов
Попова М.Ю., Танцурова К.С., Яковлева Ю.А.
ФГБОУ ВО Южно-Уральский ГМУ Минздрава России
Кафедра акушерства и гинекологии
Профилактика передачи ВИЧ-инфекции от матери к ребенку во время беременности и родов
Попова М.Ю., Танцурова К.С., Яковлева Ю.А.
ФГБОУ ВО Южно-Уральский ГМУ Минздрава России
Кафедра акушерства и гинекологии
Актуальность проблемы. Ежегодно увеличивается количество ВИЧ-положительных людей, вместе с этим растет доля женщин среди них и, следовательно, увеличивается количество родов у ВИЧ-инфицированных женщин. К современной профилактике относят своевременную диагностику ВИЧ-инфекции и выявление факторов высоко риска заражения ВИЧ у беременных, медикаментозную профилактику, проводимую антиретровирусными препаратами (АРВП) у женщин и детей, тактику ведения беременности и родов, а также ведение ребенка в первые полтора года жизни [1, 3].
Цель работы. Изучить особенности диагностики, течения беременности у ВИЧ-положительных женщин и профилактику заражения ВИЧ-инфекцией от матери к ребенку.
Задачи исследования:
1. Определить структуру тест-консультирования у беременных женщин.
2. Обозначить последовательность действий во время принятия родов у ВИЧ-положительных женщин.
Материалы и методы. Всем беременным женщинам, планирующим сохранить беременность, проводят тестирование на ВИЧ-инфекцию с обязательным пред- и после тестовым консультированием, для проведения профилактики передачи ВИЧ от матери к ребенку. Следует провести двухразовое тестирование: при первом обращении по поводу беременности и в третьем триместре беременности на 34–36 неделе. Чтобы исключить пропуски ВИЧ-инфицирования из-за нахождения беременной в серонегативном периоде, на ВИЧ-инфекцию должны протестировать биологического отца на сроке беременности женщины 20-26 недель [4]. В случае положительного результата теста, женщина подлежит тестированию на противовирусную ДНК или РНК ВИЧ в центре СПИД до 28 недели беременности. Также проводится дополнительное после тестовое консультирование, которое проводит врач-инфекционист в центре СПИД или доверенный инфекционист территориального образования непосредственно в родовспомогательном учреждении. При консультировании ВИЧ-положительных беременных, следует обсудить вопросы, касающиеся риска передачи ВИЧ от матери ребенку и методов его предупреждения, необходимости замены грудного вскармливания на искусственные смеси, диагностики ВИЧ у новорожденного, необходимости дальнейшего врачебного наблюдения женщины и ребенка в Центре СПИД.
ВИЧ-инфицированная мать может быть заразной для своего ребенка во время беременности (особенно после 30-й недели), в процессе родов и во время грудного вскармливания. Очень высок риск инфицирования ребенка, если мать была заражена в период беременности или при наступлении беременности на поздних стадиях ВИЧ-инфекции.
Химиопрофилактика передачи ВИЧ-инфекции проводится в двух периодах: во время беременности и во время родов. Наиболее успешные результаты имеют место при комплексном проведении антиретровирусной терапии в сочетании с выбором адекватной тактики родов и отменой грудного вскармливания. При выборе АРВ-препаратов для химиопрофилактики во время беременности учитывают: стадию ВИЧ-инфекции, число CD-4 лимфоцитов, уровень вирусной нагрузки, срок беременности и наличие сопутствующих заболеваний.
Второй этап профилактики заражения ВИЧ-инфекцией связан с родами. Как правило, безводный период во время родов должен составлять не более 4 часов, продолжительность родового процесса не более 15 часов [2]. Во время родов немаловажным является обработка влагалища 0,25 % водным раствором Хлоргексидина при первом влагалищном исследовании, если у женщины имеется воспалительные заболевания, в частности кольпит, то при каждом последующем влагалищном исследовании. В процессе родов внутривенно капают антиретровирусный препарат – Зидовудин, с начала родовой деятельности из расчёта 0,002 г на 1 кг веса пациентки в течение первого часа родов, далее снижают дозу до 0,001 г на 1 кг веса в час до момента отделения ребёнка от матери. Резистентность вируса к Зидовудину или побочные эффекты на прием этого препарата в анамнезе является противопоказанием. Во время родов пытаются избегать таких процедур, как родовозбуждение, перинео- и эпизиотомия, наложение акушерских щипцов и вакуум-экстракция плода, но если использую их, то только по жизненным показаниям. Уровень РНК ВИЧ выше 1000 копий/мл и/ или количество CD4+ лимфоцитов В среднем:
заведующий кафедрой хирургии полости рта, д.м.н., профессор, заслуженный врач РФ,
ассистент кафедры хирургии полости рта, к.м.н.,
1. Вирус иммунодефицита человека – медицина: руководство для врачей / под ред. Н.А. Белякова, А.Г. Рахмановой. – СПб.: Балтийский медицинский образовательный центр, 2011. – 656 с.
2. Бартлетт, Дж. Клинические аспекты ВИЧ-инфекции. 2012 / Дж. Бартлетт, Дж. Галлант, П. Фам. – М.: Р. Валент, 2012. – 528 с.
3. ВИЧ-инфекция и СПИД. Национальное руководство. Краткое издание / под ред. В.В. Покровского. – М.: ГЭОТАР-Медиа, 2014. – 528 с.
4. ВИЧ-инфекция у взрослых. Клинические рекомендации. – Министерство здравоохранения РФ, 2017. – 64 с.
7. Choromańska M. Prosthetic status and needs of HIV positive subjects / M. Choromańska, D. Waszkiel // Adv. Med. Sci. – 2006. – Vol. 51, N 1. – P. 106–109.
8. Engeland C.G. HIV infection and tooth loss / C.G. Engeland, P. Jang, M. Alves et al. // Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. – 2008. – Vol. 105, N 3. – P. 321–326.
9. Baqui A. Association of HIV viral load with oral diseases / A. Baqui, T. Meiller, M. Jabra-Rizk et al. // Oral Dis. – 1999. – Vol. 5, N 4. – P. 294–298.
10. Aichelmann-Reidy M.E. HIV infection and bone loss due to periodontal disease / M.E. Aichelmann-Reidy, D.L. Wrigley, J.C. Gunsolley // J. Periodontol. – 2010. – Vol. 81, N 6. – P. 877–884.
11. Guarnelli M.E. Radiographic evaluation of alveolar bone height in HIV-positive patients / M.E. Guarnelli, L. Trombelli, G. Calura // Minerva Stomatol. – 1999. – Vol. 48, N 6. – P. 247–255.
12. Persson R.E. Alveolar bone levels in AIDS and HIV seropositive patients and in control subjects / R.E. Persson, L.G. Hollender, G.R. Persson // J. Periodontol. – 1998. – Vo. 69, N 9. – P. 1056–1061.
13. Dodson T.B. HIV status and the risk of post-extraction complications / T.B. Dodson // J. Dent. Res. – 1997. – Vol. 76. – P. 1644–1652.
14. Тимофеев, А.А. Особенности клинического течения одонтогенных воспалительных заболеваний челюстей и мягких тканей у больных наркоманией и ВИЧ-инфицированных / А.А. Тимофеев // Современная стоматология. – 2006. – № 2. – С. 88–95.
15. Блувштейн, Г.А. Клинико-морфологические аспекты хирургических ошибок и осложнений у больных ВИЧ/ СПИД / Г.А. Блувштейн, С.А. Мозеров, А.А. Кулаков // Известия высших учебных заведений. Поволжский регион. Медицинские науки. – 2010. – № 4 (16). – С. 61–72.
16. Campo-Trapero J. Dental management of patients with human immunodeficiency virus / J. Campo-Trapero, J. CanoSánchez, J. del Romero-Guerrero // Quintessence Int. – 2003. – Vol. 34, N 7. – P. 515–525.
17. Abel S.N. Principles of Oral Health Management for the HIV/AIDS Patient / S.N. Abel, D. Croser, S. Fischman et al. // Dental Alliance for AIDS/HIV Care (DAAC), 2000. – 53 p.
18. Пивник, А.В. Тромбоцитопения при ВИЧ-инфекции / А.В. Пивник [и др.] // Терапевтический архив. – 2008. – № 80 (7). – С. 75–80.
19. Хайретдинов, Р.К. Тромбоцитопения при ВИЧинфекции / Р.К. Хайретдинов [и др.] // Вестник РУДН. Сер. Медицина. – 2010. – № 3. – С. 129–132.
20. Little J.W. Dental Management of the Medically Compromised Patient / J.W. Little, D.A. Falace, C.S. Miller et al. – 8th ed. – St. Louis, MO: Elsevier, Inc., 2013. – 715 p.
21. Monier P. Osteonecrosis complicating highly active antiretroviral therapy in patients infected with human immunodeficiency virus / P. Monier, K. McKown, S. Bronze // Clin. Infect. Dis. – 2000. – Vol. 31. – P. 1488–1492.
22. Miller K.D. High prevalence of osteonecrosis of the femoral head in HIV-infected adults / K.D. Miller, H. Masur, E.C. Jones et al. // Ann. Intern. Med. – 2002. – Vol. 137. – P. 17–25.
23. Allison G.T. Osteonecrosis in HIV disease: epidemiology, etiologies, and clinical management / G.T. Allison, M.P. Bostrom, M.J. Glesby // AIDS. – 2003. – Vol. 17. – P. 1–9.
24. Gutiérrez F. Osteonecrosis in Patients Infected With HIV: Clinical Epidemiology and Natural History in a Large Case Series from Spain / F. Gutiérrez, S. Padilla, M. Masiá et al. // JAIDS Journal of Acquired Immune Deficiency Syndromes. – 2006. – Vol. 42, N 3. – P. 286–292.
25. Johnson M.D. Osteonecrosis in HIV-infected persons: radiographic findings delay clinical diagnosis / M.D. Johnson, C.F. Decker // AIDS Read. – 2008. – Vol. 18, N 3. – P. 124– 126.
26. Звоновский, В.Б. ВИЧ и стигма / В.Б. Звоновский // Журнал исследований социальной политики. – 2008. – № 6 (4). – С. 505–522.
27. Богачанская, Н.Н. Отношение врачей-терапевтов к ВИЧ-инфицированным пациентам / Н.Н. Богачанская // Современные исследования социальных проблем. – 2011. – № 1(05). – С.217–219.
28. Brondani M.A. Stigma around hiv in dental care: patients› experiences / M.A. Brondani, J.C. Phillips, R.P. Kerston et al. // J. Can. Dent. Assoc. – 2016. – 82: g1.
29. Kalichman S. Measuring AIDS stigmas in people living with HIV/AIDS: the Internalized AIDS-Related Stigma Scale / S. Kalichman, L. Simbayi, A. Cloete et al. // AIDS Care. – 2009. – Vol. 21, N 1. – P. 87–93.
30. Logie C. Meta-analysis of health and demographic correlates of stigma towards people living with HIV / C. Logie, T. Gadalla // AIDS Care. – 2009. – Vol. 21, N 6. – P. 742–753.
31. Робустова, Т.Г. Имплантация зубов (хирургические аспекты) / Т.Г. Робустова. – М.: Медицина, 2003. – 560 с.
32. Ренуар, Ф. Факторы риска в стоматологической имплантологии / Ф. Ренуар, Б. Рангерт. – М.: Азбука, 2004. – 176 с.
33. Параскевич, В.Л. Дентальная имплантология: основы теории и практики: руководство / В.Л. Параскевич. – М., 2006. – 240c.
34. Дентальная имплантация : учебное пособие / сост.: Сельский Н.Е., Буляков Р.Т., Галиева Э.И., Гуляева О.А., Викторов С.В., Трохалин А.В., Коротик И.О. – Уфа: Изд-во ФГБОУ ВО БГМУ Минздрава России, 2016 – 116 с.
35. Baron M. Implants in an HIVpositive patient: a case report / M. Baron, F. Gritsch, A.M. Hansy et al. // Int. J. Oral Maxillofac. Implants. – 2004. – Vol. 19. – P. 425–430.
36. Shetty K. Dental implants in the HIV-positive patientcase report and review of the literature / K. Shetty, R. Achong // Gen. Dent. – 2005. – Vol. 53. – P. 434–437.
37. Romanos G.E. Immediate loading with fixed implantsupported restorations in an edentulous patient with an HIV infection: a case report / G.E. Romanos, E. Goldin, L. Marotta et al. // Implant Dent. – 2014. – Vol. 23. – P. 8–12.
38. Achong R.M. Implants in HIV-positive patients: 3 cases reports / R.M. Achong, K. Shetty, A. Arribas et al. // J. Oral Maxillofac. Surg. – 2006. – Vol. 64. – P. 1199–1203.
39. Kolhatkar S. Immediate dental implant placement in HIV-positive patients receiving highly active antiretroviral therapy: a report of two cases and a review of the literature of implants placed in HIV-positive individuals / S. Kolhatkar, S. Khalid, A. Rolecki et al. // J. Periodontol. – 2011. – Vol. 82. – P. 505–511.
40. Gay-Escoda C. Longterm outcomes of oral rehabilitation with dental implants in HIV-positive patients: A retrospective case series / C. Gay-Escoda, D. Pérez-Álvarez, O. Camps-Font // Med. Oral Patol. Oral Cir. Bucal. – 2016. – Vol. 21, N 3. – P. 385–391.
41. Stevenson G.C. Short-term success of osseointegrated dental implants in HIV-positive individuals: a prospective study / G.C. Stevenson, P.C. Riano, A.J. Moretti et al. // J. Contemp. Dent. Pract. – 2007. – Vol. 8. – P. 1–10.
42. Bornstein M.M. Systemic conditions and treatments as risks for implant therapy / M.M. Bornstein, N. Cionca, A. Mombelli // Int. J. Oral Maxillofac. Implants. – 2009. – Vol. 24. – P. 12–27.
43. Oliveira M.A. The success of endosseous implants in human immunodeficiency virus-positive patients receiving antiretroviral therapy: a pilot study / M.A. Oliveira, M. Gallottini, D. Pallos et al. // J. Am. Dent. Assoc. – 2011. – Vol. 142. – P. 1010–1016.
44. Sparaco A. Surgical dental implants in people living with HIV-AIDS / A. Sparaco, M. Ghezzi, G. Donati et al. // Retrovirology. – 2012. – Vol. 9, N 1. – P. 85.
45. Gherlone E.F. Implant Prosthetic Rehabilitation in Controlled HIV-Positive Patients: A Prospective Longitudinal Study with 1-Year Follow-Up / E.F. Gherlone, P. Cappar , S. Tecco et al. // Clin. Implant. Dent. Relat. Res. – 2016. – Vol. 18, N 4. – P. 725–734.
46. Rania V. Long-term Efficacy of Dental Implants in HIVPositive Patients / V. Rania, P. Pellegrino, G. Donati et al. // Clin. Infect. Dis. – 2015. – Vol. 61, N 7. – P. 1208.
47. Hwang D. Medical contraindications to implant therapy: part I: absolute contraindications / D. Hwang, H.L. Wang // Implant. Dent. – 2006. – Vol. 15. – P. 353–360.
48. Diz P. Dental implants in the medically compromised patient / P. Diz, C. Scully, M. Sanz // J. Dent. – 2013. – Vol. 41. – P. 195–206.
49. Becker W. Osteoporosis implant failure: an axploratory case-control study / W. Becker, P. Hujoel, B. Becker et al. // Periodontol. – 2000. – Vol. 71, N 4. – Р. 625–631.
50. Козлова М.В. Ремоделирование при атрофии альвеолярной части челюстей у пациентов с остеопеническим синдромом / М.В. Козлова, А.М. Панин, А.М. Мкртумян // Клиническая геронтология. – 2008. – Т. 14. – № 2. – С. 30–34.
51. Янушевич, О.О. Качественная оценка челюстных костей у пациентов при комплексной антиостеопоретической терапии / О.О. Янушевич [и др.] // Российская стоматология. – 2014. – № 4. – Т. 7. – С. 34–40.
52. Dolan S.E. Reduced bone density in HIV-infected women / S.E. Dolan, J.S. Huang, K.M. Killilea et al. // AIDS. – 2004. – Vol. 18, N 3. – P. 475–483.
53. Yin M. Bone mass and mineral metabolism in HIV+ postmenopausal women / M. Yin, J. Dobkin, K. Brudney et al. // Osteoporos. Int. – 2005. – Vol. 16, N 11. – P. 1345–1352.
54. Fausto A. Potential predictive factors of osteoporosis in HIV-positive subjects / A. Fausto, M. Bongiovanni, P. Cicconi et al. // Bone. – 2006. – Vol. 38, N 6. – P. 893–897.
55. Arnsten J.H. Decreased bone mineral density and increased fracture risk in aging men with or at risk for HIV infection / J.H. Arnsten, R. Freeman, A.A. Howard et al. // AIDS. – 2007. – Vol. 21, N5. – P. 617– 623.
56. Jones S. Risk factors for decreased bone density and effects of HIV on bone in the elderly // S. Jones, D. Restrepo, A. Kasowitz et al. // Osteoporos. Int. – 2008. – Vol. 19, N 7. – P. 913–918.
57. Brown T.T. Antiretroviral therapy and the prevalence of osteopenia and osteoporosis: a meta-analytic review / T.T. Brown, R.B. Qaqish // AIDS. – 2006. – Vol. 20, N 17. – P. 2165–2174.
58. Gallant J.E. Efficacy and safety of tenofovir DF vs stavudine in combination therapy in antiretroviralnaive patients: a 3-year randomized trial / J.E. Gallant, S. Staszewski, A.L. Pozniak et al. // JAMA. – 2004. – Vol. 292, N 2. – P. 191–201.
59. Stephensen C.B. Vitamin D status in adolescents and young adults with HIV infection / C.B. Stephensen, G.S. Mar quis, L.A. Kruzich et al. // Am. J. Clin. Nutr. – 2006. – Vol. 83, N 5. – P. 1135–1141.
60. Chew N.S. Osteopenia and osteoporosis in HIV: pathogenesis and treatment / N.S. Chew, P.P. Doran, W.G. Powderly // Curr. Opin. HIV AIDS. – 2007. – Vol. 2, N 4. – P. 318–323.
61. Gilsanz V. Reciprocal relations of subcutaneous and visceral fat to bone structure and strength / V. Gilsanz, J. Chalfant, A.O. Mo et al. // J. Clin. Endocrinol. Metab. – 2009. – Vol. 94, N 9. – P. 3387–3393.
62. McComsey G.A. Bone Disease in HIV Infection: A Practical Review and Recommendations for HIV Care Providers / G.A. McComsey, P. Tebas, E. Shane et al. // Clinical Infectious Diseases. – 2010. – Vol. 51, N 8. – P. 937–946.
63. Shiau S. Incident fractures in HIVinfected individuals: a systematic review and meta-analysis / S. Shiau, E.C. Broun, S.M. Arpadi et al. // AIDS. – 2013. – Vol. 27. – P. 1949–1957.
64. Triant V.A. Fracture prevalence among human immunodeficiency virus (HIV)–infected versus non-HIV-infected patients in a large U.S. healthcare system / V.A. Triant, T.T. Brown, H. Lee et al. // J. Clin. Endocrinol. Metab. – 2008. – Vol. 93. – P. 3499–3504.
65. Womack J.A. Increased risk of fragility fractures among HIV-infected compared to uninfected male veterans / J.A. Womack, J.L. Goulet, C. Gibert et al. // PLoS One. – 2011. – Vol. 6: e17217
66. Young B. Increased rates of bone fracture among HIVinfected persons in the HIV Outpatient Study (HOPS) compared with the US general population, 2000–2006 / B. Young, C.N. Dao, K. Buchacz et al. // Clin. Infect. Dis. – 2011. – Vol. 52. – P. 1061–1068.
67. Bruera D. Decreased bone mineral density in HIV-infected patients is independent of antiretroviral therapy / D. Bruera, N. Luna, D.O. David et al. // AIDS. – 2003. – Vol. 17, N 13. – P. 1917–1923.
68. Иорданишвили, А.К. Репаративный остеогенез: теоретические и прикладные аспекты проблемы / А.К. Иорданишвили, В.Г. Гололобов // Пародонтология. – 2002. – № 1. – С. 22–31.
70. Fakruddin J.M. HIV-1 Vpr enhances production of receptor of activated NF-kappaB ligand (RANKL) via potentiation of glucocorticoid receptor activity / J.M. Fakruddin, J. Laurence // Arch. Virol. – 2005. – Vol. 150, N 1. – P. 67–78.
71. Cotter E.J. HIV proteins regulate bone marker secretion and transcription factor activity in cultured human osteoblasts with consequent potential implications for osteoblast function and development / E.J. Cotter, A.P. Malizia, N. Chew et al. // AIDS Res. Hum. Retroviruses. – 2007. – Vol. 23. – P. 1521– 1530.
72. Gibellini D. HIV-1 triggers apoptosis in primary osteoblasts and HOBIT cells through TNFalpha activation / D. Gibellini, E. De Crignis, C. Ponti et al. // J. Med. Virol. – 2008. – Vol. 80, N 9. – P. 1507–1514.
73. Baqui A.A. Enhanced interleukin-1beta, interleukin-6 and tumor necrosis factor-alpha production by LPS stimulated human monocytes isolated from HIV+ patients / A.A. Baqui, M.A. Jabra-Rizk, J.I. Kelley et al. // Immunopharmacol. Immunotoxicol. – 2000. – Vol. 22, N 3. – P. 401–421.
74. Brown T.T. Bone turnover, osteoprotegerin/RANKL and inflammation with antiretroviral initiation: tenofovir versus non-tenofovir regimens / T.T. Brown, A.C. Ross, N. Storer et al. // Antivir. Ther. – 2011. – Vol. 16. – P. 1063–1072.
75. French M. Plasma levels of cytokines and chemokines and the risk of mortality in HIV-infected individuals: a casecontrol analysis nested in a large clinical trial / M. French, A. Cozzi-Lepri, R. Arduino // AIDS. – 2015. – Vol. 29. – P. 847–851.
76. Симбирцев, А.С. Иммунопатогенез и перспективы иммуномодулирующей терапии ВИЧ-инфекции. Часть 1. Общие вопросы иммунологии и ВИЧ1 / А.С. Симбирцев // ВИЧ-инфекция и иммуносупрессии. – 2017. – Т. 9. – № 1. – С. 2.
77. Жоголев, К.Д. Регуляция остеогенеза и иммуногенеза репаративных процессов / К.Д. Жоголев // СПб.: Мед., 2003. – 136 с.
78. Park J. Bone regeneration in oritical size defects by cells mediated BMP – 2 gene transfer: a comparison of adenoviral vectors and liposomes / J. Park, J. Ries, K. Gelse et al. // Gene. Ther. – 2003. – Vol. 10. – P. 1089–1098.
79. Kwan T.S. IL-6, RANKL, TNF-alpha/IL-1: interrelations in bone resorption pathophysiology / T.S. Kwan, M. Padrines, S. Theoleyre // Cytokine Growth Factor Rev. – 2004. – Vol. 15. – P. 49–60.
80. Rodriguez M. High frequency of vitamin D deficiency in ambulatory HIV-Positive patients / M. Rodriguez, B. Daniels, S. Gunawardene et al. // AIDS Res. Hum. Retroviruses. – 2009. – Vol. 25, N 1. – P. 9–14.
81. Dao C.N. Low vitamin D among HIV-infected adults: prevalence of and risk factors for low vitamin D levels in a cohort of HIV-infected adults and comparison to prevalence among adults in the US general population / C.N. Dao, P. Patel, E.T. Overton et al. // Clin. Infect. Dis. – 2011. – Vol. 52. – P. 396–405.
82. Childs K.E. Short communication: inadequate vitamin D exacerbates parathyroid hormone elevations in tenofovir users / K.E. Childs, S.L. Fishman, C. Constable et al. // AIDS Res. Hum. Retroviruses. – 2010. – Vol. 26. – P. 855–859.
83. Holick M.F. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline / M.F. Holick, N.C. Binkley, H.A. Bischoff-Ferrari et al. // J. Clin. Endocrinol. Metab. – 2011. – Vol. 96, N 7. – Р. 1911–1930.
84. Schоttker B. Is vitamin D deficiency a cause of increased morbidity and mortality at older age or simply an indicator of poor health? / B. Schоttker, K.U. Saum, L. Perna et al. // Eur. J. Epidemiol. – 2014. – Vol. 29, N 3. – Р. 199–210.
85. ВИЧ-инфекция / А.Г. Рахманова [и др.]. – СПб., 2004. – 696 с.
86. Brown T.T. Loss of bone mineral density after antiretroviral therapy initiation, independent of antiretroviral regimen / T.T. Brown, G.A. McComsey, M.S. King et al. // J. Acquir. Immune. Defic. Syndr. – 2009. – Vol. 51. – P. 554–561.
87. Pinto Neto L.F. Low bone mass prevalence, therapy type, and clinical risk factors in an HIV-infected Brazilian population / L.F. Pinto Neto, S. Ragi-Eis, N.F. Vieira et al. // J. Clin. Densitom. – 2011. – Vol. 14, N 4. – Vol. 434–439.
- Обратные ссылки не определены.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


