Иммуноглобулин с антителами к вич
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Н. Л. Громыко, Е. И. Барановская, С. В. Жаворонок, Н. М. Голубых
Иммуноферментным анализом проведено определение концентрации иммуноглобулинов А, М, G в сывороткекрови 68 ВИЧ-инфицированных беременных , 36 ВИЧ-негативных беременных женщин и 31 ВИЧ-инфицированнойнебеременной. Показано влияние беременности на гуморальный иммунитет при ВИЧ-инфекции .
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Н. Л. Громыко, Е. И. Барановская, С. В. Жаворонок, Н. М. Голубых
NONSPECIFIC ANTIBODIES IN BLOOD SERUM IN HIV-POSITIVE PREGNANT WOMEN
We studied serum immunoglobulin A,M,G levels in 68 HIV-positive, 36 HIV-negative pregnant women and 31 HIV-positive non-pregnant women by enzyme linked immunosorbent assay. HIV-infection has negative influence on humoral immunity during pregnancy .
Проблемы здоровья и экологии
соответственно, р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Key words: immunoglobulins, HIV-infection, pregnancy.
Проблемы здоровья и экологии
Важную роль в защите организма от различных инфекций играют иммуноглобулины. При ВИЧ-инфекции наряду с изменениями клеточного иммунитета происходит дезорганизация гуморального звена, неспецифическая поликлональная активация В-лимфоцитов, потеря В-клеток памяти [1, 2]. При хроническом течении инфекции на фоне небольшого числа В-клеток отмечается гипергаммаглобулинемия, которая возрастает по мере прогрессирования заболевания с последующим истощением этого отдела иммунной системы [3]. В исходе беременности важную роль играют иммунологические взаимоотношения между материнским организмом и плодом, которые затрагивают не только клеточное, но и гуморальное звено иммунитета. В первую очередь снижается активность приобретенного иммунитета при сохранении функции врожденного иммунитета, важным компонентом которого являются естественные антитела [4, 5].
Цель работы: оценить клиническое значение содержания иммуноглобулинов класса А, М, G при ВИЧ-инфекции у беременных.
Материал и метод
В исследование включены 135 женщин после получения письменного информированного согласия. Женщины разделены на три группы: 1 группа — беременные без ВИЧ-инфекции (36 человек), 2 группа — ВИЧ-инфицированные небеременные (31 человек), 3 группа — ВИЧ-инфицированные беременные (68 человек).
Критерии включения в 1 группу: ВИЧ-негативные беременные. Критерии исключения из контрольной группы: наличие у беременных хронических инфекционных заболеваний, осложняющих течение беременности и служащих причиной вторичного иммунодефицита.
Критерии включения во 2 группу: ВИЧ-позитивные небеременные женщины репродуктивного возраста. Критерии исключения из группы: тяжелые состояния, требующие интенсивной терапии в отделении реанимации.
Критерии включения в 3 группу: установленный ВИЧ-позитивный статус у беременных.
В исследовании использованы следующие методы: клинико-анамнестический метод, общелабораторные исследования, ультразвуковое и допплерометрическое исследование. В работе также учтены результаты гистологического исследования последов.
мы (N) до 1,3N; сильно повышенной концентрацией — более 1,3N; пониженной концентрацией — ниже N. Концентрацию иммуноглобулинов в сыворотке крови определяли в сроке беременности 36-40 недель, а также у 20 беременных без ВИЧ-инфекции в сроке 10-12 недель.
Клиническая стадия ВИЧ/СПИДа выставлена по классификации ВОЗ (I-IV стадия), степень иммуносупрессии — по классификации CDC.
В работе использовались следующие математико-статистические методы: описательная статистика данных в группах (вычислены медианы (Ме) и интерквартильные размахи (25 и 75 про-центили), доля (Р) и доверительный интервал доли). Нормальность распределения количественных признаков в выборке определена с помощью критерия Шапиро-Уилка; сравнение нескольких групп проведено с помощью критерия Крускала-Уолиса (Н), сравнение двух групп — с использованием критерия Манна-Уитни (Z). Использован корреляционный анализ (коэффициент корреляции — rs) методом Спирмена. Для оценки изменений показателей в одной группе использован критерий Вилкоксона (Т). Для оценки различия частоты встречаемости признаков использован критерий х2. Для оценки относительного риска развития неблагоприятного исхода рассчитывалось отношение шансов (ОШ) с 95 % доверительным интервалом (ДИ). Статистически значимыми считали результаты при уровне р 500 кл/мкл) 7 (22,5; 9,5-41,0) 28 (41,1; 29,3-53,7)
Средняя (200-500 кл/мкл) 15 (48,3; 30,1-66,9) 28 (41,1; 29,3-53,7)
Тяжелая ( Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
ВИЧ-инфицированные беременные с I и II клинической стадией заболевания имеют меньшее содержание IgG по сравнению с небеременными тех же клинических стадий (Z = 3,29; р = 0,001 для I стадии; Z = 2,2; р = 0,027 для II стадии). Уровень иммуноглобулина у беременных III и IV стадий не отличается от такового у небеременных. При I и II стадии заболевания частота возникновения фетоплацентарной недостаточности составляет 39,2 % (95 % ДИ 21,559,4) и 44,4 % (95 % ДИ 21,5-69,2) соответственно. При III и IV стадии патология фетоплацентарной области отмечена в 66,6 % (95 % ДИ 38,3-88,1) случаев, что может нарушать трансплацентарный перенос иммуноглобулина.
Различия в содержании IgG при разных стадиях заболевания также связаны с развити-
ем послеродовых осложнений. В группе ВИЧ-инфицированных беременных послеродовый период протекал с осложнениями у 9 (13,2 %; 95 % ДИ 6,2-23,6) женщин. Частота возникновения инфекционно-воспалительных осложнений увеличивается с ухудшением клинической стадии заболевания: I стадия — 3,2 % (95 % ДИ 0,0816,7), II — 15,7 % (95 % ДИ 3,3-39,5), III и IV стадия — 31,2 % (11,0-58,6). Шансы возникновения послеродовых осложнений при III и IV стадии выше, чем при I стадии (ОШ = 13,64; 95 % ДИ 1,41-66,9; х2 = 5,14; р = 0,023). Нами выявлена положительная корреляционная связь между концентрацией IgG в сыворотке крови до родоразрешения и частотой возникновения послеродовых осложнений в группе ВИЧ-инфицированных беременных (rs = 0,44; р = 0,0003).
H = 69,4; p Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
* статистически значимые отличия от 3 триместра (T = 11,0; Z = 3,5; p Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
2. Mechanisms of hypergammaglobulinemia and impaired antigen-specific humoral immunity in HIV-1 infection / Angelo De Milito [et al.] // Blood. — 2004. — Vol. 103, № 6. — P. 2180-2186.
3. Кишкун, А. А. Иммунологические и серологические исследования в клинической практике / А. А. Кишкун. — М.: МИА, 2006. — 536 с.
4. Miller, E. Changes in serum immunity during pregnancy /
E. Miller // American Journal of human biology. — 2009. — Vol. 21. — P. 401-403.
5. Number, maturity and phagocytic activity of neutrophils in the three trimesters of pregnancy / S. S. Pramanik [et al.] // East Med-iterr Health J. — 2007. — Vol. 13, № 4. — P. 862-867.
6. Шмагель, К В. Иммунитет беременной женщины / К. В. Шма-гель, В. А. Черешнев. — М/: Медицинская книга, 2003. — 226 с.
7. Dynamics of immunoglobulins at the feto-maternal interface /
F. Saji [et al.] // Rev Reprod. — 1999. — Vol. 4, № 2. — P. 81-90.
8. Simister, N. E. Placental transport of immunoglobulin G / N. E. Simister // Vaccine. — 2003. — Vol. 21, № 24. — P. 3365-3369.
9. Дранник, Г. Н. Клиническая иммунология и аллергология / Г. Н. Дранник. — М.: МИА, 2003. — 604 с.
Содержимое (Table of Contents)
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Настоящая общая фармакопейная статья распространяется на группу иммунобиологических препаратов – иммуноглобулины человека, которые представляют собой иммунологически активную белковую фракцию сыворотки или плазмы крови человека, несущую антительную активность различной специфичности. Препараты иммуноглобулинов представляют собой жидкость или порошок (гигроскопичную массу), содержащие иммуноглобулины, преимущественно класса G (Ig G) – антитела против различных возбудителей бактериальных и вирусных инфекций и/или их токсинов.
Иммуноглобулины человека подразделяют на:
- иммуноглобулины нормальные (для внутримышечного, подкожного, внутривенного введения и энтерального применения), которые используют для специфической профилактики бактериальных и вирусных инфекций, для повышения неспецифической резистентности организма, а также для лечения инфекционно-токсических и вирусных заболеваний;
- иммуноглобулины специфические, применяемые для профилактики и/или лечения определенной инфекции;
- иммуноглобулины специального назначения (для лечения аллергических заболеваний и др.)
В состав иммуноглобулинов человека входит не менее 95% иммуноглобулинов класса G.
Иммуноглобулины человека не содержат консервантов и антибиотиков.
ПРОИЗВОДСТВО
Иммуноглобулины человека изготавливаются из пула плазмы крови, полученной не менее чем от 1000 здоровых доноров (для специфических иммуноглобулинов количество доноров не ограничено), методами с доказанной эффективностью выделения иммуноглобулиновой фракции и обеспечения вирусной и специфической безопасности.
Производство иммуноглобулинов человека должно гарантировать сохранение структуры и функции белков иммуноглобулинов, обеспечивающих специфическую и вирусную безопасность препаратов, исключающих контаминацию чужеродными агентами и включающих стадию/стадии производства, которые обеспечивают инактивацию и элиминацию инфекционных агентов. Антибактериальная и противовирусная эффективность препаратов должна быть обеспечена соответствующей степенью концентрации антител в процессе производства (не менее чем в 3 раза при содержании белка в препарате 4,5-5,5% и не менее чем в 6 раз при содержании белка в препарате 9,0 – 16,0%).
ИСПЫТАНИЯ
Жидкий препарат – бесцветный или со светло-желтой окраской, прозрачный или слабо опалесцирующий раствор; лиофилизированный препарат – белый или светло-желтый порошок или аморфная гигроскопическая масса (если в фармакопейной статье или нормативной документации не указаны другие требования).
(для лиофилизированных препаратов). Не более 20 мин, если в фармакопейной статье или нормативной документации нет других указаний. Приводят описание методики с указанием применяемого растворителя, его объема и условий растворения (температура растворителя, необходимость перемешивания и др.).
(для жидких лекарственных форм). Препарат должен оставаться жидким и не образовывать геля после выдерживания в водяной бане или водяном термостате при температуре (56±1)°С в течение 4 ч.
В нормативной документации указывают количественное содержание антибактериальных антител (минимум против одного возбудителя) и/или противовирусных антител (минимум против одного возбудителя). Определение проводят по методике, указанной в фармакопейной статье, с использованием соответствующих стандартных образцов.
Препарат не должен содержать поверхностного антигена вируса гепатита В. Определение проводят иммуноферментным методом с использованием тест-систем, разрешенных к применению и имеющих чувствительность не ниже 0,1 МЕ/мл в соответствии с инструкциями по применению.
Антитела к вирусу гепатита С должны отсутствовать. Определение проводят иммуноферментным методом с использованием тест-систем, разрешенных к применению и имеющих 100% чувствительность и специфичность в соответствии с инструкциями по применению.
Препарат не должен содержать антител к вирусу иммунодефицита человека (ВИЧ-1 и ВИЧ-2) и антиген р24 ВИЧ-1. Определение проводят иммуноферментным методом с использованием тест-систем, разрешенных к применению и имеющих 100% чувствительность и специфичность в соответствии с инструкциями по применению.
Хранят в защищенном от света месте при температуре от 2 до 8°С, если нет других указаний в фармакопейной статье или нормативной документации.
Антитела как показатель состояния иммунной системы
В организме человека присутствует пять классов иммуноглобулинов: IgA, IgD, IgG, IgE, IgM. Они отличаются по массе, по составу, и, что самое главное, по свойствам.
IgE и IgD содержатся в сыворотке крови в малом количестве и не имеют диагностической ценности. Наиболее значимыми для анализа состояния иммунной системы и постановки диагноза являются IgM, IgA и IgG.
IgM — первый иммуноглобулин, который начинает вырабатывать организм в ответ на инфекцию. Он обладает высокой активностью, стимулирует различные звенья иммунитета. Составляет 10% от всех фракций иммуноглобулинов.
Примерно через пять суток после попадания антигена в организм начинает вырабатываться IgG (70–75% от всех иммуноглобулинов). Он обеспечивает основной иммунный ответ. Более половины всех выделяемых во время болезни иммуноглобулинов относятся именно к этому классу.
IgA в основном локализуется в слизистых оболочках дыхательных путей, желудка, кишечника и мочеполовой системы. То есть там, где болезнетворные микроорганизмы чаще всего проникают в наш организм. Этот класс иммуноглобулинов как бы связывает чужеродные вещества и не дает им прикрепиться к поверхности слизистых оболочек. Доля IgA 15–20% от всего числа присутствующих в организме иммуноглобулинов.
Концентрация антител к определенной инфекции помогает поставить диагноз, определить уровень иммунитета после вакцинации, выявить скрытые заболевания. Чаще всего анализы на антитела назначают при подозрении на такие заболевания (или для контроля их лечения), как:
- корь;
- гепатит;
- ветрянка (ветряная оспа);
- краснуха;
- гельминтоз;
- хеликобактер пилори;
- лямблиоз;
- вирус Эпштейна — Барр;
- полиомиелит;
- герпес.
Анализ на иммуноглобулины определенного класса могут также назначить также при:
- сепсисе;
- ревматоидном артрите;
- циррозе печени;
- онкологии;
- хронических гнойных отитах, менингитах, пневмониях, синуситах;
- нарушении работы иммунной системы;
- миеломной болезни;
- ВИЧ-инфекции.
При выявлении причин бесплодия могут назначить анализ на антитела к ХГЧ или на антиспермальные антитела. При беременности проводится исследование на антитела к резус-фактору.
Анализы на антитела к вирусам и другим инфекционным агентам проводятся исключительно по назначению врача.
Кровь на анализы на антитела сдается натощак. Забор биоматериала осуществляется из вены. Перед проведением исследования пациенту желательно избегать эмоциональных перегрузок, не заниматься тяжелой физической работой, не посещать спортзал и не принимать алкоголь.
Метод ИФА чувствителен даже к небольшому количеству иммуноглобулинов и обладает высокой специфичностью. Это значит, что результаты исследования будут достоверными и точными.
Обычно исследование занимает 1–2 рабочих дня. Некоторые лаборатории готовы выдать срочный результат уже через 2–3 часа, но стоимость будет примерно вдвое выше.
Правильно интерпретировать результаты анализа на иммуноглобулины может только врач. Он учитывает не только показатели в бланке исследования, но и состояние пациента, симптомы заболевания или их отсутствие, данные других исследований.
Каждая лаборатория использует свои тест-системы, потому результаты анализов, проведенных в разных диагностических центрах, могут отличаться. Указанные в статье границы являются ориентировочными.
Нормы общего IgA для детей:
- до 3 месяцев — от 0,01 до 0,34 г/л;
- от 3 месяцев до 1 года – от 0,08 до 0,91 г/л;
- от 1 года до 12 лет:
- девочки: от 0,21 до 2,82 г/л;
- мальчики: от 0,21 до 2,91 г/л;
- 12–60 лет — от 0,65 до 4,21 г/л;
- После 60 лет — от 0,69 до 5,17 г/л.
- 12–60 лет — от 0,63 до 4,84 г/л;
- после 60 лет — от 1,01 до 6,45 г/л.
Иммуноглобулин класса А повышается при хронических инфекциях, при муковисцидозе, при поражении печени. Также антитела этого типа могут активно вырабатываться при аутоиммунных болезнях. Снижение титра антител происходит при атопическом дерматите, некоторых заболеваниях крови и лимфатической системы. А также при нарушении синтеза белковых молекул и приеме некоторых лекарств.
Содержание IgM в сыворотке крови у новорожденных должно быть в пределах 0,06-0,21 г/л.
- старше 3 месяцев и до 1 года:
- девочки: от 0,17 до 1,50 г/л;
- мальчики: от 0,17 до 1,43 г/л;
- от 1 года до 12 лет:
- девочки: от 0,47 до 2,40 г/л;
- мальчики: от 0,41 до 1,83 г/л;
Для женщин: от 0,33 до 2,93 г/л.
Для мужчин: от 0,22 до 2,40 г/л.
IgM повышается при остром воспалении, пневмонии, синуситах, бронхите, болезнях кишечника и желудка. Выход концентрации за верхнюю границу нормы может говорить о поражении печени, паразитарных заболеваниях, а также о миеломной болезни. Понижение уровня IgM наблюдается при нарушениях синтеза белка или поражениях иммунной системы. Это может происходить после удаления селезенки, при большой потере белка, при лечении цитостатиками и другими препаратами, которые подавляют иммунитет, при лимфоме, а также при некоторых врожденных состояниях.
В отличие от предыдущих иммуноглобулинов, уровень IgG отличается у мужчин и женщин с самого рождения.
У представительниц женского пола его нормы составляют:
- до 1 месяца — от 3,91 до 17,37 г/л;
- от 1 месяца до 1 года — от 2,03 до 9,34 г/л;
- в 1–2 года — от 4,83 до 12,26 г/л;
- старше 2 лет — от 5,52 до 16,31 г/л.
У сильной половины человечества:
- до 1 месяца — от 3,97 до 17,65 г/л;
- от 1 месяца до 1 года — от 2,05 до 9,48 г/л;
- 1–2 года — от 4,75 до 12,10 г/л;
- старше 2 лет — от 5,40 до 16,31 г/л.
IgG может повыситься при хронических инфекциях, при аутоиммунных заболеваниях, при паразитарных заболеваниях, саркоидозе, муковисцидозе, при поражении печени, миеломе и гранулематозе.
Понижение уровня IgG может наблюдаться при онкологии кроветворной и лимфатической системы, при мышечной дистрофии и некоторых других заболеваниях.
При ВИЧ-инфекции уровень IgG может быть как крайне высоким, так и крайне низким, в зависимости от стадии заболевания и состояния иммунной системы.
С антителами к резус-фактору все немного проще. В норме их не должно быть. Если антитела обнаружены, значит, произошла иммунизация во время предыдущей беременности или при переливании донорской крови.
Аутоантитела в норме также должны отсутствовать. Их наличие говорит о развитии аутоиммунных заболеваний.
Существует огромное количество видов исследований на обнаружение антител. Например, комплексный анализ на TORCH-инфекции (токсоплазма, краснуха, цитомегаловирус, герпес), который необходимо сдавать при планировании беременности, будет стоить 2000–3000 рублей. Анализ на антитела к резус-фактору обойдется примерно в 450–600 рублей.
Анализ на антитела к определенным инфекциям стоит от 350 до 550 рублей. При этом стоит учитывать, что определение, например, IgG и IgM — это два разных исследования, каждое из которых нужно будет оплачивать отдельно.
Определение антиядерных (антинуклеарных) антител обойдется примерно в 500–750 рублей, антиспермальных — 700–1250 рублей, анализ на антитела к тиреоглобулину и тиреопероксидазе стоит примерно 400–550 рублей.
Нужно также заложить в расходы около 120–180 рублей за взятие крови.
Анализ крови для определения уровня иммуноглобулинов проводят многие лаборатории. Но как выбрать ту, где его проведут одновременно быстро, качественно и недорого?
Выбирая лабораторию, обратите внимание на перечень анализов. Чем больше этот список, тем более широкими возможностями для диагностики обладает лаборатория.
Еще один фактор — время, через которое вам обещают результат. Большинство лабораторий отводят на это исследование 2–3 дня, некоторые предоставляют услуги срочного анализа — 1 день.
При заборе крови обратите внимание на процедурный кабинет, его оснащение, используемые расходные материалы. Все должно быть стерильным: обычно прямо при вас медсестра протирает стол, подушечку и т.д. дезинфицирующим средством. Это гарантия вашей безопасности.
Еще один фактор — удобство. Не стоит ехать через весь город, чтобы сдать анализ на антитела на 20–30 рублей дешевле. За время дороги вы можете испытать физические или эмоциональные перегрузки, из-за которых результаты будут искажены.
Итак, выбирайте лабораторию или медицинский центр с современным медицинским оснащением, широким перечнем анализов, находящийся недалеко от вашего дома либо по пути на работу или учебу. Если эта лаборатория работает много лет и успела набрать определенный авторитет среди врачей и пациентов — это дополнительный плюс.
Анализ крови на выявление антител — высокоточный и информативный метод исследования. Его используют как для уточнения диагноза при определенных инфекциях, так и для определения общего состояния иммунной системы или выявления некоторых соматических заболеваний. Но интерпретировать результаты анализа должен врач с учетом всех клинических данных, возраста, пола и состояния пациента.
Подготовка к анализу на антитела не отличается сложностью, но все же некоторые правила соблюдать стоит: во-первых, исключите физические нагрузки, в том числе и физиотерапию, за пару дней до исследования, во-вторых, воздержитесь от жирной, соленой и острой пищи, алкоголя и кофе. Если вы принимаете какие-либо препараты или недавно перенесли какое-либо заболевание — сообщите об этом врачу.
Русское название
Латинское название вещества Иммуноглобулин человека антирезус Rho(D)
Фармакологическая группа вещества Иммуноглобулин человека антирезус Rho(D)
Типовая клинико-фармакологическая статья 1
Характеристика. Иммунологически активная белковая фракция, выделенная из человеческой плазмы или сыворотки доноров, проверенных на отсутствие антител к ВИЧ (ВИЧ-1, ВИЧ-2), вирусу гепатита С и поверхностного антигена вируса гепатита В. Активным компонентом препарата является IgG, содержащий неполные анти-Rho(D)-антитела.
Фармдействие. Предотвращает изоиммунизацию Rho(D)-отрицательной матери, подвергшейся воздействию Rho(D)-положительной крови плода при рождении Rh0(D)-положительного ребенка, при аборте (как самопроизвольном, так и искусственном), в случае проведения амниоцентеза или при получении травмы органов брюшной полости во время беременности. Сокращает частоту резусизоиммунизации матери при введении препарата в течение 48–72 ч после рождения полностью выношенного Rho(D)-положительного ребенка Rho(D)-отрицательной матерью.
Фармакокинетика. Cmax антител в крови достигается через 24 ч. Период полураспада иммуноглобулина человека антирезус Rho(D) составляет 23–26 дней. T1/2 антител из организма — 4–5 нед .
Показания. Профилактика резус-конфликта у резус-отрицательных женщин, не сенсибилизированных к антигену Rho(D) (т.е. не выработавшим резус-антител) при условии первой беременности и рождения резус-положительного ребенка, кровь которого совместима с кровью матери по группам крови системы АВО; при искусственном прерывании беременности у резус-отрицательных женщин, также не сенсибилизированных к Rho(D)-антигену, в случае резус-положительной принадлежности крови мужа.
Противопоказания. Гиперчувствительность, резус-отрицательные родильницы, сенсибилизированные к антигену Rh0(D), в сыворотке крови которых обнаружены резус-антитела; новорожденные.
Дозирование. До начала введения ампулы с препаратом выдерживают в течение 2 ч при комнатной температуре (18–22 °C). Во избежание образования пены препарат набирают в шприц иглой с широким просветом. Препарат во вскрытом флаконе хранению не подлежит. Нельзя вводить в/в .
В/м, по 1 дозе, однократно: родильнице — в течение первых 48–72 ч после родов, при искусственном прерывании беременности — непосредственно после окончания операции. Одна доза — 300 мкг при титре 1:2000 или 600 мкг при титре 1:1000.
Потребность в определенной дозе в случае прохождения полного срока беременности может быть различной в зависимости от объема крови плода, попавшей в кровоток матери. В 1 дозе (300 мкг) содержится достаточное количество антител для предотвращения сенсибилизации к резус-фактору, если объем эритроцитов, попавших в кровоток, не превышает 15 мл. В тех случаях, когда предполагается попадание в кровоток матери большего объема эритроцитов плода (свыше 30 мл цельной крови или свыше 15 мл эритроцитов), следует провести подсчет эритроцитов плода с использованием утвержденной лабораторной методики (например, модифицированного метода кислотного вымывания-окрашивания по Кляйхауэру и Бетке), чтобы установить необходимую дозировку Ig . Вычисленный объем эритроцитов плода, попавших в кровоток матери, делят на 15 мл и получают число доз препарата, которые необходимо ввести. Если в результате вычислений дозы получается дробь, следует округлить число доз до следующего целого числа в сторону увеличения (например, при получении результата 1,4 следует ввести 2 дозы (600 мкг) препарата).
Для проведения профилактики в предродовой период следует ввести 1 дозу препарата (300 мкг) приблизительно на 28-й нед беременности. Затем обязательно нужно ввести еще 1 дозу (300 мкг), предпочтительно в течение 48–72 ч после родов, если родившийся ребенок окажется резус-положительным.
В случае продолжения беременности после возникновения угрозы аборта при любом сроке беременности следует ввести еще 1 дозу (300 мкг) препарата. Если подозревается попадание в кровоток матери свыше 15 мл эритроцитов плода, необходимо изменить дозу, как описано в выше.
После самопроизвольного аборта, искусственного аборта или прерывания внематочной беременности при сроке беременности более 13 нед рекомендуется ввести 1 дозу (300 мкг) препарата (или больше, если подозревается попадание в кровоток матери свыше 15 мл эритроцитов плода) Если беременность прервана на сроке менее 13 нед беременности, возможно однократное использование мини-дозы (приблизительно 50 мкг).
После проведения амниоцентеза, либо на 15–18 нед беременности, либо в течение III триместра беременности, или же при получении травмы органов брюшной полости в течение II или III триместра рекомендуется ввести 1 дозу (300 мкг) препарата (или больше, если подозревается попадание в кровоток матери свыше 15 мл эритроцитов плода). Если травма органов брюшной полости, амниоцентез или иное неблагоприятное обстоятельство требует введения препарата при сроке 13–18 нед беременности, следует ввести еще 1 дозу (300 мкг) на сроке 26–28 нед . Для поддержания защиты в течение всей беременности нельзя допускать падения уровня концентрации пассивно полученных антител к Rho(D) ниже уровня, необходимого для предотвращения иммунного ответа на резус-положительные эритроциты плода. В любом случае, дозу препарата следует вводить в течение 48–72 ч после родов — если ребенок резус-положителен. Если роды происходят в течение 3 нед после получения последней дозы, послеродовую дозу можно отменить (за исключением тех случаев, когда в кровоток матери попало свыше 15 мл эритроцитов плода).
Побочное действие. Гиперемия и гипертермия до 37,5 °C (в течение первых суток после введения), диспепсия; редко (при гиперчувствительности, в т.ч. при недостаточности IgА) — аллергические реакции (вплоть до анафилактического шока).
Взаимодействие. Возможно комбинирование с др. ЛС ( в т.ч. антибиотиками).
Особые указания. У детей, родившихся от женщин, которые получали Ig человека антирезус Rho(D) до родов, при рождении возможно получение слабо положительных результатов прямых тестов на наличие антиглобулина. В сыворотке крови матери возможно обнаружение антител к Rho(D), полученных пассивным путем, если тесты-скрининг на антитела производятся после дородового или послеродового введения Ig человека к Rho(D).
Иммунизацию женщин живыми вакцинами следует проводить не ранее, чем через 3 мес после введения Ig антирезус.
Не пригодны к применению препараты во флаконах и шприцах с нарушенной целостностью или маркировкой, при изменении физический свойств (изменение цвета, помутнение раствора, наличие неразбивающихся хлопьев), при истекшем сроке годности, при неправильном хранении.
Если установлено, что отец Rho(D)-отрицательный, вводить препарат нет необходимости.
После введения препарата пациенты должны находиться под наблюдением в течение 30 мин. Медицинские кабинеты должны иметь средства противошоковой терапий. При развитии анафилактоидных реакции применяют антигистаминные ЛС , ГКС и альфа-адреномиметики.
Препарат не вводят резус-положительным родильницам.
[1] Государственный реестр лекарственных средств. Официальное издание: в 2 т.- М.: Медицинский совет, 2009. - Т.2, ч.1 - 568 с.; ч.2 - 560 с.

Современные ВВИГ получают фракционированием плазмы крови человека. Они представляют собой препараты поликлональных антител класса IgG, синтезированных В-лимфоцитами в ответ на антигенные стимулы, имевшие место на протяжении жизни человека-донора. IgG – гликопротеин с молекулярной массой около 150 кДа, содержащийся в плазме человека в количестве от 7 до 12 г⁄л [12]. Класс IgG классифицируют на четыре подкласса (IgG1, IgG2, IgG3, IgG4), класс IgA – на два подкласса (IgA1, IgA2). Все классы и подклассы составляют девять изотипов, которые присутствуют в норме у всех индивидов. Каждый изотип IgG определяется последовательностью аминокислот константной области тяжелой цепи [2].
Современные препараты ВВИГ подразделяются на три группы [3]:
I. Стандартные препараты – содержат в основном IgG (иммуноглобулин человека нормальный для внутривенного введения).
II. Стандартные специфические (гипериммунные) препараты – содержат в основном IgG, но имеют более высокое содержание противовирусных антител.
III. Обогащенные препараты ВВИГ – содержат антитела классов IgG, IgM, IgA против патогенных вирусов и бактерий.
Эффективность и безопасность медицинского применения ВВИГ определяются дуализмом функции IgG: они могут специ фически взаимодействовать с чужеродными антигенами и одновременно способны вызывать неспецифические эффекты. Такая функциональная дихотомия является следствием особенностей структуры молекулы IgG. Ее вариабельный регион (два Fab-фрагмента) состоит из легкой и частично из тяжелой цепей и специфически взаимодействует с антигенами, что обусловлено меняющейся от белка к белку последовательностью аминокислотных остатков в N-концевой части молекулы. Константный регион (Fc- или кристаллизующийся фрагмент) связывает компонент комплемента 1 (С1) и взаимодействует с Fc-рецепторами макрофагов или нейтрофилов. Активация эффекторной функции Fc-фрагмента антитела происходит после агрегации IgG на поверхности антигена, структура молекулы меняется, что служит сигналом для запуска системы комплемента или индукции опсонизации через фагоцитоз (рис. 1) [2].
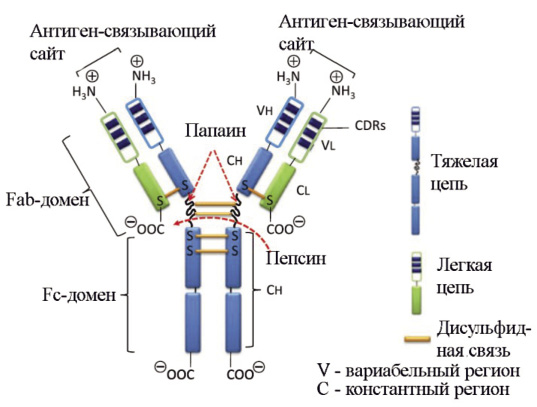
Рис. 1. Схематическое строение иммуноглобулина G. Обработка пепсином приводит к расщеплению в участке молекулы на С-концевой стороне, за дисульфидной связью, соединяющей две тяжелые цепи вариабельного участка IgG. В результате образуются один сдвоенный F(аb’)-фрагмент [F(аb’)2] и один Fc-фрагмент. Расщепление IgG папаином происходит в N-концевом участке, непосредственно перед дисульфидной связью, в результате образуются два одинаковых Fab-фрагмента и один Fc-фрагмент [12]
Обобщение опыта клинического применения ВВИГ позволило Е.К. Донюш [3] утверждать, что они обеспечивают:
– увеличение бактерицидной активности сыворотки, стимуляцию фагоцитоза, нейтрализацию некоторых бактериальных токсинов;
– блокаду дифференцировки В-лимфоцитов, продуцирующих антитела;
– предотвращение или блокаду взаимодействия аллергена с IgE, фиксированного на тучной клетке, за счет IgG4 блокирующих антител;
– подавление продукции аллерген-специфических и ауто-антител за счет воздействия антиидиотипических антител;
– снижение продукции и активности провоспалительных цитокинов;
– предупреждение комплемент-зависимого повреждения тканей за счет связывания C3b и C4b компонентов комплемента;
– предохранение от дополнительных вирусных инфекций, обладающих триггерным эффектом при аутоиммунных заболеваниях.
Первыми неспецифическими иммуноглобулинами, использованными в клинической практике, были иммуноглобулины для внутримышечного применения (intramuscular immunoglobulin, IMIG). В России разрешены иммуноглобулин человека нормальный, противоаллергический и 6 специфических иммуноглобулинов, получаемых из плазмы крови иммунизированных людей (противооспенный, антирабический, антистафилококковый, противостолбнячный, против гепатита В и клещевого энцефалита) [1].
Технология приготовления таких иммуноглобулинов разработана в 1940-х гг. Включает этапы получения плазмы крови человека и осаждения из нее IgG этанолом при температуре ниже 0 °С и определенном значении рН [1, 2]. Дополнительной очистки IgG не проводится. Получаемый препарат содержит 70–80 % мономерных IgG и значительные количества IgA и IgM. Вводимые в его составе в организм человека антитела имеют обычный период полураспада, активируют комплемент в присутствии антигена и обладают опсонизирующими свойствами. Применение нормальных иммуноглобулинов оказалось эффективным для профилактики и лечения кори, гепатита А и для предупреждения бактериальных инфекций у детей с наследственной агаммаглобулинемией [3, 12].
Непреодолимыми в рамках данной технологии получения IgG недостатками данных препаратов, стали болезненность в месте введения, низкая скорость поступления антител в системный кровоток и невозможность быстро создавать высокие концентрации антител в ургентных ситуациях. При попытках внутривенного введения у пациентов развивались опасные анафилактоидные реакции и гипотония, что связано с неспецифической активацией комплемента в результате спонтанного образования агрегатов иммуноглобулинов и наличием в препарате следовых количеств протеаз [7]. Поэтому применение препаратов, полученных по данной технологии, ограничено внутримышечным введением.
Низкая терапевтическая эффективность энзиматических и химических производных IgG вынудила разработчиков ВВИГ в начале 1970-х гг. вернуться к получению интактного IgG. Особую значимость для потребителей препаратов крови в те годы приобрела их вирусная безопасность. Проблемы качества и безопасности ВВИГ на основе интактного IgG решались строгой государственной регламентацией процессов сбора и фракционирования плазмы доноров, контроля производства. Были разработаны национальные и международные документы, регулирующие производство ВВИГ. Система таких мер приведена в табл. 1.
Меры безопасности и контроля качества при производстве ВВИГ [12]
Требования к этапу, критические для обеспечения качества/безопасности ВВИГ
Учреждение по заготовке крови (лицензирование и проверяются национальным регулирующим органом; контроль оборудования, фракционирующего плазму)
Скрининг донор крови и плазмы
Эпидемиологический надзор за населением, идентификация доноров, конфиденциальное анкетирование кандидатов в доноры на наличие факторов риска, анализ их медицинских документов и анкеты
Процедура сбора крови/плазмы
Контроль длительности процедуры забора крови у доноров, смешивания с растворами, предотвращающими коагуляцию, температуры от момента забора крови до ее направления в блок переработки и др. параметров процесса, определенных нормативным документом
Тестирование донора на вирусоносительство перед забором крови
Выявление антител к ВИЧ 1 и 2, вирусам гепатитов А, В и С, HBsAg, парвовируса В19. Исследование должно проводится индивидуально или минипулами, использованные методы должны быть валидированы
Другие тесты у доноров
Тестирование на изоагглютинины к антигенам А, В, D, не использование крови доноров с высокими титрами антител к этим антигенам
Должна использоваться плазма, замороженная в течение 24–72 ч после забора
Замораживание и хранение плазмы
Должен использоваться быстрый способ замораживания плазмы, в процессе ее хранения температура не должна меняться
Во время транспортировки должен вестись постоянный мониторинг температуры ее хранения с записью соответствующим оборудованием. Температура хранения при транспортировке должна быть минус 20 °С или менее
Предприятия по фракционированию плазмы крови (лицензирование и инспекция национальным регулирующим органом)
Используются технологии амплификации нуклеиновых кислот. Определяется нуклеиновая кислота ВИЧ 1 и 2, вирусов гепатитов А, В и С, парвовируса В19
Тестирование производственного пула
Антитела на ВИЧ 1 и 2, вирус гепатита С, HBsAg (обязательно); РНК вируса гепатита С (обязательно в Европе). Исследование нуклеиновых кислот других вирусов – в соответствии с регулирующими документами
Предприятие по фракционированию плазмы
Должно быть разработано, построено и функционировать в соответствии с GMP
Этапы очистки белков и инактивация вирусов
Все процессы должны быть валидированы, все операции должны выполняться в соответствии с утвержденной СОП
Стерилизующая фильтрация и асептическое заполнение упаковок
Лиофильное высушивание (когда необходимо)
Проверка конечного продукта
Все операции должны выполняться в соответствии с утвержденной СОП
Устранение недостатков, характерных для ВВИГ на основе интактного IgG, проводилось путем более тщательной очистки препарата от агрегатов иммуноглобулинов, протеаз, плазмина, плазминогена, активатора прекалликреина, примесей IgA и IgM. Е.К. Донюш [3] выделяет 4 поколения ВВИГ.
Препараты первого поколения – начало 1970-х гг., это энзиматически и химически модифицированные IgG, не имевшие функционального Fc-фрагмента.


Рис. 2. Основные технологии, используемые для получения коммерческого ВВИГ и других компонентов крови из плазмы человека [12]. А, Б, В и Г – технологии, описанные в работах Bertolini J. [8], Teschner W. et al. [17], Terpstra F.G. et al. [16] и Stucki M. еt al. [15] соответственно
Препараты второго поколения – конец 1970-х гг., включали полностью интактную молекулу IgG с активной Fc-функцией и могли применяться не только с целью заместительной, но и иммуномодулирующей терапии. Однако степень их очистки оставалась низкой, они содержали IgA в количествах, вызывающих анафилактические реакции при внутривенном введении, показатель Fc-функции не превышал 70–75 %.
Препараты третьего поколения создавались в середине-конце 1980-х гг., характеризовались высокой чистотой и полной активностью Fc-фрагмента, высокой степенью вирусной безопасности, достигаемой многоступенчатым процессом производства. Выпускались в жидком виде и могли храниться при температуре 2–8 °С.
Препараты четвертого поколения – препараты, удовлетворяющие более жестким требованиям вирусной безопасности и физиологического распределения IgG по подклассам. Разработаны в 1990-х гг. и широко используются в настоящее время. Имеют высокую чистоту IgG с нормальным распределением по подклассам, содержание мономеров и димеров более 95 %. Активность Fc-фрагмента молекулы IgG приближается к 100 %. Препараты получают, используя многоступенчатую схему инактивации вирусов, включающую не менее двух самостоятельных методов (сольвент-детергентная обработка + инкубация при низких значениях рН или пастеризация в сочетании с обработкой полиэтиленгликолем). Препараты выпускают в жидком виде, допускается хранение при комнатной температуре.
В качестве стабилизаторов ВВИГ четвертого поколения используются вещества, безопасные для пациентов с нарушением углеводного обмена и дисфункцией почек, 10 %-е растворы ВВИГ позволяют снизить объемную нагрузку на пациента. Учитывая, что степень очистки IgG в препаратах четвертого поколения приближается к 100 %, их можно считать пределом развития всего направления получения ВВИГ из плазмы крови доноров. Отдельные усовершенствования будут касаться повышения эффективности технологий получения и клинического применения ВВИГ (препарат для подкожного применения, комбинации различных иммуноглобулинов в препарате и др.), их вирусной безопасности, способов очистки от примесей компонентов, которые раньше не считали способными влиять на результат клинического применения (растворимые молекулы CD4, CD8, HLA, следовые количества факторов свертывания крови VIII, IX, X, XI, XII и др.). Основные технологии, используемые в настоящее время для получения ВВИГ и других компонентов крови, показаны на рис. 2.
Стандартная технология производства позволяет из 1 литра плазмы получить до 2,5 упаковок альбумина 10 %, до 3,5 упаковок иммуноглобулина для внутривенного введения 5 % и около 200–250 МЕ фактора VIII [4].
Основной тенденцией в стабилизации препаратов ВВИГ в настоящее время считается использование высокой концентрации IgG (100 мг/ мл по белку); слабокислой среды (рН 4,5–5,5); включение в лекарственную форму стабилизаторов, таких как полиолы (сорбит), сахара (мальтоза, глюкоза), или аминокислоты (глицин, пролин, изолейцин); отсутствие в препаратах хлорида натрия и сахарозы; осмолярность, близкая к физиологической; отсутствие консервантов и антибиотиков [1, 10].
Требования к свойствам ВВИГ следующие [3]:
– они должны иметь оптимальный спектр антител в соответствии с инфицированностью населения (более 1000 доноров);
– обладать доказанной эффективностью (с помощью контролируемых клинических исследований);
– распределения IgG по подклассам должно соответствовать их содержанию в плазме крови;
– для каждой партии препарата должен быть задекларирован титр антител;
– макроагрегаты должны составлять менее 1 % общего содержания IgG;
– антикомплементарная активность не должна превышать 1,0 СН50/1 мг белка протеина;
– гемолизины не должны содержаться в препарате, титр АВ-антител должен быть менее 1:8;
– активаторы прекалликреина, консерванты, активированные ферменты, токсические вещества не должны присутствовать в препарате;
– если предусмотрено применение у пациентов с врожденным дефицитом IgA; содержание IgA должно быть минимальным;
– высокая противовирусная очистка.
Возможность получения IgG с высокой степенью очистки позволила в последнее десятилетие вернуться к практике их подкожного введения, оказавшейся неудачной в 1940–1950-е гг. из-за большого количества реакций на балластные компоненты иммуноглобулинов, получаемых по технологиям того времени. Иммуноглобулины для подкожного введения (subcutaneous immunoglobulin, SCIG) в основном используются для лечения пациентов с врожденными нарушениями антителообразования (низкий уровень IgA), с повышенным содержанием в сыворотке крови воспалительных маркеров, флебитами, заболеваниями почек и другой патологией, создающей условия для осложнения при введении ВВИГ [6]. В настоящее время за рубежом в клинической практике используется не менее 6 SCIG. Сравнение свойств SCIG с аналогичными свойствами ВВИГ приведено в табл. 2.
Для улучшения проницаемости внеклеточного матрикса для IgG в SCIG добавляется рекомбинантная человеческая гиалуронидаза (rHuPH20), что позволяет сократить расход препарата на курс лечения пациента и добиться более высоких уровней антител в плазме крови [9]. По совокупности свойств и благодаря более простому применению в клинике, SCIG, особенно препараты с rHuPH20, способны вытеснить ВВИГ с рынка фармацевтических препаратов.
Существует серьезное противоречие между требованиями к качеству и эффективности ВВИГ, и его безопасностью. Прежде всего, оно имеет отношение к вирусной безопасности ВВИГ и других препаратов крови. Чтобы ВВИГ был эффективным и соответствовал критериям качества, плазма должна быть получена от как можно большего количества доноров, более 1000. Но чем больше донаций использовано для получения плазмы, тем больше риск того, что она будет инфицирована опасными для человека вирусами. Когда ВВИГ начали применять в клинической практике, считалось, что если IgG фракционируют холодным этанолом, то это обеспечивает вирусную безопасность полученных препаратов. Но эти надежды не оправдались, вирусы, особенно возбудитель гепатита С, продолжали находить в крупных партиях ВВИГ [19].
Читайте также:


