Что происходит с т-хелперами и вич
Рецептором для ВИЧ является дифференцировочный антиген CD4, а также неспецифические, не зависящие от наличия CD4 компоненты. Фиксация вируса с мембранным рецептором CD4 клетки хозяина блокирует основную функцию этих иммунокомпетентных клеток -- восприятие сигналов от антигенпрезентирующих клеток. Последующая за рецепцией репликация вируса ведет к гибели клеток, выпадению выполняемой ими функции и развитию иммунодефицита.
В организме человека имеется целый ряд иммунокомпетентных, соматических и ряд других клеток, имеющих рецепторы для ВИЧ (CD4+ лимфоциты, CD8+ лимфоциты, дендритные клетки, моноциты, эозинофилы, мегакариоциты, нейроны, микроглия, сперматозоиды).
Помимо основного рецептора для ВИЧ-1 -- CD4, имеется еще ряд корецепторов, в частности, хемокиновые рецепторы, необходимые для проникновения ВИЧ в клетку.
Проникнув в CD4+ клетки, ВИЧ сразу же начинает репликацию. Все регуляторы, активирующие СD4+клетки, обеспечивают увеличение репликации вируса. К подобным регуляторам относятся фактор некроза опухолей (ФНО), фактор, стимулирующий колонии гранулоцитов/макрофагов, интерлейкин-6 (ИЛ-6). К негативным регуляторам, тормозящим репликацию вируса, относятся интерферон (ИФ) и трансформирующий фактор роста.
Выделено два типа СР4+клеток: Т-хелперы-1 (Th1) и Т-хелперы-2 (Th2). У больных ВИЧ-инфекцией идет угнетение Th1, чем обеспечиваются и вирусная патология, и онкогенез.
Жизненный цикл ВИЧ после проникновения в организм имеет последовательный характер: связывание вириона с поверхностью клетки, слияние мембран вириона иклетки, проникновение вируса внутрь клетки, высвобождение нуклеотида и геномной РНК вируса, интеграция генома вируса в геном инфицированной клетки, латентная фаза, фаза активации транскрипции с ДНК провируса и последующая транскрипция белков вируса, наработка всех компонентов вируса с формированием новых вирионов и их высвобождением из клетки, влекущим за собой гибель клетки-мишени.
В патологический процесс вовлекаются в первую очередь и в большей степени CD4+ лимфоциты, моноциты крови, макрофаги тканей, дендритные клетки крови, лимфатических узлов, селезенки, кожи, альвеолярных и интерстициальных макрофагов легких, микроглия и другие клетки нервной системы, имеющие CD4-рецепторы. Так же поражаются В- и О-лимфоциты, ретикулярные клетки, эпителиальные клетки кишечника, клетки Лангерганса, причем последние инфицируются даже легче, чем CD4+ лимфоциты. Именно клеткам Лангерганса придается большое значение в распространении ВИЧ по организму, ибо в них вирус сохраняется длительное время, иногда годы.
Наличие CD4 рецептора на многих и не только иммунокомпетентных клетках, возможность поражать и клетки, не имеющие этого рецептора, определяют политропность ВИЧ и полиморфизм клинической картины.
Если на CD4+ лимфоциты вирус оказывает цитопатическое действие с лизисом клетки или слиянием в синцитий, то в моноцитах/макрофагах ВИЧ реплицируется с умеренной интенсивностью и не оказывают цитонекротического действия. Изучение динамики сывороточных монокинов подтверждает активное участие в патогенезе ВИЧ-инфекции моноцитов/макрофагов, основных продуцентов фактора некроза опухолей и интерлейкина-1B. С гиперпродукцией ФНО-а, ИЛ-1b и ИЛ-6 связывают развитие при ВИЧ-инфекции лихорадки, анемии, диареи, кахексии, патологических изменений на коже и слизистых при саркоме Капоши, церебральных симптомов. В то же время было установлено, что ВИЧ ингибирует продукцию ИЛ-2 и g -ИФ, синтезируемым Т-хелперами первого типа, и не ингибирует функцию Т-хелперов второго типа. Следовательно, играя важную роль в регуляции синтеза цитокинов, ВИЧ за счет переключения иммунного ответа с Т-хелперов первого типа на Т-хелперы второго типа, стимулирует гуморальное звено иммунитета.
После инфицирования клетки вирусом происходит соединение вирусной оболочки с мембраной клетки. Помимо того, вирусный белок обеспечивает слияние мембран соседних клеток между собой с образованием одной многоядерной клетки -- синцития. При этом слияние может быть как зараженных клеток между собой, так и зараженных с незараженными.
С момента интеграции генома вируса в геном клетки начинается стадия латентной инфекции. В этот период вирус находится в клетке в виде интегрированного в геном ДНК -- провируса.
В расшифровке патогенеза ВИЧ-инфекции многие вопросы решены, установлены основные этапы развития процесса в клетке после инфицирования ее вирусом. Выявлен ряд факторов, активирующих экспрессию генов ВИЧ. К ним относятся факторы, активирующие Т-лимфоциты: специфические антигены (например, вирусы группы Herpes), неспецифические антигены (например, митогены типа фитогемаглютинина), цитокины (например, фактор некроза опухолей, некоторые интерлейкины, гамма-интерферон), бактериальные иммуномодуляторы. К активаторам экспрессии ВИЧ относятся глюкокортикостероидные гормоны, ультрафиолетовое облучение, перекись водорода, свободные кислородные радикалы. Активирует инфекционный процесс беременность.
Исключительно важный этап патогенеза болезни -- сборка вирусных частиц и выход нового потомства вируса из инфицированной клетки. Отличительной чертой ВИЧ является взрывной характер процессов активации транскрипции, синтеза белков-предшественников, сборки вирионов и их почкования: за 5 минут одна лимфоцитарная клетка может образовать до 5000 вирусных частиц.
Вирусная экспрессия определяет клинику ранней фазы болезни. Пик экспрессии вируса в клетках лимфоидной ткани предшествует накоплению его в плазме. Появление вирусспецифических цитотоксических Т-лимфоцитов совпадает со временем окончания экспрессии вируса в лимфатических узлах. Образование нейтрализующих антител обеспечивает переход острой фазы болезни в хроническую.
Иммунопатогенетически ВИЧ-инфекция проявляется дефицитом Т- и В-звеньев иммунной системы, дефицитом комплемента, фагоцитов, снижением функции неспецифических факторов защиты. В результате идет формирование анергии с проявлениями аллергического, аутоаллергического и иммунокомплексного патологического процесса. Уже во II стадии ВИЧ-инфекция характеризуется снижением абсолютного числа лейкоцитов, повышением уровня естественных киллеров (NK-клетки), нарастанием реакции торможения миграции лимфоцитов. Изменения гуморального звена иммунитета проявляются нарастанием IgG+ В- лимфоцитов и 4-5-кратным ростом уровня сывороточных IgE. Выявляется диспропорция уровней подклассов иммуноглобулинов: IgG1 и IgG3 у больных увеличивается, а концентрация IgG2 и IgG4 существенно уменьшается. Несмотря на гипергаммаглобулинемию, увеличение количества циркулирующих в крови В-лимфоцитов, их функциональная активность на митогены остаются относительно сниженными, что позволяет В-систему иммунитета у ВИЧ-больных расценивать как супрессированную. Количество В-клеток в периферической крови больных в стадии СПИДа может быть снижено в три и более раз.
Взаимодействие ВИЧ-1 с мембраной CD4+ лимфоцитов определяет не только отрицательные реакции инфицированных клеток, но и приводит к программированной клеточной гибели -- апоптозу зрелых CD4+ лимфоцитов или CD34+ гемопоэтических клеток-предшественников даже при отсутствии их инфицирования вирусом.
Л.Монтанье (1996) считает, что в патогенезе СПИДа основное место принадлежит аутоиммунному процессу. В пользу этого говорят исследования характера иммунных реакций у больных: наличие аутоантител и аллоантител к лимфоцитам, формирование аллергических реакций цитотоксического типа, накопление циркулирующих иммунных комплексов, наличие комплементопосредованной цитотоксичности, активация антителозависимой клеточной цитотоксичности. В пользу наличия аутоиммунных процессов в патогенезе ВИЧ-инфекции говорят и клинические проявления болезни, в частности, часто сопутствующие болезни такие типичные аутоаллергические варианты патологии, как спондилоартропатии, системные ревматоидные синдромы.
Формирование иммунодефицита при ВИЧ-инфекции не ограничивается только поражением лимфоцитов с CD4-фенотипом. Так, нарушение синтеза белков НLA I ведет к ингибированию функции лимфоцитов с CD8-фенотипа, т.е. Т-супрессоров. Белок вируса оказывает супрессивное действие на продукцию Т-клетками ИЛ-2 и g - интерферона. А с продукцией ИЛ-2 и других цитокинов тесно связана функция цитотоксических Т-лимфоцитов, ответственных за противовирусную и противоопухолевую защиту организма. Все это патогенетически определяет характерную для ВИЧ-инфекции ассоциированную вирусную, бактериальную, грибковую и онкопатологию.
Наряду с поражением иммунной системы в патологический процесс вовлекается и кроветворная ткань. Для заболевания характерны лейкопения, анемия, тромбоцитопения.
Таким образом, поражение иммунной системы при ВИЧ-инфекции носит системный характер, проявляясь глубокой супрессией Т- и В-звеньев клеточного иммунитета. В ходе развития ВИЧ-инфекции происходят закономерные изменения гиперчувствительности немедленного и замедленного типа, гуморального иммунитета и факторов неспецифической защиты, функциональной активности лимфоцитов и моноцитов/макрофагов. Нарастает уровень сывороточных иммуноглобулинов, циркулирующих иммунных комплексов. Наряду с дефицитом CD4+ лимфоцитов в динамике болезни нарастает функциональная недостаточность CD8+ лимфоцитов, NK-клеток, нейтрофилов. Нарушение иммунного статуса клинически проявляется инфекционным, аллергическим, аутоиммунным и лимфопролиферативным синдромами иммунологической недостаточности, синдромами, свойственными болезни иммунных комплексов. Все это определяет в целом клинику ВИЧ-инфекции.
Существует целый ряд дополняющих друг друга механизмов взаимодействия ВИЧ с клетками Т-хелперов. Последние стимулируют работу Т-киллеров и макрофагов, индуцируют продукцию антител В-лимфоцитами. Лимфоциты-носители молекул Т8 (CD8) могут быть либо киллерами, либо супрессорами. Некоторые из механизмов еще спорны, подвергаются изменениям; постоянно появляются новые детали и нюансы влияния ВИЧ на иммунную систему
1-й механизм. При продуктивном процессе состоявшейся репродукции и массированном (несколько тысяч вирионов в генерации одной клетки) выходе из лимфоцитов ВИЧ интенсивно лизирует Т-хелперы. Но даже если вирусы спонтанно отпочковываются от Т-клетки-хелпера (без ее лизиса), клетка не успевает восстанавливать целостность мембран, молекулы цитоплазмы свободно элиминируют из клетки, и Т-хелпер гибнет. Поскольку Т-хелперы составляют порядка 60% циркулирующих Т-клеток, быстрая их гибель приводит к глубоким нарушениям иммунной системы инфицированного человека. СПИД развивается на фоне острой недостаточности CD4-лимфоцитов.
2-й механизм. На фоне общей стимуляции метаболизма лимфоцитов после их инфицирования вирусом, приводящей их к “гибели от истощения”, происходит интеграция геномов вируса и клетки. Диссиминация инфекции захватывает значительное число хелперных Т-лимфоцитов CD4+ фенотипа, при этом хронические инфекции и ряд других воздействий ведут к дополнительной стимуляции CD4+ популяции. Усиленная пролиферация Т-клеток ведет к активации супрессорных механизмов, увеличению количества CD8-лимфоцитов (Leu2a+ - Т-супрессоры) и резкому повышению их функции.
3-й механизм. Частицы ВИЧ изменяют реактогенные зоны поверхности Т-хелперов, что приводит к образованию нежизнеспособных синцитиев. Компоненты вирусной оболочки, синтезируемые в процессе репродукции вируса, резко нарушают цитоплазматическую мембрану клетки-хозяина: в результате элиминации протоплазмы клетки сливаются, образуются нежизнеспособные многоядерные структуры
Исследования подтвердили, что вирус резко изменяет мембраны Т-лимфоцитов и приводит к их слиянию в нежизнеспособные многоядерные клетки-монстры. Образование синцитиев возможно по типу гемагглютинирующего эффекта, когда здоровые лимфоциты при соприкосновении с инфицированными в свою оболочку включают поверхностные белки вируса, и взаимодействие рецепторных зон приводит к образованию крупных нежизнеспособных конгломератов.
4-й механизм. ВИЧ не разрушает CD4-лимфоциты, а изменяет и значительно замедляет их рост в периодической культуре, тогда как другие виды Т-клеток продолжают размножаться нормально. Отмечено, что скорость гибели зараженных клеток пропорциональна количеству CD4-рецепторов на их поверхности. Со временем число CD4-клеток становиться меньше, хотя некоторая их часть выживает и сохраняет вирус в латентном состоянии в виде провируса.
5-й механизм. ВИЧ маскирует CD4-маркер. Было показано, что в выживших CD4-лимфоцитах вирус может маскировать CD4-маркер на поверхности клеток или предотвращать его появление там. В результате получается, что число CD4-клеток еще меньше, чем на самом деле. С исчезновением CD4-клеток падает уровень ИЛ-2 и в результате замедляется рост клонов зрелых Т-клеток, индуцируемых этим лимфокином. Из-за ослабления синтеза интерлейкина и интерферона падает активность К-клеток и макрофагов, которые в номе стимулируютя этими белками.
В инфицированных ВИЧ клетках происходит снижение белков МНС класса 1 на их поверхности. Поскольку цитотоксические CD8-лимфоциты могут связывать антиген только вместе с белками МНС класса 1, этот эффект препятствует узнаванию и разрушению инфицированных вирусом клеток. Таким путем ВИЧ избегает любых воздействий со стороны иммунной системы, то есть создается ситуация “иммунного паралича”.
Антигены 1 класса главного комплекса гистосовместимости - молекулы HLA-A,B,C и 2 класса - HLA-DR- молекулы, имеющиеся на поверхности макрофагов, В-лимфоцитов, активированных Т-лимфоцитов. Молекулы 1 класса необходимы для распознавания поверхностных клеточных антигенов, а 2 класса - для контроля ответа. ВИЧ превращает Т-хелпер в донора супрессивного фактора. Р.Галло было сообщено, что ВИЧ вызывает не только уменьшение числа CD4-клеток и выделение растворимого фактора супрессии оставшимися лимфоцитами, но и делает эти уцелевшие клетки не способными осуществлять первую решающую стадию иммунного ответа - узнавание антигена. Это можно объяснить тем, что вирус вызывает повреждение рецепторов антигена на поверхности CD4-клеток. Этот рецептор подобен замку: для того, чтобы начался Т-клеточный ответ в него должен быть вставлен “ключ”, которым служит сочетание антигена и белка МНС класса. Возможно также, что вирус кодирует белок, попадающий на поверхность инфицированной клетки и препятствующий нормальной рецепции.
6-й механизм. В инфицированных CD4-клетках ВИЧ вызывает секрецию растворимого фактора супрессии. Это вещество блокирует иммунные реакции, зависящие от Т-клеток как in vitro, так и in vivo. При этом угнетается образование специфических антител и пролиферация Т-клеток.
Считают, что геном вируса не кодирует последовательность растворимых факторов супрессии, а только индуцирует в CD4-клеткет его синтез. Такой же механизм, возможно, лежит в основе иммуносупрессии при других инфекциях. Интересно было бы сравнить этот супрессивный фактор с иммуносупрессивным фактором продуктов перекисного окисления липидов.
7-й механизм. Вирус иммунодефицита человека вызывает изменения поверхности CD4-лимфоцитов, что провоцирует их уничтожение как чуждых иммунной системе. CD4-клетки, будучи инфицированными, погибают от того, что на них нападают Т-лимфоциты-киллеры. Таким путем идет непрерывное снижение количества Т-хелперов в крови, лимфоузлах, селезенке и других тканях. В то же время количество супрессорных CD8-лимфоцитов не уменьшается и даже несколько возрастает, что приводит к снижению показателя Тх/Тс.
8-й механизм. Проникший в лимфоциты ВИЧ изменяет геном Т-хелперов, в результате чего они лишаются способности к трансформации и нормальному ответу на ИЛ-2.
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Васильева Елена Викторовна, Кудрявцев И.В., Максимов Г.В., Вербов В.Н., Серебрякова М.К.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Васильева Елена Викторовна, Кудрявцев И.В., Максимов Г.В., Вербов В.Н., Серебрякова М.К.
Impact of HIV infection and tuberculosis on the peripheral blood T-cell differentiation
Tuberculosis is the leading cause of death among HIV infected individuals. In this regard, an important task is the timely detection of tuberculosis in HIV infected patients. Previously, we have shown that the diagnostic value of in vitro test, QuantiFERON-TB Gold In-Tube is not decreased in patients with HIV infection against the background of tuberculosis . However, it remains unclear what kind of cell populations produce IFNγ in response to specific Mycobacterium tuberculosis antigens stimulation in vitro, because the immunodeficiency, caused by HIV, makes primarily for a decrease the abundance and attenuation functions of CD4 T-lymphocytes. The aim of thшы work was to compare the degree of differentiation of T-lymphocytes CD4 (Th) and CD8 (Tcyt) in patients with pulmonary tuberculosis and healthy donors against the background of HIV infection . The study data were obtained during the examination of 28 patients with pulmonary tuberculosis without HIV infection (HIV-TB+), 23 patients with HIV infection (TB-HIV+) and 30 patients coinfected with HIV and tuberculosis (TB+HIV+). The comparison group consisted of 37 healthy individuals (TB-HIV-). Аbsolute and abundance (relative content) of major subpopulations of T-lymphocytes (based on the expression of CD27 marker, CD28, CD45RA and CD62L ) in the peripheral blood for all patients included in the study (n = 118) were evaluated by flow cytometry approach. For patients with pulmonary tuberculosis (n = 58) QuantiFERON-TB Gold In Tube (Qiagen, QFT) test was performed. Th/Tcyt ratio was not significantly different among the groups of TB-HIVand TB+HIV(1.76 [1.51; 2.30] against 1.86 [1.22; 2.79], p = 0.960). At that time, the size of both subpopulations “terminally differentiated” Tcyt (Tcyt Eff, CD27-CD28-CD62L-CD45RA-) Th lymphocytes and effector memory lymphocytes (Th EM, CD27-CD28+CD62L-CD45RA-), was significantly different in all four study groups. Multidirectional changes of the absolute and abundance (relative content) in these cell populations in comparison with healthy donors for tuberculosis and HIV infection was noticed. Absolute content of Tcyt Eff, compared with healthy donors (76.1 [20.7; 143.5]), 4-fold increases in the group of HIV+TB+ and 2 times in groups TB+HIVand TB-HIV+. Th EM content increases only at TB+HIVgroup compare to healthy donors. In groups of patients with HIV infection (TB-HIV+ and TB+HIV+) a decrease in the content of these cells was observed. Thus, our work shows that the population of Th EM and Tcyt Eff could potentially be viewed as universal biomarkers for two socially significant infectious diseases: tuberculosis and HIV infection . In future experiments, it is necessary to validate these results to ensure specificity and determine the number of Th EM and Tcyt Eff specificly induced by Mtb antigens.
Russian Journal of Infection and Immunity = Infektsiya i immunitet Инфекция и иммунитет
2017, vol. 7, no. 2, pp. 151-161 2017, Т. 7, № 2, с. 151-161
ВЛИЯНИЕ ВИЧ-ИНФЕКЦИИ И ТУБЕРКУЛЕЗА НА СТЕПЕНЬ ДИФФЕРЕНЦИРОВКИ Т-ЛИМФОЦИТОВ ПЕРИФЕРИЧЕСКОЙ КРОВИ
Е.В. Васильева1, И.В. Кудрявцев2,5,6, Г.В. Максимов3, В.Н. Вербов4, М.К. Серебрякова2, А.П. Ткачук1, Арег А. Тотолян4,5
1ФНИЦЭМ им. Н.Ф. Гамалеи Минздрава РФ, Москва, Россия
2ФГБНУИнститут эспериментальной медицины, Санкт-Петербург, Россия
3СПбГУЗ Городской противотуберкулезный диспансер, Санкт-Петербург, Россия
4 ФБУН НИИ эпидемиологии и микробиологии имени Пастера, Санкт-Петербург, Россия
5ГБОУ ВПО Первый Санкт-Петербургский государственный медицинский университет имени академика
И.П. Павлова Минздрава РФ, Санкт-Петербург, Россия
6ФГАОУ ВПО Дальневосточный федеральный университет, г. Владивосток, Россия
Адрес для переписки:
Васильева Елена Викторовна 123098, Россия, Москва, ул. Гамалеи, 18, ФНИЦЭМ им. Н.Ф. Гамалеи Минздрава России. Тел.: 8 921 931-10-21 (моб.). E-mail: alenalenkina@gmail.com
Васильева Е.В., Кудрявцев И.В., Максимов Г.В., Вербов В.Н., Серебрякова М.К., Ткачук А.П., Тотолян Арег А. Влияние ВИЧ-инфекции и туберкулеза на степень дифференцировки Т-лимфоцитов периферической крови // Инфекция и иммунитет. 2017. Т. 7, № 2. С. 151-161. Сог 10.15789/2220-7619-2017-2-151-161
Elena V. Vasileva
123098, Russian Federation, Moscow, Gamaleya str., 18,
N.F. Gamaleya Federal Research Centre for Epidemiology
Phone: +7 921 931-10-21 (mobile).
Vasileva E.V., Kudryavtsev I.V., Maxlmov G.V., Verbov V.N., Serebriakova M.K., Tkachuk A.P., Totolian Areg A. Impact of HIV infection and tuberculosis on the peripheral blood T-cell differentiation // Russian Journal of Infection and Immunity = Infektsiya i immunitet, 2017, vol. 7, no. 2, pp. 151-161. doi: 10.15789/2220-7619-2017-2-151-161
и в 2 раза в группах ТБ+ВИЧ— и ТБ-ВИЧ+. В то же время содержание Th EM увеличивается только к группе ТБ+ВИЧ—, по сравнению со здоровыми донорами. В группах пациентов с ВИЧ-инфекцией (ТБ—ВИЧ+ и ТБ+ВИЧ+) наблюдается снижение содержания этих клеток. Таким образом, в нашей работе показано, что популяции Th EM и Tcyt Eff могут потенциально рассматриваться как универсальные биомаркеры для двух социально значимых инфекционных заболеваний: туберкулеза и ВИЧ-инфекции. В следующих экспериментах необходимо провести валидацию полученных результатов и определить содержание Th EM и Tcyt Eff, специфичных к антигенам микобактерий.
Ключевые слова: ВИЧ-инфекция, туберкулез, проточная цитометрия, субпопуляции T-хелперов, СD45RA, CD62L, QuantiFERON-TB Gold In-Tube.
IMPACT OF HIV INFECTION AND TUBERCULOSIS ON THE PERIPHERAL BLOOD T-CELL DIFFERENTIATION
Vasileva E.V.a, Kudryavtsev I.V.b e f, Maximov G.V.c, Verbov V.N.d, Serebriakova M.K.b, Tkachuk A.P.a, Totolian Areg A.de
a N.F. Gamaleya Federal Center of Epidemiology and Microbiology, Moscow, Russian Federation b Institute of Experimental Medicine, St. Petersburg, Russian Federation c City Anti-Tuberculosis Despensary, St. Petersburg, Russian Federation dSt. Petersburg Pasteur Institute St. Petersburg, Russian Federation e Pavlov State Medical University, St. Petersburg, Russian Federation f Far Eastern Federal University, Vladivostok, Russian Federation
Abstract. Tuberculosis is the leading cause of death among HIV infected individuals. In this regard, an important task is the timely detection of tuberculosis in HIV infected patients. Previously, we have shown that the diagnostic value of in vitro test, QuantiFERON-TB Gold In-Tube is not decreased in patients with HIV infection against the background of tuberculosis. However, it remains unclear what kind of cell populations produce IFNy in response to specific Mycobacterium tuberculosis antigens stimulation in vitro, because the immunodeficiency, caused by HIV, makes primarily for a decrease the abundance and attenuation functions of CD4 T-lymphocytes. The aim of thmbi work was to compare the degree of differentiation of T-lymphocytes CD4 (Th) and CD8 (Tcyt) in patients with pulmonary tuberculosis and healthy donors against the background of HIV infection. The study data were obtained during the examination of 28 patients with pulmonary tuberculosis without HIV infection (HIV-TB+), 23 patients with HIV infection (TB-HIV+) and 30 patients coinfected with HIV and tuberculosis (TB+HIV+). The comparison group consisted of 37 healthy individuals (TB—HIV—). Absolute and abundance (relative content) of major subpopulations of T-lymphocytes (based on the expression of CD27 marker, CD28, CD45RA and CD62L) in the peripheral blood for all patients included in the study (n = 118) were evaluated by flow cytometry approach. For patients with pulmonary tuberculosis (n = 58) QuantiFERON-TB Gold In Tube (Qiagen, QFT) test was performed. Th/Tcyt ratio was not significantly different among the groups of TB—HIV— and TB+HIV— (1.76 [1.51; 2.30] against 1.86 [1.22; 2.79], p = 0.960). At that time, the size of both subpopulations "terminally differentiated" Tcyt (Tcyt Eff, CD27CD28-CD62L CD45RA ) Th lymphocytes and effector memory lymphocytes (Th EM, CD27-CD28+CD62L-CD45RA-), was significantly different in all four study groups. Multidirectional changes of the absolute and abundance (relative content) in these cell populations in comparison with healthy donors for tuberculosis and HIV infection was noticed. Absolute content of Tcyt Eff, compared with healthy donors (76.1 [20.7; 143.5]), 4-fold increases in the group of HIV+TB+ and 2 times in groups TB+HIV— and TB—HIV+. Th EM content increases only at TB+HIV— group compare to healthy donors. In groups of patients with HIV infection (TB—HIV+ and TB+HIV+) a decrease in the content of these cells was observed. Thus, our work shows that the population of Th EM and Tcyt Eff could potentially be viewed as universal biomarkers for two socially significant infectious diseases: tuberculosis and HIV infection. In future experiments, it is necessary to validate these results to ensure specificity and determine the number of Th EM and Tcyt Eff specificly induced by Mtb antigens.
Key words: HIV infection, tuberculosis, flow cytometry, T-cell subsets, СD45RA, CD62L, QuantiFERON-TB Gold In-Tube.
В России туберкулез является ведущей причиной смерти больных ВИЧ-инфекцией. Так, согласно оценкам ВОЗ, 11% заболевших туберкулезом (ТБ) в 2015 г., были ВИЧ-положительными [22].
Дефицит лимфоцитов СВ4, возникающий при инфекции ВИЧ, значительно увеличивает
восприимчивость к инфекции Mycobacterium tuberculosis [13]. В связи с этим актуальной задачей является своевременное выявление туберкулеза после постановки диагноза ВИЧ-инфекции, определение групп высокого риска заболевания туберкулезом, для последующего динамического наблюдения за ними фтизиатром.
Традиционно скрининг латентной туберкулезной инфекции (ЛТБИ) проводится с приме-
нением пробы Манту in vivo, при этом установленным фактом является нарастание частоты ложноотрицательных результатов у пациентов с глубокой иммуносупрессией. Ранее нами было показано, что диагностическая значимость in vitro теста QuantiFERON-TB Gold InTube не снижается у пациентов с туберкулезом на фоне ВИЧ-инфекции [1, 6]. Вместе с тем остается неясным, какие популяции клеток продуцируют IFNy в ответ на специфическую стимуляцию антигенами M. tuberculosis в тестах in vitro у ВИЧ-инфицированных пациентов, поскольку иммунодефицит, вызванный ВИЧ, обусловлен в первую очередь уменьшением относительного содержания и ослаблением функций CD4 Т-лимфоцитов [18].
На сегодняшний день установлено, что по мере дифференцировки Т-лимфоцитов их функциональная активность, как правило, увеличивается [2, 5, 14]. Поэтому степень дифферен-цировки является важным показателем состояния Т-клеточного иммунитета. Этот показатель характеризует функциональную активность эф-фекторных Т-клеток и позволяет оценить тяжесть (активность) инфекционного процесса. Дифференцировка T-лимфоцитов при ВИЧ-инфекции [9, 17] и туберкулезе [12, 16] как моноинфекций изучена достаточно подробно, в то время как исследования синергичного взаимодействие ВИЧ и туберкулеза на дифференцировку клеток немногочисленны и нередко противоречивы.
В связи с этим целью нашего исследования было сравнить степень дифференцировки Т-лимфоцитов CD4 и CD8 у больных туберкулезом легких и здоровых доноров на фоне ВИЧ-инфекции.
Материалы и методы
За период с 2015—2016 гг. было проведено сравнительное проспективное исследование пациентов с туберкулезом органов дыхания, подтвержденным ростом M. tuberculosis на питательных средах, и ВИЧ-позитивных пациентов. Все лица, включенные в исследование (n = 118) были распределены на 4 группы: группу сравнения (I) составили здоровые лица (ТБ—ВИЧ—, n = 37), II — с туберкулезом без ВИЧ-инфекции (n = 28, ТБ+ВИЧ-), III — пациенты с ВИЧ-инфекцией (n = 23, ТБ—ВИЧ+), IV — с туберкулезом органов дыхания и ВИЧ-инфекцией (n = 30, ТБ+ВИЧ+). Демографическая и клиническая характеристики групп пациентов представлены в таблице 1.
Методом проточной цитометрии оценивалось абсолютное и относительное содержание основных субпопуляций T-лимфоцитов (на основе экспрессии маркеров CD27, CD28, CD45RA и CD62L) в периферической крови. Пациентам с туберкулезом легких (n = 58) был выполнен тест QuantiFERON-TB Gold In-Tube (Qiagen, QFT).
Таблица 1. Клиническая и демографическая характеристика обследованных
Table 1. Clinical and demographic characteristics
I ТБ-ВИЧ- TB-HIV-(n = 37) II ТБ+ВИЧ- TB+HIV-(n = 28) III ТБ-ВИЧ+ TB-HIV+ (n = 23) IV ТБ+ВИЧ+ TB+HIV+ (n = 30)
Возраст Me [Q1;Q3] Age, Me [Q1;Q3] 28 [22;36] 46 [31;53] 31 [28;33] 35 [31;40]
Пол: женщины/мужчины, % Gender: men/women, % 35/65 29/71 40/60 37/66
Форма туберкулеза, % Form of tuberculosis, % ИНФ/INF - 57 - 53
ТБ ВГЛУ/TB ITLN 7 10
Вирусная нагрузка, копий/мл Viral load, copies/ml - - 16 832 [1836;47 266] 102 717 [1546;473 450]
CD4, абс. CD4, abs. Me [Q1;Q3] 767 [693;855] 794 [545;1008] 357 [260;450] 247 [101 ;414]
14 октября 2013
- 19597
- 15,7
- 2
- 3
Распространенность СПИДа в мире на 2009 год.

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Иммунная система
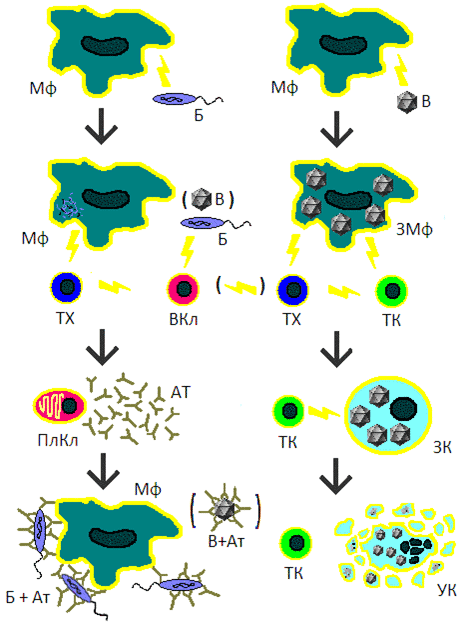
Рисунок 1. Упрощенная схема иммунного ответа. Молниями указано, как один тип клеток активирует другие. Мф — макрофаг, Б — бактерия, ТХ — Т-хелпер, ВКл — B-клетка, ПлКл — плазматическая клетка, Ат — антитела, Б+Ат — бактерия, покрытая антителами, привлекающими макрофагов, В — вирус, ЗМф — зараженный макрофаг, ТК — Т-киллер, ЗК — клетка, зараженная вирусом, УК — умирающая (апоптотирующая) клетка, В+Ат — вирус, покрытый антителами.
рисунок автора статьи
Жизненный цикл ВИЧ
Видео. Жизненный цикл ВИЧ.
Обратная транскрипция осуществляется вирусным белком обратной транскриптазой [31]. Обратная она потому, что обычно в клетке все наоборот — информация переносится с ДНК на РНК (а с РНК — в последовательность аминокислот белков). РНК по сравнению с ДНК очень нестабильна, и поэтому для ВИЧ характерна огромная скорость мутации — в десятки тысяч раз быстрее, чем для человека. Если скорость нейтральных мутаций для ДНК составляет у различных видов и для различных генов в среднем меньше 10 −9 замен на сайт в год, то скорость мутирования генетического материала РНК-вирусов — около 10 −3 замен на сайт в год (у гена env ВИЧ: 10 −2 –10 −3 замен на сайт в год [21]). Это одна из причин, почему иммунная система не может справиться с ВИЧ — он слишком быстро изменяется.
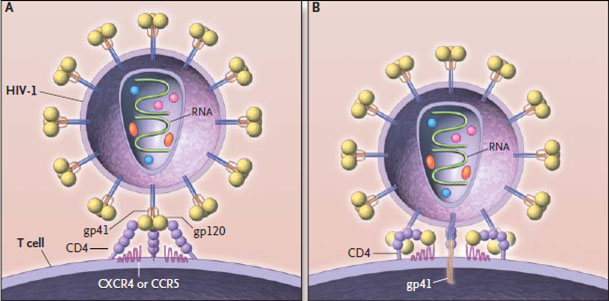
Таким образом, после того как копия вируса в геноме клетки начинает действовать, на её поверхности появляются знакомые нам белки gp41 и gp120, в цитоплазме — остальные вирусные белки и вирусная РНК. И через некоторое время от зараженной клетки начинают отпочковываться всё новые и новые копии ВИЧ.
Способы уничтожения иммунной системы
При отпочковывании вирус использует клеточную мембрану клетки, и со временем это должно вызвать ее разрушение. К тому же, вирусный белок Vpu вызывает увеличение проницаемости мембраны клетки [6]. При активации вируса в клетке появляется неинтегрированная в геном двуцепочечная ДНК [19], наличие которой может рассматриваться клеткой как повреждение ее генетического материала и индуцировать ее смерть через апоптоз (С точки зрения организма такая клетка потенциально может стать раковой). Помимо этого, вирусные белки напрямую нарушают баланс про- и противоапоптотических белков в клетке. К примеру, вирусная протеаза p10 может разрезать противоапоптотический фактор Bcl-2. Белки Nef [26], Env [22] и Tat [24] вовлечены в возрастание количества клеточных белков CD95 и FasL, служащих индукторами апоптоза по т.н. Fas-опосредованному пути. Белок Tat положительно регулирует каспазу 8 [2] — ключевой фактор индукции апоптоза.
Если же клетки не погибли сами, они активно уничтожаются Т-киллерами. (Это стандартный ответ иммунитета на заражение любыми вирусами.)
Помимо этого, при производстве gp120 и Tat часть их выбрасывается зараженной клеткой в кровоток, а это оказывает токсическое действие на организм [4], [28]. gp120 оседает на все СD4 + -клетки (в том числе и здоровые), что имеет три последствия:
- Белок СD4 важен для взаимодействия Т-хелпера с фагоцитом, при слипании же СD4 с gp120 T-хелпер перестает выполнять эту функцию.
- На gp120 как на чужеродный белок образуются антитела; после оседания gp120 на здоровые клетки, последние маркируются антителами, и иммунная система их уничтожает [9].
- После обильного связывания Т-хелпером gp120 клетка умирает сама. Дело в том, что CD4 — это корецептор. Он усиливает сигнал от TCR (T-cell receptor) — главного белка, позволяющего выполнять Т-клеткам функцию иммунитета. В норме эти рецепторы активируются вместе. Если же активируется один тип рецепторов, но не активируется другой, это является сигналом, что что-то пошло не так, и клетка умирает посредством апоптоза.
Антитела, призванные препятствовать инфекции, в случае с ВИЧ часто, наоборот, ее усиливают [28]. Почему так происходит — не совсем понятно. Одну причину мы рассмотрели выше. Возможно, дело в том, что антитела сшивают несколько вирусных частиц вместе, и в клетку попадает не один, а сразу много вирусов. Помимо этого, антитела активируют клетки иммунитета, а в активированной клетке вирусные белки синтезируются быстрее.
Вдобавок, gp120 и gp41 имеют участки, похожие на участки некоторых белков, участвующих в иммунитете (например, MHC-II [25], IgG [23], компонент системы комплемента Clq-A [14]). В результате на эти участки образуются антитела, способные помимо вируса маркировать совершенно здоровые клетки (если на них будут эти белки), с соответствующими для них последствиями.
Так как на поверхности зараженной клетки появляется gp120, то она, как и вирусная частица, будет сливаться с другими СD4-содержащими клетками, образуя огромную многоядерную клетку (синцитий), неспособную выполнять какие-либо функции и обреченную на смерть.
На самом деле, помимо Т-хелперов, СD4 содержатся во множестве других клеток — предшественниках Т-киллеров/Т-хелперов, дендритных клетках, макрофагах/моноцитах, эозинофилах, микроглии (последние четыре — разновидности фагоцитов), нейронах (!), мегакариоцитах, астроцитах, олигодендроцитах (последние две — клетки, питающие нейроны), клетках поперечно-полосатых мышц и хорионаллантоиса (присутствует в плаценте) [29]. Все эти клетки способны заражаться ВИЧ, но сильно токсичен он лишь для Т-хелперов. Это и определяет основное клиническое проявление СПИДа — сильное снижение количества Т-хелперов в крови. Однако для других клеток заражение тоже не проходит бесследно — у больных СПИДом часто снижена свертываемость крови, имеются неврологические и психиатрические отклонения [16], наблюдается общая слабость.
Пути заражения ВИЧ
Внимание! Ввиду того, что СПИД является венерическим заболеванием, информация, приведенная в этом разделе, может вас оскорбить либо вызвать неприятные эмоции при прочтении. Будьте осторожны.
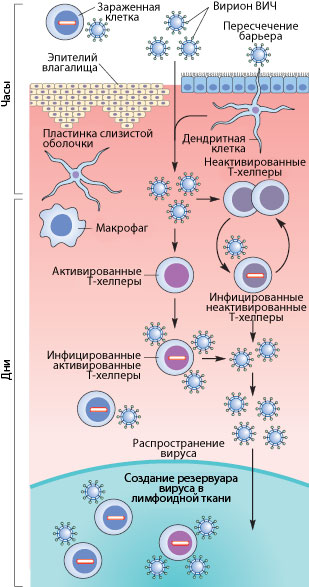
Рисунок 3. Пути проникновения ВИЧ в организм при половом контакте. Слева указано примерные временные рамки каждого этапа.
Как же происходит первичное заражение человека ВИЧ? Думаю, что с переливанием крови или с использованием общего шприца при употреблении наркотиков читателю все понятно — вирус доставляется напрямую из зараженной крови в здоровую. При вертикальном способе передачи инфекции (от матери к ребенку) заражение может произойти во время внутриутробного развития, в момент родов или в период кормления ребенка грудью (т.к. вирус и зараженные вирусом клетки содержатся в молоке матери) [17], [20]. Тем не менее, даже у ребенка, рожденного от ВИЧ-инфицированной матери, есть шанс остаться здоровым, особенно если мать использует ВААРТ (высокоактивную антиретровирусную терапию) [5]. А почему же люди заражаются при половом контакте?
Механизмы передачи вируса при половом акте не до конца ясны. Тем не менее, они понятны в общих чертах. Итак, рассмотрим барьеры, которые необходимо преодолеть вирусу, чтобы добраться до макрофагов и Т-хелперов. К сожалению, рассматривать особо нечего: барьер только один — это слой эпителиальных клеток и вырабатываемая ими слизь, находящиеся во влагалище (а также пенисе, прямой кишке, глотке). Барьер этот тонок — он может быть всего одну клетку в толщину, — но для вируса труднопреодолим, доказательством чего может служить сравнительно небольшой процент заражений — примерно 1–2 случая на 100 половых контактов. Итак, и какими же путями преодолевает вирус это препятствие?
Наиболее очевидный механизм — это микротравмы. При обычном половом контакте, а особенно при анальном сексе, почти неизбежно появляются микротрещины; при наличии же венерических заболеваний часто возникают изъязвления слизистой. Через эти микротравмы вирус, содержащийся в сперме и влагалищном секрете, может проникнуть к иммунокомпетентным клеткам [17], [20].
Помимо дендритных клеток, в кишечнике существует другой тип клеток, предназначенный для ознакомления организма с антигенами внешней среды. Это так называемые М-клетки, пропускающие через себя довольно крупные объекты неповрежденными из просвета кишечника. В т.ч. через них может проходить и вирион ВИЧ.
Свой вклад в заражение вносит и провоспалительный процесс, в норме присутствующий в женских половых путях из-за наличия в них спермы. Благодаря ему Т-клетки подвержены активации, что способствует их восприимчивости к инфекции.
Итак, риск заразиться ВИЧ возрастает в ряду (Классический секс → Анальный секс → переливание крови / использование общих шприцов при принятии наркотиков). Что же касается орального секса, то весьма небольшой шанс заразиться есть только у принимающей стороны — слюна и тем более желудочный сок инактивирует ВИЧ. Теоретически, этим способом может заразиться и мужчина, но для этого необходимы ранки на пенисе.
При поцелуях и обычных бытовых контактах вирус не передается — он очень неустойчив в окружающей среде .
Заключение
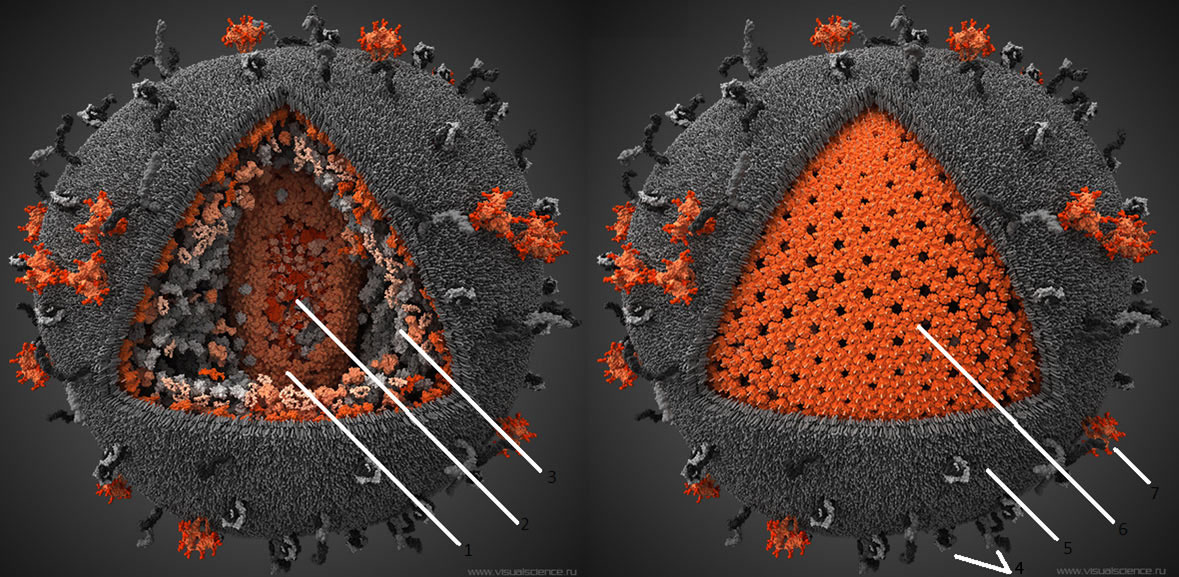
10000 нуклеотидов в каждой. Всего геном включает девять генов, которые в результате альтернативного сплайсинга кодируют 15 различных белков. 3 — Различные белки, захваченные вирусом из хозяйской клетки. 4 — Человеческие белки, обычно находящиеся на поверхности мембраны клеток. Захваченые в результате отпочковывания, они увеличивают вирулентность вируса. 5 — Внешняя оболочка ВИЧ, ведущая свое происхождение от цитоплазматической мембраны клетки, от которой когда-то отпочковался вирион. 6 — Матрикс, образованный тримерами белка р17. 7 — Тримерные комплексы белков gp120 и gp41, при помощи которых вирус проникает в клетку. На поверхности среднего вириона насчитывается около 20 таких тримеров. Чтобы увидеть рисунок в полном размере, нажмите на него.
. Все эти факты позволяют надеяться, что вскоре ВИЧ, как и оспа, останется в прошлом.
Читайте также:


