Среда питательная для выделения иерсиниоза и псевдотуберкулеза
Питательная среда для выделения возбудителей кишечного иерсиниоза и псевдотуберкулеза, сухая.
Описание
ИНСТРУКЦИЯ
по применению набора реагентов для бактериологических исследований
- характеристика набора
Выпускается в полиэтиленовых банках по 250 г.
2.1. ПРИНЦИП ДЕЙСТВИЯ
Совокупность компонентов, входящих в состав набора, обеспечивает питательные потребности для роста, дифференциации возбудителей кишечного иерсиниоза и псевдотуберкулеза, а также ингибиции отдельных видов микроорганизмов.
2.2. СОСТАВ набора
| Панкреатический гидролизат рыбной муки……………….. | 23,5 |
| Желчь очищенная, сухая ……………………………….. | 4,0 |
| Натрия хлорид …………………. ……………………………… | 3,0 |
| Д-глюкоза …………………………………………………. | 10,0 |
| Мочевина ….…………………………………………….. | 5,0 |
| Бромтимоловый синий …………………………………..…….. | 0,128 |
| Натрий углекислый………………………………………….……… | 0,1-0,3 |
| Бриллиантовый зеленый …………………………………………. | 66×10 -5 |
| Агар микробиологический ………………………………. | 10,0±3,0 |
При визуальном просмотре чашек колонии указанных штаммов должны выглядеть следующим образом:
Y.enterocolitica 287-II — круглые, гладкие, блестящие, сине-зеленые, диаметром не менее 1,5 мм;
Y.pseudotuberculosis III — матовые, шероховатые, зеленовато-синие, с фестончатым краем и темным, выпуклым центром, диаметром не менее 1,0 мм.
Дифференцирующие свойства среды. Питательная cреда должна обеспечивать дифференциацию тест-штаммов Y.enterocolitica 287-II и Y.pseudotuberculosis III от тест-штаммов E. coli 3912/41 (055:K59) и S. flexneri 1а 8516 на всех засеянных чашках Петри при посеве по 0,1 мл смеси тест-штамма Y.enterocolitica 287-II с E. coli 3912/41 (055:K59), Y.enterocolitica 287-II с S. flexneri 1а 8516, Y.pseudotuberculosis III с E. coli 3912/41 (055:K59), Y.pseudotuberculosis III с S. flexneri 1а 8516 через 48 ч инкубации при температуре (28±1) °С.
При визуальном просмотре чашек колонии указанных штаммов должны выглядеть следующим образом:
- coli 3912/41 (055:K59) — ярко-желтые, сочные, круглые, выпуклые, диаметром не менее 2,0 мм;
- flexneri 1а 8516 — желтые, плоские, диаметром не менее 1,0 мм.
Ингибирующие свойства среды. Иерсиния-агар должен полностью подавлять рост тест-штамма Staphylococcus aureus Wood-46 на всех засеянных чашках Петри при посеве 0,1 мл микробной взвеси из разведения 10 -2 через 48 ч культивирования при температуре (28±1) °С.
- ОБОРУДОВАНИЕ И МАТЕРИАЛЫ
- Термостат обеспечивающий температуру 37±1 °С
- Весы лабораторные 2 класса точности
- Автоклав
- Пробирки стеклянные
- Пипетки стеклянные позволяющие отбирать объемы жидкости 1 и 2 мл
- Цилиндр стеклянный мерный вместимостью 1000 мл
- Чашки Петри стерильные
- Вода дистиллированная
- Колбы
- Воронки стеклянные
- АНАЛИЗИРУЕМЫЕ ОБРАЗЦЫ
Объекты исследований в санитарной, клинической микробиологии и научные исследования.
- Проведение АНАЛИЗа
Исследования образцов проводятся по соответствующим Методическим указаниям и ГОСТам.
Препарат в количестве, необходимом для приготовления конкретной серии питательной среды, размешивают в 1 л дистиллированной воды, нагревают до кипения и кипятят 5 мин на медленном огне. Затем фильтруют через ватно-марлевый фильтр и вновь кипятят 1-2 мин. Охлаждают до 45-50 °С и разливают в чашки Петри слоем 5-6 мм, закрывают крышками и ставят для застывания. Перед посевом чашки со средой подсушивают на рабочем столе с открытыми крышками в течение 30-40 мин.
Разлитая в чашки Петри среда может быть использована в течение 2-х сут при температуре хранения 2-8 °С.
- РЕГИСТРАЦИЯ И УЧЕТ РЕЗУЛЬТАТОВ
Для получения достоверных результатов посевы образцов производить не менее, чем в трех повторностях.
Срок годности – 1 год.
Для получения надежных результатов необходимо строгое соблюдение настоящей инструкции по применению.
Владельцы патента RU 2251570:
Изобретение относится к микробиологии и может быть использовано для диагностики иерсиниоза и псевдотуберкулеза путем выделения Yersinia enterocolitica и Yersinia pseudotuberculosis из клинического и другого материала. Питательная среда (И-агар) содержит, г/л: пептон - 19,0-21,0, дрожжевой экстракт - 1,9-2,1, маннит - 19,0-21,0, натрия пируват - 1,9-2,1, натрия хлорид - 0,95-1,05, магния сульфат - 0,009-0,011, натрия дезоксихолат - 0,48-0,53, нейтральный красный - 0,028-0,032, кристаллический фиолетовый - 0,009-0,0011, агар-агар - 11,9-13,1, иргасан - 0,0039-0,0041, дистиллированная вода - остальное. При более простом составе по сравнению с ближайшим аналогом И-агар имеет улучшенные селективные характеристики в отношении Y. pseudotuberculosis без существенного изменения других свойств среды. 3 табл.
Изобретение относится к микробиологии и может быть использовано для диагностики иерсиниоза и псевдотуберкулеза путем выделения Yersinia enterocolitica и Yersinia pseudotuberculosis из клинического материала и объектов внешней среды.
Известно использование для выделения из клинического и неклинического материала возбудителей кишечного иерсиниоза (патогенных бактерий вида Yersinia enterocolitica) среды Yersinia Selective Medium - CIN-агара [1]. Недостатками указанной среды являются подавление на этой среде роста близкородственных бактерий, вызывающих псевдотуберкулез - Yersinia pseudotuberculosis, а также сложность приготовления и недоступность для многих практических лабораторий некоторых ингредиентов среды [2].
Целью настоящего изобретения является упрощение состава питательной среды и улучшение ее селективных свойств в отношении Yersinia pseudotuberculosis
Поставленная цель достигается, что для приготовления питательной среды (И-агара) используют пептон, дрожжевой экстракт, маннит, пируват натрия, хлорид натрия, сульфат магния, дезоксихолат натрия, нейтральный красный, кристаллический фиолетовый, агар-агар, иргасан (триклозан) и дистиллированную воду при следующем содержании компонентов, г/л:
Дрожжевой экстракт 1,9-2,1
Натрия пируват 1,9-2,1
Натрия хлорид 0,95-1,05
Магния сульфат 0,009-0,011
Натрия дезоксихолат 0,48-0,53
Нейтральный красный 0,028-0,032
Кристаллический фиолетовый 0,009-0,0011
Дистиллированная вода остальное
Все компоненты среды, за исключением иргасана, растворяют в дистиллированной воде и доводят значение рН до 7,4±0,2. Среду стерилизуют в автоклаве при температуре 120-122°С в течение 14-16 минут. Иргасан растворяют в асептических условиях при помешивании в 1,5-2,5 мл стерильной дистиллированной воды при температуре 45-50°С. После стерилизации в остывшую до 45-50°С основу вносят раствор иргасана и тщательно перемешивают. Готовую среду разливают в стерильные чашки Петри и подсушивают.
Посев материала на поверхность среды производят общепринятыми методами. Учет производят после 24-48 часов инкубации при температуре 32°С. Культуры патогенных иерсиний вырастают в виде типичных выпуклых мелких прозрачных колоний розового цвета с четко очерченным малиновым “глазком” в центре (“бычий глаз”). Колонии имеют гладкую блестящую поверхность, ровные края и маслянистую консистенцию.
Для сравнения с CIN-агаром в серии экспериментов у И-агара определяли чувствительность, время появления роста бактерий, селективные свойства, а также морфолого-физиологические признаки выделенных на этой среде иерсиний.
Для определения чувствительности сред производили смыв ночных культур иерсиний со скошенного питательного агара и стандартизировали полученную суспензию до 10 единиц по ОСО 42-28-59-85 и готовили ее десятикратные разведения. По 0,1 мл взвеси каждого штамма в различных разведениях вносили в чашки Петри с испытуемыми средами. Чувствительность среды определяли по наибольшему разведению, обеспечивающему формирование колоний или визуально видимый рост на всех засеянных чашках. По отношению к Y.enterocolitica чувствительность И-агара и CIN агара составила 10 -8 , по отношению к Y.pseudotuberculosis чувствительность И-агара составила 10 -7 , а рост Y.pseudotuberculosis на CIN агаре был подавлен во всех разведениях.
Время появления (скорость) роста в часах определяли по минимальному периоду инкубации посевов, необходимому для формирования типичных колоний на среде в чашках. Результаты представлены в табл.1.
| Таблица 1 | ||
| Время появления роста типичных колоний, ч | ||
| Тест-штиммы | Питательные среды | |
| Ближайший аналог | Предложенная среда | |
| Y.enterocolitica серовара O3 | 23,1 | 22,7 |
| Y.enterocolitica серовара O9 | 23,4 | 22,9 |
| Y.pseudotuberculosis | Рост отсутствует | 24,5 |
Селективные свойства сред оценивали путем посева 0,1 мл микробной взвеси ночных агаровых культур, содержащей 300 колониеобразующих единиц иерсиний в чистой культуре и в смесях с культурами бактерий-ассоциантов при соотношении 1:1, на чашки с испытуемыми и контрольной средами. В качестве ассоциантов использовали культуры Salmonella typhimurium, Serratia marcescens, Serratia liquefaciens, Proteus vulgaris, Proteus mirabilis, Pseudomonas aeruginosa, Enterobacter cloacae, Enterococcus faecalis, Escherichia coli, Staphylococcus aureus, K.pneumoniae, K.oxytoca, P.stuartii и P.rettgeri, а в качестве контрольной среды - триптон-соевый агар в общепринятой прописи. Показатель ингибиции (ПИ) рассчитывали по формуле:
Результаты приведены в табл.2. В отличие от CIN-агара на предложенной среде помимо типичных колоний Y.enterocolitica вырастают типичные колонии Y.pseudotuberculosis без каких-либо признаков подавления роста. Вместе с тем ингибирующее действие И-агара по отношению к серрациям и псевдомонадам слабее, чем у CIN-агара. Однако этот недостаток полностью компенсируется четкими различиями в морфологии колоний указанных микроорганизмов и иерсиний. Дифференцирующие свойства И-агара позволили уверенно отличить колонии иерсиний от колоний ассоциантов в 90% случаев посева смешанных культур.
| Показатели ингибиции сред через 48 ч инкубирования при 32°С | ||
| Тест-штаммы | Питательные среды | |
| Ближайший аналог | Предложенная среда | |
| Y.enterocolitica серовара O3 | 0,98 | 1,00 |
| Y.enterocolitica серовара O9 | 0,94 | 0,97 |
| Y.pseudotuberculosis | 0 | 0,94 |
| S.marcescens | 0,06 | 0,85 |
| S.liquefaciens | 0,29 | 0,89 |
| P.aeruginosa | 0 | 0,95 |
| S.typhimurium | 0 | 0 |
| P.mirabilis | 0 | 0 |
| P.vulgaris | 0 | 0 |
| E.cloacae | 0 | 0 |
| E.faecalis | 0 | 0 |
| E.coli | 0 | 0 |
| K.pneumoniae | 0 | 0 |
| K.oxytoca | 0 | 0 |
| P.stuartii | 0 | 0 |
| P.rettgeri | 0 | 0 |
| S.aureus | 0 | 0 |
В табл.3 представлены размеры колоний иерсиний, выращенных на испытуемых средах при 32°С. При расчете не было обнаружено статистически достоверных различий между диаметром колоний иерсиний на предложенной среде и CIN-агаре (при уровне вероятности 95%).
| Средний диаметр колоний иерсиний (мм) | |||
| Тест-штаммы | Время инкубации | Питательные среды | |
| Ближайший аналог | Предложенная среда | ||
| Y.enterocolitica серовара O3 | 24 ч | 0,82±0,05 | 0,82±0,05 |
| 48 ч | 1,17±0,07 | 1,2±0,08 | |
| Y.enterocolitica серовара O9 | 24 ч | 0,8±0,07 | 0,77±0,06 |
| 48 ч | 1,1±0,11 | 1,18±0,1 | |
| Y.pseudotuberculosis | 24 ч | Рост отсутствует | 0,58±0,05 |
| 48 ч | Рост отсутствует | 0,99±0,06 |
Морфологические, тинкториальные, физиолого-биохимические и антигенные свойства иерсиний, выросших на И-агаре, соответствовали таковым после культивирования на среде сравнения - CIN-агаре.
В материал с миндалин здоровых свиней, помещенный в забуференную пептонную воду (рН 7,6), вносили следующие культуры: Y.enterocolitica серовара О3 (100 КОЕ/мл); S.typhimurium, S.marcescens, P.vulgaris, P.aeruginosa, E.cloacae, E.faecalis, E.coli и S.aureus (no 1000 КОЕ/мл). Посевы инкубировали при 4-6°С в течение 7 сут. Высевы на предлагаемую среду и CIN-агар производили сразу после внесения культур, а также на 3-е, 5-е и 7-е сутки. Засеянные селективные среды для иерсиний инкубировали при 32°С в течение 48 часов с последующей реидентификацией выделенных культур по физиолого-биохимическим и антигенным свойствам. В 10 высевах из 12 (83,3%) иерсиний выделены как на CIN-агаре, так и на предложенной среде.
Таким образом, при более простом составе по сравнению с ближайшим аналогом И-агар имеет улучшенные селективные характеристики в отношении Y. pseudotuberculosis без существенного изменения других свойств среды.
1. Schiemann D.A. Synthesis of a selective agar medium for Yersinia enterocolitica. Can. J. Microbiol, 1979, Vol.25, P.1298-1304 (прототип).
2. Schiemann D.A. Yersinia enterocolitica: observations on some grown characteristics and response to selective agents. Can. J. Microbiol, 1980, Vol.26, P.1232-1240.
3. Л.В.Саяпина. Диагностическая ценность новой питательной среды для выделения и культивирования возбудителей кишечного иерсиниоза и псевдотуберкулеза. Журнал микробиологии, эпидемиологии и иммунологии, 2000, №6, с.15-18.
4. P.R. Murray, E. Jo Baron, M.A. Pfaller et al. Manual of clinical microbiology, Washington, D.C, 1999, p.483-496.
Питательная среда для выделения Yersinia enterocolitica и Yersinia pseudotuberculosis, содержащая пептон, дрожжевой экстракт, маннит, натрия пируват, натрия хлорид, магния сульфат, натрия дезоксихолат, нейтральный красный, кристаллический фиолетовый, агар-агар, иргасан и дистиллированную воду при следующем содержании компонентов, г/л:
| Классы МПК: | C12G1/04 сульфитация сусла; десульфитация C12N1/20 бактерии; питательные среды для них | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Автор(ы): | Храмов М.В. , Ажермачева Н.И. , Савельева Г.М. , Марчихина И.И. , Мессорош В.Г. , Ценева Г.Я. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Патентообладатель(и): | Государственное федеральное предприятие "Государственный научный центр прикладной микробиологии" | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Приоритеты: |
|
Среду стерилизуют при 0,5 атм 20 минут или текучим паром 3 дня подряд по 20 мин. Среду охлаждают в скошенном положении для получения столбика высотой 2,5 см и косяка длиной 4 см. Готовая среда бледно-розового цвета.
Сеют штрихом по скошенной поверхности и уколом в столбик. Инкубируют при 37°С 18-24 часа. Кислотообразование вызывает появление желтой окраски, разложение мочевины (увеличение рН) - покраснение.
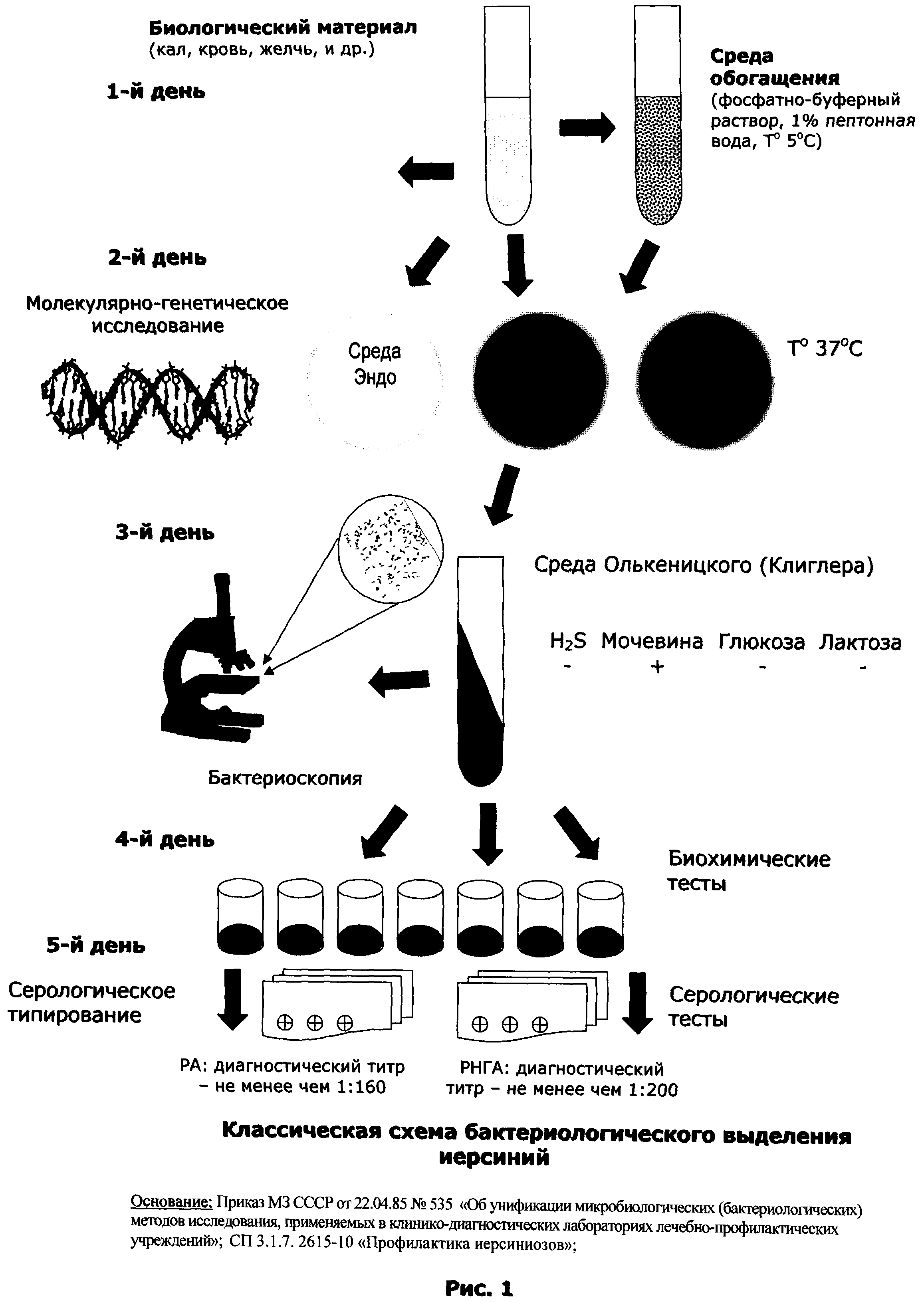
Недостатком является то, что основное предназначение данной среды -идентификация бактерий семейства Enterobacteriacea, которое включает 12 родов и более 300 видов микроорганизмов. Следовательно, среда Олькеницкого не решает задачу дифференциально-диагностического выделения бактерий рода Yersinia, (рис.2).
Задачей данного изобретения является создание простой дифференциально- диагностической питательной среды с высокой разрешающей способностью, которая позволяет определить принадлежность выделенной культуры к роду Yersinia без использования дополнительных сред, в результате происходит значительное сокращение сроков исследования.
Поставленная задача решается путем приготовления дифференциально-диагностической питательной среды для идентификации бактерий рода Yersinia, содержащей микробиологический агар (сухой), лактозу, глюкозу, мочевину, краситель феноловый красный и дистиллированную воду, согласно изобретению питательная среда дополнительно содержит краситель метиленовый синий и хлористый кальций при следующем соотношении компонентов, г/100 мл:
Хлористый кальций - 0,2
Феноловый красный (1% спиртовый р-р) - 0,2 мл
Метиленовый синий (1% спиртовый р-р) - 0,1 мл
Дистиллированная вода - до 100 мл
В качестве растворителя для красителей феноловый красный и метиленовый синий используют этиловый спирт.
При разработке предлагаемой питательной среды учтены и использованы биохимические особенности рода Yersinia и отдельных видов этого рода.
Одновременное использование в составе заявляемой питательной среды спиртового раствора метиленового синего и фенолового красного позволяет получить специфическое окрашивание (столбик малиновый, скошенная часть фиолетовая) характерное исключительно для бактерий рода Yersinia. Следовательно, предлагаемая питательная среда может рассматриваться как простая, а также их биохимические свойства.
Композиция из двух красителей - дифференциально-диагностическая среда с высокой разрешающей способностью для бактерий рода Yersinia
Введение в питательную среду хлористого кальция, не являющегося компонентом питания иерсений, обеспечивает ее изотоничность, предохраняя бактериальные клетки от осмотического шока.
При этом существенными признаками предлагаемого предложения следует считать качественный и количественный состав питательной среды, с высокой разрешающей способностью, т.к. величины содержания компонентов в заявляемой питательной среде являются оптимальными и обусловливают относительную сбалансированность стоимости среды с ее ростовыми характеристиками. Под понятием высокая разрешающая способность питательной среды заявитель подразумевает возможность выделения бактерий рода Yersinia в ходе одного посева на заявляемую питательную среду без использования дополнительных тестов, в результате чего сроки исследования сокращаются до 18-24 часов.
Питательную среду готовят следующим образом.
Сухие ингредиенты среды растворяют в дистиллированной воде в любой последовательности. После растворения агара смесь нагревают до кипения и добавляют индикаторы (феноловый красный и метиленовый синий). Устанавливают рН среды в пределах 7,0-7,2 и разливают по пробиркам по 5-6 мл, стерилизуют автоклавированием 15 мин под давлением 0,5 атм.
В горячем виде среда имеет грязно-зеленый цвет, а сразу после автоклавирования приобретает желто-оранжевую окраску в результате восстановления метиленового синего.
Пробирки со средой осторожно встряхивают и устанавливают в наклонном положении под углом 45° (для получения скашивания, оставляя вертикальный столбик высотой 1,5-2,0 см и косую поверхность 4-5 см). При остывании среды она вновь приобретает грязно-зеленную окраску вследствие окисления индикатора атмосферным кислородом.
Посев материала проводят по всей скошенной поверхности (косяку) и последующим уколом в столбик среды.
При культивировании на данной среде через сутки различные представители семейства Enterobacteriaceae вызывают характерные изменения в окраске предлагаемой среды (табл.2).
|
Примечание: *) - по ходу укола.
Иерсинии ферментируют глюкозу с образованием кислоты (облигатный признак для всех представителей семейства Enterobacteriaceae) расщепляют мочевину и восстанавливают метиленовый синий индикатор. Однако конечные химические и окислительно-восстановительные сдвиги в столбике и на скошенной поверхности среды (косяке) существенно различаются по окраске. В столбике происходит увеличение значения рН за счет ощелачивания среды (результат расщепления мочевины), в результате чего восстановленный метиленовый синий индикатор обесцвечивается. При этом столбик окрашивается феноловым красным индикатором в малиновый цвет (рис.3).
Следовательно, предлагаемая питательная среда может рассматриваться как дифференциально-диагностическая. На скошенной части столбика также происходит расщепление (гидролиз) мочевины и, следовательно, ощелачивание среды. Феноловый красный индикатор окрашивается в малиновый цвет, который, смешиваясь с метиленовым синим, дает интенсивно-фиолетовую окраску среды.
Таким образом, различные представители бактерий семейства Enterobacterioceae, имеющие разные биохимические свойства по отношению к лактозе, глюкозе, мочевине и метиленовому синему, изменяют цвет среды при различных значениях рН. Иерсинии дают четкую картину, как правило, уже через 18-24 часа, а другие представители семейства вызывают характерные изменения среды и в более короткие сроки.
Заявляемая питательная среда соответствует критериям изобретения:
Дифференциально-диагностическая питательная среда для идентификации бактерий рода Yersinia, содержащая микробиологический агар (сухой), лактозу, глюкозу, мочевину, краситель феноловый красный и дистиллированную воду, отличающаяся тем, что питательная среда дополнительно содержит краситель метиленовый синий и хлористый кальций при следующем соотношении компонентов, г/100 мл. рН - 7,0-7,2. 

Читайте также:
- Референс центр по туляремии
- Африканская чума свиней в таблицах
- Можно ли отказаться от прививки от столбняка взрослым
- Лепра в художественной литературе
- Пневмококковая вакцина синфлорикс инструкция
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции

