Резистентность стрептококков к антибиотикам
Московская медицинская академия им. И.М. Сеченова, НИФ "Ультрасан", Москва
Изучение антибиотикочувствительности циркулирующих штаммов бета-гемолитических стрептококков серогрупп А, В, C и G, выделенных от здоровых и больных детей и взрослых за период с 1987 по 1996 год (более 900 культур), показало сохранение уровней МПК (в пределах чувствительности) беталактамных антибиотиков для стрептококков серогрупп А, C и G. Отмечается увеличение количества штаммов, устойчивых к эритромицину и линкомицину, возрастание распространенности культур, резистентных одновременно к хлорамфениколу, тетрациклину и гентамицину. Установлена активность в отношении стрептококков изученных серогрупп альтернативных антибиотикам препаратов Томицида и Солкармона, показана эффективность их применения для лечения и профилактики стрептококкозов. Обсуждается предположение о небезопасности использования беталактамных антибиотиков при лечении синдрома токсического шока, вызванного стрептококком группы А.
В данной публикации обобщены результаты сравнительного изучения антибиотикочувствительности БГС серогрупп А, В, С и G, выделенных из ротоглотки здоровых носителей и больных ангинами и ОРЗ детей и взрослых, а также данные по изучению активности в отношении БГС двух альтернативных антибиотикам препаратов - Томицида и Солкармона.
Использовали диско-диффузионный метод, методы разведений в агаре и жидкой среде, а также разработанную нами модификацию микрометода в жидкой среде с индикатором феноловым красным, которая позволяет определять минимальную подавляющую концентрацию (МПК) антибиотика уже через 7-8 часов, а к концу первых суток - значения его минимальной бактерицидной концентрации (МБК) [1].
В то же время, как было продемонстрировано в предыдущей публикации [2], эти показатели для изолятов СГА и СГВ от больных детей и взрослых были достоверно выше таковых для изолятов от здоровых носителей. Повышение уровней МПК и МБК прямо зависело от тяжести клинических проявлений фолликулярных и лакунарных ангин . Это может быть связано как с селективным давлением антибиотика, так и с изменением биологических свойств возбудителя в организме больного.
Значения МПК90 и МБК90 эритромицина также не претерпели существенных изменений, однако среди изученных нами культур (в основном, выделенных в 1995-1996 гг.) 2,5% были резистентны к этому антибиотику, причем большинство из них и к линкомицину (МПК > 8 мкг/мл). Биохимическими механизмами, обусловливающими резистентность к макролидам и линкозамидам , являются их ферментативная инактивация или изменение сродства к ним рибосом бактериальной клетки [3]. Циркуляция клонов БГС с высокой степенью устойчивости к макролидам и линкозамидам (до 70% изолятов), которую регистрируют в отдельных регионах мира с начала 70-х годов, перерастает в настоящее время в серьезную проблему [4, 5].
Известно, что эти антибиотики являются препаратами "второго ряда" при лечении заболеваний, вызванных БГС; их применяют в участившихся случаях неэффективности или непереносимости пенициллинотерапии стрептококковых фарингитов , при санации носителей, а также в лечении тяжелых инвазивных форм СГА-инфекции: некротических фасциитов, целлюлитов , синдрома токсического шока (СТШ) и др. Неэффективность использования беталактамных антибиотиков при лечении стрептококковых фарингитов и санации ротоглотки носителей БГС связывают либо с ферментативной инактивацией препарата, особенно в условиях дисбиотических сдвигов, при которых могут усиливаться соответствующие метаболические процессы, либо с наличием толерантных свойств у возбудителя. Толерантные культуры, для которых значения МБК более чем в 16 раз превышают МПК, отличаются от нетолерантных меньшей экспрессией пенициллинсвязывающих белков у бактерий [6]. Экранирование этих структур, характерное для стрептококка в стационарной фазе роста, преобладающего в популяции при большом объеме инфекта, считают причиной неэффективности пенициллинотерапии инвазивных форм СГА-инфекции. При этом культуры стрептококка, выделенные от больных, в условиях in vitro остаются чувствительными к использованному беталактамному антибиотику [7].
Полагаем, что применение массивных доз пенициллина при лечении инвазивной стрептококковой инфекции, во всяком случае при СТШ, может быть не только неэффективным, но и повлечь серьезные осложнения в течении болезни из-за "выброса" значительных количеств эндотоксинов аутохтонной грамотрицательной микрофлорой в результате повреждения ее клеточных стенок беталактамными антибиотиками [8]. Наблюдаемый в настоящее время подъем заболеваемости инвазивными формами СГА-инфекции обусловлен повышенной токсигенностью, в силу изменений в геноме, "вернувшихся" в циркуляцию серотипов СГА. Поражающий эффект связывают с индукцией эритрогенным токсином (возможно и некоторыми структурами клеточной стенки стрептококка) синтеза мононуклеарами медиаторов с биоповреждающим действием [7]. Однако тяжелейшие клинические проявления, скорость нарастания системных поражений свидетельствуют об участии в механизме патогенеза СТШ и эндогенных факторов, в частности, эндотоксинов аутохтонной микрофлоры, скорее всего, бактероидов. Следует отметить, что описан экзо-эндотоксиновый механизм патогенеза некоторых видов сепсиса , в том числе вызванного СГА и Bacteroides fragilis [9]. Известно, что в организме постоянно присутствует некоторое количество свободного эндотоксина: до 0,1 мг/г в отделяемом кишечника и в нанограммовых количествах в крови и лимфотоке. По-видимому, эритрогенный токсин мобилизует значительные количества эндотоксина, вовлекая его в патофизиологический процесс. В модельных опытах на животных была показана способность эритрогенного токсина в сотни раз понижать уровень летальных доз эндотоксина [10]. Неслучайно, на наш взгляд, наиболее эффективным антибиотиком при лечении СТШ оказался клиндамицин , который способен подавлять индуцированный эндотоксинами синтез фактора некроза опухоли , основного фактора патогенеза при СТШ [7]. Рамки настоящей статьи не позволяют нам привести все имеющиеся данные, свидетельствующие в пользу высказанного предположения о небезопасности применения беталактамных антибиотиков при СТШ, вызванного СГА.
Известно, что БГС могут быть как донорами, так и реципиентами в обмене генетическими детерминантами антибиотикоустойчивости с другими стрептококками, а также микроорганизмами более далекими в таксономическом отношении [3]. Кроме того, показано, что маркеры резистентности к антибиотикам у БГС могут включаться в генетические структуры, ответственные за продукцию некоторых факторов вирулентности бактерий, например, гемолизинов стафилококка [11], а способность к продукции бета-лактамаз у энтерококков передается им с плазмидой, ответственной за устойчивость к гентамицину [12].
Все это определяет целесообразность слежения за распространенностью вариантов БГС, устойчивых и к тем антибиотикам, которые не используются широко в терапии заболеваний БГС-этиологии: хлорамфениколу , тетрациклинам, аминогликозидам. Рис. 1 иллюстрирует тенденцию к увеличению числа изолятов БГС, устойчивых к тетрациклину и гентамицину, особенно среди СГА (на 40 и 30%, соответственно), что, по-видимому, связано с наибольшей распространенностью именно СГА-инфекций по сравнению с вызванными стрептококками других серогрупп инфекциями. Число культур БГС, умеренно устойчивых и устойчивых к хлорамфениколу, составило, по нашим данным, около 7%, причем за период наблюдения оно увеличилось на 2-3% (с небольшими колебаниями среди различных серогрупп). Анализ спектра антибиотикорезистентности обнаружил почти трехкратное возрастание числа полирезистентных (к тетрациклину, гентамицину и хлорамфениколу) культур БГС.
Чувствительность СГВ к большинству антибиотиков ниже, чем у СГА, СГС и СГG, которые незначительно различаются по этому признаку. МПК и МБК беталактамных антибиотиков для СГВ в 5-10 раз выше, что связано, вероятно, с наличием у этих микроорганизмов полисахаридной капсулы и с более низкой скоростью гибели клеток. По нашим данным, наиболее активными в отношении СГВ являются эритромицин (хотя и встречаются резистентные клоны), линкомицин, ампициллин, гликопептидные антибиотики . Среди СГВ наблюдается самый высокий по сравнению с остальными БГС, процент штаммов, устойчивых к хлорамфениколу, тетрациклину и гентамицину, встречаются штаммы с пониженной чувствительностью к оксациллину [2].
Среди 18 видов и 8 родственных групп бактерий, причисленных к важнейшим патогенам человека, особую роль играют стрептококки. По медицинской значимости они занимают второе место после стафилококков. Из числа стрептококков, патогенных для человека, с середины 80-х гг. ХХ столетия во многих странах мира наблюдается рост заболеваемости, обусловленной β-гемолитическими стрептококками группы А (БГСА, S.pyogenes).
β-гемолитический стрептококк группы А (пиогенный стрептококк, БГСА S.pyogenes) - грамположительный, неспорообразующий, неподвижный микроорганизм. Растёт на кровяном агаре, обладает выраженной гемолитической активностью, каталазанегативный, чувствителен к бацитрацину. Встречается повсеместно, часто колонизирует кожные покровы и слизистые оболочки человека. Главными путями передачи являются воздушно-капельный, контактный и пищевой. Патогенез заболеваний связан с продукцией токсинов: гемолизин, стрептолизин, стрептокиназы А и В, дезоксирибонуклеаза, гиалуронидаза. Основные нозоформы представлены поверхностными (ангины, фарингит, импетиго, рожа), инвазивными (некротизирующий фасциит, миозит, менингит, эндокардит, пневмония, послеродовой сепсис) и токсин-опосредованными инфекциями (скарлатина, синдром токсического шока). Со стрептококковой инфекцией связано также возникновение неврологических расстройств у детей, проявляющихся обсессивно-компульсивными расстройствами (PANDAS-синдром).
Streptococcus pyogenes сохраняет 100% чувствительность к β-лактамным антибиотикам (пенициллинам, цефалоспоринам, карбапенемам). Они остаются единственным классом антибиотиков, к которым у S.pyogenes не развилась резистентность. Актуальной проблемой является устойчивость к макролидам, которая в некоторых регионах мира превышает 30%. Многоцентровое исследование резистентности клинических штаммов S.pyogenes, проведённое в 2000-2001 гг., позволило изучить распространенность устойчивости, прежде всего к макролидам, в различных регионах России. Частота резистентности к эритромицину варьировала и достигала 11,4%, при этом не было обнаружено штаммов, устойчивых к телитромицину, представителю нового класса антибиотиков - кетолидов. Почти в 90% случаев резистентность к макролидам была обусловлена метилированием рибосом, в остальных случаях она была связана с активным выведением (эффлюксом) антибиотика из клетки.
Стрептококковый тонзиллофарингит
Стрептококковый тонзиллофарингит (ангина) - острое общее инфекционное заболевание с преимущественным поражением лимфоидного аппарата и слизистой оболочки глотки, вызванное БГСА. Под рецидивирующим стрептококковым тонзиллофарингитом следует понимать множественные эпизоды заболевания в течение нескольких месяцев с положительными результатами бактериологических и/или экспресс-методов диагностики БГСА, отрицательными результатами исследований между эпизодами заболевания, повышением титров противострептококковых антител после каждого случая болезни.
Этиология: среди бактериальных возбудителей острого тонзиллофарингита наибольшее значение имеет БГСА.
Эпидемиология. В США ежегодно диагностируется 1-1,4 млн. случаев тонзиллофарингита БГСА-этиологии. Передача осуществляется воздушно-капельным, контактным и пищевым путями. Источниками инфекции являются больные, реже - бессимптомные носители. Вероятность заражения увеличивается при высокой обсемененности и тесном контакте. БГСА может вызывать крупные вспышки тонзиллофарингита в организованных коллективах. Чаще болеют дети в возрасте 5-15 лет. Наибольшая заболеваемость - в зимне-весенний период.
Клиническая картина: Инкубационный период составляет от нескольких часов до 2-4 дней. Характерно острое начало с повышения температуры тела до 37,5-39°С, выражена общая интоксикация. Боль в горле бывает так сильно выражена, что у больного нарушается глотание. При осмотре выявляется покраснение нёбных дужек, язычка и задней стенки глотки. Миндалины гиперемированы, отёчны, часто с гнойным налётом желтовато-белого цвета. Налёт рыхлый, пористый, легко удаляется шпателем с поверхности миндалин без кровоточащего дефекта. У всех больных отмечается регионарный лимфаденит.
Кровь: лейкоцитоз, сдвиг лейкоцитарной формулы влево, увеличение СОЭ, появление С-реактивного белка.
Длительность периода разгара (без лечения) составляет 5-7 дней. В дальнейшем, при отсутствии осложнений, основные клинические проявления болезни быстро исчезают.
Осложнения. Особую опасность представляют осложнения стрептококкового тонзиллофарингита, которые делятся на:
- ранние (гнойные), развивающиеся на 4-6-й день от начала заболевания,- отит, синусит, мастоидит, паратонзиллярный абсцесс, шейный лимфаденит, менингит, бактериемия, эндокардит, пневмония;
- поздние (негнойные): постстрептококковый гломерулонефрит, токсический шок, развивающиеся в стадии реконвалесценции (на 8-10-й день от начала болезни) и острая ревматическая лихорадка, развивающаяся через 2-3 нед после купирования симптомов заболевания - опасные, часто приводящие к инвалидизации заболевания.
Диагностика. Чрезвычайно важно своевременно установить этиологию тонзиллофарингита, поскольку, за редким исключением, только ангина стрептококковой этиологии требует антибактериальной терапии. Диагностика включает микробиологическое исследование мазка с поверхности миндалин и/или задней стенки глотки. За рубежом широкое распространение получили методы экспресс-диагностики, основанные на прямом выявлении стрептококкового антигена в мазках с поверхности миндалин и/или задней стенки глотки. Современные тестовые системы позволяют получать результат через 15-20 мин с высокой специфичностью (95-100%), но меньшей, чем при культуральном исследовании, чувствительностью (60-95%), в связи с чем отрицательный результат экспресс-теста всегда должен подтверждаться культуральным исследованием.
Целью антибиотикотерапии острых стрептококковых ангин является эрадикация БГСА, что ведёт не только к ликвидации симптомов инфекции, но и предупреждает ранние и поздние осложнения, а также предотвращает распространение инфекции.
Выбор антибиотиков. Препаратами I ряда для лечения острого стрептококкового тонзиллита являются пенициллин (феноксиметилпенициллин), аминопенициллины и оральные цефалоспорины. У пациентов с доказанной аллергией на β-лактамные антибиотики следует применять макролиды, а при непереносимости последних - линкозамиды.
Носительство БГСА. В среднем около 20% детей школьного возраста являются носителями БГСА в весенне-зимнее время. Учитывая низкий риск развития гнойных и негнойных осложнений, а также незначительную роль в распространении БГСА, хронические носители, как правило, не нуждаются в антибактериальной терапии.
Острая ревматическая лихорадка
Острая ревматическая лихорадка (ОРЛ) может возникать как после тонзиллофарингита с типичной клинической картиной, так и после перенесённой бессимптомной или малосимптомной инфекции. ОРЛ возникает только после инфекций глотки, и никогда после инфекций кожи и мягких тканей. Предположительное объяснение этого феномена состоит в различии иммунного ответа на кожную и глоточную инфекцию и в отсутствии ревматогенного потенциала у штаммов, вызывающих кожные инфекции. Риск развития ОРЛ после нелеченного тонзиллофарингита составляет 1%. К ревматогенным М-серотипам стрептококка относятся 1, 3, 5, 6, 18, 19, 24.
В настоящее время в развитых странах острая ревматическая лихорадка встречается с частотой 0,5 на 100000 детей школьного возраста. В развивающихся странах заболеваемость составляет от 100 до 200 на 100000 детей школьного возраста, ежегодно регистрируется от 10 до 15 млн. новых случаев ОРЛ, которая является основной причиной смерти от сердечно-сосудистой патологии.
Следует отметить, что немотивированная задержка восстановления трудоспособности, слабость, нестойкий субфебрилитет, артралгии, сердцебиение и нерезко повышенная СОЭ, сохраняющиеся после перенесенной ангины, в сочетании с ростом титров противострептококковых антител (антистрептолизин О, антистрептокиназа, антистрептогиалуронидаза, анти-ДНКаза В) могут свидетельствовать о дебюте острой ревматической лихорадки.
В соответствии с рекомендациями ВОЗ для диагностики острой ревматической лихорадки в качестве международных применяются критерии Джонса, пересмотренные Американской кардиологической ассоциацией в 1992 г. (см. табл.). Наличие двух больших критериев или одного большого и двух малых в сочетании с данными, документированно подтверждающими предшествующую БГСА-инфекцию, свидетельствует о высокой вероятности ОРЛ. Однако ни один диагностический критерий не является строго специфичным для ОРЛ, поэтому трудности в раннем распознавании заболевания и дифференциальной диагностике с другими нозологиями сохраняются по-прежнему.
Критерии Джонса, применяемые для диагностики первой атаки ревматической лихорадки (по состоянию на 1992 г.)
С открытием антибиотиков, обладающих избирательным действием на микробы in vivo, могло показаться, что наступила эпоха окончательной победы человека над инфекционными болезнями. Но уже вскоре было обнаружено явление резистентности отдельных штаммов микробов к губительному действию антибиотиков.
Устойчивость микроорганизмов к действию антибиотиков вызвана несколькими причинами. Во-первых, в любой совокупности микроорганизмов, встречаются естественно устойчивые к антибиотикам варианты. При воздействии антибиотика на популяцию основная масса клеток гибнет (если антибиотик обладает бактерицидным действием) или прекращает развитие (если антибиотик обладает бактериостатическим действием). В то же самое время устойчивые к антибиотику клетки продолжают размножаться. Устойчивость к антибиотику этими клетками может передаваться по наследству, давая начало новой устойчивой к антибиотику популяции. В данном случае происходит селекция устойчивых вариантов с помощью антибиотика. Во-вторых, у чувствительных к антибиотику микроорганизмов может идти процесс адаптации к вредному воздействию антибиотического вещества. В этом случае может наблюдаться, с одной стороны, замена одних звеньев обмена веществ микроорганизма, естественный ход которых нарушается антибиотиком, другими звеньями, не подверженными действию препарата, при этом микроорганизм также не будет подавляться антибиотиком. С другой стороны микроорганизмы могут начать усиленно вырабатывать вещества, разрушающие молекулу антибиотика, тем самым нейтрализуя его действие. Таким образом, антибиотикоустойчивость микроорганизмов является свойством, которое передается по наследству, а значит, зависит от генотипа и его устойчивости.
Разные штаммы и виды микроорганизмов отличаются друг от друга своей природной устойчивостью к антибиотикам. Немаловажное значение при подборе культур молочнокислых бактерий, отбираемых в состав заквасок для производства биопродуктов и биологически активных добавок, обладающих лечебно-профилактическим и функциональным действием, особое значение придается такому свойству как устойчивость к антибиотикам. Из литературных источников известно, что совместное применение антибиотиков и антибиотикоустойчивых штаммов молочнокислых бактерий способствует эффективному восстановлению нормальной микрофлоры кишечника человека уже в процессе антибиотикотерапии. Также современными достижениями генетики установлено, что мезофильные стрептококки содержат от 3 до 7 плазмид, которые кодируют такие свойства, как продуцирование антибиотических веществ и сохранение устойчивости к антибиотикам [1] .
Целью работы являлось исследование устойчивости молочнокислых стрептококков к антибиотикам разных поколений и спектров действий, к амоксициллину, ампициллину, тетрациклину, левомицетину, нитроксолину и ципролету. Оценку чувствительности бактерий к антибиотикам проводили по терапевтическому индексу, который характеризуется концентрацией различных антибиотиков в крови при введении терапевтических препаратов.
Из большого разнообразия микроорганизмов, представленных на Российском рынке, для исследований были выбраны семь бактериальных концентратов биофабрик г. Барнаула и Углича. В состав бактериальных концентратов входили сливочный, молочный, ароматобразующий и термофильный стрептококки.
В результате исследований было установлено, что наиболее устойчивыми к антибиотикам оказались бактериальные концентраты, в состав которых входили следующие молочнокислые стрептококки:
1. Lactococcus lactis subsp. сremoris – устойчив к 5 из 6 антибиотиков, неустойчив к ампициллину.
2. Lactococcus lactis subsp. lactis; Lactococcus lactis subsp. cremoris; Lactococcus lactis subsp. diacetilactis – устойчив к 4 из 6 антибиотиков, неустойчив к амоксициллину и нитроксолину.
3. Lactococcus lactis subsp. lactis; Lactococcus lactis subsp. cremoris; Lactococcus lactis subsp. diacetilactis; Streptococcus salivarius subsp. thermophilus – устойчив к 4 из 6 антибиотиков, неустойчив к ципролету и ампициллину.

Основными возбудителями хронического тонзиллита и фарингита являются Streptococcus pneumoniae и Staphylococcus aureus, распространенность которых составляет 70-75% [4]. Среди прочих возбудителей выделяют Haemophilus influenzae, Streptococcus pyogenes, Moraxella catarrhalis, Streptococcus viridans и др. В последнее время также часто встречаются случаи фарингомикоза, обусловленные Candida albicans.
Этиотропным методом лечения хронических заболеваний верхних дыхательных путей является системная антибиотикотерапия, которая базируется на знании типичных возбудителей или на тестировании чувствительности культуры конкретных микроорганизмов, выделенных из очага поражения. Растущая в последние годы резистентность этих микроорганизмов ко многим основным антибиотикам является главной проблемой в рациональной антибиотикотерапии бактериальных инфекций. Сейчас почти 10% штаммов этих возбудителей в России не чувствительны к пенициллину и его производным, антибиотикам цефалоспоринового ряда первого и второго поколения [5; 8].
Применяемые в терапии антимикробные препараты могут вызвать иммунодепрессивное и аллергизирующее действие, подавлять репаративные процессы, а также могут привести к появлению устойчивых к антибиотикам штаммов. Поэтому проблема лечения гнойно-воспалительных заболеваний ЛОР органов все еще остается актуальной.
Целью работы явился анализ чувствительности микроорганизмов, выделенных от больных с хроническими заболеваниями верхних дыхательных путей, к противомикробным препаратам для разработки методов рациональной антибиотикотерапии при данной патологии.
Материалы и методы. Были обследованы 50 больных (35 женщин и 15 мужчин), из них с хроническим фарингитом — 25 человек, с хроническим тонзиллитом - 15, с фарингомикозом - 10. Изучение спектра микроорганизмов и антибиотикочувствительность проводили с использованием классических бактериологических методов исследования. Мазки из зева брали с помощью стерильных ватных тампонов в асептических условиях до назначения антибактериальной терапии. После взятия биоматериала тампоны помещали в полужидкие транспортные среды Amies, после чего материал сразу же отправляли на исследование в бактериологическую лабораторию. Для выделения бактериальной микрофлоры посевы производили на желточно-солевой агар, кровяной агар, на среду Эндо и для выделения патогенных грибов - на среду Сабуро.
Результаты исследования
Основными возбудителями хронического фарингита, тонзиллита и фарингомикоза в 40% случаев явились стрептококки (S. pneumoniae - 26%, S. pyogenes A - 8%, S. intermedius - 6%), в 60% - стафилококки (S. aureus - 41%, коагулазонегативные стафилококки S. epidermidis - 19%). При микологическом исследовании материала у больных фарингомикозом наряду с выше указанными возбудителями в 100% случаев были выделены Candida albicans.
Основными возбудителями хронического фарингита в 50% случаев являются стрептококки и стафилококки, а хронического тонзиллита — стрептококки (в 30%) и стафилококки (в 70%).
Как показал анализ антибиотикограмм (рис. 1), у больных с хроническим фарингитом стафилококки в 80-84% случаев были наиболее чувствительны к меропенему, фузидину и канамицину, в 72-76% наблюдений - к цефалотину, цефазолину и гентамицину, в 64-68% случаев - к цефалексину, цефуроксиму, цефаклору и эритромицину. Наименьшая чувствительность (в 16-36% случаев) выявлена к бензилпенициллину, оксациллину, линкомицину, ванкомицину, ципрофлоксацину и рифампицину.
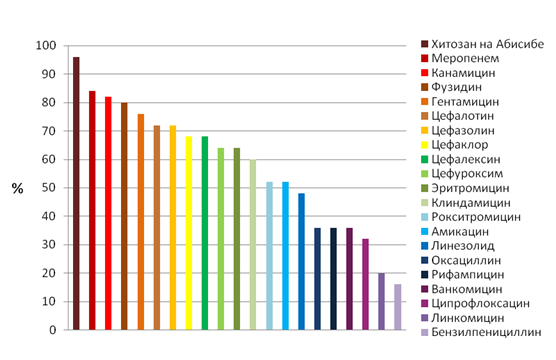
Рис. 1. Чувствительность стафилококков к антибиотикам при хроническом фарингите
Стрептококки, выделенные от пациентов с хроническим фарингитом, оказались чувствительны в 80-90% к гентамицину, стрептомицину, меропенему, а наименьшая чувствительность выявлена в 20-40% случаев к бензилпенициллину, ампициллину, эритромицину, тетрациклину (рис. 2).
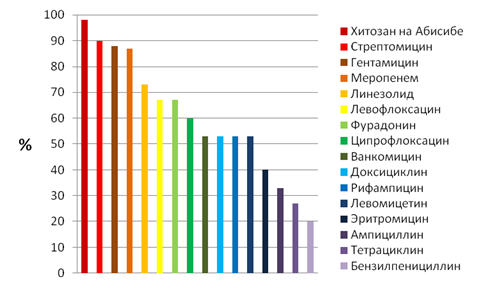
Рис. 2. Чувствительность стрептококков к антибиотикам при хроническом фарингите
Антибиотикограмма у больных с хроническим тонзиллитом показала, что стафилококки в 90-100% случаев были наиболее чувствительны к меропенему, гентамицину и канамицину, а в 8-36% случаев выявлена минимальная чувствительность к бензилпенициллину, оксациллину и линкомицину (рис. 3).
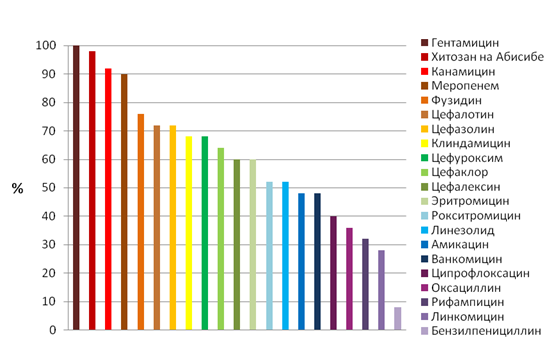
Рис. 3. Чувствительность стафилококков к антибиотикам при хроническом тонзиллите
Стрептококки оказались чувствительны в 80-97% к гентамицину, стрептомицину, линезолиду и меропенему, а в 50% и менее случаев выявлена чувствительность к бензилпенициллину, левомицетину, эритромицину, тетрациклину (рис. 4).
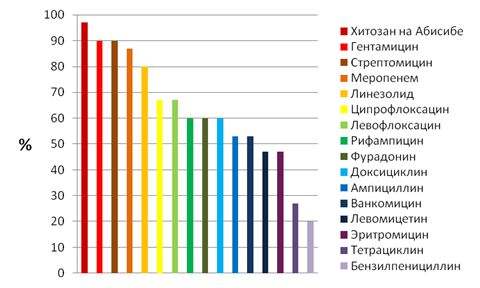
Рис. 4. Чувствительность стрептококков к антибиотикам при хроническом тонзиллите
При фарингомикозе дрожжевые грибы рода Candida оказались чувствительны только к амфотерицину В, нистатину и клотримазолу, а к флуконазолу, интраконазолу и кетоназолу установлена абсолютная резистентность (рис. 5).
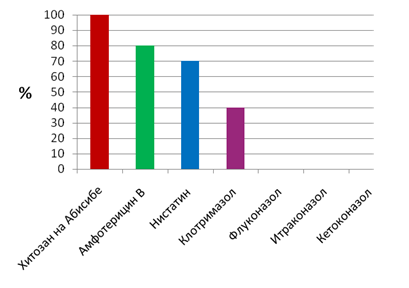
Рис. 5. Чувствительность кандид к противогрибковым препаратам при фарингомикозе
На основании проведенных исследований показано, что при хроническом фарингите, тонзиллите и фарингомикозе выявлена высокая чувствительность выделенных стафилококков (96-98%), стрептококков (97-98%) и дрожжевых грибов рода Candida (100%) к хитозану на Абисибе (рис. 1-5).
Заключение
Основными возбудителями хронических заболеваний верхних дыхательных путей являются стрептококки (S. pneumoniae - 26%, S. pyogenes A - 8%, S. intermedius - 6%), стафилококки (S. aureus - 41%, коагулазонегативные стафилококки S. epidermidis — 19%), а также дрожжевые грибы рода Candida. Большинство возбудителей проявляют высокую резистентность к антибактериальным препаратам широкого спектра действия, таким как бензилпенициллин и оксациллин.
На основании проведенных исследований для лечения пациентов с хроническим тонзиллитом и фарингитом можно рекомендовать следующие антибиотики: меропенем, гентамицин, канамицин, фузидин, стрептомицин, цефалотин, цефазолин, цефалексин, цефуроксим, цефаклор, линезолид. Наибольшей фунгицидной активностью обладали амфотерицин В, нистатин, клотримазол.
Наряду с антимикробными препаратами необходимо уделить внимание препарату природного происхождения - хитозану на Абисибе, к которому чувствительны 96-100% всех выделенных патогенных микроорганизмов, включая Candida albicans. На основании полученных результатов этот противомикробный препарат может быть рекомендован при хронических заболеваниях верхних дыхательных путей.
Рецензенты:
Демидова М.А., д.м.н., профессор, зав. кафедрой управления и экономики фармации Тверской ГМА, г. Тверь;
Портенко Г.М. д.м.н., профессор, зав. кафедрой оториноларингологии Тверской ГМА, г. Тверь.
Степаненко И.С. 1 , Костина Ю.А. 2 , Батаршева А.А. 3 , Сластников Е.Д. 4
ИССЛЕДОВАНИЕ ЧУВСТВИТЕЛЬНОСТИ STREPTOCOCCUS PYOGENES, ВЫДЕЛЕННЫХ ИЗ ЗЕВА, К ТРАДИЦИОННЫМ АНТИБИОТИКАМ
Аннотация
Ключевые слова: Streptococcus pyogenes, гемолитические штаммы Streptococcus spp., чувствительность к антибиотикам.
Stepanenko I.S. 1 , Kostina Yu.A. 2 , Batarsheva A.A. 3 , Slastnikov E.D. 4
1 ORCID: 0000-0001-5793-438Х, MD, Associate Professor, 2 ORCID: 0000-0002-7825-7856, MD, Associate Professor, 3 ORCID: 0000-0001-7604-0680, Postgraduate Student, 4 ORCID: 0000-0003-2843-8672, Student, FSBEI of Higher Education “Ogarev Mordovia State University” in Saransk
RESEARCH OF SENSITIVITY OF STREPTOCOCCUS PYOGENES EGESTED FROM OROPHARYNX TO TRADITIONAL ANTIBIOTICS
Abstract
The study involved 350 students of the Medical Institute at the age of 22-24 years old without signs of acute infectious diseases of the upper respiratory tract. 19 β-hemolytic strains were identified as Streptococcus spp. Final identification and sensitivity of S. pyogenes to 13 antimicrobials was examined using the bacteriological analyser “Magellan diagnostics” (UK) and evaluated according to the EUCAST recommendations. Investigated strains of S.pyogenes showed sensitivity to levofloxacin, linezolid, vancomycin, amoxicillin/clavulanate, clindamycin, meropenem, tetracycline, cefepime, cefotaxime, ceftriaxone and chloramphenicol. Resistance of the isolated strains was noted for azithromycin and erythromycin. The results of the study indicate the necessity to limit the use of these drugs in the treatment of infections caused by pyogenic streptococci.
Keywords: Streptococcus pyogenes, hemolytic strains of Streptococcus spp., sensitivity to antibiotics.
С 1929 г. после открытия А.Флемингом пенициллина, а затем и других антимикробных препаратов, избирательно воздействующих на микробы in vivo, казалось, что человечество, наконец, может справиться со всеми инфекционными болезнями. Но уже начиная с 70-х годов этого же столетия, мы столкнулись с огромной проблемой – явление резистентности отдельных штаммов микроорганизмов к действию антибиотиков [1, С. 5]. Микроорганизмы приобретают устойчивость к действию антибиотиков по несколькими причинами. В любой совокупности микроорганизмов, встречается изначально или врожденно устойчивые к антимикробным препаратам варианты. При воздействии бактерицидных антибиотиков на микроорганизмы основная масса клеток гибнет или, при воздействии бактериостатических препаратов, прекращает свой рост и размножение, но в это время устойчивые к антибиотику микробы продолжают размножаться. Резистентность к антибиотикам может передаваться микроорганизмами как вертикально, так и горизонтально, давая начало новой устойчивой к антибиотику популяции. У чувствительных к антибиотику микроорганизмов может развиваться приобретенная устойчивость к воздействию антимикробного препарата. И в результате генетической изменчивости, а в частности, мутаций, наблюдается замена одних звеньев обмена веществ микроорганизма, естественный ход которых нарушается антибиотиком, другими звеньями, не подверженными действию препарата, при этом микроорганизм также не будет чувствителен к антибиотику. Механизмов приобретенной резистентности, которыми обладают микробы несколько. Это так же выработка веществ, разрушающих молекулу антибиотика, тем самым нейтрализуя его действие. Таким образом, антибиотикорезистентность микроорганизмов является свойством, которое может приобретаться и передаваться по наследству, а значит, зависит от генотипа и его устойчивости. Разные штаммы и виды микроорганизмов отличаются друг от друга своей устойчивостью к антибиотикам [2, С. 12].
Стрептококки – это большая группа условно-патогенных кокков и заболевания, вызываемые различными видами этого рода, описаны задолго до выявления и идентификации этих микроорганизмов. Т. Бильротом в 1874 г. стрептококки впервые были обнаружены в тканях человека при рожистом воспалении, раневых инфекциях и описаны [3, С. 57].
Streptococcus pyogenes классифицируется как β-гемолитический стрептококк серогруппы А. Этот вид довольно часто является возбудителей бактериальных инфекций человека. S. pyogenes вызывает тонзиллофарингиты, скарлатину, импетиго, рожистое воспаление, флегмоны, некротизирующий фасцит, миозит, артрит, синдром токсического шока [4, С. 1]. Осложнениям некоторых инфекций, при не рациональной антибиотикотерапии и длительном носительстве, являются острая ревматическая лихорадка и гломерулонефрит, связанные с наличием у S. рyogenes перекрестно-реагирующих антигенов с клетками суставов, миокарда и почек [5, С. 205]. В последние десятилетие наблюдается изменение эпидемиологии стрептококковых инфекций и рост заболеваемости тяжелыми инфекциями (некротизирующий фасцит, синдром токсического шока), а так же отмечается появление и распространение штаммов пиогенного стрептококка, резистентных к макролидам, линкозамидам, тетрациклинам [6, С. 12], [7, С. 1]. Поэтому, принимая во внимание, что структура заболеваемости и резистентности S. рyogenes к антимикробным препаратам значительно варьирует в различных регионах РФ, целесообразно проведение мониторинга антибиотикочувствительности представителей данного вида.
Слизистые верхних дыхательных путей человека являются поставщиком микроорганизмов для замкнутых помещений, в том числе и медицинских учреждений. Медицинские работники, чья профессиональная деятельность связана с длительным нахождением в условиях стационара, могут стать источником развития внутрибольничных заболеваний в медицинских учреждениях различного профиля, обусловленных условно-патогенными микроорганизмами [2, С. 12].
Результаты исследования. В ходе исследования отделяемого зева 350 студентов, без острых респираторных заболеваний, был выделен 41 штамм (рис. 1), образующий гемолиз на кровяном агаре.
Из них, как Streptococcus spp. были идентифицированы 19 штаммов (рис. 2). 11 штаммов из 19 после конечной верификации были идентифицированы как S.pyogenes, 3 – S.dys.ss equisimilis, 5 – S.agalactia (рис. 3).

Рис. 1 – Выделение гемолитических штаммов микроорганизмов из зева, (%)

Рис. 2 – Выделение штаммов Streptococcus spp. из зева, (%)

Рис. 3 – Выделение видов Streptococcus spp. из зева, (%)
Чувствительность выделенных штаммов изучали к 13 традиционно применяемым для исследования S.pyogenes антимикробным препаратам: азитромицин, амоксициллин/клавулановая кислота, ванкомицин, клиндамицин, левофлоксацин, линезолид, меропенем, тетрациклин, хлорамфеникол, цефепим, цефотаксим, цефтриаксон, эритромицин. Согласно пограничным значениям EUCAST (версия 4.0) [9, С. 66] чувствительность стрептококков групп A к пенициллинам и карбапенемам оценивается на основании их чувствительности к бензилпенициллину и пограничные значения минимальной подавляющей концентрации (МПК) составляют 0,25 мг/л. Исходя из этого, выделенные штаммы S.pyogenes оказались чувствительны к амоксициллин/клавуланату, цефепиму, цефотаксиму, цефтриаксону и меропенему, так как МПК этих соединений составили 0,12 и 0,25 мг/л (см. таблицу 1). Пограничные значения МПК для фторхинолонов (EUCAST, версия 4.0) [9, С. 68] составляют для чувствительных штаммов ≤1 мг/л, для резистентных – >2 мг/л. МПК к левофлоксацину для выделенных штаммов составила 0,5 мг/л, то есть все штаммы S.pyogenes чувствительны к левофлоксацину. Пограничные значения МПК для гликопептидов составляют 2 мг/л (EUCAST, версия 4.0) [9, С. 69]. Выделенные штаммы пиогенного стрептококка оказались чувствительны к ванкомицину, так как МПК составили от 0,12 мг/л до 2 мг/л. Согласно EUCAST (версия 4.0) [9, С. 69] пограничные МПК для азитромицина и эритромицина составляют для чувствительных штаммов ≤0,25 мг/л, для резистентных – >0,5 мг/л. Пять штаммов изученных стрептококков проявили устойчивость к эритромицину и 3 штамма – к азитромицину. Все штамма стрептококков оказались чувствительны к клиндамицину, так как пограничные МПК составили от 0,12 мг/л до 0,5 мг/л и соответствуют требованиям EUCAST (версия 4.0) [9, С. 69], которые для чувствительных штаммов ≤0,5 мг/л, для резистентных – >0,5 мг/л.
Таблица 1 – Антибиотикочувствительность штаммов S.pyogenes
| Антибиотик | Штаммы | МПК мг/л | ||||||
| 0,12 | 0,25 | 0,5 | 1 | 2 | 4 | 8 | ||
| Азитромицин | 11 | 8 | 2 | 1 | ||||
| Амоксициллин/ Клавулановая кислота | 11 | 8 | 3 | |||||
| Ванкомицин | 11 | 4 | 4 | 2 | ||||
| Клиндамицин | 11 | 4 | 2 | 5 | ||||
| Левофлоксацин | 11 | 11 | ||||||
| Линезолид | 11 | 3 | 1 | 7 | ||||
| Меропенем | 11 | 4 | 7 | |||||
| Тетрациклин | 11 | 1 | 10 | |||||
| Хлорамфеникол | 11 | 5 | 4 | 2 | ||||
| Цефепим | 11 | 8 | 3 | |||||
| Цефотаксим | 11 | 8 | 3 | |||||
| Цефтриаксон | 11 | 8 | 3 | |||||
| Эритромицин | 11 | 6 | 5 | |||||
Выделенные штаммы S.pyogenes проявили чувствительность к тетрациклину, МПК составили не более 1 мг/л (пограничные значения согласно EUCAST [9, С. 70] – для чувствительных штаммов ≤1 мг/л, для резистентных – >2 мг/л), оказались чувствительны к линезолиду, так как МПК составили не более 2 мг/л (пограничные значения согласно EUCAST [9, С. 70] – для чувствительных штаммов ≤2 мг/л, для резистентных – >4 мг/л) и к хлорамфениколу – МПК к которому не превысили 4 мг/л (пограничные значения согласно EUCAST [9, С. 70] – для чувствительных штаммов ≤8 мг/л, для резистентных – >8 мг/л).
Выводы. Полученные данные о частоте носительства условно-патогенных стрептококков (5%) в зеве молодых людей, участвующих в исследовании, которое не ведет к формированию острых патологических процессов в зеве, не требует активной эрадикации стрептококков и свидетельствует о динамическом равновесии биоценоза. Выделенные штаммы S.pyogenes оказались чувствительными к левофлоксацину, линезолиду, ванкомицину, хлорамфениколу, амоксициллин/клавуланату, клиндамицину, меропенему, тетрациклину, цефепиму, цефотаксиму, цефтриаксону. Выявленная резистентность к азитромицину и эритромицину свидетельствует о необходимости ограничения использования данных препаратов для лечения инфекций, вызванных пиогенными стрептококками.
Список литературы / References
Список литературы на английском языке / References in English
Читайте также:


