Патологическая морфология пастереллеза птиц
Пастереллез (геморрагическая септицемия) – инфекционная болезнь многих видов сельскохозяйственных и диких животных, в том числе птиц, характеризующаяся явлениями септицемии и воспалительно-геморрагическими процессами во внутренних органах, на серозных и слизистых оболочках.
Впервые возбудителя холеры кур в чистой культуре выделил Л. Пастер в 1880 г. Название Pasteurella возбудителю присвоено в честь ученого в 1910 г.
По современной классификации пастереллы объединены в секцию 5, семейство Pasteurellaceae, в котором один род Pasteurella. Род представлен шестью видами. Основные возбудители болезни – Pasteurella multocida и Pasteurella gemolytica.
Морфология. P. multocida в мазках-отпечатках из крови и органов представляют собой грамотрицательные короткие овоидные палочки (длиной 0,4-1,2мкм и шириной 0,3-0,4мкм). При окраске по Романовскому-Гимзе имеют вид биполяров (интенсивно окрашиваются по полюсам). В мазках из культур пастереллы имеют вид коккоовоидных палочек, располагающихся одиночно, попарно, реже в виде коротких цепочек Неподвижные, образуют слизистые капсулы, спор не образуют.
Культуральные свойства. P. multocida – факультативный анаэроб. Оптимум температуры 37-38 0 С, рН среды 7,2-7,4. Растут в МПБ и на МПА, но лучше, при внесении к ним сыворотки крови, на средах Хоттингера или Мартена. На МПА (S-формы) образуют мелкие, выпуклые, прозрачные, круглой формы колонии серого цвета, М-формы – более крупные слизистые колонии с непрозрачным центром; R-формы – шероховатые непрозрачные колонии. В косопроходящем свете колонии S-формы флюоресцируют, что связано с капсулообразованием; в МПБ – слабое равномерное помутнение среды и образование на дне пробирки слизистого осадка, поднимающегося при встряхивании в виде характерной косички. М-формы растут более интенсивно и дают более выраженный слизистый осадок. R-формы образуют хлопьевидный или зернистый осадок.
Пастереллы ферментируют с образованием кислоты глюкозу, сахарозу, маннит, сорбит, не ферментируют лактозу, дульцит, аденит. Образуют индол, не разжижают желатин, на кровяном агаре не вызывают гемолиза, проба на каталазу положительная.
Антигенная структура. P. multocida имеет К-(капсульный) и О-(соматический) антигены. К-антигены разделены на четыре серологических типа: А, В, D и Е.
P. multocida серовара А (по Картеру) преимущественно поражает птиц, реже крупный рогатый скот и свиней, серовара В и Е вызывают острое заболевание домашних и диких животных, протекающее в виде геморрагической септицемии, серовар D встречается у всех видов животных.
Устойчивость. В окружающей среде невысокая. При 58 0 С погибают за 20 минут, при 90 0 С – за 10 минут, при кипячении – моментально. Выдерживают замораживание до – 70 0 С. При высушивании на открытом воздухе гибнут за 2-3 суток. В почве выживают до 12 суток, в навозе – 14 суток, птичьем помете – до 72 суток, в гниющих трупах — до 3 месяцев, в зерне – до 44 суток. Дезинфицирующие растворы в принятых концентрациях (раствор, содержащий 5 % активного хлора, 3 % растворы формальдегида и гидроксида натрия) убивают пастерелл в течение 10 минут.
Патогенность. Патогенные и вирулентные свойства пастерелл варьируют и наиболее сильно выражены у животных того вида, от которого они выделены. Эпизоотические штаммы высоковирулентны для белых мышей и кроликов. Установлена корреляция между вирулентностью, капсуло- и токсинообразованием. Наибольшей вирулентностью обладают свежевыделенные культуры. В лабораторных условиях при хранении культур вирулентность пастерелл резко снижается.
Патогенез. При остром течении болезни пастереллы быстро размножаются, проникают в кровеносную и лимфатическую системы, вызывая септицемию. За счет образования эндотоксинов и других агрессивных субстанций повреждаются стенки сосудов, они становятся проницаемы для плазмы, клеточных элементов, развивается геморрагический диатез, появляются отеки подкожной и межмышечной клетчатки. В результате нарушения кровообращения наступает некроз тканей.
Эпизоотологические данные. К пастереллезу наиболее восприимчив крупный рогатый скот (молодняк), куры, гуси, утки. Определенную устойчивость к пастереллезу имеют лошади и плотоядные. Пастереллы имеют широкую экологическую амплитуду, способны нормально развиваться в разнообразных условиях окружающей среды. В природе среди животных и птиц установлено широкое и длительное пастереллоносительство.
Источник возбудителя – больные и переболевшие животные (птица), выделяющие возбудителя с истечениями из носа, испражнениями. К заболеванию пастереллезом приводит ослабление резистентности организма под влиянием неблагоприятных факторов (неудовлетворительные условия содержания и кормления, стрессы). Основные пути заражения – аэрогенный и алиментарный. Пастереллез относится к респираторной инфекции.
Эпизоотические вспышки пастереллеза с острым проявлением болезни по типу геморрагической септицемии у крупного рогатого скота и диких жвачных в условиях СНГ обычно вызывает P. multocida типа В, у кур и индеек – P. multocida типа А. Спорадическую заболеваемость пастереллезом (подострое и хроническое течение болезни по типу энзоотической пневмонии) чаще вызывают у телят P. multocida типа А и Р- haemolytica; у свиней – P. multocida типов А и D и P. haemolytica.
Предубойная диагностика. При остром течении пастереллеза отмечают резкое повышение температуры, угнетенное состояние, конъюнктивит, опухание языка, затрудненное дыхание, кашель, отеки. Если поражен кишечник, то наблюдается понос, жажда от потери воды, прогрессирующее исхудание, бледность слизистых оболочек, упадок сил, вялость.
Послеубойная диагностика. Сверхострое (молниеносное) течение пастереллеза изменений в органах, как правило, не вызывает; острое – дает многочисленные кровоизлияния на отечной, слизистой оболочке дыхательных путей, под плеврой, брюшиной, эпикардом, в сердечной мышце, в подкожной клетчатке и паренхиматозных органах. В межчелюстном пространстве – студенистый инфильтрат. Лимфатические узлы головы, шеи, грудной полости, кишечника увеличены, гиперемированы. Селезенка без изменений. Печень увеличена, под капсулой видны некротические узелки. Легкие кровенаполнены, также с очажками некроза. Почки наполнены кровью, под капсулой – точечные кровоизлияния. Слизистая оболочка кишечника воспалена, с точечными или полосчатыми кровоизлияниями. При подостром течении эпикард усеян кровоизлияниями, в сердечной сумке скапливается экссудат, при хроническом течении имеет место гнойно-фибринозное воспаление дыхательных путей, очаговое воспаление легких, плеврит фибринозный перикардит, отложение хлопьев фибрина на легочной и костальной плевре. Легкие могут приобретать мраморный вид.
Для подтверждения диагноза необходимы лабораторные исследования: из патологического материала паренхиматозных органов и лимфоузлов делают мазки-отпечатки, окрашивают их методом Романовского-Гимзе и проводят бактериоскопию. Делают посев эмульсии из взятого материала на мясопептонный бульон и пластинчатый агар, ставят биопробу на белых мышах или кроликах.
Лабораторный диагноз. Для выделения пастерелл используют только свежий патологический материал от нескольких трупов больных животных. Для первичного выделения и культивирования пастерелл пригодны только обогащенные питательные среды, в том числе МПА, с 5-10 % крови барана или лошади или сывороточный МПБ. Посевы из внутренних органов (кровь, печень, селезенка, легкие, трубчатая кость, головной мозг) и из мест поражения (лимфатические узлы, отечная ткань и др.) инкубируют в термостате при 37 0 С в течение 24-48 ч. Из патологического материала готовят мазки и окрашивают по Граму, Романовскому-Гимзе или синькой Леффлера.
Вирулентность выделенной культуры определяют путем постановки биологической пробы. Белых мышей или кроликов заражают культурой пастерелл, выделенной от крупного рогатого скота, свиней, овец, птиц (голубей, кур, уток). Белых мышей и кроликов заражают подкожно в дозе 0,2-0,5 мл суточной культурой пастерелл; голубей и 90-120 суточных цыплят – бульонной культурой в дозе 0,5 мл внутримышечно. Кроликов перед заражением исследуют на пастереллоносительство. С этой целью в течение трех дней до заражения им закапывают в носовые отверстия по две капли 0,5 % водного раствора бриллиантовой зелени. Появление гнойного истечения свидетельствует о пастереллоносительстве. Этих кроликов не используют в опыте.
Для биопробы применяют также кровь или суспензию из паренхиматозных органов от павших животных. Через 24-48 ч после заражения культурой или исследуемым материалом подопытные животные погибают. На основании морфологии, культурально-биохимических свойств и биопробы ставят диагноз на пастереллез.
Специфическая профилактика. У переболевших животных образуется нестерильный иммунитет. После вакцинации животные (особенно птицы) могут оставаться пастереллоносителями.
Для активной иммунизации применяют видоспецифичные эмульгированные вакцины отдельно для крупного рогатого скота, буйволов и свиней; преципитированную вакцину – для овец и свиней; полужидкую – для крупного рогатого скота и буйволов - ассоциированную вакцину против пастереллеза, сальмонеллеза и диплококковой септицемии – для свиней. Для активной иммунизации птиц применяют инактивированные (эмульгированная для кур и уток, а также эмульсивакцина отдельно для кур, индеек, уток и гусей) и живые ослабленные вакцины (из пастеровского штамма для домашней птицы всех видов и две вакцины из штамма АВ и штамма К разработанной Краснодарской НИВС для водоплавающих птиц).
Для профилактики и лечения больных животных используют гипериммунную сыворотку. Пастереллы высокочувствительны к гентамицину, левомицетину, стрептомицину, тетрациклинам и некоторым сульфаниламидным препаратам.
Ветеринарно-санитарная оценка и мероприятия. При наличии инфильтратов, дистрофических изменений в мускулатуре и внутренних органах, тушу и все субпродукты направляют на утилизацию. Если органолептические показатели нормальны и результаты исследований на сальмонелл отрицательны, то тушу и внутренние органы направляют на изготовление вареных колбас. В случае обнаружения сальмонелл мясо обезвреживают проваркой или направляют на изготовление консервов, мясных хлебов. Внутренние органы утилизируют.
Кровь и кишки больных животных подвергают утилизации, шкуры дезинфицируют 1 % раствором соляной кислоты, разведенным в 20 % растворе поваренной соли в течение 2 суток в местах первичной переработки животных. Сбор эндокринного сырья не разрешается. Категорически запрещен вывоз с производства мяса и субпродуктов в сыром виде.
Молоко больных животных подлежит кипячению и использованию в хозяйстве.
Пастереллез у домашней птицы. Внутренние органы утилизируют, тушки направляют на проварку, прожарку или на переработку в консервы. Пух и перо дезинфицируют.
Помещение убойно-разделочного цеха и инвентарь дезинфицируют горячим 2 % раствором едкого натра или хлорной известью (не менее 1 % активного хлора). Инструментарий в течение 10 минут кипятят в 2 % растворе кальцинированной соды.

Пастереллез (холера) птиц – инфекционная болезнь птиц, вызываемая пастереллами и проявляющаяся при остром течении симптомами септицемии с образованием на серозных и слизистых оболочках множественных кровоизлияний.
Историческая справка. Первым в 1978году открыл возбудителя пастереллеза (холеры) кур русский ученый Е.М. Земмер. В 1880году Л. Пастер выделил и вырастил возбудителя на нейтральном курином бульоне. Свое название Pasteurella получила в честь Пастера в 1910году. Пастереллез встречается во всех странах мира с умеренным и теплым климатом, реже регистрируется в северных странах.
Экономический ущерб значительный и складывается из падежа, вынужденного убоя больной птицы, пастереллоносителей и финансовых затрат на проведение оздоровительных и профилактических мероприятий. Летальность может достигать 50-80%.
Возбудитель болезни. Одни исследователи считают, что пастереллез у всех видов птиц вызывается P. Multicida, другие исследователи считают, что у уток пастереллез вызывает – P. Anatipestifer, у гусей – P. Septicaemiae. В S- форме его выделяют при остром течении болезни, и он наиболее вирулентен. Мукоидные варианты, изолированные при подостром и хроническом течении болезни, отличаются меньшей вирулентностью, а R- варианты, или диссоцианты, обычно авирулентны. Прямая корреляция между морфологией колоний, вирулентнотью и иммуногенностью пастерелл обусловлена капсулой. При исследовании от больных птиц чаще всего выделяют возбудителя, которого относят к серотипу А (по Картеру). Данный возбудитель пастереллеза на скорлупе яиц сохраняется до 7 дней. Возбудитель болезни Pasteurella multicida; неподвижная мелкая овальная бактерия 0,25-0,5µ шириной, 0,5-2 µ длиной. По Граму не красится, окрашивается по Романовскому анилиновыми красками. В культуре имеет склонность к плеоморфизму. Микроб не имеет жгутиков, не образует спор, имеет слизистую капсулу, которая хорошо заметна при окрашивании влажным методом с тушью и исследовании под фазово – контрастным микроскопом. Все пастереллы факультативные анаэробы, хорошо растут на питательных средах со щелочной реакцией (рН 7,2 -7,8), особенно пышно растут на гормональных средах или на средах ферментативного расщепления мяса и казеина. На бульоне в первые дни роста вызывают общее помутнение среды, в последующие дни – просветление с образованием на дне слизистого осадка, поднимающегося при встряхивании виде косы. На агаре пастереллы растут в виде мелких голубоватых прозрачных, позднее – беловатых колоний, прочно врастающих в питательную среду. Желатин не разжижают, молоко не свертывают, не растут на картофеле, не изменяют лакмусового молока, постоянно образуют индол в бульоне, содержащем триптофан, дают положительную реакцию на каталазу, восстанавливают нитраты в нитриты, не дают гемолиза на кровяных средах. Пастереллам свойственна вариабильность, зависящая от условий среды; они легко диссоциируют, образуя S, R и переходные формы колоний.
Устойчивость пастерелл относительно невысокая — в навозе, земле и гниющих трупах пастереллы остаются жизнеспособными от 1 до 3 месяцев. В тушках кур и уток, хранившихся в замороженном состоянии, пастереллы остаются жизнеспособными в течение года. При температуре 70-90°С погибают в течение 5-10минут, при 1-5°С – в течение нескольких дней. При высушивании на открытом воздухе и солнце пастереллы погибают в течение 48часов, при действии прямых солнечных лучей – в течение 10минут. На инфицированных предметах – от 35 минут до 34 дней, в помете птиц – от 12 до 22-72дней. Из дезинфицирующих веществ на пастерелл губительно действуют – 5%-ный раствор карболовой кислоты, убивающий их через 1минуту, 5%-ный раствор известкового молока – через 4-5 минут, 1%-ный раствор хлорной извести – через 10минут. Губительно на пастерелл действуют 2%-ные растворы едкого натрия и 3-5%-ные растворы горячего креолина.
Эпизоотологические данные. К пастереллезу восприимчивы все возрастные группы домашней и дикой птицы. Источником возбудителя пастереллеза является больная и переболевшая птица. Возбудитель инфекции передается через трупы птиц и животных, павших от пастереллеза, а также боенские отходы, яйца, пух-перо, корм, воду, оборудование и другие инфицированные объекты. Переносчиками возбудителя пастереллеза могут быть грызуны, насекомые (клещи, клопы, мухи), дикая птица, животные других видов, а также обслуживающий персонал. При этом не исключается и трансовариальный путь передачи заболевания. Чаще всего пастереллезом птиц заболевает молодняк гусей, уток и кур. Заражаются птицы преимущественно аэрогенным и реже алиментарным путем. К факторам, способствующими возникновению пастереллеза, относятся нарушения ветеринарно-санитарного режима, технологии содержания и кормления птицы.
Патогенез. При спонтанном заражении пастерелла локализуется в слизистой оболочке желудочно-кишечного тракта, которая в дальнейшем подвергается зернистой дистрофии и некрозу. Подобного рода изменения в дальнейшем появляются в печени, вызывая нарушение ее функции. В результате появления токсинов происходят глубокие поражения сердечной мышцы и сопровождаются острым паренхиматозным воспалением с выпотом серозно-геморрагического экссудата.
Клинические признаки. Инкубационный (скрытый) период от нескольких часов до 2-4 дней. Пастереллез у птиц может иметь сверхострое, острое и хроническое течение болезни. При этом сверхострое течение болезни у птиц чаще всего наблюдается в начале эпизоотии, и сопровождается внезапной гибелью птицы. Больная птица неожиданно падает и, взмахнув несколько раз крыльями, погибает без каких-либо клинических признаков. Сверхострое течение болезни у птиц обычно бывает в начале эпизоотии и более часто встречается у водоплавающей птицы.
При остром течении болезни больная птица в большинстве случаев сидит нахохлившись, угнетена, голову держит под крылом или запрокидывает ее назад, крылья опущены, температура тела повышается до 43-44°С, гребень и сережки синюшны, перья взъерошены, аппетит ослаблен, у больных отмечаем сильную жажду, из клюва слизистые или пенистые истечения, на расстоянии слышны влажные хрипы и затрудненное дыхание. Диарея сопровождается жидкими фекалиями с кровью. По мере развития заболевания у больной птицы прогрессирует слабость, иногда бывают судороги, летальный исход отмечаем через 2-3 дня.
Хроническое течение пастереллеза у птиц бывает после острого или подострого или может быть связано с наличием менее вирулентного штамма возбудителя. Хроническое течение пастереллеза у птицы проявляется общей слабостью, прогрессирующим истощением, из клюва идут вязкие истечения, наблюдаются отечность и твердые припухлости на голове и сережках, воспаление суставов, конъюнктивит, затрудненное и учащенное дыхание, отмечается снижение яйценоскости. Дополнительно для хронического течения болезни у птиц характерны признаки синусита, ринита и скопления вязкого экссудата вокруг носовых отверстий и на конъюнктиве. Птица при данной форме болезни погибает редко.
Патологоанатомические изменения. Патологоанатомические изменения у павшей птицы зависят от формы течения болезни.
При остром течении болезни ветеринарный специалист в печени отмечает картину паренхиматозного гепатита. Печень внешне набухшая, с притупленными краями, коричневатого или желтовато- коричневого цвета, дряблая. На поверхности и в глубине паренхимы ветеринарный специалист может обнаружить милиарные или величиной с булавочную головку многочисленные некротические фокусы, серовато-белого цвета или мутные, желтоватые, редко или густо рассеянные по паренхиме органа.
Как правило, у павшей птицы отмечаем серозный или серозно- фибринозный перикардит. В сердечной сорочке можно обнаружить значительное количество мутного из-за примеси мелких хлопьев фибрина и серозного экссудата. Сердечная мышца дряблая, имеет цвет вареного мяса, иногда в ней отмечают беловато-желтого цвета очажки коагуляционного некроза. Коронарные сосуды резко кровенаполнены. При пастереллезе птиц ветеринарный специалист может встретиться с крупозной пневмонией. Пораженные легкие плотные, темно-красного или красно-коричневого цвета, но стадии опеченения в отличие от крупозной пневмонии у животных, у птиц не бывает. В том случае если воспалительный процесс у птиц зашел далеко в процесс может быть вовлечена костальная плевра, отмечаем острую застойную гиперемию и отек.
В отдельных случаях у птицы поражаются верхние дыхательные пути и воздухоносные мешки. Стенки их утолщены, не прозрачные, покрыты пленками фибрина.
Селезенка увеличена, дряблая, темно-красного цвета. У некоторой павшей птицы в селезенке обнаруживаем беловато-желтовато-серые очажки некроза.
При пастереллезе у птицы всегда поражается кишечник. Слизистая оболочка кишечника (особенно 12-ти перстная кишка) в состоянии катарального, реже геморрагического воспаления. Внешне она набухшая, покрасневшая, усеяна точечными кровоизлияниями и покрыта тягучей слизью. При вскрытии павшей от пастереллеза водоплавающей птицы в кишечнике часто находим язвы и участки некроза.
Патологоанатомические изменения при подостром течении пастереллеза в основном такие же, как и при остром, но выражены более слабо. Трупы павшей птицы сильнее истощены.
Для хронического течения пастереллеза у птиц характерны некротические очаги, которые ветеринарный специалист обнаруживает в различных органах, — фибринозные плевриты, перикардиты и артриты. При вскрытии некротических очагов находим желтоватую творожистую массу с неприятным запахом. Подобные некротические очаги обнаруживают в легких, печени, подкожной клетчатке, кишечнике, иногда в селезенке, сердечной мышце и сердечной сумке. В подкожной клетчатке у птиц некротические очаги не имеют определенной локализации. Их можно находить в различных участках тела. У отдельных птиц иногда бывают поражены суставы (серозно-фибринозный синосит и артрит). Внешне они набухшие, в их полостях скапливается в большом количестве фибринозно-некротические массы. У павшей птицы нередко бывают поражены бородки, которые наполнены некротической массой и внешне имеют вид шаровидных образований. Одновременно при вскрытии могут встречаться фибринозные плевриты и перикардиты. При фибринозном перикардите сердечная сорочка обычно утолщена за счет отложения фибринозного экссудата. Нередко фибринозный экссудат заполняет воздухоносные мешки.
Диагноз на пастереллез у птиц ставят на основании эпизоотологических данных, клинических признаков, патологоанатомических изменений и результатов лабораторных исследований. Для лабораторного исследования берется только свежий патологический материал от не подвергавшихся лечению птиц и не ранее чем через 7-10дней после лечения. Для выделения возбудителя используют простые, но лучше обогащенные МПА и МПБ (с добавлением 5-10%-ного амидопептида-2 или 5%-ной стерильной сыворотки от лошадей, крупного рогатого скота, или 20%-ной желточной взвеси – один куриный желток на 200мл физиологического раствора). Для постановки диагноза на пастереллез птиц необходимо выделение пастерелл, патогенных для лабораторных животных.
Дифференциальный диагноз. Ветеринарные специалисты должны пастереллез дифференцировать от болезни Ньюкасла, колисептицемии птиц, стрептококкоза, стафилококкоза, пуллороза, спирохетоза, а у водоплавающей птицы от гриппа птиц.
Иммунитет и средства специфической профилактики. При пастереллезе иммунитет изучен недостаточно. Для активной иммунизации применяют 6 вакцин, в том числе 3 инактивированные (эмульгированная для кур и уток, а также эмульсинвакцина отдельно для кур, индеек, уток, гусей) и 3 живые вакцины (из пастеровского штамма для всех видов домашней птицы и 2 из штамма АВ и К Краснодарской НИВС для водоплавающих птиц).
При установлении пастереллеза хозяйство, отделение, птичник Постановлением Губернатора области объявляют неблагополучным и в нем вводят ограничения. Ограничения на мясоперерабатывающие предприятия и заготовительные пункты накладываются на время убоя всей имевшейся на момент установления пастереллеза птицы и проведения санации (механическая очистка, дезинфекция, дератизация). Оздоровление хозяйства проводят в соответствии с инструкцией о мероприятиях по борьбе с пастереллезом птиц. Утвержденной Главным управлением ветеринарии Министерства сельского хозяйства СССР 20 мая 1975года.
Профилактика. Птице создают оптимальные условия содержания и кормления, хозяйство охраняют от заноса возбудителя извне, строго соблюдают другие ветеринарно-санитарные правила, а при непосредственной угрозе – своевременно иммунизируют все поголовье.

Одной из главных проблем, препятствующих росту поголовья домашних животных и птиц, являются инфекционные заболевания, в частности пастереллезы [4]. Пастереллез – широко распространенная высококонтагиозная инфекционная болезнь многих видов домашних и диких животных, сопровождающаяся при остром течении признаками септицемии, крупозным воспалением и отеком легких, плевритом, отеками в различных частях тела, а при подостром и хроническом течении гнойно-некротизирующей пневмонией, артритом, маститом, кератоконъюнктивитом, эндометритом и энтеритом.
Согласно сведениям МСХ РК за 2009-2015 гг., одной из основных причин массового падежа сайгаков в 2009-2015 гг. являлась пастереллезная инфекция, а стабильно неблагополучными по пастереллезу являются Западно-Казахстанская, Восточно-Казахстанская и Алматинская области [5].
Научный и практический интерес к пастереллезу животных обусловлен природной очаговостью, пастереллоносительством переболевших животных, появлению не только единичных случаев заболевания, но и крупных вспышек как среди домашних, так и диких животных 2.
В представленной работе отражены данные по изучению культурально-морфологических и биохимических свойств эпизоотических изолятов Pasteurella multocida, выделенных от крупного рогатого скота и сайги. Проведенные исследования позволяют оценить возможность использования полученных культур Pasteurella multocida как для оценки иммуногенности существующих вакцин, так и для применения их в качестве основы для разработки рекомбинантных вакцин.
Материалы и методы исследований
В опытах использовали следующие изоляты и штамм Pasteurella multocida:
1) изолят, выделенный из патологического материала от сайгака и освеженный на телятах в 1988 г. (получен из лаборатории коллекции микроорганизмов НИИПББ);
2) изолят, выделенный из патологического материала от крупного рогатого скота из Алматинской области в 2016 г.;
3) в качестве контроля использовали мутантный штамм Pasteurella multocida AroA (Коллекционный номер/B-0050/L), полученный в 2013 г. и депонированный в музее НИИПББ.
Для освежения и повышения вирулентных свойств изучаемых изолятов проводили шесть последовательных пассажей через организм белых беспородных мышей массой 16-18 г путем заражения подкожно в область спины 18 часовой бульонной культурой, в объеме 0,5 см3.
При изучении культурально-морфологических свойств выделенных чистых культур штаммов Pasteurella multocida использовали питательные среды BHIA (Brain heart infusion agar) и BHIB (Brain heart infusion broth). Посевной материал инкубировали в биологических пробирках и чашках Петри при 37 °С в течение 18-24 ч.
Морфологию клеток определяли путем световой микроскопии, мазки-отпечатки окрашивали по методу Грама. Биохимические свойства пастерелл изучали методом их гликолитической активности путем высева на средах Гисса с использованием различных углеводов и последующим инкубированием при 37 °С в течение 24 ч. О ферментации углеводов судили по изменению окраски среды.
Каталазный тест проводили путем смешивания на предметных стеклах, нанося каплю раствора каталазы на бакмассу. Образование пузырьков газа отмечали как положительный результат.
Для полного подтверждения полученных данных проводили биохимический тест с использованием набора ЭНТЕРО-Рапид 24 (Чехия), для постановки теста использовали суточную культуру вышеуказанных образцов, выращенных на BHIA. Учет результатов проводили, используя цветную шкалу набора по окрашиванию проб в лунках.
Результаты исследования и их обсуждение
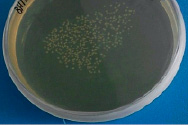
При посеве изолята Pasteurella multocida, выделенного от КРС на BHIА, через 24 ч культивирования формируются круглые, выпуклые, с гладкой влажной поверхностью прозрачные и полупрозрачные колонии с ровными краями диаметром до и более 2,5 мм.
При культивировании изолята, выделенного от сайгака, через 18-24 ч инкубации наблюдается рост просвечивающих круглых, с ровными краями, гладкой поверхностью колоний слизистой консистенции, диаметром до 2 мм. В проходящем свете 24 ч культура имеет прозрачные края янтарного цвета с слегка затемненным центром. Результаты исследований представлены на рисунке.
В пробирках с жидкой питательной средой BHIB при выращивании изучаемых культур пастерелл во всех случаях наблюдали образование слизистого осадка, которые при встряхивании поднимались в виде характерной косички, что также свидетельствует о принадлежности к пастереллам.
По результатам проведенных исследований установлено, что существенной морфологической особенностью пастерелл являются временные различия в величине и цвете колоний, а также скорости роста на питательных средах.
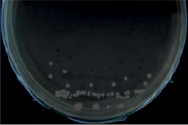
а) изолят Pasteurella multocida, выделенный от КРС
б) изолят Pasteurella multocida, выделенный от сайги
Морфологические свойства колоний пастерелл, выделенных из патологического материала КРС и сайгака
Исследование гликолитической активности пастерелл на средах Гисса
Испытанные культуры пастерелл
штамм AroA, контроль
Результаты биохимического теста для идентификации Pasteurella multocida
Испытанные культуры пастерелл
штамм AroA, контроль
Морфология клеток пастерелл. Морфологию клеток изучали посредством световой микроскопии. По данным литературы, характерной особенностью данного микроорганизма является биполярность при окрашивании мазков [6]. В изучаемых культурах Pasteurella multocida, неоднократно пересеваемых на плотной питательной (BHIА) и жидкой (BHIB) средах, микроб наиболее часто имеет вид коккообразной палочки, диплококка, расположенных чаще всего отдельно, но встречались парные, групповые скопления и цепочки из коротких палочек разной длины.
При изучении вирулентных свойств испытуемых изолятов, с повышением пассажного уровня отмечали снижение сроков гибели мышей от 24 ч до 18-20 ч, при этом через 12-14 ч после заражения лабораторных животных наблюдали угнетение, учащение дыхания, малоподвижность и взъерошенность волосяного покрова.
В результате вскрытия мышей обнаруживали патологические изменения во внутренних органах: легкие гиперемированы, кровоизлияния на эпикарде сердца, под серозной оболочкой печени, селезенки, геморрагическое воспаление кишечника. При микроскопии мазков-отпечатков, сделанных из крови и органов (сердца, печени, почки, селезенки) лабораторных животных экспериментально зараженных изучаемыми изолятами Pasteurella multocida, в поле зрения встречались грамотрицательные палочки, чаще овоидной формы. Средняя часть бактерийных клеток окрашена бледнее, чем концы. Из органов павших мышей были выделены чистые культуры пастерелл.
После восстановления вирулентных свойств пастерелл проводили эксперименты по изучению биохимических свойств путем высева в биологические пробирки на среды Гисса, постановки каталазного теста и с использованием набора ЭНТЕРО-Рапид 24. Данные по изучению гликолитической активности выделенных чистых культур Pasteurella multocida от КРС и сайги оценивали по изменению цвета в пробирках со средами. В качестве контроля использовали мутантный штамм Pasteurella multocida AroA, полученные результаты представлены в табл. 1.
Данные табл. 1 свидетельствуют о ферментации пастереллами углеводов и спиртов: маннит, глюкоза, сахароза, инозит, ксилоза, кроме пробирок содержащих дульцит, лактозу и раффинозу.
Параллельно проведенный каталазный тест показал положительный результат. Полученные результаты позволяют отнести изучаемые пастереллы к виду Pasteurella multocida, которые согласуются с данными В.И. Покровского [3].
На конечном этапе экспериментов проводили биохимический тест с использованием набора ЭНТЕРО-Рапид 24, результаты показаны в табл. 2.
Из данных, представленных в табл. 2, можно сделать вывод, что при биохимическом тесте с использованием набора ЭНТЕРО-Рапид 24 оба проверяемых образца и контроль дали положительный результат на индол, сахарозу, трегалозу, глюкозу, маннозу и N-acetyl-β-D-glucosaminidase. При этом пробы были окрашены: с индолом в розовый, сахарозой – желто-зеленый, трегалозой, глюкозой, маннозой и N-acetyl-β-D-glucosaminidase – желтый цвет. Изменение цвета при проведении биохимического теста с использованием набора ЭНТЕРО-Рапид 24 свидетельствует о положительной реакции, что является маркерным признаком для Pasteurella multocida [7].
Пастереллы, изолированные из патологического материала от КРС и сайги, после шести последовательных пассажей на лабораторных животных вызывают гибель через 18-20 ч, что доказывает их высокую вирулентность.
На основании проведенных исследований можно сделать вывод, что чистые культуры Pasteurella multocida, выделенные из патологического материала крупного рогатого скота и сайгака, образуют колонии S-формы и позволяют отнести их к роду Pasteurella, виду Pasteurella multocida.
Выделенные культуры Pasteurella multocida могут быть использованы для оценки иммуногенности существующих вакцин и применения их в качестве основы для разработки рекомбинантных вакцин.
Читайте также:


