Окраска по нейссеру дифтерийной палочки
Впервые дифтерийная палочка Corynebacterium diphtheriae) была описана Э. Клебсом в 1883 г., а Ф. Леффлером — в 1884 г.
Морфология и тинкториальные свойства. Бактерии отличаются резко выраженным полиморфизмом. Обычно они имеют 3—4 мк в длину и 0,3—0,5 мк в толщину (рис. 83 и 84).

Рис. 84. Мазок из дифтерийной пленки. Окраска метиленовой синькой (одномоментный способ).
Рис. 83. Дифтерийная палочка в культуре Окраска по Нейссеру. 
Встречаются, однако, то более длинные, то более короткие формы. В морфологическом отношении дифтерийные палочки характеризуются тем, что их цитоплазма содержит зернистые включения, а на одном или обоих концах клетки имеются колбовидные утолщения, что придает им форму булавы (согупа — булава). Отсюда и название Corynebacterium diphtheriae. Flo отношению друг к другу палочки располагаются под прямым или острым углом, часто наподобие растопыренных пальцев.
Дифтерийная палочка грамположительна и хорошо красится всеми анилиновыми красками, но воспринимает окраску неравномерно, что. зависит от содержащихся в ней зерен волютина (Бабеша—Эрнста). Последние имеют круглую или овальную форму и располагаются обычно по концам палочек. Волютиновые зерна воспринимают окраску значительно интенсивнее остальной цитоплазмы, благодаря чему их легко обнаружить и при помощи простых методов окраски. В лабораторной практике для этой цели пользуются окраской препаратов метиленовой синью или по методу Нейссера (см. технику окраски, стр. 51).
Культуральные и биохимические свойства. Рост дифтерийных бактерий происходит в аэробных условиях при оптимальной температуре 37°.

Рис. 85. Колонии дифтерийной палочки на теллуритовой
среде.
а — колонии типа gravis; б — колонии типа mitis.
- Среда Клауберга. 100 мл 3% питательного агара (или 7,5 г сухого питательного агара на 100 мл дистиллированной воды) расплавить, добавить 3 мл 2% раствора теллурита калия, 10 мл глицериновой смеси и 50 мл лаковой крови. Быстро все перемешивают и разливают в чашки. Среда прозрачная, цвет красного вина.
Лаковая кровь готовится следующим образом: к 34 мл дистиллированной воды (стерильной) добавить 16 мл дефибринированной крови крупного рогатого скота или человека либо сухой крови, разведенной соответственно наставлению.
Приготовление глицериновой смеси: к 40 мл дефибринированной крови крупного рогатого скота или человека либо сухой разведенной крови добавить 20 мл химически чистого стерильного глицерина. Смесь рекомендуется выдержать в холодильнике 3—6 недель. На этой среде дифтерийная палочка, восстанавливающая соли теллура, растет в виде круглых непрозрачных колоний черного цвета или с темно-серым центром. Ложнодифтерийные палочки образуют мелкие непрозрачные колонии серого цвета с коричневым центром. Дифтероиды растут в виде выпуклых блестящих колоний серого цвета с черным центром.
- Цистин-теллурит-сывороточная среда Тиндаля (модифицированная по инструкции). К 100 мл 2% расплавленного и охлажденного до 60° питательного агара добавляют последовательно: 1) 1% раствор цистина на 0,1 N растворе H2S04 (или НС1) — 12 мл; цистин надо растворять в серной или соляной кислоте, подогревая на водяной бане при температуре 80—85°, 2) 0,1 н. раствор NaOH—12 мл, 3) 2% раствор теллурита калия 1,8 мл, 4) 2,5% раствор гипосульфита натрия—1,8 мл, 5) нормальную лошадиную или бычью сыворотку — 20 мл. Среду перемешивают и разливают в стерильные чашки слоем в 4—5 мл.
- Сухая хинозольная индикаторная среда Б учина (по инструкции). К 100 мл холодной воды добавляют 7—8 г порошка сухой хипозольной среды, тщательно размешивают и нагревают на слабом огне до полного расплавления агара. Среду кипятят в течение 2—3 минут, не допуская пригорания агара, до образования крупнопузырчатой, быстро оседающей пены.
К охлажденной до 50° среде добавляют 5 мл (лучше 10—15 мл) стерильной крови, размешивают и разливают в чашки.
После застывания среду слегка подсушивают в термостате и она «может быть использована в течение 3—4 суток при условии хранения от +4 до +10. Приготовленная среда имеет синий цвет. Колонии дифтерийной палочки вырастают через 24—48 часов, при этом восстанавливают индикатор и среда приобретает фиолетовый цвет на месте роста дифтерийной палочки. Колонии дифтерийной палочки окрашиваются в синий цвет.
Резистентность. Температура 60° убивает дифтерийную палочку в течение 10 минут. К прямому солнечному и рассеянному свету палочка дифтерии чувствительна.
К высыханию относительно устойчива. 5% раствор карболовой кислоты убивает ее в течение 1 минуты.
Дифтерийный токсин и патогенность для животных.
Дифтерийная палочка выделяет экзотоксин, токсичность которого может быть настолько велика, что 0,002 мл его при подкожном введении морской свинке вызывает смерть животного через 3—5 дней. Дифтерийный токсин крайне неустойчив: он разрушается при нагревании до 60° и резко ослабляется от действия света и кислорода воздуха. Под влиянием одновременного действия формалина (0,3—0,4%) и температуры 40° в продолжение 1 месяца удается получить — анатоксин. Анатоксин применяется для активной иммунизации людей против дифтерии и при изготовлении лечебных сывороток.
В противоположность токсину анатоксин достаточно стоек: под влиянием действия света и от долгого хранения его антигенная сила не изменяется.
Лучшей средой для получения экзотоксина является мартеновский бульон (см. стр. 67). Сила токсина определяется его наименьшей смертельной дозой — Dim, т. е. тем наименьшим количеством токсина, которое при подкожном введении убивает морскую свинку весом 250 г на 4-й или на 5-й день. У животных не удается получить заболевание, аналогичное дифтерии человека. Однако у некоторых животных, особенно у морской свинки, после заражения развивается ряд весьма характерных патологоанатомических изменений. В результате подкожного введения дифтерийной культуры или дифтерийного токсина животное погибает в ближайшие дни. При вскрытии на месте введения наблюдается серозный или серозно-геморрагический инфильтрат. Надпочечники увеличены и резко гиперемированы. В плевральной полости, в околосердечной сумке и в полости брюшины наблюдается скопление серозного экссудата.
При внутрикожном введении дифтерийного токсина или культуры наблюдаются характерные местные некротические поражения кожи.
Патогенез и клиника дифтерии. Источником инфекции при дифтерии является больной человек, который через выделения — слизь, гной, слюну, мокроту рассеивает микробы в окружающее пространство, на обстановку и предметы. Чаще всего заражение происходит капельноаэрогенным путем. Опасность представляют также реконвалесцент и здоровый бактерионоситель. Дифтерийные
палочки могут сохраняться довольно долго в зеве людей, перенесших дифтерию. Бактерионосительство при дифтерии имеет большое эпидемиологическое значение: оно создает иммунитет и в то же время способствует распространению инфекции.
Дифтерия передается капельным путем при кашле, чиханье и разговоре от бактерионосителя, а также косвенно — через различные предметы, бывшие в употреблении больного человека (белье, постельные принадлежности, игрушки, книги, посуда). Алиментарный путь заражения (через молоко и мороженое)—явление редкое.
В основе патогенеза дифтерии решающее значение имеет интоксикация дифтерийным экзотоксином. Проявляется дифтерия в виде первичного поражения слизистых оболочек миндалин, небных занавесок, носоглотки и носа, откуда процесс может распространяться глубже по дыхательным путям, поражая гортань и бронхи. Иногда наблюдается также дифтерия глаз, раневых поверхностей, уха и влагалища. На месте внедрения микробов появляются сероватые пленки, спаянные с подлежащей тканью; при удалении их видна кровоточащая поверхность.
Размножение дифтерийных палочек происходит только на месте их внедрения, и в кровь они обычно не поступают. В месте своего размножения дифтерийные бактерии вырабатывают экзотоксин, который, всасываясь, дает общую интоксикацию организма.
Инкубационный период при дифтерии 2—7 дней. Заболевание начинается подъемом температуры, болью в горле при глотании и недомоганием. Токсином поражается мышца сердца (малый и частый пульс, глухие тоны). Кровяное давление понижено вследствие поражения надпочечников. В дальнейшем в тяжелых случаях дифтерии появляется цианоз, похолодание конечностей и наступает смерть от острой недостаточности сердечной деятельности.
Дифтерия гортани, или истинный круп, характеризуется сухим лающим кашлем, сужением просвета гортани, кислородным голоданием, заканчивающимся смертью. Токсическими осложнениями при дифтерии являются параличи мягкого неба, конечностей и различных мышц; особенно опасны параличи сердечной мышцы.
Наряду с тяжелыми встречаются легкие, атипические формы дифтерии, которые протекают под видом различных
воспалений миндалин. Такие случаи трудно распознаются и поэтому весьма опасны в эпидемиологическом отношении.
Иммунитет. Иммунитет при дифтерии антитоксический. Он основан на наличии в сыворотке антител — антитоксинов. Грудные дети обычно дифтерией не болеют, что обусловлено имеющимся у них пассивным иммунитетом, который они получают от матери плацентарным путем и отчасти с молоком. В дальнейшем антитоксины накапливаются в результате активной естественной иммунизации и контакта с носителями дифтерийной палочки.
Микробиологическая диагностика. При дифтерии применяют следующие виды лабораторного исследования: бактериоскопический, бактериологический, экспериментальный. Материалом для исследования служат отделяемое пораженных слизистых оболочек, пленки, а по требованию эпидемиолога — молоко, мороженое, смывы с различных предметов (игрушек и др.) Берут материал стерильным тампоном, состоящим из комочка ваты, намотанного на конец деревянной палочки или металлического стержня. При наличии резко очерченных дифтеритических пленок следует потереть пораженный участок тампоном, чтобы получить некоторое количество экссудата. Из носа материал берут таким же тампоном, но на него наматывают несколько меньшее количество ваты. Для того чтобы захватить материал, нужно пройти тампоном первый носовой ход. При взятии материала из
нoca необходимо производить туалет ноздрей (обмывание физиологическим раствором или спиртом) и не касаться кожи носа.
Взятый материал помещают в пробирки и немедленно отправляют в лабораторию. Если доставка занимает больше 3—4 часов, то используют тампоны, смоченные 5% раствором глицерина в 0,85% растворе поваренной соли. Тампоны следует защищать от действия солнца, замораживания и высыхания. Небольшая высеваемость (20—50%) дифтерийной палочки от больных дифтерией чаще всего обусловливается неправильным взятием материала и длительностью времени от момента его взятия до посева.
В лаборатории приступают к бактериологическому исследованию. Тампоны вводят в пробирку со свернутой лошадиной сывороткой и затем втирают его содержимое в поверхность сыворотки, производя при этом вращательные движения. Одновременно делают посев на чашку с теллуритовым кровяным агаром, на среду Клауберга или на среду Тинсдаля для получения чистой культуры дифтерийной палочки. В целях диагностики бактериоскопическое исследование содержимого на тампоне в настоящее время проводят редко, но иногда в срочных случаях по требованию врача применение его оправдано. Тогда после посева материала делают мазки для окраски синью и по Нейссеру.
Посеянный материал выращивают при температуре 37° и исследуют спустя 18—24 часа. В срочных случаях можно провести исследование раньше, например через 6—12 часов. Из выросшей культуры готовят мазки и окрашивают по Граму, щелочной метиленовой синью и по Нейссеру и микроскопируют. Иногда рост микробов задерживается. В этих случаях необходимо оставить посев еще на сутки и повторить его бактериоскопическое исследование. Присутствие микроорганизмов, обладающих характерными для дифтерии морфологическими и тинкториальными свойствами, можно расценивать как положительный результат.
Метод, который позволяет выделить дифтерийную палочку быстрее, заключается в том, что тампон предварительно смачивают стерильной сывороткой, которую свертывают на тампоне нагреванием до 80°. Сывороточным тампоном протирают пораженный участок (зев, миндалины) и помещают его в термостат при 37°.
Свойства дифтерийной палочки и близких к ней дифтероидов
Дифтерия - острое инфекционное заболевание, вызываемое дифтерийной палочкой (Corynebacterium diphtheriae), характеризующееся местным фибринозным поражением слизистых оболочек рото- и носоглотки (diphthera – пленка), а также тяжелой интоксикацией с поражением сердечно-сосудистой, нервной системы и надпочечников. Лабораторная диагностика дифтерии осуществляется в соответствии со схемой 14.
Микроскопический метод в настоящее время фактически не применяется из-за его низкой информативности в связи с субъективизмом учета и выполняется только по требованию лечащего врача. Микроскопии подвергают мазки, окрашенные по Граму, метиленовым синим, по Нейссеру (для выявления включений волютина). Дифтерийные палочки (Corynebacterium diphtheriae) при окраске по Нейссеру содержат полярно расположенные темно-синие, почти черные, включения волютина и располагаются в виде римских цифр V или Х, тогда как сходные с ними дифтероиды и ложнодифтерийные бактерии (Corynebacterium pseudodiphtheriae) зерен волютина не имеют и располагаются в виде частокола. Разработан также метод прямого флюорохромирования дифтерийных палочек корифосфином, окрашивающим включения волютина в красно-коричневый цвет, а цитоплазму в зеленый или желтый цвет, что позволяет повысить эффективность бактериоскопического метода.
Бактериологический метод-основной метод диагностики дифтерии. Исследуемый материал засевают на одну из специальных питательных сред для культивирования дифтерийных палочек, наиболее часто на среду Клауберга (МПА с глицерином, дефибринированной кровью и теллуритом натрия, задерживающим рост сопутствующей непатогенной микрофлоры). На среде Клауберга Corynebacterium diphtheriae образует 2 типа колоний:
а) серовато-черного цвета с радиальной исчерченностью поверхности, напоминающие цветок маргаритки или розетку (биовар gravis);
б) черные, круглые, выпуклые колонии колонии за счет восстановления теллурита (биовар mitis).
В мазке из типичной для дифтерийной палочки колонии обнаруживают грамположительные палочки булавовидной формы, расположенные в виде римских цифр V или Х, содержащие зерна волютина (рис. 16). Оставшуюся часть колонии пересевают на кровяной МПА для выделения чистой культуры.
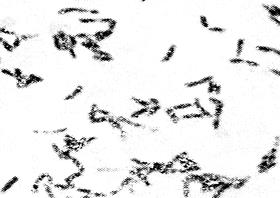
Рис. 16. Возбудитель дифтерии - Corynebacterium diphtheriae. Окраска по Нейссеру. Расположение в виде римских цифр V или Х, включения волютина по полюсам. х900
Цистиназу у выделенных культур (проба Пизу) определяют путем посева методом укола петли исследуемой культуры на цистиновый МПА с азотнокислым свинцом. Посевы помещают на сутки в термостат при 37 0 С. При наличии цистиназы в среде образуется почернение (образование сульфида свинца) по ходу укола, вокруг которого появляется коричневое облачко.
Выделенную культуру идентифицируют и дифференцируют от сходных с ней непатогенных коринебактерий по биологическим свойствам (табл. 16). Для определения уреазы петлю исследуемой культуры вносят в пробирку, содержащую спиртовый раствор мочевины и индикатор феноловый красный. Пробирку выдерживают 30 минут в термостате при 37 0 С, при наличии уреазы содержимое пробирки окрашивается в красный цвет.
При выделении нетоксигенной культуры ставят реакцию агглютинации с противодифтерийной сывороткой для выявления видового антигена Corynebacterium diphtheriae.
Серологический метод –РА, РНГА с целью определения антител в парных сыворотках крови больных дифтерией.
Таблица 16.Биологические свойства коринебактерий
Дата публикования: 2015-10-09 ; Прочитано: 770 | Нарушение авторского права страницы
studopedia.org - Студопедия.Орг - 2014-2020 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.002 с) . 
Впервые дифтерийная палочка Corynebacterium diphtheriae) была описана Э. Клебсом в 1883 г., а Ф. Леффлером — в 1884 г.
Морфология и тинкториальные свойства. Бактерии отличаются резко выраженным полиморфизмом. Обычно они имеют 3—4 мк в длину и 0,3—0,5 мк в толщину (рис. 83 и 84).

Рис. 84. Мазок из дифтерийной пленки. Окраска метиленовой синькой (одномоментный способ).
Рис. 83. Дифтерийная палочка в культуре Окраска по Нейссеру. 
Встречаются, однако, то более длинные, то более короткие формы. В морфологическом отношении дифтерийные палочки характеризуются тем, что их цитоплазма содержит зернистые включения, а на одном или обоих концах клетки имеются колбовидные утолщения, что придает им форму булавы (согупа — булава). Отсюда и название Corynebacterium diphtheriae. Flo отношению друг к другу палочки располагаются под прямым или острым углом, часто наподобие растопыренных пальцев.
Дифтерийная палочка грамположительна и хорошо красится всеми анилиновыми красками, но воспринимает окраску неравномерно, что. зависит от содержащихся в ней зерен волютина (Бабеша—Эрнста). Последние имеют круглую или овальную форму и располагаются обычно по концам палочек. Волютиновые зерна воспринимают окраску значительно интенсивнее остальной цитоплазмы, благодаря чему их легко обнаружить и при помощи простых методов окраски. В лабораторной практике для этой цели пользуются окраской препаратов метиленовой синью или по методу Нейссера (см. технику окраски, стр. 51).
Культуральные и биохимические свойства. Рост дифтерийных бактерий происходит в аэробных условиях при оптимальной температуре 37°.

Рис. 85. Колонии дифтерийной палочки на теллуритовой
среде.
а — колонии типа gravis; б — колонии типа mitis.
- Среда Клауберга. 100 мл 3% питательного агара (или 7,5 г сухого питательного агара на 100 мл дистиллированной воды) расплавить, добавить 3 мл 2% раствора теллурита калия, 10 мл глицериновой смеси и 50 мл лаковой крови. Быстро все перемешивают и разливают в чашки. Среда прозрачная, цвет красного вина.
Лаковая кровь готовится следующим образом: к 34 мл дистиллированной воды (стерильной) добавить 16 мл дефибринированной крови крупного рогатого скота или человека либо сухой крови, разведенной соответственно наставлению.
Приготовление глицериновой смеси: к 40 мл дефибринированной крови крупного рогатого скота или человека либо сухой разведенной крови добавить 20 мл химически чистого стерильного глицерина. Смесь рекомендуется выдержать в холодильнике 3—6 недель. На этой среде дифтерийная палочка, восстанавливающая соли теллура, растет в виде круглых непрозрачных колоний черного цвета или с темно-серым центром. Ложнодифтерийные палочки образуют мелкие непрозрачные колонии серого цвета с коричневым центром. Дифтероиды растут в виде выпуклых блестящих колоний серого цвета с черным центром.
- Цистин-теллурит-сывороточная среда Тиндаля (модифицированная по инструкции). К 100 мл 2% расплавленного и охлажденного до 60° питательного агара добавляют последовательно: 1) 1% раствор цистина на 0,1 N растворе H2S04 (или НС1) — 12 мл; цистин надо растворять в серной или соляной кислоте, подогревая на водяной бане при температуре 80—85°, 2) 0,1 н. раствор NaOH—12 мл, 3) 2% раствор теллурита калия 1,8 мл, 4) 2,5% раствор гипосульфита натрия—1,8 мл, 5) нормальную лошадиную или бычью сыворотку — 20 мл. Среду перемешивают и разливают в стерильные чашки слоем в 4—5 мл.
- Сухая хинозольная индикаторная среда Б учина (по инструкции). К 100 мл холодной воды добавляют 7—8 г порошка сухой хипозольной среды, тщательно размешивают и нагревают на слабом огне до полного расплавления агара. Среду кипятят в течение 2—3 минут, не допуская пригорания агара, до образования крупнопузырчатой, быстро оседающей пены.
К охлажденной до 50° среде добавляют 5 мл (лучше 10—15 мл) стерильной крови, размешивают и разливают в чашки.
После застывания среду слегка подсушивают в термостате и она «может быть использована в течение 3—4 суток при условии хранения от +4 до +10. Приготовленная среда имеет синий цвет. Колонии дифтерийной палочки вырастают через 24—48 часов, при этом восстанавливают индикатор и среда приобретает фиолетовый цвет на месте роста дифтерийной палочки. Колонии дифтерийной палочки окрашиваются в синий цвет.
Резистентность. Температура 60° убивает дифтерийную палочку в течение 10 минут. К прямому солнечному и рассеянному свету палочка дифтерии чувствительна.
К высыханию относительно устойчива. 5% раствор карболовой кислоты убивает ее в течение 1 минуты.
Дифтерийный токсин и патогенность для животных.
Дифтерийная палочка выделяет экзотоксин, токсичность которого может быть настолько велика, что 0,002 мл его при подкожном введении морской свинке вызывает смерть животного через 3—5 дней. Дифтерийный токсин крайне неустойчив: он разрушается при нагревании до 60° и резко ослабляется от действия света и кислорода воздуха. Под влиянием одновременного действия формалина (0,3—0,4%) и температуры 40° в продолжение 1 месяца удается получить — анатоксин. Анатоксин применяется для активной иммунизации людей против дифтерии и при изготовлении лечебных сывороток.
В противоположность токсину анатоксин достаточно стоек: под влиянием действия света и от долгого хранения его антигенная сила не изменяется.
Лучшей средой для получения экзотоксина является мартеновский бульон (см. стр. 67). Сила токсина определяется его наименьшей смертельной дозой — Dim, т. е. тем наименьшим количеством токсина, которое при подкожном введении убивает морскую свинку весом 250 г на 4-й или на 5-й день. У животных не удается получить заболевание, аналогичное дифтерии человека. Однако у некоторых животных, особенно у морской свинки, после заражения развивается ряд весьма характерных патологоанатомических изменений. В результате подкожного введения дифтерийной культуры или дифтерийного токсина животное погибает в ближайшие дни. При вскрытии на месте введения наблюдается серозный или серозно-геморрагический инфильтрат. Надпочечники увеличены и резко гиперемированы. В плевральной полости, в околосердечной сумке и в полости брюшины наблюдается скопление серозного экссудата.
При внутрикожном введении дифтерийного токсина или культуры наблюдаются характерные местные некротические поражения кожи.
Патогенез и клиника дифтерии. Источником инфекции при дифтерии является больной человек, который через выделения — слизь, гной, слюну, мокроту рассеивает микробы в окружающее пространство, на обстановку и предметы. Чаще всего заражение происходит капельноаэрогенным путем. Опасность представляют также реконвалесцент и здоровый бактерионоситель. Дифтерийные
палочки могут сохраняться довольно долго в зеве людей, перенесших дифтерию. Бактерионосительство при дифтерии имеет большое эпидемиологическое значение: оно создает иммунитет и в то же время способствует распространению инфекции.
Дифтерия передается капельным путем при кашле, чиханье и разговоре от бактерионосителя, а также косвенно — через различные предметы, бывшие в употреблении больного человека (белье, постельные принадлежности, игрушки, книги, посуда). Алиментарный путь заражения (через молоко и мороженое)—явление редкое.
В основе патогенеза дифтерии решающее значение имеет интоксикация дифтерийным экзотоксином. Проявляется дифтерия в виде первичного поражения слизистых оболочек миндалин, небных занавесок, носоглотки и носа, откуда процесс может распространяться глубже по дыхательным путям, поражая гортань и бронхи. Иногда наблюдается также дифтерия глаз, раневых поверхностей, уха и влагалища. На месте внедрения микробов появляются сероватые пленки, спаянные с подлежащей тканью; при удалении их видна кровоточащая поверхность.
Размножение дифтерийных палочек происходит только на месте их внедрения, и в кровь они обычно не поступают. В месте своего размножения дифтерийные бактерии вырабатывают экзотоксин, который, всасываясь, дает общую интоксикацию организма.
Инкубационный период при дифтерии 2—7 дней. Заболевание начинается подъемом температуры, болью в горле при глотании и недомоганием. Токсином поражается мышца сердца (малый и частый пульс, глухие тоны). Кровяное давление понижено вследствие поражения надпочечников. В дальнейшем в тяжелых случаях дифтерии появляется цианоз, похолодание конечностей и наступает смерть от острой недостаточности сердечной деятельности.
Дифтерия гортани, или истинный круп, характеризуется сухим лающим кашлем, сужением просвета гортани, кислородным голоданием, заканчивающимся смертью. Токсическими осложнениями при дифтерии являются параличи мягкого неба, конечностей и различных мышц; особенно опасны параличи сердечной мышцы.
Наряду с тяжелыми встречаются легкие, атипические формы дифтерии, которые протекают под видом различных
воспалений миндалин. Такие случаи трудно распознаются и поэтому весьма опасны в эпидемиологическом отношении.
Иммунитет. Иммунитет при дифтерии антитоксический. Он основан на наличии в сыворотке антител — антитоксинов. Грудные дети обычно дифтерией не болеют, что обусловлено имеющимся у них пассивным иммунитетом, который они получают от матери плацентарным путем и отчасти с молоком. В дальнейшем антитоксины накапливаются в результате активной естественной иммунизации и контакта с носителями дифтерийной палочки.
Микробиологическая диагностика. При дифтерии применяют следующие виды лабораторного исследования: бактериоскопический, бактериологический, экспериментальный. Материалом для исследования служат отделяемое пораженных слизистых оболочек, пленки, а по требованию эпидемиолога — молоко, мороженое, смывы с различных предметов (игрушек и др.) Берут материал стерильным тампоном, состоящим из комочка ваты, намотанного на конец деревянной палочки или металлического стержня. При наличии резко очерченных дифтеритических пленок следует потереть пораженный участок тампоном, чтобы получить некоторое количество экссудата. Из носа материал берут таким же тампоном, но на него наматывают несколько меньшее количество ваты. Для того чтобы захватить материал, нужно пройти тампоном первый носовой ход. При взятии материала из
нoca необходимо производить туалет ноздрей (обмывание физиологическим раствором или спиртом) и не касаться кожи носа.
Взятый материал помещают в пробирки и немедленно отправляют в лабораторию. Если доставка занимает больше 3—4 часов, то используют тампоны, смоченные 5% раствором глицерина в 0,85% растворе поваренной соли. Тампоны следует защищать от действия солнца, замораживания и высыхания. Небольшая высеваемость (20—50%) дифтерийной палочки от больных дифтерией чаще всего обусловливается неправильным взятием материала и длительностью времени от момента его взятия до посева.
В лаборатории приступают к бактериологическому исследованию. Тампоны вводят в пробирку со свернутой лошадиной сывороткой и затем втирают его содержимое в поверхность сыворотки, производя при этом вращательные движения. Одновременно делают посев на чашку с теллуритовым кровяным агаром, на среду Клауберга или на среду Тинсдаля для получения чистой культуры дифтерийной палочки. В целях диагностики бактериоскопическое исследование содержимого на тампоне в настоящее время проводят редко, но иногда в срочных случаях по требованию врача применение его оправдано. Тогда после посева материала делают мазки для окраски синью и по Нейссеру.
Посеянный материал выращивают при температуре 37° и исследуют спустя 18—24 часа. В срочных случаях можно провести исследование раньше, например через 6—12 часов. Из выросшей культуры готовят мазки и окрашивают по Граму, щелочной метиленовой синью и по Нейссеру и микроскопируют. Иногда рост микробов задерживается. В этих случаях необходимо оставить посев еще на сутки и повторить его бактериоскопическое исследование. Присутствие микроорганизмов, обладающих характерными для дифтерии морфологическими и тинкториальными свойствами, можно расценивать как положительный результат.
Метод, который позволяет выделить дифтерийную палочку быстрее, заключается в том, что тампон предварительно смачивают стерильной сывороткой, которую свертывают на тампоне нагреванием до 80°. Сывороточным тампоном протирают пораженный участок (зев, миндалины) и помещают его в термостат при 37°.
Свойства дифтерийной палочки и близких к ней дифтероидов
Читайте также:


