Микробиологическая диагностика актиномикозов полости рта
Разнообразные микроорганизмы, заселяя практически любую природную среду, незримо сопутствуют человеку на протяжении всей его жизни. Обитая в почве, воде, воздухе, на растениях, на стенах жилых и производственных помещений, микроорганизмы постоянно контакт
Они широко распространены в окружающей среде: в почве, воде, в том числе в водопроводной и ключевой, в горячих минеральных источниках, на растениях, на каменистых породах и даже в пустынях. В организме человека актиномицеты сапрофитируют на коже, в ротовой полости, зубном налете, лакунах миндалин, верхних дыхательных путях, бронхах, на слизистой оболочке желудочно-кишечного тракта, влагалища, анальных складок и т. д.
Термин актиномицеты (устаревшее название лучистые грибки) распространяется в настоящее время на широкий круг грамположительных аэробных и микроаэрофильных бактерий, обладающих способностью к формированию ветвящегося мицелия с характерным спороношением, атакже палочек неправильной формы и кокковидных элементов, которые образуются в результате фрагментации мицелия.
К актиномицетам относятся бактерии родов Actinomyces, Actinomadura, Bifidobacterium, Nocardia, Micromonospora, Rhodococcus, Streptomyces, Tsukamurella и др.
Переходу актиномицетов из сапрофитического в паразитическое состояние способствуют снижение иммунозащитных сил организма, наличие тяжелых инфекционных или соматических заболеваний (хронической пневмонии, гнойного гидраденита, диабета и т. д.), воспалительные заболевания слизистых оболочек полости рта, респираторного и желудочно-кишечного тракта, оперативные вмешательства, длительное применение внутриматочных контрацептивов, переохлаждение, травмы и др.
В таких случаях развивается актиномикоз — хроническое гнойное неконтагиозное заболевание, обусловленное формированием характерных синюшно-красных, а затем багровых инфильтратов плотной консистенции с множественными очагами флюктуации и свищами с гнойным отделяемым в мягких и костных тканях практически любых локализаций. Длительность инкубационного периода может колебаться от 2–3 недель до нескольких лет (от времени инфицирования до развития манифестных форм актиномикоза).
Ведущим в развитии актиномикоза является эндогенный способ, при котором возбудитель проникает в ткани из мест его сапрофитического обитания, чаще всего через пищеварительный тракт и полость рта (кариозные зубы, десневые карманы, крипты миндалин). Наиболее благоприятные условия для внедрения актиномицетов создаются в толстой кишке, вследствие застоя пищевых масс и большей вероятности травматизации стенки. При экзогенном способе возбудители проникают в организм из окружающей среды аэрогенно или при травматических повреждениях кожи и слизистых оболочек.
Распространение актиномицетов из первичного очага поражения происходит контактным путем по подкожной клетчатке и соединительнотканным прослойкам органов и тканей. Возможен также и гематогенный путь при прорыве актиномикотической гранулемы в кровеносный сосуд.
В возникновении и формировании актиномикотического процесса также существенную роль играют сопутствующие аэробные и анаэробные бактерии. Большинство случаев актиномикоза обусловлены полимикробной флорой. Обычно наряду с актиномицетами выделяют Staphylococcus spp., Streptococcus spp., Fusobacterium spp., Capnocytophaga spp., Bacteroides spp., представителей семейства Enterobacteriaceae и др. Присоединение гноеродных микроорганизмов обостряет течение актиномикоза, изменяет его клиническую картину, способствует распространению процесса.
Клиническая картина актиномикоза разнообразна, встречается во всех странах в практике врачей различных специальностей (стоматологов, хирургов, дерматологов, гинекологов и др.). Основные локализации — челюстно-лицевая (до 80%), торакальная, абдоминальная, параректальная, мицетома (мадурская стопа). Кроме того, актиномикотические поражения проявляются не только в классическом виде с характерной инфильтрацией тканей, абсцессами и свищами, но и в виде доминирующей патогенной флоры неспецифического воспалительного процесса, осложняющего течение основного заболевания.
Актиномицеты могут играть активную роль в этиологии хронического тонзиллита. Небные миндалины колонизируются актиномицетами при хроническом тонзиллите и в ассоциации с другими бактериями часто провоцируют воспалительные реакции. Вследствие стоматологических процедур может возникнуть актиномикотическая бактеримия полости рта. В 30% случаев от 80% выявленных бактеримий определяется актиномикотическая природа стоматита, этиологическими агентами которого являются сапрофиты ротовой полости — A. viscosus, A. odontolyticus и A. naeslundi. Присоединяясь к местной патогенной флоре, актиномицеты способствуют развитию длительно незаживающего воспалительного процесса при угревой сыпи, трофических язвах, гиперемиях, мацерациях и мокнутиях на коже. Обладая высокой степенью колонизации кишечника, они являются одним из основных агентов дисбактериоза. Обобщая все вышеизложенное, нужно отметить, что бактерии из обширной группы актиномицетов могут фигурировать как участники любых инфекционных и воспалительных проявлений организма человека от дерматита до эндокардита.
Таким образом, актиномикоз, отличающийся многообразием локализаций и клинических проявлений, нужно своевременно диагностировать и возможно эффективно лечить, зная закономерности патогенетического развития, предрасполагающих факторов инфицирования, характеристик возбудителей и методов лечения.
Однако диагностика и лечение заболеваний, связанных с участием актиномицетов, являются предметами единичных специализированных лабораторий и клиник в мире. Трудности в их дифференциальной диагностике служат препятствием широкой известности этих микроорганизмов в клинической практике.
Диагностика актиномикоза
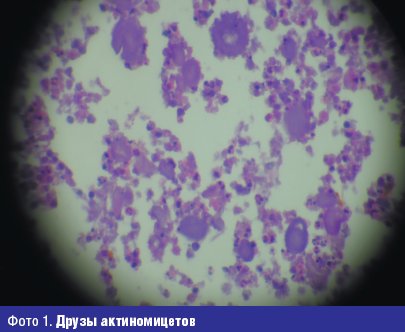
Друзы не образуются при нокардиозе. В тканях Nocardia обнаруживается в виде тонких нитей мицелия 0,5–0,8 мкм и палочковидных форм такой же толщины. Благодаря своей кислотоустойчивости Nocardia хорошо окрашивается по Граму–Вейгерту в синий цвет и по Цилю–Нильсену — в красный: все это позволяет проводить дифференциальную диагностику между актиномикозом и нокардиозом, т. к. это диктуется различием методов лечения при этих болезнях.
Важное значение для верификации актиномикоза любых локализаций имеет микробиологическое исследование, которое включает микроскопию и посев патологического материала на питательные среды. Оптимальная температура для роста 35–37°С.
При микроскопии клинического материала и выросших культур, окрашенных по Граму или метиленовой синькой, актиномицеты выглядят как ветвистые нити длиной 10–50 мкм или представлены полиморфными короткими палочками 0,2–1,0×2–5 мкм, часто с булавовидными концами, одиночные, в парах V- и Y-образной конфигураций и в стопках. Грамположительные, но часто окрашивание не типичное, в виде четок.
Многие аэробные актиномицеты хорошо растут на обычных бактериологических средах — мясо-пептонном, триптиказо-соевом, кровяном и сердечно-мозговом агарах. Для выявления микроаэрофильных видов используют тиогликолевую среду. Культуральные признаки актиномицетов весьма разнообразны. На плотных агаровых средах колонии по размерам напоминают бактериальные — диаметром 0,3–0,5 мм. Поверхность колоний может быть плоской, гладкой, бугристой, складчатой, зернистой или мучнистой. Консистенция тестовидная, крошковатая или кожистая. Многие актиномицеты образуют пигменты, придающие колониям самые различные оттенки: сероватые, синеватые, оранжевые, малиновые, зеленоватые, коричневые, черновато-фиолетовые и др.
Клинические аэробные изоляты, например Nocardia asteroids и Streptomyces somaliensis, на богатой питательной среде дают так называемый атипичный рост — плотные кожистые колонии, обычно не опушенные столь типичным для штаммов воздушным мицелием и без спороношения. Для проявления дифференцировки, образования характерных спор и пигментов требуются специальные среды: с коллоидным хитином, почвенным экстрактом или отварами растительных материалов.
За период 2007 года под нашим наблюдением находилось 25 больных с различными клиническими формами актиномикоза. Среди обследованных пациентов было 12 женщин и 13 мужчин (в возрасте 15–25 лет — 4 человека, 26–35 лет — 4 человека, 36–45 — 2, 46–55 — 5 человек и 56–66 лет — 10 человек).
Под нашим наблюдением находилась больная К., 43 лет с редким случаем первичного актиномикоза кожи мягких тканей паховых областей, свищевая форма.
Больна в течение 1 года, когда появились изменения в паховой области слева вследствие постоянного натирания кожи неудобным нижним бельем. К врачам не обращалась. Ухудшение в декабре 2007 г., когда появились 2 язвы, свищи с гнойным отделяемым. Консультирована дерматологом, который заподозрил неопластический процесс. Обследована онкологом, паразитологом. Диагноз онкологического или паразитарного заболевания установить не удалось. Направлена к микологу с подозрением на глубокий микоз. При осмотре: очаг поражения расположен в левой паховой области размером около 1,7×5 см, функционируют 2 свища со скудным гнойным и сукровичным отделяемым. Больная обследована в микологической лаборатории института им. Е. И. Марциновского ММА им. И. М. Сеченова на актиномикоз и бактериальную инфекцию. В исследуемом патологическом материале при микроскопии препаратов обнаружены актиномицеты, палочки, кокки, лептотрихии. При посеве гнойного отделяемого из свищей на питательные среды получен рост актиномицетов и кокковой флоры.
Диагноз актиномикоза кожи и мягких тканей верифицирован. Больная проходит наблюдение и лечение у миколога.
Больной Н., 24 лет с диагнозом угревая болезнь, актиномикоз (фото 2).
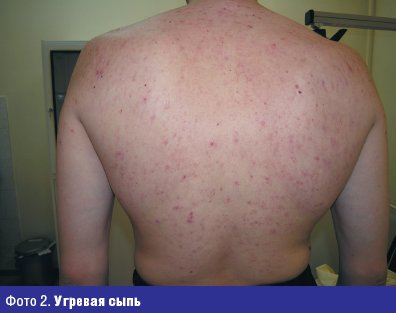
Жалобы на высыпания на коже туловища с детства. Достоверно можно говорить о давности заболевания 10 лет, когда в 14-летнем возрасте был установлен диагноз угревая болезнь. Больной лечился наружными средствами и антибиотиками различных групп с временным эффектом. Общее состояние в настоящее время осложнилось хроническим гастритом. При осмотре: кожа туловища, лица, спины поражены воспалительными элементами (папуло-пустулезная сыпь, открытые и закрытые комедоны), в некоторых местах сливного характера, инфильтрация кожи и мягких тканей. При микроскопическом исследовании себума из элементов угревой сыпи у больного обнаружены кокки и единичные палочки. В посеве из исследуемого материала в условиях микологической лаборатории (фото 3).
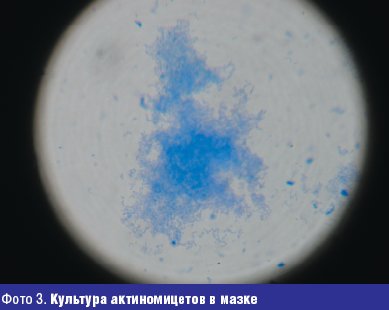
Диагноз: угревая болезнь, актиномикоз лица, туловища, спины кожи и мягких тканей вторичного характера, инфильтративная форма в стадии умеренно выраженного обострения. В настоящее время больному проводится лечение микологом в поликлинике института им. Е. И. Марциновского ММА им. И. М. Сеченова.
Лечение
Лечение больных актиномикозом проводится комплексное в различных сочетаниях в зависимости от локализации и клинических проявлений — препаратами йода, антибиотиками, иммунокоррегирующими и общеукрепляющими средствами, актинолизатом, проводят местное лечение мазями, физиотерапевтическими процедурами и хирургическим вмешательством.
Йодистые препараты (до 3 г йодистого калия в день), ранее доминирующие в терапии актиномикоза, в настоящее время могут применяться в комбинации с антибиотиками или рентгенотерапией, как дополнительное средство для размягчения и рассасывания инфильтрата.
При лечении актиномикоза также необходимо учитывать присоединяющуюся патогенную микрофлору, которая может проявлять повышенную резистентность к антибиотикам, что объясняется длительным предшествующим применением различных химиопрепаратов. С целью воздействия на сопутствующую флору используют метронидазол (Метрогил, Трихопол, Эфлоран) и клиндамицин (Далацин, Климицин). Хороший противовоспалительный эффект показывает применение сульфаниламидных препаратов (ко-тримоксазол, сульфадиметоксин, сульфакарбамид). При присоединении микотической инфекции назначают противогрибковые препараты: флуконазол, итраконазол, тербинафин, кетоконазол и др.
Общеукрепляющая терапия стимулирует реактивность организма и повышает эффективность иммунотерапии. Дезинтоксикационная терапия проводится внутривенными растворами Гемодеза, 5% раствором глюкозы и др. С целью активации регенерации применяется аутогемотерапия — еженедельно, всего на курс 3–4 переливания. Витамины назначают в среднетерапевтических дозах.
Иммунотерапия Актинолизатом способствует накоплению специфических иммунных тел и улучшает результаты лечения, позволяя снизить объем антибактериальных средств и избежать нежелательных побочных воздействий. Актинолизат вводят внутримышечно 2 раза в неделю по 3 мл, на курс 25 инъекций, курсы повторяют 2–3 раза с интервалом в 1 месяц.
В качестве местной терапии показано мазевое лечение с антибактериальными препаратами указанных групп, промывание свищей растворами антисептиков, препаратами фуранового типа, введение 1%, 2%, 5% спиртового раствора йода, которые способствуют очищению актиномикозных очагов и ликвидации воспалительных явлений.
Физиотерапевтические процедуры. В стадии формирования очага проводят электрофорез кальция хлорида и Димедрола. После вскрытия очагов при остаточных инфильтратах назначают электрофорез йода, Лидазы, флюкторизацию. Ультразвук применяется непосредственно на область очага поражения по общепринятой схеме в течение 12–25 дней (в зависимости от состояния больного и очага поражения) с интервалами в 3–4 месяца.
Хирургическое лечение проводится на фоне консервативной терапии и заключается в радикальном иссечении очагов поражения в пределах видимо здоровых тканей. При невозможности проведения радикальной операции (например, при шейно-челюстно-лицевом актиномикозе) показано вскрытие и дренирование очагов абсцесса.

Изучение микробиологических аспектов этиологии и патогенеза болезней пародонта является актуальной проблемой стоматологии. Обоснование роли определенных видов микроорганизмов в развитии патологического процесса, определение условий и механизмов реализации неповреждающего действия открывают новые перспективы для профилактики и лечения данных заболеваний. Уже установлена ведущая роль стрептококков в возникновении кариозных повреждений эмали зубов, а также значение отдельных сероваров Streptococcus mutans в этом процессе [1]. Продолжается выяснение влияния инфекционного фактора на этиологию и других форм патологических процессов в полости рта.
В полости рта местные микроорганизмы часто ассоциируются с этиологией двух широко распространенных патологических процессов - кариес и перидонтальные заболевания. Оральная патология, как правило, развивается после нарушения сбалансированного состояния среди местной микрофлоры, что приводит к появлению потенциально патогенных микроорганизмов [2].
В полости рта существующая важная среда обеспечивает относительно стабильную температуру (от 34º до 36 ºС) и рН ближе к нейтральной в большинстве участков, таким образом, поддерживается рост широкого разнообразия микроорганизмов. Вместе с тем ротовую полость нельзя рассматривать как однообразную среду. В ней можно определить несколько участков - мест для обитания микроорганизмов, каждое из которых характеризуется разнообразными физико-химическими факторами и таким образом поддерживает рост и развитие разной микробной общины. Это происходит частично из-за большого анатомического разнообразия полости рта, а также взаимосвязи между разными анатомическими структурами [3, 4].
Оральная микрофлора у людей весьма сложная и разнообразная. Она включает более чем 300 бактериальных видов, к которым можно добавить Protozoa, грибы, а также микоплазмы и актиномицеты. Их распространение меняется качественно и количественно в зависимости от их местообитания [5].
Как известно, количественный критерий имеет важное значение при установлении возбудителя инфекционного процесса. Возрастание доли определенного вида среди остальных микроорганизмов в течение заболевания, а также доминирование его в популяции, населяющей очаг поражения, может косвенно свидетельствовать об этиологической роли данного вида [6, 7]. У здоровых людей десневая бороздка содержит ограниченное количество матрикса зубной бляшки. Более 30% всей культивируемой микрофлоры такой бляшки составляют грамположительные палочки. Около 90% из них - это представители актиномицетов (Actinomyces viscosus, A.naeslundii, A.israelli) [1]. Прекращение гигиенического ухода за полостью рта ведет к накоплению матрикса бляшки. Это сопровождается, с одной стороны, развитием гингивита, а с другой - возрастанием доли актиномицетов, которые постепенно становятся доминирующей флорой. В зрелой, ненарушенной зубной бляшке актиномицеты составляют примерно половину всех микроорганизмов: A.viscosus и A.naeslundii - 38,4 %, A.israelli - 10 %, A.odontolyticus - 3,5 % [1].
На модели экспериментального гингивита показано, что количество A.viscosus и A. israelli увеличивается параллельно с нарастанием интенсивности воспаления десен. Другими исследователями также отмечена прямая корреляция между выраженностью клинических симптомов гингивита и содержанием A.viscosus в материале зубной бляшки.
При микробиологическом исследовании десневой жидкости и зубной бляшки у больных пародонтитом определено, что численность популяции A.viscosus и Rothia dentocariosa в области поражения оказалась больше, чем в непораженных участках. На преобладание актиномицетов в зубной бляшке при пародонтите указывают, в то время как другие авторы наблюдали высокое содержание R.dentocariosa, A.naeslundii, A.viscosus лишь у больных с минимальной активностью процесса.
Другая форма патологии органов рта, при которой доминируют актиномицеты - пришеечный кариес. В таких кариозных поражениях обнаружено более 50% A.viscosus, A.naeslundii, A.odontolyticus.
Поверхность слизистой полости рта омывается стабильно двумя важными физиологическими жидкостями - слюна и жидкость гингивальной щели. Они существенно важны для поддержания экосистемы оральной полости, обеспечивая ее при этом водой, питательными веществами, адгезией микроорганизмов, а также антимикробными факторами. Супрагингивальная среда промывается слюной, в то время сабгингивальный регион (гингивальная щель) промывается в основном жидкостью гингивальной щели [5].
В настоящей работе рассматривается вопрос о патологическом значении ферментирующих актиномицетов, а также микробиологические и иммунологические аспекты при пародонтите и гингивите с антиномикотической этиологией.
Материал и методы
Материалом для исследования служили мазки из ротовой полости, материалы пародонтального кармана зубов и из гингивиальной щели. Параллельно приготовлениям мазков образец поместили в 5 м транспортную среду (0,06 % обогащенную тиогликолевую среду), морфологические и тинктональные свойства изучали при окрашивании препаратов по Грамму, Цилью Нельсону и Романовскому Гимзе.
Для выделения культур Actinomyces в качестве плотной среды использовали тиогликолевую, крахмаламмиачную, а также среду Сабуро, кровяной агар.
Инкубации при 35-37 ºС проводили в анаэробных и аэробных условиях в течение 15 дней. Исследовали морфологические, культуральные, физиологические и биохимические свойства выделенных изолятов по общепринятому методу. Колонии изучали при помощи лупы и микроскопа.
Результаты и обсуждение
В результате бактериологического и бактериоскопического анализа больных гингивитом и пародонтитом был выявлен актиномицет в ассоциации с другими микроорганизмами. У больных пародонтитом (50 человек) у 23 (46%) были выделены актиномицеты в ассоциации с другими микроорганизмами, у 27 (54,0%) были выделены лишь другие микроорганизмы. У больных гингивитом (83 человека) у 33 (40%) были выделены актиномицеты в ассоциации с другими микроорганизмами, а у 50 (60%) только другие микроорганизмы. При пародонтите часто выделены Act.odontolyticus, Act.viscosus, Act.israelii, Act.eriocsonii, Act.albicans, Act.nauslandii, Act.spp. А при гингивите были выделены актиномицеты - Act.odontolyticus, Act.viscosus, Act.israelii, Act.eriocsonii. Все эти актиномицеты были выделены в ассоциации с аэробными и анаэробными микроорганизмами.
При пародонтите были выделены следующие микроорганизмы: S.aureus, α гемолитические стрептококки, E.coli, C.albicans, A.actinomycetimocomitans, Fuzabacterium spp., грамположительные анаэробные кокки, бактероиды. А при гингивите актиномицеты были выделены в ассоциации с аэробными бактериями - S.aureus, α гемолитические стрептококки, Neisseria spp., C.albicans, Micrococcus spp., A.actinomycetemcomitans, из анаэробных - грамположительные анаэробные кокки, Porphyromonos qinqivalis.
В дальнейших исследованиях были проанализированы сравнительные показатели иммунной системы у больных пародонтитом и гингивитом актиномикотической этиологии, а также без нее.
У больных пародонтитом (IgA - 1,70±0,09 мг/ мл, IgM - 1,5±0,01 мг/ мл, IgG - 13,8±0,09 мг/ мл) и гингивитом (IgA - 1,25±0,1 мг/мл, IgM - 0,98±0,01 мг/ мл, IgG - 6,0±0,1 мг/мл) с актиномикотической этиологией анализ средних уровней иммуноглобулинов в сыворотке крови показал достоверное понижение, чем у больных, у которых этиологическим агентом служили другие бактерии и грибы (пародонтиты: IgA - 8,77±0,1 мг/ мл, IgM - 3,91±0,2 мг/мл, IgG - 23,7±0,04 мг/ мл; гингивиты: IgA - 2,72±0,02 мг/мл, IgM - 1,7±0,01 мг/мл, IgG - 12,7±0,02 мг/мл). А концентрация sIgA у больных с актиномикотическкой этиологией была заметно понижена (пародонтит - 56,4±10,1 мг/ мл, гингивит - 45,3±9,1 мг/мл) по сравнению с нормой, а также у больных, у которых выделены другие микроорганизмы, так как в норме уровень sIgA составляет 207,5±92,2 мг/мл.
У больных пародонтитом и гингивитом, у которых заболевания вызваны актиномицетами в сочетании с другими микроорганизмами, в уровне цитокинов в сыворотке крови отмечалось незначительное увеличение (у больных гингивитом: TNFα - 77,3±3,5, IL-1 - 78,4±3,3; у больных пародонтитом: TNFα - 71,8±6,3, IL-1 - 72,3±7,5). Можно полагать, что отмеченные изменения в концентрации цитокинов обусловлены у больных с остротой воспалительных процессов. По всей вероятности, как пародонтиту, так и гингивиту, обусловленным актиномицетами в ассоциации с другими микроорганизмами, свойственно было хроническое течение заболевания. Напротив, у больных пародонтитом и гингивитом, вызванным другими микроорганизмами, воспалительный процесс (как гнойный, так и без него) протекал остро, что сказывалось на содержании провоспалительных цитокинов (у больных гингивитом: TNFα - 102,5±10,4, IL-1 - 106,5±10,7; у больных пародонтитом: TNFα - 169,6±13,0, IL-1 - 236,8±11,5).
Результаты количественного определения субпопуляции Т-лимфоцитов показали, что содержание CD3 (у больных гингивитом - 48,2±10,0%, у больных пародонтитом - 38,6±8,3%), CD4 (гингивит - 29,9±7,5%, пародонтит - 27,3±7,0%), CD8 (гингивит - 21,0±5,9%, пародонтит - 14,5±3,5%), а также CD22 (гингивит - 9,5±3,1%, пародонтит - 4,5±1,1%) у всех больных с актиномикотической этиологией, были снижены по сравнению с лицами контрольной группы (CD3 - 65,5%, CD4 - 38,5%, CD8 - 29,5%, CD22 - 12,8%) (р
Морфология. Род Actynomyces Ветвящиеся бактерии. Не содержат в клеточной стенке хитина, стенка имеет строение грамположительных бактерий. Мицелий имеет вид тонких прямых палочек, образуют нити. Характерная особенность актиномицетов — способность образовывать хорошо развитый мицелий. Палочковидные формы, часто с утолщенными концами, в мазке располагаются по одиночке, парами, V- и Y-образно. Все морфологические формы способны к истинному ветвлению, особенно на тиогликолевой полужидкой среде. По Граму окрашиваются плохо, часто образуют зернистые либо четкообразные формы; некислотоустойчивы. Типовой вид — Actinomyces bovis.
Культуральные свойства. Облигатные и факультативные анаэробы. Растут медленно, посевы следует культивировать 7сут. Температурный оптимум роста 37С. Некоторые штаммы дают α-β-гемолиз на средах с кровью. Некоторые виды формируют нитчатые микроколонии, напоминающие мицелий, на 7е сутки образуют S-формы колоний, иногда окрашенные в желтый/красный цвет. A. odontolyticus на кровяном агаре образует красные колонии с зоной β-гемолиза.
Биохимическая активность. Хемоорганотрофы. Ферментируют углеводы с образованием кислоты без газа, продукты ферментации — уксусная, муравьиная, молочная и янтарная кислоты. Наличие каталазы и способность восстанавливать нитраты в нитриты, индол не образуют.
Антигенная структура. В ИФА выделяют 6 cepoгpyпп: A, B, C, D, E и F.
Чувствительность к антимикробным препаратам. Чувствительны к пенициллинам, тетрациклину, эритромицину, но резистентны к антимикотикам. Чувствительны к действию обычно применяемых антисептиков и дезинфектантов.
Эпидемиология. Источник инфекции — почва. Механизм передачи — контактный, а путь передачи — раневой. Колонизируют слизистую оболочку полости рта человека и млекопитающих.
Патогенез. Вызывают оппортунистическую инфекцию.
Клиника. Актиномикоз — хроническая оппортунистическая инфекция человека и животных, вызываемая анаэробными и факультативно-анаэробными актиномицетами, которая характеризуется гранулематозным воспалением.
Микробиологическая диагностика: Материал для исследования - мокрота, ликвор, гной из свищей, биопсия тканей.
Для диагностики используют бактериоскопический, бактериологический, серологический и аллергологический методы.
Бактериоскопически: по обнаружению в исследуемом материале друз актиномицетов, имеющих вид мелких желтоватых или серовато-белых зернышек с зеленоватым отливом. По Граму споры окрашиваются в темно-фиолетовый, мицелий — в фиолетовый, а друзы — в розовый цвет.
Для подавления роста сопутствующей микрофлоры гной и мокроту перед посевом центрифугируют в растворе пенициллина и стрептомицина. Засевают на питательные среды (сахарный агар) и культивируют в аэробных и анаэробных условиях. У выделенных культур определяют способность сворачивать и пептонизировать молоко — признак, характерный для актиномицетов. Выделение анаэробных видов подтверждает диагноз актиномикоза.
Для серодиагностики ставят РСК с актинолизатом. Реакция недостаточно специфична, поскольку положительные результаты могут отмечаться при раке легкого и тяжелых нагноительных процессах. Применение в качестве АГ вместо актинолизата внеклеточных белков актиномицетов повышает чувствительность РСК. Этот же АГ можно использовать и для постановки РИГА.
Аллергическую пробу проводят с актинолизатом. Диагностическое значение имеют положительные пробы.
Лечение. Применение пенициллина, тетрациклина, эритромицина, клиндамицина.
Профилактика. Специфическая профилактика - нет. Неспецифическая - повышение иммунного статуса.
94. Возбудители риккетсиозов. Таксономия. Характеристика. Микробиологическая диагностика. Специфическая профилактика и лечение.( сыпной тиф) Эпидемический сыпной тиф — острый антропоноз с трансмиссивным механизмом распространения платяными вшами. Клинически характеризуется лихорадкой, тяжелым течением в связи с поражением кровеносных капилляров с нарушением кровоснабжения жизненно важных органов (мозг, сердце, почки), появлением сыпи.
Эпидемиология и механизм заражения. Заражение реализуется либо втиранием фекалий инфицированных вшей через расчесы кожи, либо путем вдыхания пылевидного аэрозоля из высохших инфицированных риккетсиями фекалий.
Клиника, диагноз, лечение. Инкубационный период 10 дней. Начало заболевания острое, клинические проявления обусловлены генерализованным поражением системы эндотелиальных клеток кровеносных сосудов, что приводит к нарушению каскада тромбо-антитромбообразования. Морфологическую основу болезни составляет генерализованный васкулит с формированием сыпи на кожных покровах. Болезнь протекает с высокой температурой, симптомами поражения сердечно-сосудистой и нервной систем. Иммунитет — непродолжительный, клеточно-гуморальный.
Диагностика: осуществляется по клинико-эпидемиологическим данным, подкрепляется лабораторным исследованием на специфические антитела (РСК, РНГА, ИФА и др.).
Лечение: Быстрое этиотропное лечение однократным приемом доксициклина, при его отсутствии — препаратами тетрациклинового ряда.
Профилактика. Изоляция завшивленных больных, дезинфекция препаратами, содержащими перметрин. Для специфической профилактики разработана живая вакцина из штамма Е, которая применяется в комбинации с растворимым антигеном риккетсии Провачека (живая комбинированная сыпнотифозная вакцина из штамма), а также инактивированная вакцина из растворимого антигена.
Болезнь Бриля – рецидив после ранее перенесенного эпидемического сыпного тифа.
Клинически протекает как эпидемический тиф легкой и средней тяжести.
Микробиологическая диагностика. Затруднена неопределенностью симптоматики на первой неделе заболевания (до появления сыпи) и ее сходством с симптомами при инфекциях, чаще брюшнотифозной. Диагноз устанавливается на основании клинико-эпидемиологических данных с учетом анамнеза больного и подкрепляется серологическим исследованием со специфическим антигеном. При отсутствии переносчика в очаге лечение может осуществляться без изоляции больного, в зависимости от его состояния. Прогноз благоприятен даже в отсутствии лечения антибиотиками.
Профилактика. Меры профилактики те же, что и при эпидемической форме. Специфическая профилактика невозможна.
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
1. Таксономия боррелий, лептоспир и трепонем, и названия заболеваний, вызываемых ими.
2. Микроскопическая диагностика сифилиса.
3. Реакции, используемые в серодиагностике сифилиса. Общая характеристика каждой из них.
4. Серодиагностика сифилиса с использованием РПГА.
5. Серодиагностика сифилиса с использованием ИФА.
6. Серодиагностика сифилиса с использованием РСК.
7. Методы микробиологической диагностики лептоспироза.
8. Методы микробиологической диагностики боррелиозов
9. Ультрамикроскопическое строение спирохет в виде схемы. Указать название структур этих микроорганизмов.
10. Ультраозвученный трепонемный антиген.
11. Кардиолипиновый антиген.
12. Инактивированная лептоспирозная вакцина.
13. Эритроцитарный трепонемный диагностикум.
14. Гемолитическая кроличья сыворотка к эритроцитам барана.
15. Единый бруцеллезный диагностикум.
16. Бруцеллезные вакцины.
17. Группы риска по бруцеллезу. Определение восприимчивых и невосприимчивых лиц
18. Проба Бюрне, компоненты, постановка, учет результатов.
19. Серодиагностика бруцеллеза.
20. Методы микробиологической диагностики туляремии. Характеристика перечисленных методов.
21. Реакция Асколи. Компоненты, постановка, учет результатов.
22. Характеристика возбудителя чумы
24. Сибиреязвенный иммуноглобулин.
25. Характеристика возбудителей сибирской язвы.
27. Характеристика возбудителя сифилиса.
28. Характеристика возбудителя возвратного тифа.
29. Характеристика возбудителя лептоспироза.
30. Виды трепонем, вызывающих невенерические трепонематозы, название этих болезней.
31. Характеристика возбудителя столбняка.
32. Характеристика возбудителя ботулизма.
33. Характеристика возбудителя дифтерии.
34. Характеристика возбудителей газовой анаэробной инфекции.
35. Бактериологический метод исследования при дифтерии.
36. Бактериологический метод исследования при газовой анаэробной инфекции.
37. Бактериологический метод исследования при ботулизме.
38. Определение токсигенности методом Оухтерлони.
39. Реакция нейтрализации токсина антитоксином. Компоненты, постановка, учет результатов.
40. Иммунотерапия столбняка.
41. Иммунотерапия ботулизма.
42. Иммунотерапия дифтерии.
43. Иммунотерапия газовой анаэробной инфекции
44. Специфическая профилактика столбняка.
45. Специфическая профилактика ботулизма.
46. Специфическая профилактика дифтерии.
47. Специфическая профилактика газовой анаэробной инфекции.
48. Возможные осложнения при иммунотерапии л антитоксическими сыворотками. Метод Безредка.
49. Характеристика стафилококков.
51. Методы микробиологической диагностики стафилококковой инфекции.
52. Специфическая иммунопрофилактика стафилококковой инфекции.
53. Определение критериев патогенности стафилококков.
54. Бактериологический метод исследования при стафилококковом сепсисе.
55. Характеристика стрептококков.
56. Факторы патогенности стрептококков. Перечислить болезни, вызываемые стрептококками
57. Методы микробиологической диагностики стрептококковой инфекции.
58. Характеристика менингококков. Заболевания, вызываемые ими. Факторы патогенности.
59. Принцип патогенеза эпидемического цереброспинального менингита.
60. Методы микробиологической диагностики эпидемического цереброспинального менингита.
61. Специфическая профилактика менингококковой инфекции.
62. Характеристика гонококков.
63. Бактериологический метод исследования гонореи.
64. Экспресс-метод в диагностике гонореи (РИФ).
65. Микроскопическая диагностика гонореи
66. Гонококковая вакцина.
67. Факторы патогенности менингококков.
68. Методы микробиологической диагностики менингококкового сепсиса.
69. Вакцины менингококковые.
70.Характеристика возбудителей туберкулеза.
71. Характеристика туберкулезной инфекции у человека.
72. Методы диагностики туберкулеза. Общая характеристика каждого из них.
73. Микроскопический метод диагностики туберкулеза.
74. Бактериологическая диагностика туберкулеза.
75. Аллергодиагностика туберкулеза.
76. Серологическая диагностика туберкулеза.
79. Эритроцитарный туберкулезный диагностикум.
Читайте также:


