Методические рекомендации по африканской чуме свиней
| Карта эпизоотической ситуации по АЧС | |||||
|---|---|---|---|---|---|
| 02.04.2020 | 02.03.2020 | 28.01.2020 | |||
| 27.12.2019 | 22.11.2019 | 30.10.2019 | 09.10.2019 | 05.08.2019 | 09.07.2019 |
| 13.05.2019 | 22.04.2019 | 25.03.2019 | 25.02.2019 | 24.12.2018 | 14.12.2018 |
| 20.11.2018 | 30.10.2018 | 17.09.2018 | 30.07.2018 | 30.07.2018 | 30.05.2018 |
| 16.04.2018 | 19.03.2018 | 28.02.2018 | 22.01.2018 | 04.12.2017 | 17.11.2017 |
| 19.10.2017 | 06.10.2017 | 14.09.2017 | 07.09.2017 | 24.08.2017 | 05.06.2017 |
| 15.05.2017 | 06.03.2017 | 23.01.2017 | 07.11.2016 | 09.09.2016 | 23.08.2016 |
| 15.07.2016 | 24.06.2016 | 10.06.2016 | 02.06.2016 | 22.03.2016 | 08.02.2016 |
| 28.01.2016 | 27.11.2015 | 26.10.2015 | 15.09.2015 | 28.08.2015 | 19.08.2015 |
| 04.08.2015 | 30.01.2015 | 27.01.2015 | 13.10.2014 | 01.08.2014 | 12.05.2014 |

Африканская чума свиней
Африканская чума свиней – особо опасная, острозаразная, вирусная болезнь. В России впервые зарегистрирована в 2008 году. Вирус поражает диких и домашних свиней всех пород и возрастов в любое время года. Для жизни и здоровья людей опасности не представляет.
Болезнь высоколетальная, распространяется очень быстро и наносит огромный экономический ущерб сельскому хозяйству. Погибают до 100 % заболевших свиней. Лечение запрещено, вакцины не существует.
Свиньи заражаются при контакте с больными и переболевшими животными: через корма (особенно пищевые отходы), воду, предметы ухода, транспортные средства, загрязненные выделениями больных животных, а также через контакт с трупами павших свиней и продуктов убоя зараженных свиней. Наиболее часто к появлению АЧС приводит скармливание свиньям непроваренных пищевых отходов домашней кухни, различных пищеблоков и столовых, боенских отходов, а также комбикормов и зернопродуктов, не прошедших термическую обработку. Болезнь переносят домашние и дикие животные, птицы, грызуны и насекомые.
Вирус очень устойчив: в продуктах, воде и внешней среде сохраняется месяцами, замораживание и высушивание на него не действуют. Уничтожается исключительно путем нагревания до высоких температур.
Симптомы. От заражения до появления симптомов проходит 2-7 дней. У животных повышается температура тела до 42 о С, появляются одышка, кашель, пропадает аппетит, усиливается жажда, отмечаются приступы рвоты и паралича задних конечностей, на коже внутренней поверхности бедер, на животе, шее, у основания ушей, на пятачке и хвосте становятся заметны красно-фиолетовые пятна. Смерть наступает на 1-5 день, реже позднее. Бывает хроническое течение болезни.
- Не допускайте посторонних в свое хозяйство. Переведите свиней в режим безвыгульного содержания. Владельцам личных подсобных хозяйств и фермерских хозяйств следует содержать свиней в свинарниках и сараях без выгула и контакта с другими животными;
- исключите кормление свиней кормами животного происхождения и пищевыми отходами без проварки. Покупайте корма только промышленного производства или проваривайте их, при температуре не менее 80 градусов Цельсия, перед кормлением;
- проводите обработку свиней и помещений для их содержания один раз в 10 дней против кровососущих насекомых (клещей, вшей, блох). Постоянно ведите борьбу с грызунами;
- не осуществляйте подворный убой и реализацию свинины без проведения предубойного осмотра и проведения ветеринарно-санитарной экспертизы мяса и продуктов убоя специалистами государственной ветеринарной службы;
- не покупайте живых свиней в местах несанкционированной торговли без ветеринарных сопроводительных документов, не завозите свиней и продукцию свиноводства из других регионов без согласования с государственной ветеринарной службой;
- обязательно предоставьте поголовье свиней для ветеринарного досмотра, вакцинаций (против классической чумы свиней, рожи) и других обработок, проводимых ветеринарными специалистами;
- не выбрасывайте трупы животных, отходы от их содержания и переработки на свалки, обочины дорог, не захоранивайте их на своем огороде или другом земельном участке. Не пытайтесь переработать мясо павших или вынужденно убитых свиней – это запрещено и может привести к дальнейшему распространению болезни.
Обо всех случаях заболевания и внезапного падежа свиней НЕМЕДЛЕННО СООБЩИТЕ в районную ветеринарную станцию и в управление ветеринарии Челябинской области, по телефонам (351) 239 61 16; (351) 239 61 19; (351) 239 61 56.
Помните, за действия (бездействие), повлекшие за собой возникновение очагов АЧС и её распространение предусмотрена административная и уголовная ответственность!
Мазлум Али, Власова Н.Н., Аронова Е.В., Иголкин А.С. ФГБУ"ВНИИЗЖ", г. Владимир
Кривонос Р.А. департамент ветеринарии Краснодарского края, г. Краснодар
Черных О.Ю. ГБУКК"Кропоткинская краевая ветеринарная лаборатория", г. Кропоткин
Введение. Метод, позволяющий определять количество инфекционных единиц вируса в различных образцах, является необходимым инструментом в вирусологии. В исследовательских лабораториях титр вируса, вызывающего цитопатический эффект в культуре клеток, обычно рассчитывают, исходя из количества пораженных единиц культуры клеток (лунки, флаконы), после внесения в них серийных разведений исходного вируссодержащего материала и выражают в тканевых цитопатических дозах - ТЦД50, если эффект наблюдается у половины инфицированных проб [13].
Использование данного метода требует продолжительного периода времени: от 3 до 10 дней в зависимости от свойств исходного вируса. С появлением новых технологий для определения титра вируса в пробе все чаще применяют метод ПЦР в реальном времени (ПЦР-РВ). По данным Van Guilder HD, Vrana KE, Freeman WM (2008) ПЦР-РВ (или количественная ПЦР) лабораторный метод, основанный на циклической амплификации определенных фрагментов генома, который используется для одновременной индикации возбудителя и измерения количества молекул ДНК. В свою очередь, после проведения соответствующих расчетов его результаты позволяют определить титр вируса в испытуемой пробе [22].
Возбудителем африканской чумы свиней (далее, АЧС) является ДНК-содержащий вирус семейства Asfarviridae, рода Asfivirus [2, 3, 8, 12]. Поскольку геном вируса АЧС представлен ДНК, в отличие от детекции геномов РНК-содержащих вирусов, для его обнаружения методом ПЦР-РВ не требуются получения кДНК, что, как минимум, на 1 час сокращает время исследований и составляет с этапом выделения ДНК 2 часа 30 минут.
Для титрования вируса АЧС используют первичные культуры клеток (культура клеток костного мозга свиней, культура лейкоцитов свиней, альвеолярных макрофагов свиней, почек свиней и селезенки свиньи), обладающие высокой чувствительностью [3, 4].
При культивировании в первичных культурах клеток свиньи вирус АЧС вызывает специфическую гемадсорбцию и оказывает цитопатогенное воздействие. Постановка реакции гемадсорбции (РГАд) является наиболее специфичным и чувствительным методом идентификации вируса АЧС, поскольку ни один из вирусов, поражающих свиней, не вызывает проявления гемадсорбции. Согласно рекомендации МЭБ, РГАд используется в качестве референтной методики выявления вируса АЧС, несмотря на трудоемкость постановки и продолжительность реакции (5-7 дней) [3, 4, 16, 20].
Исходя из вышеизложенного, при выполнении ряда лабораторных исследований и определении количества вируса в пробе в определенных случаях целесообразно заменить традиционные методы и использовать такие технологии, как ПЦР-РВ для проведения быстрого и эффективного анализа уровня накопления вируса.
Порогового значение цикла (Ct), фиксируемое в результате ПЦР-РВ, дает точные и воспроизводимые результаты с низкими стандартными отклонениями [21, 22].
Кроме того, ПЦР-РВ позволяет проводить абсолютную количественную оценку содержания нуклеиновых кислот в пробе при наличии референтной матрицы ДНК с известной концентрацией и количеством копий [24].
К другим преимуществам ПЦР-РВ относится быстрая и эффективная возможность сравнения и качественной оценки исследуемых образцов.
Так, в зарубежной литературе представлен ряд работ, в которых 4 демонстрируется определение вирулентности вируса по его содержанию в крови, отмечая, что скорость изменения С (соответственно, скорость увеличения титра в крови) у аттенуированного вируса ниже, чем у вирулентного [14, 18].
В своей работе Lacasta Anna et al. показали, что у животных, инфицированных аттенуированным штаммом вируса АЧС, наблюдалась более поздняя регистрация вирусной ДНК. Они выявляли вирус в назальных экскретах и крови только на 7-й день после инфицирования, причем, титр накопления вируса был в среднем ниже на 4-5 lg, чем у свиней, инфицированных вирулентным штаммом E75, и не превышал значений 104-5 ГАдЕ50/мл [18].
В другой работе Lewis T. et. al. показали, что делеция гена 9GL у вируса АЧС изолята Malawi Lil-20/1 (MAL) влияет на созревание ви-риона и репродукцию вируса в макрофагах и ослабляет вирусную инфекцию у свиней. Животные, инфицированные этим аттенуированным изолятом, оставались клинически здоровыми и демонстрировали увеличение значения Ot, выявляемое в ПЦР-РВ, что соответствовало снижению титра вируса в крови в 100-10 000 раз по сравнению с неделетированным изолятом Malawi Lil-20/1 [14].
Использование ПЦР-РВ в диагностике АЧС имеет еще одно преимущество перед РГАд, так как при постановке последнего невозможно выявление негемадсорбирующих вариантов вируса, как правило, у свиней с хронической или бессимптомной формой течения болезни. Следует также учитывать, что специфическая ГАд, хотя и является характерным признаком вирулентных вариантов вируса АЧС, отдельные негемадсорбирующие изоляты также могут быть высоковирулентными [15].
Таким образом, целью наших исследований являлось определение корреляции показателя Ct в ПЦР в режиме реальном времени и значений титра вируса, устанавливаемого в реакции гемадсорбции, а также расчета количества копий генома вируса АЧС в пробе.
Расчет титра вируса проводили по методу Рида и Менча, или по методу Кербера в модификации Ашмарина через 7 дней после начала эксперимента [9, 10].
В качестве источника геномной ДНК и для заражения культуры клеток или титрования исходного вируса в работе использовали вирус АЧС изолят Krasnodar 07/17, выделенный в июле 2017 года из пробы селезенки павшей домашней свиньи (Краснодарский край). Накопление вируса осуществляли путем его пассирования в первичной культуре клеток СС в течение 2-3 пассажей.
Для получения и накопления ПЦР-продукта использовали: матричную ДНК вируса АЧС изолят Krasnodar 07/17 в объеме 5 мкл на реакцию, Taq-ДНК-полимеразу - 0,5 мкл, 10*буфер с (NH4)2SO4 - 2 мкл, смесь дезоксинуклеотидтрифосфатов 10 мМ - 0,5 мкл (Fermentas), праймеры, фланкирующие ген B646L (табл. 1) (по 10 пМ каждого), и 2 мкл 25мМ MgCl2. Объем деионизированной воды рассчитывали, исходя из общего объема реакционной смеси, равного 20 мкл. Режим амплификации использован согласно работе Neilan J.G. и др., 2004 [19].
Таблица 1. Праймеры, использованные для амплификации гена B646L вируса АЧС
Последовательность 5' 3'
Результаты амплификации гена B646L оценивали с помощью электрофореза в 1,0% агарозном геле.
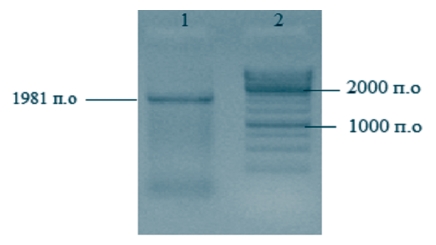
Рис. 1. Результаты электрофоретического разделения в 1% геле агарозы ПЦР-продукта (вирус АЧС изолят Krasnodar 07/17): трек 1 - электрофорез ПЦР-продукта полноразмерного гена B646L; трек 2 - маркер 1к (производитель ThermoFisher) с линейкой фрагментов от 10000 п.о. до 250 п.о.
Поскольку размер амплифицированного фрагмента 1981 п.о. и его концентрация после очистки из агарозного геля составляла 25,1 нг/мкл, рассчитанное количество копий гена составляло 1,17x1с11 копий/мкл.
На втором этапе исследований приготовили 10 десятикратных разведений образца ПЦР-продукта и провели их анализ в ПЦР-РВ с трехкратной повторностью. Результаты представлены в таблице 2.
Таблица 2. Значение Ct в ПЦР-РВ при разных концентрациях амплификата гена B646L вируса АЧС (n=3)
| Разведение пробы | Концентрация ДНК амплификата гена B646L (нг/мкл) | Значение Ct | Количество копий гена в 1мкл | Результат |
|---|---|---|---|---|
| 1 | 25,1Ч10-1 | -* | 1,17Ч19 | Ложн.отр |
| 2 | 25,1Ч10-2 | -* | 1,17Ч18 | Ложн.отр |
| 3 | 25,1Ч10-3 | -* | 1,17Ч17 | Ложн.отр |
| 4 | 25,1Ч10-4 | 5.8 | 1,17Ч16 | Пол. |
| 5 | 25,1Ч10-5 | 8.2 | 1,17Ч105 | Пол. |
| 6 | 25,1Ч10-6 | 11.34 | 1,17Ч104 | Пол. |
| 7 | 25,1Ч10-7 | 15.15 | 1,17Ч103 | Пол. |
| 8 | 25,1Ч10-8 | 18.09 | 1,17Ч102 | Пол. |
| 9 | 25,1Ч10-9 | 21.11 | 1,17Ч101 | Сомн. |
| 10 | 25,1Ч10-10 | 25.00 | 1,17 | Сомн |
Полученные результаты ПЦР-РВ продемонстрировали обратно пропорциональную линейную зависимость показателя Ct от количества копий гена B646L вируса АЧС, когда снижение концентрации в 10 раз приводит к увеличению Ct на 3 цикла (рисунок 2).
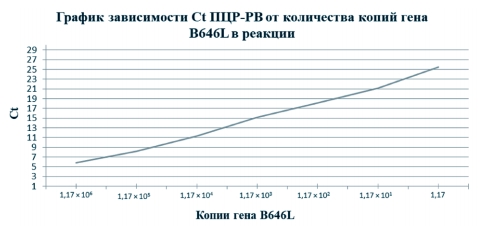
Рис. 2. Корреляция значений Ct ПЦР-РВ с количеством копий гена B646L
Таким образом, в результате экспериментов было установлено, что при высокой концентрации ДНК в образцах (>1,17x10 копий генома) реакция ПЦР-РВ может приводить к ложно отрицательному результату, поскольку чрезмерное количество исходной матрицы препятствует отжигу праймеров на амплифицированных матрицах, а когда количество копий снижается ПЦР-РВ позволяет обнаруживать геном вируса АЧС вплоть до минимального количества копий - 11,7 копии/мкл. Так как для постановки реакции используется 10 мкл матричной ДНК, чувствительность ПЦР-РВ в данных опытах составляет 117 копий.
На следующем этапе для наиболее точного определения титра вируса АЧС в пробе с помощью реакции гемадсорбции, провели сравнительный анализ чувствительности первичных культур клеток.
С этой целью параллельно заразили культуры клеток СС и КМС вирусом АЧС изолят Krasnodar 07/17 в дозе 103 ГАдЕ50 на матрас (объем 50 мл), и наблюдали за репродукцией вируса в культуре клеток. Из каждого матраса на седьмые сутки отобрали по 300 мкл культуральной жидкости, исследовали данные образцы методом ПЦР-РВ и определяли титр вируса АЧС в обеих культурах клеток в РГАд. Р результате титр вируса АЧС в культуре клеток СС составил 106 ГАдЕ50, а титр вируса АЧС в культуре клеток КМС составил 105 ГАдЕ50, то есть на 1lg ниже. Полученные данные также были подтверждены методом ПЦР-РВ, где значение Ct на седьмой день в культуре клеток СС составило 12,2, а в культуре клеток КМС 15,9.
Поскольку обе культуры клеток были использованы для заражения одной и той же дозой вируса, а репродукция вируса АЧС в культуре клеток СС показала более высокую чувствительность данной культуры к вирусу, для выполнения дальнейших этапов работы была выбрана культура клеток СС, как наиболее соответствующая целям исследований.
Таблица 3. Значение Ct ПЦР в реальном времени при разных разведениях вируса АЧС (n = 3)
| Титр | Разведение | Ct/ВКВ* | Среднее** | Стандартное отклонение*** | 95% доверительный интервал**** |
|---|---|---|---|---|---|
| 107 ГАдЕ 50 | исходный | 20,54 | 8,03 | ±0,12 | 7,67 – 8,39 |
| 106 ГАдЕ50 | 1 | 22,71 | 11,95 | ±0,136 | 11.54 – 12,36 |
| 105 ГАдЕ50 | 2 | 23,38 | 16,23 | ±0,542 | 14,6 – 17,86 |
| 104 ГАдЕ50 | 3 | 23,61 | 19,84 | ±0,138 | 19,43 – 20,25 |
| 103 ГАдЕ50 | 4 | 23,83 | 23,86 | ±0,565 | 22,17 – 25,56 |
| 102 ГАдЕ50 | 5 | 23,48 | 27,37 | ±0,574 | 25.65 – 29.07 |
| 10 ГАдЕ50 | 6 | 25,26 | Н.З | Н.З | Н.З |
| 0,1 ГАдЕ50 | 7 | 24,38 | Н.З | Н.З | Н.З |
Примечание: Н.З - нет значения Ct; * - внутренний контроль выделения ДНК; ** - среднее значение рассчитано по формуле:

Для определения формулы расчета титра вируса построили линию регрессии и рассчитали коэффициент корреляции между логарифмом титра вируса и логарифмом Ct с помощью программы Statistica (рисунок 3)
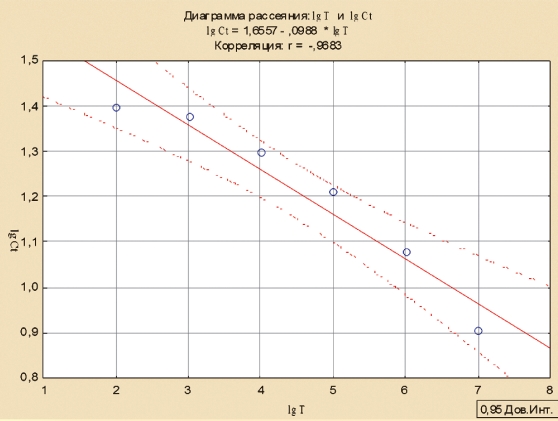
Рис. 3. График зависимости между логарифмом титра вируса АЧС и логарифмом значения Ct ПЦР-РВ
В наших исследованиях, коэффициент корреляции составил 0,9683, что свидетельствует о высокой достоверности (точности) исследований и позволяет производить вычисление титра вируса в пробе.
Таким образом, при анализе корреляции между показателями Ct ПЦР-РВ и результатами титрования проб в культуре клеток СС удалось установить близкую к линейной зависимость показателя Ct от титра вируса АЧС. Необходимо отметить, что в данном случае снижение концентрации на 1,0 lg, приводило к увеличению Ct на 4 цикла (рисунок 4).
Следующим этапом нашей работы являлось определение аналогичного соответствия показателей Ct ПЦР-РВ с титром вируса, полученного из крови инфицированного животного вирусом АЧС изолят Krasnodar 07/17, павшего на 7 сутки после заражения (титр вируса в крови составлял 7,0 lg ГАдЕ/см3). Аналогично опытам с изолятом Krasnodar 07/17 в культуре клеток СС, образцы крови также использовали для приготовления 7 десятикратных разведений для исследования методом ПЦР-РВ в 3 повторностях. Сравнение результатов экспериментов и определение соотношения значений Ct и титра вируса продемонстрировало практически полную идентичность полученных результатов (рисунок 4).
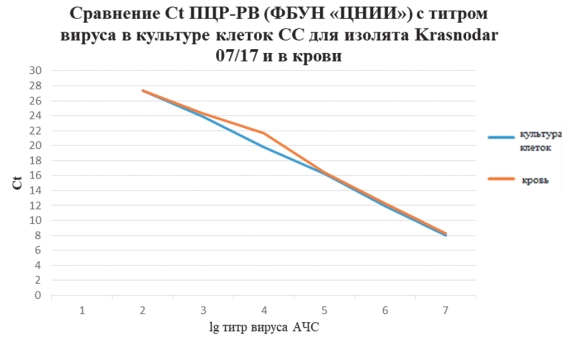
Рис. 4. Значение Ct ПЦР-РВ в соотношении с титром вируса АЧС в культуре клеток и в крови инфицированной свиньи
Результаты Ct обоих экспериментов в культуре клеток и в крови показали высокий уровень достоверности.
По результатам, представленным на рисунке 4, видно равномерное снижение значения Ct на 4 цикла при каждом последующем десятикратном разведении (то есть при увеличении титра на один логарифм). Следовательно, корреляция выражается в линейной зависимости соотношения Ct и титра вируса, подъем значения Ct каждые 4 цикла соответствовал снижению титра вируса на 1 lg.
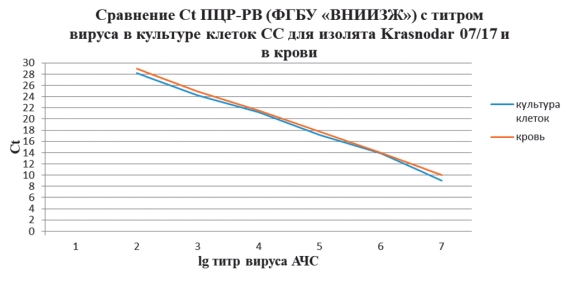
Рис. 5. Значение Ct ПЦР-РВ в соотношении с титром вируса АЧС в культуре клеток и в крови инфицированной свиньи
Однако, считаем необходимым обратить внимание, что значение циклов Ct могут изменяться в зависимости от чувствительности набора, целевого детектируемого участка генома вируса АЧС, и чувствительности культуры клеток, на которой проводится определение титра вируса.
Заключение. Как правило, уровень репродукции вируса АЧС определяется титрованием в культуре клеток, поскольку чувствительность РГАд в 10 раз выше (1 ГАдЕ - 10-12 вирионов), чем чувствительность ПЦР-РВ (10 ГАдЕ или
117 копий), но постановка этой реакции более трудоемка и длительна (7-10 сутки) по сравнению с ПЦР-РВ (2 час 30 минут). Кроме того, несмотря на то, что титрование более чувствительный метод, в определенных случаях, точность результата зависит от чувствительности культуры клеток и квалификации исполнителя.
Выявленная корреляция между значением Ct и титром вируса в пробе позволяет в лабораторной практике использовать ПЦР-РВ для количественного определения содержания вируса в образце, а также, дает возможность детального изучения ряда биологических свойств возбудителя АЧС.
При необходимости использование ПЦР-РВ также дает возможность определить количество копий генома вируса в исследуемых образцах, с поправкой на то, что корреляция должна быть изучена и оптимизирована для определенного набора.
Ключевые слова: вирус африканской чумы свиней, полимеразная цепная реакция в режиме реального времени, реакция гемадсорбции, значения Ct, культура клеток СС, культура клеток КМС, геном вируса АЧС, корреляция, количество копий, биологические свойства, количественный метод.















Управление ветеринарии Курганской области является уполномоченным в области ветеринарии органом исполнительной власти Курганской области, осуществляющим государственное регулирование в сфере ветеринарной деятельности на территории Курганской области, и входит в систему государственной ветеринарной службы Российской Федерации.
Задачами Управления являются:
1) защита населения от болезней, общих для человека и животных;
2) охрана территории Курганской области от заноса заразных болезней животных;
3) предупреждение и ликвидация заразных и массовых незаразных болезней животных;
4) обеспечение безопасности продуктов животноводства в ветеринарно-санитарном отношении.
Управление ветеринарии Курганской области обладает правами юридического лица, имеет гербовую печать.
Финансирование Управления ветеринарии Курганской области и подведомственных учреждений осуществляется за счет средств областного бюджета.
Почтовый адрес Управление ветеринарии Курганской области:
640002, г. Курган, ул. Володарского, 65 стр.1
часы работы с 9-00 до 18-00
телефоны: 8 (3522) 43-10-30
Новости
Разъяснение о реализации продукции растениводства
- фуража (растительный корм, для питания животных, содержащих высушенные или не высушенные, обработанные или не обработанные вегетативные части растений (стебли, листья, ветки, корни) исключая плоды и семена;
- корма (готовый корм растительного происхождения, включая комбикорма, для свиней и корма, которые могут быть использованы для кормления свиней, компоненты для приготовления кормов — семена зерновых (зернобобовых) целых и измельченные, а именно кормовая пшеница, рожь, овес, ячмень, просо.
Запрет не распространяется на целые и измельченные семена растений, предназначенные в пищу людям, в корм и для приготовления кормов (исключая кормовые пшеницу (включая полбу), рожь, овес, ячмень, просо) для комнатных животных (птицы, кошки, собаки и др.), рыб, рептилий, земноводных, для наземных и водных беспозвоночных животных.
С учетом вышеизложенного, поясняем:
1. Ограничений связанных с реализацией продукции растениеводства внутри территории Курганской области не вводится за исключением предприятий занимающих отраслью свиноводства на которые поставка возможна только после тепловой обработке при температуре свыше 70 °С в течении не менее 0,5 часа.;
2. При реализации продукции растениеводства за пределы Курганской области действуют следующие правила:
- реализация зерна разрешена на все птицеводческие и животноводческие предприятия (за исключением предприятий, осуществляющих выращивание свиней);
- реализация зерна на свиноводческие и зерноперерабатывающие предприятия, осуществляющие переработку зерна на корм, разрешено только после тепловой обработки при температуре свыше 70 °С в течении не менее 0,5 часа. При этом, руководитель предприятия, реализующего зерно, предоставляет ветеринарной службе официальное письмо за своей подписью руководителя и подкрепленной оригинальной печатью предприятия о прохождении данной партии зерна тепловой обработке при температуре свыше 70 °С в течении не менее 0,5 часа и несет полную ответственность в случае выявления в ней вируса АЧС;
- реализация продовольственного зерна и семян сельскохозяйственных культур, жмыхов не ограничена.
Коренной Ф.И., Гуленкин В.М.
Application of a Geoinformation System ArcGIS in the Veterinary Epidemiological Analyis
Basic aspects of ArcGIS software application are set forth for the work on the analysis of the veterinary epidemiological situation, which is being carried out in the Information and Analysis Centre of the Veterinary Surveillance Authority (the city of Vladimir). Here is given a brief outline of basic GIS methods, which are used in the field of veterinary medicine around the world. The article represents data on international non-governmental associations, which provide the cooperation of specialists in the field of geospatial epidemiology.

В статье изложены основные аспекты применения инструментария ArcGIS для работ по анализу эпизоотологической информации, проводимых в информационно-аналитическом центре Управления Ветнадзора (г.Владимир). Дается краткий обзор основных методов технологии геоинформационных систем (ГИС), используемых в области ветеринарной медицины за рубежом. Приведены сведения о международных неправительственных ассоциациях, обеспечивающих сотрудничество специалистов в области геопространственной эпидемиологии.
Введение
Бурное развитие вычислительной техники в последние десятилетия предопределило появление мощных программных комплексов – географических информационных систем (ГИС) – обеспечивающих хранение, моделирование, анализ и визуализацию больших массивов данных, имеющих географическую привязку. Применение ГИС в области ветеринарной медицины для эпизоотологического анализа позволило вывести ветеринарную географию на новый уровень, предоставив возможности:
- централизованного сбора и хранения информации о пространственном распределении регистрируемых вспышек заболеваний животных;
- автоматизированного анализа этих данных с целью выявления закономерностей, обусловленных сходством природных и социально-экономических факторов на различных территориях;
- создания электронных и бумажных карт для отображения эпизоотической ситуации как в отдельно взятых регионах, так и в мире в целом;
- создания карт риска, отображающих вероятность заноса/возникновения определенного заболевания.
Начало широкого применения ГИС для нужд эпизоотологического анализа датируется второй половиной 90-х годов прошлого века и связано с именами таких ученых как P.Durr (Австралия), A.Gatrell (Великобритания), M.Ward (Австралия), A.Lawson (США). Одной из основополагающих работ в этом направлении можно считать книгу “GIS and Spatial Analysis in Veterinary Science”, вышедшую под редакцией P.Durr и A.Gatrell в 2004 г. [1]. Хороший обзор технологий применения ГИС в области эпидемиологии и работ в этом направлении дан также в статье [2].
ГИС в ветеринарной медицине Российской Федерации
Ниже перечислены основные аспекты применения ГИС в информационно-аналитическом центре.
1. Создание и поддержка баз данных по заболеваниям животных на территории Российской Федерации и за рубежом. Основными заболеваниями, с которыми работает ИАЦ в настоящее время, являются ящур, африканская чума свиней, классическая чума свиней, высокопатогенный грипп птиц, бешенство, сибирская язва, бруцеллез, лептоспироз и некоторые другие заболевания. Для создания в среде ArcGIS базы геоданных по какому-либо заболеванию широко используются GPS-технологии и программа Google Earth Pro. Как правило, база данных представляет собой шейп-файл точечного типа, представляющий локализацию зарегистрированных вспышек заболевания. Атрибутами для каждой вспышки являются такие ее характеристики, как дата начала заболевания, наименование населенного пункта (либо другого географического пункта), где зарегистрировано заболевание, количество заболевших животных, общее количество животных в очаге, серотип вируса, источник информации и т.д. Кроме того, сотрудниками ИАЦ созданы базы данных по популяции сельскохозяйственных и диких животных, расположению крупных животноводческих предприятий, пограничных пунктов ветеринарного контроля на основании информации, предоставляемой Государственным комитетом по статистике РФ и другими официальными источниками.

Рис. 1. Пример отображения тематических слоев эпидемически значимых объектов по Владимирской области.
Рис. 2. Примеры карт, созданных в Информационно-аналитическом центре Управления Ветнадзора, г.Владимир.
3. С целью прогнозирования возможного распространения заболеваний в ИАЦ проводится работа по геопространственному анализу данных по текущей заболеваемости. При ее выполнении широко применяются инструменты ArcGIS для пространственного (географического) анализа. Например, применение инструмента “Standard Deviational Ellipse” к данным о вспышках африканской чумы свиней (АЧС) на территории России за 2007-2010 гг. позволило сделать вывод о различных факторах, обусловливающих распространение заболевания среди диких кабанов и среди домашних свиней (рис. 3). Так, вспышки заболевания у диких кабанов имеют тенденцию группировки вдоль лесных массивов у подножья Кавказского хребта. Направление же распространения заболевания среди домашних свиней совпадает с направленностью основных транспортных магистралей в регионе, что дает право предположить антропогенную природу переноса возбудителя (при транспортировке животных, мясопродуктов и кормов). Еще один из широко использующихся инструментов ArcGIS – функция вычисления пространственной автокорреляции (статистика Морана). С ее помощью, например, были наглядно выявлены пространственно-временные кластеры заболевания (рис. 4)
Одной из часто применяемых нами функций является вычисление пространственной плотности объектов (“Kernel Density”). Данный инструмент используется как для визуализации пространственного распределения каких-либо объектов интереса (например, плотность распределения птицефабрик на территории России, см. рис. 5), так и при выполнении более сложных работ, связанных с анализом географических и социо-экономических факторов, ассоциированных с распределением случаев заболевания. Вычисление пространственной плотности широко использовалось, например, при выявлении факторов риска распространения африканской чумы свиней. В этой работе был сделан вывод о преимущественном влиянии густоты дорожной сети, плотности домашнего свинопоголовья, а также плотности водных объектов на вероятность возникновения новых случаев АЧС. Были определены коэффициенты регрессии, что позволило составить карту риска распространения заболевания для всей территории России (рис. 6). Дальнейший ход эпизоотии показывает хорошее согласие полученных данных с локализацией вновь возникающих вспышек.

Рис. 5. Пример использования инструмента “Kernel Density” для визуализации плотности распределения птицефабрик на территории страны.

Рис. 6. Карта риска распространения африканской чумы свиней, составленная с использованием инструмента “Kernel Density”.
4. Сотрудниками информационно-аналитического центра составлены методические рекомендации по применению программного обеспечения ArcGIS для геопространственного анализа вспышек заболеваний животных [10, 11]. Они предназначены для эпизоотологов, научных сотрудников, персонала управлений Россельхознадзора и Департаментов ветеринарии субъектов Российской Федерации.
Международные неправительственные организации
Литература и ссылки
1. GIS and Spatial Analysis in Veterinary Science. Edited by Durr, P.A., Gatrell, A.C./ CABI Publishing, 2004.- 307 p.
2. Kistemann, T., Dangendorf, F., Schweikart, J. New perspectives on the use of Geographical Information Systems (GIS) in environmental health sciences/ J. Hyg. Environ. Health, 2002- v.205.- p. 169-181
16. Lawson, Andrew B. Bayesian Disease Mapping: Hierarchical Models in Spatial Epidemiology / Chapman and Hall/CRC. 2008. - 368 p.
Читайте также:


