Материал от больного для микробиологического исследования при чуме
Для лабораторной диагностики чумы используют бактериоскопический, бактериологический, биологический, серологические и молекулярно-генетические методы.
Диагноз чумы у человека ставится на основании выявления у него возбудителя – выделение и идентификация культуры, обнаружения специфического для чумного микроба антигена FI и специфических антител к антигену FI в сыворотках больных и переболевших.
В качестве экспресс-методов используют иммунофлюоресцентный анализ (обнаружение микроба с помощью флюоресцирующих иммуноглобулинов), ПЦР (обнаружение микроба по наличию искомого участка ДНК в результате его многократного копирования), иммуносуспензионные методы – система 2-3 компонентных реакций с эритроцитарными диагностикумами или иммуноферментный анализ для обнаружения специфических антигенов чумного микроба. С этой же целью применяют и другие варианты иммуносуспензионных методов: дот-иммуноферментный анализ, радиоиммунный анализ. Все экспресс-методы выполняют после обеззараживания материала.
Обязательному лабораторному исследованию подлежит материал:
- от больных людей с симптомами болезни, сходными с клиническими проявлениями всех форм чумы;
- лиц, контактировавших с больными легочной чумой;
- лиц, участвовавших (без защитной одежды) во вскрытии трупов людей и верблюдов, погибших от чумы;
- лиц, участвовавших в прирезке и разделке туши больного чумой верблюда и других животных, обработке мяса в процессе приготовления пищи, употреблявших в пищу мясо больных чумой животных;
- лиц, совершивших аварию с разбрызгиванием заразного материала при работе с возбудителем чумы.
Материал от больных, как правило, целесообразно брать сразу при поступлении в лечебное учреждение и спустя 3 дня после окончания специфического лечения антибиотиками с интервалами между очередными исследованиями 24 ч до получения трех отрицательных результатов. Материал от лиц, контактировавших с больными или контаминированными объектами – при поступлении в изолятор и по окончании профилактического лечения, перед выпиской.
Исследованию подлежит: при легочной форме чумы – мокрота, при её отсутствии – мазок из зева, кровь из вены, моча; при септической форме – кровь, моча; при бубонной форме – пунктат бубона, кровь, моча; при кожной форме – отделяемое язвы, кровь, моча; при кишечной форме – кал, кровь, моча; при менингиальных явлениях – спинномозговая жидкость.
У лиц, контактировавших с больным легочной формой чумы, а также в других случаях, если есть подозрение, что заражение произошло аэрогенным путем, исследуют мазок из зева. В остальных случаях у контактных исследования не проводят.
Забор материала на исследование у больных с подозрением на чуму следует, как правило, проводить в условиях стационара до начала специфического лечения обученным квалифицированным медицинским персоналом под наблюдением специалиста противочумного учреждения или специалиста по особо опасным инфекциям ЦГиЭ субъекта Российской Федерации. В случае невозможности забрать материал в первые 2 ч после возникновения подозрения, лечение начинают по клиническим показаниям до забора материала.
Забор материала у лиц, контактировавших с больными чумой и совершивших аварию, производят в изоляторе до начала профилактического лечения.
Исследование материала проводят специалисты территориальных противочумных учреждений на своей базе, а также на базе лабораторий отделов особо опасных инфекций ФГУЗ ЦГиЭ субъекта Российской Федерации, если они соответствуют требованиям действующих "Санитарных правил безопасности работы с микроорганизмами I-II групп патогенности". Специалисты отделов особо опасных инфекций проводят исследование обеззараженного материала экспресс-методами. Ведущим методом является люминесцентно-серологический. Определение антигена у больного возможно только при осложненной клинике в спинномозговой жидкости, в пунктате бубона – при тяжелом течении болезни, в моче – при всех формах болезни, начиная с 3-4 дня заболевания в низких титрах.
Методы забора материала – в приложении 8.
Запрещается давать окончательный (отрицательный или положительный) ответ на основании результатов экспресс-методов.
Исследование материала от больного чумой.
- приготовление мазков, окраска фиксированных мазков анилиновыми красителями, чумными флюоресцирующими иммуноглобулинами;
- полимеразная цепная реакция;
- посев на жидкие и плотные питательные среды со стимуляторами роста чумного микроба (кровь, моча, спинномозговая жидкость, пунктат бубона);
- посев на плотные питательные среды со стимулятором роста чумного микроба и ингибиторами посторонней флоры (мокрота, мазок из зева, субстрат из вскрывшегося бубона, отделяемое язвы, моча, испражнения);
- проба с диагностическими бактериофагами нативного материала на соответствующей плотной среде;
- проба на чувствительность к антибиотикам с нативным материалом на плотной среде методом дисков;
- поиск антигена FI иммуносуспензионными методами: реакция непрямой гемагглютинации, реакция нейтрализации антител, иммуноферментный анализ, дот-иммуноферментный анализ, радиоиммунный анализ (моча, спинномозговая жидкость, пунктат бубона); параллельно в качестве контроля ставят те же реакции с диагностикумами на другие инфекции (туляремия, бруцеллёз, холера и др.);
- заражение лабораторных животных (морские свинки, белые мыши) внутрибрюшинно и подкожно (кровь, пунктат бубона, спинномозговая жидкость), подкожно и накожно (мокрота, мазок из зева, вскрывшийся бубон, отделяемое язвы, моча, испражнения).
II этап (2-5 ч от начала исследования):
- выдача предварительного положительного ответа на основании наличия в мазках биополярно окрашенных грамотрицательных овоидных палочек, их специфического свечения при окраске мазка флюоресцирующими чумными иммуноглобулинами, положительной ПЦР, положительных иммуносуспензионных реакций при отрицательных контролях.
III этап (24-48 ч):
- выдача подтверждения предварительного положительного ответа на основании наличия характерного роста на жидких и плотных питательных средах, наличия в мазках из этих сред грамотрицательных овоидных палочек с биполярным окрашиванием, положительной пробой с бактериофагами (лизис культуры чумными бактериофагами Покровской и Л-413С).
Высев культуры для дальнейшей идентификации на питательный агар и агар с содержанием дефибринированной крови (5 %) для определения продукции FI после инкубации при 37° С. Одновременно выдача предварительного ответа о чувствительности выделенной культуры к антибиотикам. Посев культуры на среды Гисса с рамнозой, глицерином, сахарозой, арабинозой, ЦДС или среду Ленской для определения уреазной активности (после накопления чистой культуры).
IV этап (3-7-е сутки):
- выдача окончательного положительного ответа на основании выделения чистой культуры чумного микроба из посевов нативного материала, его идентификации по морфологическим, культуральным, биохимическим признакам, чувствительности к диагностическим бактериофагам, наличию специфических плазмид, а также на основании подтверждения диагноза выделением идентичных культур от павших или забитых лабораторных животных.
V этап (5-8-е сутки):
- выдача отрицательного ответа на основании отсутствия специфического роста на питательных средах при посеве нативного материала и органов забитых биопробных животных, отрицательной ПЦР, отрицательных иммуносуспензионных реакций с нативным материалом и органами забитых или павших биологических проб, отсутствия патологоанатомических изменений у последних, отсутствия в парных сыворотках больного специфических антител к чумному микробу.
Исследование материала от лиц, контактировавших с больными легочной формой чумы, а также лиц, присутствовавших при аварии с разбрызгиванием заразного материала.
Исследуемый материал – мазок из зева.
- приготовление мазков, окраска анилиновыми красителями, флюоресцирующими чумными иммуноглобулинами;
- полимеразная цепная реакция;
- посев на плотные селективные среды;
- заражение лабораторных животных подкожно и накожно.
- выдача предварительного положительного ответа на основании обнаружения специфически светящихся клеток в люминесцентном микроскопе, положительной ПЦР.
- выдача подтверждения предварительного положительного ответа на основании наличия характерных по морфологии колоний в посевах на плотной среде;
- пересев колоний на питательный слабощелочной агар, на селективный агар и на агар с кровью для дальнейшей идентификации (последний посев ставят в термостат с 37° С для последующего определения F1);
- при достаточном количестве колоний постановка пробы на чувствительность с диагностическими бактериофагами на плотной среде и пробы на чувствительность к антибиотикам методом дисков.
IV этап (3-4-е сутки):
- выдача положительного ответа на основании выделения типичной по морфологии культуры, лизирующейся диагностическими бактериофагами;
- положительных иммуносуспензионных реакций на наличие антигена F1;
- дальнейшая идентификация выделенной культуры.
V этап (5-8-е сутки):
- вскрытие забитых биопроб, их исследование бактериологически и серологически;
- выдача окончательного положительного ответа на основании выделения и идентификации культуры чумного микроба, типичной по морфологическим, культуральным, биохимическим свойствам, фаголизабельности, наличию специфических плазмид, подтверждения диагноза выделением идентичной культуры от павших или забитых биопробных животных (схема идентификации выделенных культур – в приложении 9;
- выдача отрицательного ответа на основании отсутствия специфически светящихся клеток в мазках, окрашенных люминесцирующими чумными иммуноглобулинами, отрицательной ПЦР, отсутствия роста характерных по морфологии колоний на плотной среде, отсутствия характерных для чумы изменений в органах у биопробных животных и отсутствия специфического роста на плотной среде из посевов отпечатков их органов.
Исследование материала от трупа человека, погибшего от чумы.
Исследованию подлежат: кусочки паренхиматозных органов, легких из мест, где есть характерные для чумы изменения, лимфатические узлы, как регионарные к первичному аффекту, так и другие, увеличенные и имеющие изменения, сгустки крови из сердца и крупных сосудов, сыворотка крови, полученная из сгустков при их сокращении, участки любой ткани, имеющие изменения септического характера, спинномозговая жидкость, моча, содержимое кишечника, в случае наличия признаков загнивания трупа исследуют спинной и головной мозг.
Исследования ведут по этапам, как исследование материала от больного чумой человека.
Положительный предварительный диагноз может быть поставлен на любом этапе, так как при гибели от чумы все органы и ткани содержат большое количество возбудителя и его антигенов, в том числе FI. Поэтому весьма вероятен первый положительный ответ уже через 2 ч после исследования на основании наличия грамотрицательных биполярно окрашенных палочек, специфически светящихся в люминесцентном микроскопе при обработке мазков-отпечатков флюоресцирующим чумным иммуноглобулином, положительной ПЦР, высокого титра антигена FI в тканях и органах, наличия противочумных антител в сыворотке.
Высокая вероятность подтверждения диагноза через 24-48 ч после начала исследования на основании обнаружения типичных по морфологии колоний чумного микроба, положительной пробы с бактериофагом, которую следует ставить на селективном агаре во избежании зарастания пятна лизиса культуры посторонней флорой и отрицательного ответа в 2-5 часов исследований
Окончательный положительный ответ может быть поставлен через 48 ч – 6 сут. по результатам идентификации культуры чумного микроба и подтверждения ее выделением идентичной культуры от биопробного животного.
Окончательный отрицательный диагноз дают на 5-8 сутки, как и при исследовании материала от больного.
Запрещается выдавать отрицательный ответ по результатам ускоренного исследования и на основании результатов экспресс-методов.
Дата добавления: 2015-09-15 ; просмотров: 3867 . Нарушение авторских прав
1. Забор материала и микроскопическое исследование
4. Ускоренные методы бактериологического исследования
1. Чума является чрезвычайно контагиозной, поэтому взятие материала от больного (особенно легочной формы) производится с соблюдением мер предосторожности. Работа в очаге проводится в полном противочумном костюме.
В лабораторию могут быть доставлены следующие материалы:
• содержимое бубона (легочная форма чумы);
• отделяемые язвы или пунктет из карбункула (кожная форма чумы);
• материал из зева, взятый тампоном, и мокрота (легочная форма чумы);
• секционный материал (кусочки органов трупа, кровь);
Материал необходимо брать до назначения лечения. Значение микробиологического диагноза огромно, особенно для выявления первых случаев чумы. Предварительный диагноз устанавливают на основании микроскопического исследования материала, окончательный — на основании выделения и идентификации культуры.
Микроскопическое исследование: мазки фиксируют погружением полностью в жидкость Инпифорова на 20 мин. Окраска по Граму обязательна во всех случаях. Одновременно окрашивают мазок метиленовым синим Леффлера, так как этот метод лучше выявляет биполярность.
2. Бактериологическое исследование: посевы исследуемого материала производят на агар добавлением стимуляторов роста (кровь, сульфит натрия). При исследовании материала, обильно загрязненного посторонней микрофлорой (загнившие трупы, мокрота), к агару добавляют генциановый фиолетовый 1 : 100 000. В случаях подозрения на наличие бактериофага посевы обрабатывают антифаговой сывороткой. Инкубацию посевов проводят при 28 °С. В положительных случаях через 12 ч появляются колонии в виде характерных "кружевных платочков". Когда чистая культура выделена путем прямого посева, она подлежит идентификации на основании следующих данных.
• внешний вид колонии на агаре;
• характерный рост на бульоне;
• типичная морфология микробов в мазках и отрицательная окраска по Граму;
• типичная патологоанатомическая у лабораторных животных при заражении их чистой культурой;
• агглютинация со специфической сывороткой;
• отношение к специфическому бактериофагу. Исследование ферментативных свойств, подвижности и т. п. производят лишь в специальных случаях для дифференциального диагноза с родственными видами бактерий. Проба с фагом осуществляется на твердых средах путем нанесения капли фага на свежий посев культуры и на жидких — путем добавления в бульонную культуру фага в количестве 1/10 объема культуры. Окончательное заключение делают на основании изучения комплекса признаков исследуемой культуры. При этом не следует забывать о явлении изменчивости.
3. Биологическая проба обязательна при исследовании; наиболее чувствительными из лабораторных животных являются морские свинки и белые мыши. Для постановки биологической пробы животных заражают внутрибрюшинно, подкожно или внутрикожно, а в случае загрязнения материала посторонней микрофлорой — втиранием в скарифицированную кожу.
В зависимости от способа заражения и степени чувствительности к возбудителю животные погибают от чумы на 3—9-й день после инфицирования, изменения во внутренних органах в виде геморрагического воспаления, кровоизлияния: в мазках-отпечатках из органов — множество чумных микроорганизмов; посевы инфицированных органов и крови дают обильный рост возбудителя.
4. Ускоренные методы бактериологического исследования. Метод ускоренного обнаружения возбудителя чумы с помощью бактериофага, внесенного в исследуемый материал, используют для исследования объектов, имеющих основное практическое значение: материал от больного, от трупа, из внешней среды. Исследуемый материал наносят на 3 агаровые пластины с гемо-лизированной кровью и генциановым фиолетовым. На первой и второй агаровой пластине в исследуемый материал сразу же вносят чумной бактериофаг (разведенный в 10 раз). На третью чашку бактериофаг не добавляют (контроль). Результаты начинают читать через 2,5—3 ч после помещения их в термостат. При наличии значительного количества микробов чумы в исследуемом материале уже через 2 ч на фоне начального роста чумного микроба видны мелкие палочки бактериофага. Метод ускоренной диагностики чумы основан на свойстве чумного бактериофага быстро (30—40 мин) размножаться в присутствии микроба чумы.
Большого внимания заслуживает люминесцентно-серологический метод, с помощью которого можно обнаружить возбудитель чумы в воздухе, воде, пищевых продуктах. Реакция нарастания титра фага (в качестве индикаторного фага предложен чумной бактериофаг, выпускаемый институтом "Микроб" в качестве эталонной культуры). Применение реакции нарастания титра фага для индикации чумных микробов основано на экспериментальном исследовании; пользуясь реакцией нарастания титра фага, за 3—3 Уг ч удается обнаружить 1 млн палочек чумы.
В качестве исследуемого материала могут быть использованы вода, кровь, отпечатки из органов, выделения из бубона. Материал сначала подращивают на средах, затем прибавляют генциан фиолетовый (1 мл 0,1%-ный водно-спиртовой раствор на 100 мл среды) для подавления посторонней микрофлоры, а затем добавляют в пробирки разные концентрации фага.
5. Серологические реакции в практике нашли широкое применение. Они используются при подозрительных на чуму заболеваниях для ретроспективного диагноза, при обследованиях природных источников чумы. С этой целью применяют иммунофермент-ную агглютинацию, реакцию пассивной гемагглютинации, реакции непрямой агглютинации. Экспресс-методом является люминесцентно-серологический, позволяющий обнаружить возбудителя в исследуемом материале через 2 ч.
Возбудитель чумы – Yersinia pestis относится к высокопатогенным микроорганизмам (1 группы патогенности). Взятие, доставка материала при подозрении на чуму и работа с ним производятся в специализированных лабораториях с соблюдением особых правил предосторожности (в противочумном костюме, с применением специальных средств и устройств, предотвращающих попадание микроорганизма на кожу, слизистые оболочки и в дыхательные пути медицинского персонала, а также на различные объекты внешней среды).
Лица, контактировавшие с материалом, подозрительным на содержание возбудителя чумы, подвергаются полной санитарной обработке.
Принципы микробиологической диагностики чумы отражены в схеме 4.
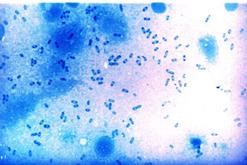
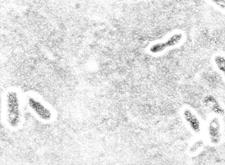
Бактериоскопический метод. Мазки, приготовленные из исследуемого материала, фиксируют в смеси Никифорова, окрашивают по Граму и метиленовым синим. С целью экспресс-диагностики мазки обрабатывают также меченой люминесцирующей сывороткой к Y. pestis (прямой ИФМ). Предварительный положительный ответ выдается в случае обнаружения в мазках биполярно окрашенных грамотрицательных овоидных бактерий, окруженных нежной капсулой (рис.7), дающих специфическое свечение в РИФ.
В качестве других методов экспресс-диагностики чумы применяют РНГА с иммуноглобулиновым чумным диагностикумом, ИФА для индикации антигенов возбудителя.
Методы ускоренной и экспресс-диагностики дают возможность дать предварительный ответ через 4 ч от начала исследования, окончательный - через 18-20 ч.
Схема 4. Микробиологическая диагностика чумы
| |
|
|
а б
Рис. 7. Возбудитель чумы(Yersinia pestis). а - чистая культура, окраска метиленовым синим. Палочки овоидной формы, окрашенные биполярно.х 630. б– мазок из материала от больного, окраска по Граму. Грамотрицательные, биполярно окрашенные, капсулообразующие палочки овоидной формы. х1350
Типичные колонии пересевают на скошенный МПА, чистую культуру чумных бактерий идентифицируют по морфологическим, культуральным, ферментативным, антигенным свойствам (РА с использованием диагностических сывороток против высокоспецифичного капсульного и соматического антигенов), фаголизабельности, определяют ее чувствительность к антибиотикам. Возбудитель чумы восстанавливает нитраты в нитриты, ферментирует глюкозу, ксилозу, маннит с образованием кислоты (без газа). В отличие от многих других представителей семейства энтеробактерий имеет более низкий температурный оптимум роста и физиологической активности - 28 °С. В процессе идентификации возбудитель чумы необходимо дифференцировать с другими иерсиниями (табл. 6).
Биологическое исследование. Заражают морских свинок или мышей подкожно, внутрибрюшинно или накожно, материалом от трупов – методом скарификации.
Животные погибают на 2—7-е сутки. Одно из зараженных животных умерщвляют на 2—3-й день с целью выделения культуры иерсиний из крови и внутренних органов. В мазках из внутренних органов, крови, экссудата погибших животных обнаруживают большое количество грамотрицательных, биполярно окрашенных бактерий. После исследования трупы животных погружают в 5% лизол, а затем сжигают.
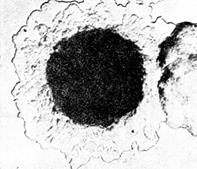
Рис. 8. Колонии возбудителя чумы(Yersinia pestis). х56
Таблица 6. Биологические свойства иерсиний
| Свойства | Y. pestis | Y. pseudotuberculosis | Y. enterocolitica |
| Подвижность при: 25 0 С 28-37 0 С | - - | + - | + - |
| Ферментация: рамнозы раффинозы инозита мочевины сахарозы | - - - - - | + + - + - | - - + + + |
| уреаза орнитиндекарбоксилаза | - - | - - | + - |
| Фракция 1 | + | - | - |
| Мышиный токсин | + | - | - |
| Пестицин 1 | + | - | - |
| Плазмокоагулаза | + | - | - |
| Фибринолизин | + | - | - |
| Чувствительность к чумному фагу | + | - | - |
| Вирулентная форма колоний | R | S | S |
Серологическое исследование проводится с целью ретроспективной диагностики чумы. Ставят РНГА с эритроцитами, на которых адсорбирован капсульный антиген возбудителя чумы, реакцию нейтрализации антигена (РНАг), ИФА и непрямую РИФ. Диагностический титр 1:40 и выше.
Генодиагностика. Разработана ПЦР для экспресс-диагностики чумы.
Правила
забора материала для лабораторного исследования от больного (трупа) при подозрении на заболевание чумой, холерой, ТОРС, человеческим гриппом, вызванным новым подтипом
Материал должен забираться до начала специфического лечения, стерильными инструментами в стерильную посуду.
Весь инструментарий и другие предметы, использованные для взятия материала, обеззараживают кипячением в 2%-ном растворе соды (или другого моющего средства) в течение 60 минут с момента закипания или в паровом стерилизаторе (пар под давлением 2,0 кг\см, при температуре 132°С) с течение 90 минут.
1. При подозрении на заболевание чумой
Согласно действующим нормативным документам все виды диагностических работ с материалом, зараженным или подозрительным на зараженность возбудителя чумы, проводятся только в специализированных лабораториях противочумных учреждений, имеющих на это соответствующее разрешение, персоналом, окончившим курсы специализации по особо опасным инфекциям и допущенные к работе с таким материалом приказом руководителя учреждения. Во всех случаях выявления больного (трупа), подозрительного на чуму, незамедлительно должны быть вызваны консультанты из противочумного учреждения. Забор материала от больных производится специалистами отдела надзора за особо опасным инфекциям Управления Роспотребнадзора по городу Москве и\или ФГУЗ "Противочумный центр" и Роспотребнадзора.
В зависимости от формы проявления заболевания для исследования берут следующий материал:
при кожной форме чумы - содержимое везикул, пустул, карбункулов, отделяемое язв, содержимое плотного инфильтрата, кровь;
при бубонной - пунктат из бубона, кровь;
при септической - кровь;
при легочной - мокрота (слизь из зева), кровь.
Пунктат бубона (везикул, пустул, карбункулов) берут шприцем емкостью не мене 5 мл. Кожу на участке, намеченном для прокола, обрабатывают 70° спиртом, а затем смазывают 5%-ным раствором йода и вновь протирают спиртом. Иглу с толстым просветом вводят с таким расчетом, чтобы ее острие достигало центральной части бубона, после чего, немного оттянув поршень, медленно вытягивают иглу. Экссудат в чумном бубоне расположен между плотными тканями, количество его незначительно и часто заполняет только просвет иглы. Поэтому полезно перед пункцией бубона в шприц набрать 0,1-0,2 мл стерильного питательного бульона или изотонического раствора хлористого натрия. После извлечения иглы из бубона через нее набирают в шприц 0,5 мл того же бульона (рН 7,2) и содержимое выливают в стерильную пробирку, закрывают резиновой стерильной пробкой. Последние капли материала из шприца наносят на 2 предметных стекла. После высыхания капли стекла помещают в фиксатор с 96° этиловым спиртом. При невозможности получить материал в бубон вводят 0,3 мл стерильного физиологического раствора, а затем отсасывают его и помещают в стерильную пробирку. При вскрывшемся бубоне материал берут из периферической плотной части, как указано выше, и отдельно - отделяемое свища. Обе порции берут и исследуют раздельно. Пунктат из отека набирают в шприц и переносят в стерильную пробирку.
При подозрении на легочную форму мокроту для исследования собирают в стерильные широкогорлые банки с притертыми или завинчивающимися крышками. При отсутствии мокроты материал получают стерильным тампоном из зева.
При всех формах чумы берут кровь из вены в количестве 10 мл, засевая сразу 5 мл в 50 мл питательного бульона (рН 7.2), остальной материал используют в дальнейшем для посева на агар, заражения биопробных животных, а также постановки серологических реакций, приготовления мазков.
Забор материала от трупа для лабораторного исследования производят в соответствии с "Инструкцией по организации санитарно-противоэпидемических (профилактических) мероприятий при выявлении на вскрытии тела умершего подозрительного на карантинные инфекции, контагиозные вирусные геморрагические лихорадки, другие особо опасные инфекции и инфекционные болезни неясной этиологии, представляющие опасность для населения г. Москвы", утвержденной Департаментом здравоохранения города Москвы 5.12.2003 г.
4. При подозрении на заболевание холерой.
(Выписка из Методических указаний МУК 4.2.2218-07 "Лабораторная диагностика холеры")
Материал от больного (подозрительного) холерой забирает медицинский работник учреждения здравоохранения немедленно после выявления больного и до начала лечения антибиотиками (при наличии естественных выделений). Диагностические исследования на холеру проводит отделение особо опасных инфекций микробиологической лаборатории ФГУЗ "Центр гигиены и эпидемиологии в городе Москве".
Для отбора проб используют чистую стерильную посуду, не содержащую следов дезинфицирующих растворов (или однократного применения). Материал для исследования должен быть доставлен не позже чем через 2 часа после его взятия. В случае удлинения сроков доставки используются транспортные среды (наиболее удобной и достаточно эффективной является 1%-ная пептонная вода).
Способы отбора проб от больных холерой, вибрионосителей и контактных с ними лиц:
- испражнения и рвотные массы в количестве 10-20 мл собирают в стерильную посуду стерильными ложками или стеклянными трубками с резиновой грушей из индивидуального судна, на дно которого помещают меньший по размеру сосуд (лоток), удобный для обеззараживания кипячением;
- для взятия материала у больных с обильным водянистым стулом можно использовать резиновый катетер, один конец которого вводят в прямую кишку, а другой опускают в банку. Жидкие испражнения стекают в сосуд свободно или при легком массаже брюшной стенки;
- стерильный ректальный ватный тампон из гигроскопической ваты вводят в прямую кишку на глубину 5-6 см и собирают им содержимое со стенок кишечника. Тампон опускают во флакон или пробирку с 1%-ной пептонной водой, обломив часть деревянного стержня;
- при отсутствии испражнений материал забирают стандартной стерильной петлей из алюминиевой проволоки. Перед забором материала петлю смачивают стерильным 0,9%-ным раствором натрия хлорида и вводят в прямую кишку на 5-6 см. Взятый материал переносят во флакон или пробирку с 1%-ной пептонной водой;
- желчь берут при дуоденальном зондировании в лечебном учреждении. В отдельные пробирки собирают две порции: из желчного пузыря и желчных протоков (В и С). Материал доставляют нативным;
- от умерших с подозрением на холеру берут отрезки (длиной около 10 см) верхней, средней и нижней частей тонкой кишки, разрез производят двойными лигатурами, предварительно наложенными на оба конца изымаемого участка кишечника. Желчный пузырь после перевязки протока извлекают целиком. Содержимое кишечника и желчь от трупа можно взять стерильным шприцем с толстой иглой в объем до 10 мл и перенести в емкость с 1%-ной пептонной водой. Взятые образцы органов трупа укладывают раздельно в стерильные банки.
Банки, пробирки в штативе с материалом закрывают непромокаемыми пробками и пергаментной бумагой, тщательно обрабатывают снаружи салфеткой, смоченной дезинфицирующим раствором, избегая затекания его внутрь. Все пробы этикетируют, укладывают в специально подготовленную для транспортирования металлическую тару и перевозят на служебном транспорте с сопровождающим.
Упаковка и транспортировка материала
Каждую пробирку, банку или другую посуду, в которою помещен материал от больного, плотно закрывают резиновыми (корковыми, стеклянными, притертыми пробками, полиэтиленовыми или завинчивающимися крышками), обрабатывают снаружи дезрастваром # . После этого пробки заклеивают лейкопластырем или покрывают колпачком из хлорвиниловой пленки (целлофановой, вощеной бумаги или пергамента) и плотно завязывают. Затем пробирки помещают в металлический пенал, края между крышкой и корпусом пенала заклеивают лейкопластырем. Пенал заворачивают в целлофановую (вощеную) бумагу, делают пометку "Верх" и помещают в бикс. Каждую банку отдельно заворачивают в хлорвиниловую пленку, целлофановую, вощеную бумагу или марлю и помещают в бикс или металлический ящик, который опечатывают и отправляют в сопровождении 2-х человек - один из которых - медицинский работник, в отделение особо опасных инфекций микробиологической лаборатории ФГУЗ "Центр гигиены и эпидемиологии в городе Москве" специально выделенным транспортом по адресу:
Графский переулок д. 4\9, ФГУЗ "Центр гигиены и эпидемиологии в городе Москве" Роспотребнадзора, микробиологическую лабораторию отделения особо опасных инфекций телефон 687-40-47 (исследования на холеру).
К посылке прилагают сопроводительный документ, в котором указывают фамилию, имя, отчество, возраст больного, диагноз, дата начала заболевания, дата смерти, вскрытия и взятия материала, часы забора, характер материала для исследования, примененные антибиотики (дата и доза), фамилия и должность врача, забравшего материал. (МУК 4.2.2218-07 "Лабораторная диагностика холеры").
Биологический материал, взятый у больных (подозрительных) на чуму, доставляется в лабораторию ФГУЗ "Противочумный центр" Роспотребнадзора по адресу: ул. Мусоргского дом 4, телефон лаборатории (495) 402-99-34, главный врач: 402-90-01, заместитель главного врача - 402-46-47.
Читайте также:


